通过色素颜色变化进行的化学动力学实验设计*
2016-09-26王小锋石翛然李晓婷
王小锋,徐 鉴,石翛然,李晓婷
(南京晓庄学院环境科学学院,江苏 南京 211171)
通过色素颜色变化进行的化学动力学实验设计*
王小锋,徐鉴,石翛然,李晓婷
(南京晓庄学院环境科学学院,江苏南京211171)
针对传统化学动力学实验设计,本文通过食品色素分解的颜色变化,开展化学动力学创新实验设计探索,加深对化学动力学知识的理解,有效地调动学生的学习积极性。本文采用过硫酸铵和Fe2+,可以有效的氧化分解有色食品色素。重点研究了食品色素浓度、过硫酸铵浓度、Fe2+浓度和温度对食品色素分解速率的影响,掌握如反应级数、速率系数、活化能等化学反应动力学的特性。
动力学;食品色素;氧化分解;实验设计
对于理工科教学而言,实践是教学的基础,兴趣是学习的动力,培养学生的创新思维、提高其综合素质和技能是教学的根本任务。传统无机化学教学中的化学动力学实验难以引起学生的学习兴趣。要想准确表达化学反应进行的快慢,就必须建立起一套行之有效的方法:确定反应的起点,找出易于测量的某种量的变化,通过实验探讨反应速率的决定因素,还有外界条件对化学反应速率的影响[1-3]。通过实验和理论分析,使学生由感性认识上升到理性认识[4]。
本论文采用与生活息息相关的食品色素,条件易满足,操作不复杂,数据处理也不深奥,实验现象直观,可加深学生对化学反应动力学知识的理解与记忆,也对食品色素和高级氧化技术有了深刻认识,增强学习兴趣[5]。
1 实 验
1.1实验原理
1.1.1过硫酸铵和Fe2+反应原理
采用过硫酸铵和Fe2+,可以有效的氧化分解有色食品色素。Fe2+在常温常压可活化过硫酸盐,产生硫酸根自由基氧化分解有机物,能耗低不需外加热源与光源。反应如式:
(1)
(2)
综合可得二价铁活化过硫酸盐反应式为
(3)
1.1.2化学动力学原理
化学动力学的基本任务是研究化学反应的速率和机理,以及各种因素对反应速率的影响,同时研究反应速率方程等化学动力学普遍规律。
(1) 反应速率方程(反应动力学方程)
一定温度下,表示化学反应系统中反应速率与反应物的浓度间函数关系的方程式称为反应速率方程(有时也与产物浓度有关)。反应
(4)
若通过实验测定反应速率方程为
(5)
则方程中α和β分别为A和B的级数,α+β = n为反应的总级数;k为速率系数。所以在本文试验中,色素分解反应速率方程假定为:
(6)
(2) 影响反应速率的因素
除了反应物的本质影响反应速率,还有反应物浓度、催化剂、温度等也影响反应速率。在固定温度下,反应物浓度对反应速率影响表现在反应速率方程中。催化剂能改变化学反应速率,而自身在反应前后的数量与化学性质都不发生变化。
研究温度对反应速率的影响应用最广泛的是Arrhenius方程。方程如下:
k=Aexp(Ea/RT)
(7)
式中:k——反应速率常数
A——指前因子
Ea——活化能,kJ·moL-1
T——反应的绝对温度,K
R——气体常数8.314 J·moL-1·K-1
1.2实验仪器和试剂
容量瓶(100 mL,250 mL);天平;烧杯;量筒;恒温加热磁力搅拌器;铁架台(带有夹子);玻璃棒;计时器;滴管。
胭脂红,上海色素研究所有限公司;过硫酸铵,上海凌峰化学试剂有限公司,分析纯AR;七水硫酸亚铁,国药集团化学试剂有限公司,分析纯AR;蒸馏水。
1.3实验过程
1.3.1溶液配制
配制20 mL 1 g·L-1和0.5 g·L-1红色色素溶液。配制250 mL 0.05 mol·L-1(NH4)2S2O8溶液和0.01 mol·L-1FeSO4·7H2O溶液,100 mL 0.1 mol·L-1(NH4)2S2O8溶液和0.02 mol·L-1FeSO4·7H2O溶液。
1.3.2反应方法
(1)食品色素分解实验
烧杯中各加入5 mL 0.05 mol·L-1(NH4)2S2O8和5 mL 0.01 mol·L-1FeSO4·7H2O。磁力搅拌均匀中,加入6滴1 g·L-1红色色素,观察烧杯中颜色的变化,并记录时间。平行重复试验三次。
(2)食品色素浓度对食品色素分解速率的影响
烧杯中加入5 mL 0.05 mol·L-1(NH4)2S2O8和5 mL 0.01 mol·L-1FeSO4·7H2O。磁力搅拌均匀中,加入6滴0.5 g·L-1红色食用色素,观察烧杯中颜色的变化,并记录时间。试验平行重复三次。与第(1)组实验对比。
(3)Fe2+浓度对食品色素分解速率的影响
烧杯中加入5 mL 0.05 mol·L-1(NH4)2S2O8和5 mL 0.02 mol·L-1FeSO4·7H2O。搅拌均匀中加入6滴1 g·L-1红色食用色素,观察烧杯中颜色的变化,并记录时间。试验平行重复三次。与第(1)组实验对比。
(4)(NH4)2S2O8浓度对食品色素分解速率的影响
烧杯中各加入5 mL 0.1 mol·L-1(NH4)2S2O8和5 mL 0.01 mol·L-1FeSO4·7H2O。搅拌均匀中加入6滴1 g·L-1红色食用色素,观察烧杯中颜色的变化,并记录时间。试验平行重复三次。与第(1)组实验对比。
(5)温度对食品色素分解速率的影响
烧杯中加入5 mL 0.05 mol·L-1(NH4)2S2O8和5 mL 0.01 mol·L-1FeSO4·7H2O,10滴1 g·L-1红色食用色素,将烧杯置于25 ℃的水浴中反应,观察烧杯中颜色的变化,并记录时间。接着再调节水浴温度为35 ℃,45 ℃,55 ℃,重复实验。试验平行重复三次。
1.4注意事项
过硫酸铵具有腐蚀性和刺激性,要带口罩和手套操作。
2 结果与讨论
2.1食品色素分解实验
如图1所示,显示6滴1 g·L-1红色食用色素受催化的分解颜色变化过程。在试验中,色素分解颜色变化通过肉眼观察发现分解过程很复杂,所以实验研究了从开始的颜色红色到颜色1、颜色2和颜色3。另外,在色素分解前段过程,由于是氧化分解的开始,色素颜色偏深,利于肉眼观察,而到了后段过程,由于色素颜色趋于变淡,很难准确区分,所以实验研究偏前段过程,即从开始的颜色红色到颜色1、颜色2和颜色3。

图1 红色食用色素分解颜色变化
2.2食品色素浓度对食品色素分解速率的影响
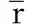

表1 6滴0.5 g·L-1(0.015 g·L-1)红色食用色素分解颜色变化速率

如表2所示,由可得,α接近0,即色素浓度对色素分解速率并不是很大。
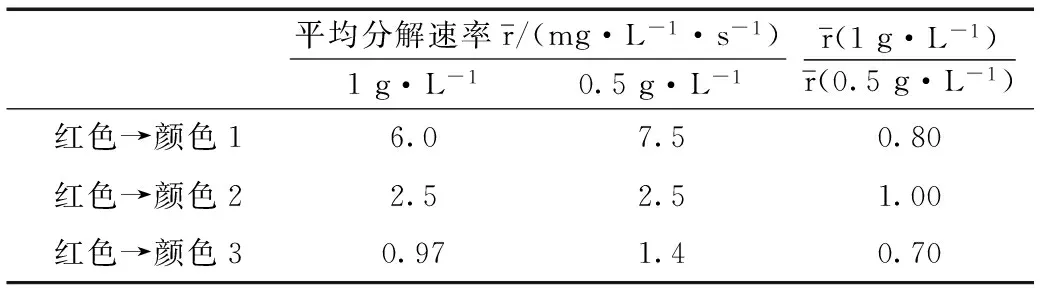
表2 不同浓度红色食用色素分解颜色变化速率

2.3Fe2+浓度对食品色素分解速率的影响
通过记录色素颜色变化的时间,加上已知色素的浓度,可以求得色素的平均分解速率,即=(0.03/t) mg·L-1·s-1。不同Fe2+浓度下色素分解速率数据如表3所示。

表3 6滴1 g·L-1(0.03 g·L-1)红色食用色素分解颜色变化速率
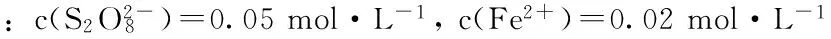


表4 不同Fe2+浓度下1 g·L-1红色食用色素分解颜色变化速率
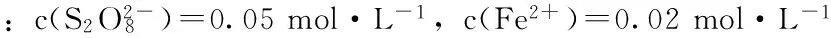
2.4(NH4)2S2O8浓度对食品色素分解速率的影响


表5 6滴1 g·L-1(0.03 g·L-1)红色食用色素分解颜色变化速率
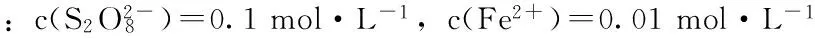
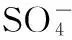

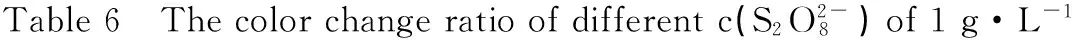
red food dyes decomposition

通过上述几组对比试验可以得出,食用色素氧化分解反应比较接近一级动力学,食用色素氧化分解反应速率方程为:
2.5温度对食品色素分解速率的影响
此组对比实验,考虑到随着温度的升高,色素分解速率会加快,导致中间的颜色变化快,肉眼难以准确观察到,分解速率由开始颜色到最终颜色计算,不同温度的速率数据如表7所示。

表7 不同温度下1 g·L-1(0.05 g·L-1)红色食用色素分解颜色变化速率

如表7所示,随着温度的升高,食用色素分解速率增大。根据Arrhenius方程,作出与1/T的关系图(图2),可得y=-4636.3x+14.489,所以活化能Ea=38.55 kJ·moL-1。

图2 与1/T的关系
3 结 论

[1]杨世迎,陈友媛,胥慧真.过硫酸盐活化高级氧化新技术[J].化学进展,2008,20(9):1433-1438.
[2]张乃东,张曼霞,孙冰.硫酸根自由基处理水中甲基橙的初步研究[J].哈尔滨工业大学学报,2006,38(4):636-635.
[3]Kislenko V N,Berlin A A,Litocvhenko N V. Kinetics of glucose
oxidation with persulfateions,catalyzed by iron salts[J]. Russian J. of General Chem.,l995,65(7):1092-1096.
[4]薛智勇,陈王,朱洪. UV/K2S2O8降解偶氮色素AO7的研究:动力学及反应途径[J].环境科学,2010, 31(7):1534-1537.
[5]Waldemer R H,Tratnyek P G,Johnson R L. Oxidation of chlorinated ethenes by heat-activated persulfate: Kinetics and products[J]. Environ. Sci.&Tech.,2007,41(3):1010-1015.
Experimental Design of Kinetics by Color Change of Food Dyes*
WANG Xiao-feng, XU Jian, SHI Xiao-ran, LI Xiao-ting
(School of Environmental Science, Nanjing Xiaozhuang University, Jiangsu Nanjing 211171, China)
Against the traditional design of kinetic experiments, innovative experiments designed was carried out to explore the chemical kinetics by color change by food dyes decomposition, from which students can deepen the understanding of the knowledge of chemical kinetics. (NH4)2S2O8activated by Fe2+can effectively oxidize and decompose food dyes. Those impacts on the rate of decomposition were discussed, such as the concentration of food dye, (NH4)2S2O8, Fe2+and temperature. Besides, the experiment was designed to master the teaching key points of reaction system such as reaction order, rate coefficient and activation energy.
dynamics; food dyes; oxidative decomposition; experimental design
教育部科学技术研究重大项目(210102);南京晓庄学院校级重点项目(No:2013NXY05)。
王小锋(1979- ),男,副教授,主要从事化学教学和配位化学研究。
O6-3
A
1001-9677(2016)016-0073-04
