育苗阶段虾夷扇贝幼体中可培养细菌的多样性
2016-09-26李明,刘继晨,孙雪莹等
育苗阶段虾夷扇贝幼体中可培养细菌的多样性
为了研究虾夷扇贝Patinopecten yessoensis育苗过程中5个发育时期 (受精卵时期S1、担轮幼虫时期S2、D形幼虫时期S3、壳顶幼虫时期S4、稚贝时期S5)幼体所含可培养细菌的多样性,采用2216E平板涂布法,从每个发育时期的幼体样品中各分离出30株细菌,并对150株菌进行16S rRNA基因测序分析。结果表明:150株细菌归属于2门3纲8目12科16属39种;在门水平,5个时期幼体样品中变形菌门均为优势门,其次为厚壁菌门;在属水平,优势属为弧菌属 (51/150)、假交替单胞菌属 (43/150)、芽孢杆菌属 (16/150)、交替单胞菌属 (9/150),占总数的79.3%;其中弧菌属在S1(43.3%)、S2(36.7%)、S3(36.7%)时期均为优势属,在S1时期,次优势属依次为假交替单胞菌属 (26.7%)、动性球菌属(10.0%)和枝芽孢杆菌属 (6.7%),在S2时期,次优势属依次为假交替单胞菌属 (23.3%)、亚硫酸杆菌属 (20.0%)和芽孢杆菌属 (13.3%),在S3时期,次优势属依次为假交替单胞菌 (16.7%)、动性球菌属 (13.3%)和交替单胞菌属 (10.0%);假交替单胞菌在S4(36.7%)和S5(40.0%)时期均为优势属,在S4时期,次优势属依次为弧菌属 (30.0%)、芽孢杆菌属 (16.7%)和交替单胞菌属 (10.0%),在S5时期,次优势属依次为弧菌属 (23.3%)、芽孢杆菌属(16.7%)和Pontibacillus(10.0%)。研究表明,虾夷扇贝育苗过程中不同发育时期的幼体所含可培养细菌种类比较丰富,细菌群落结构存在较大差异。
虾夷扇贝幼体;16S rRNA基因;细菌多样性
虾夷扇贝Patinopecten yessoensis隶属于软体动物门、瓣鳃纲、扇贝科,是一种大型冷水性贝类,具有生长快、个体肥大、味道鲜美、经济价值高等特点。该品种自然分布于日本北海道、本州北部,俄罗斯远东沿海,朝鲜半岛北部。自从20世纪80年代被引入中国后,虾夷扇贝就成为中国北方主要的贝类养殖品种之一[1]。由于大连獐子岛海域得天独厚的地理条件,獐子岛集团成为了中国最大的虾夷扇贝养殖基地。然而,在虾夷扇贝育苗过程中,由于条件致病菌的存在,经常会发生苗种大量死亡的现象,造成了严重的经济损失,这成为虾夷扇贝养殖中的一个最主要的限制因素[2]。因此,只有解决这个问题,才能为虾夷扇贝的商业化育苗提供安全可靠的生物技术支持。
虾夷扇贝和其他双壳贝类一样都是滤食性种类,其进食方式使扇贝幼体与大量的细菌接触,这些细菌中很可能有一些是条件致病菌,在扇贝育苗过程中存在潜在威胁[2-4]。除了潜在的致病菌外,有些细菌在扇贝幼体的健康发育过程中也有着重要作用。Jorquera等[5]报道了细菌可以作为双壳贝类的食物和维生素来源,并且在提高机体对细菌性疾病的抵抗力和生长发育速度方面起着重要作用。研究虾夷扇贝幼体发育过程中的细菌群落是了解其潜在致病菌和益生菌的第一步,也可为调节育苗过程中的细菌群落提供参考。Godoy等[6]用培养方法研究了紫扇贝Argopecten purpuratus幼体发育阶段可培养细菌的群落组成,发现幼体细菌群落与其生活的水体和进食的藻类细菌群落有很大不同。细菌群落的相对稳定对于育苗的成功很重要。Sandaa等[7]研究了大扇贝Pecten maximus幼体早期发育阶段的细菌群落动态,发现在幼体发育的早期阶段其细菌群落组成略有改变。
本研究中,结合传统培养方法和16S rRNA基因序列分析,研究了虾夷扇贝幼体细菌多样性,旨在为益生菌的筛选、饵料研发和病害防治提供依据,并为实现生态系统调控与管理、合理保护环境、实现养殖业可持续发展提供参考。
1 材料与方法
1.1材料
2014年3—4月从獐子岛集团虾夷扇贝育苗池采集虾夷扇贝5个发育时期 (受精卵时期S1、担轮幼虫时期S2、D形幼虫时期S3、壳顶幼虫时期S4和稚贝时期S5)的幼体样品。
1.2方法
1.2.1样品的处理 用300目无菌筛绢从育苗池收集各个发育时期的扇贝幼体样品于无菌离心管中,用无菌海水冲洗3次,离心 (3000 r/min,10 min,4℃)后称重,加入9倍无菌生理盐水,用可调速匀浆器研磨均匀。
1.2.2异养细菌的分离、计数和纯化 将匀浆液梯度稀释,取稀释液100 μL涂布于2216E平板上,于15℃下培养7 d,计数。在适当稀释度的平板上各随机挑取30个菌落,在2216E平板上划线纯化,获得纯培养分别于4℃和-80℃下保存。
1.2.3细菌DNA的提取、PCR扩增 将纯菌株接种到2216E液体培养基中培养过夜,使用土壤基因组DNA快速提取试剂盒 [生工生物工程 (上海)股份有限公司]提取细菌基因组DNA,提取方法参照试剂盒说明书。细菌16S rRNA基因片段的扩增引物为F27/R1492,由生工生物工程 (上海)股份有限公司合成,引物序列参照文献 [8]。PCR反应体系及反应程序参考文献 [2]。用10 g/L琼脂糖凝胶电泳检测PCR产物是否符合目标条带,并由生工生物工程 (上海)股份有限公司完成PCR产物的测序。
1.3数据处理
将获得的各菌株序列在EzBioCloud(http:// www.ezbiocloud.net/eztaxon)公共数据库中进行序列同源性比对,从结果中取第一个相似性最高的序列。将比对后相似性大于97%的菌株作为一个种[9],反之则为两个种。
为了比较不同发育时期幼体样品间细菌群落的差异,计算Shannon多样性指数[10]、Pielou均匀度指数[11]和Sørensen相似性指数[12]。
2 结果与分析
2.1扇贝幼体5个发育时期异养细菌的计数
各个时期幼体异养细菌计数结果如表1所示,在S1时期的幼体所含异养细菌量最少,与其未开口摄食有关。随着幼体的生长发育,其体内异养细菌数量总体呈递增趋势。

表1 虾夷扇贝幼体不同发育时期异养细菌数量Tab.1 Heterotrophic bacterial counts in Yesso scallop larvae across different developmental stages
2.2扇贝幼体5个发育时期细菌群落结构分析
经过与16S rRNA基因序列比对,150株细菌归属于2门3纲8目12科16属 (图1)。以变形菌门Proteobacteria(121/150)为优势,其次是厚壁菌门Firmicutes(29/150)。优势纲为γ-变形菌纲γ-Proteobacteria(110/150),在S1~S5时期样品中所占比例分别为 83.3%、63.3%、70.0%、76.7%和73.3%,其次为芽孢杆菌纲Bacilli,5个时期样品中所占比例分别为 16.7%、16.7%、20.0%、16.7%和26.7%;S2、S3和S4时期含有α-变形菌纲α-Proteobacteria,3个时期样品中所占比例分别为20.0%、10.0%和6.7%。
优势目为交替单胞菌目 Alteromonadales (54/150)、弧菌目Vibrionales(51/150)和芽孢杆菌目Bacillales(29/150),占总数的89.3%。弧菌目在S1(43.3%)、S2(36.7%)和S3(36.7%)时期均为优势目,在S1和S3时期,次优势目依次为交替单胞菌目 (30.0%和30.0%)和芽孢杆菌目 (16.7%和20.0%),在S2时期,次优势目依次为交替单胞菌目(26.7%)、红细菌目Rhodobacterales(20.0%)和 芽 孢 杆 菌 目(16.7%);交替单胞菌目在 S4(46.7%)和 S5 (46.7%)时期均为优势目,在S4时期,次优势目依次为弧菌目 (30.0%)和芽孢杆菌目(16.7%),在S5时期,次优势目依次为芽孢杆菌目 (26.7%)和弧菌目 (23.3%)。
优势科为弧菌科Vibrionaceae(51/150)、假交替单胞菌科Pseudoalteromonadaceae(43/150)、芽孢杆菌科 Bacillaceae(22/150)、红细菌科 Rhodobacteraceae(6/150)、交替单胞菌科Alteromonadaceae(9/150)、动性球菌科Planococcaceae(7/150),占总数的 92.0%。弧菌科在 S1(43.3%)、S2 (36.7%)和S3(36.7%)时期均为优势科,在S1时期,次优势科依次为假交替单胞菌科(26.7%)、动性球菌科 (10.0%)和芽孢杆菌科(6.7%),在S2时期,次优势科依次为假交替单胞菌科 (23.3%)、红细菌科 (20.0%)和芽孢杆菌科 (16.7%),在S3时期,次优势科依次为假交替单胞菌科 (16.7%)、动性球菌科 (13.3%)和交替单胞菌科 (10.0%);假交替单胞菌科在S4 (36.7%)和S5(40.0%)时期均为优势科,在S4时期,次优势科依次为弧菌科 (30.0%)、芽孢杆菌科 (16.7%)和交替单胞菌科 (10.0%),在S5时期,次优势科依次为芽孢杆菌科 (26.7%)、弧菌科 (23.3%)和交替单胞菌科 (6.7%)。
优势属为弧菌属Vibrio(51/150)、假交替单胞菌属 Pseudoalteromonas(43/150)、芽孢杆菌属Bacillus(16/150)、交替单胞菌属 Alteromonas (9/150),占总数的 79.3%。弧菌属在S1 (43.3%)、S2(36.7%)和S3(36.7%)时期均为优势属,在S1时期,次优势属依次为假交替单胞菌(26.7%)、动 性 球 菌 属Planococcus (10.0%)和枝芽孢杆菌属Virgibacillus(6.7%),在S2时期,次优势属依次是假交替单胞菌属(23.3%)、亚硫酸杆菌属 Sulfitobacter(20.0%)和芽孢杆菌属 (13.3%),在S3时期,次优势属依次为假交替单胞菌属 (16.7%)、动性球菌属(13.3%)和交替单胞菌属 (10.0%);假交替单胞菌属在S4(36.7%)和S5(40.0%)时期成为优势属,在 S4时期,次优势属依次为弧菌属(30.0%)、芽孢杆菌属 (16.7%)和交替单胞菌属 (10.0%),在S5时期,次优势属依次为弧菌属 (23.3%)、芽孢杆菌属 (16.7%)和Pontibacillus(10.0%)。
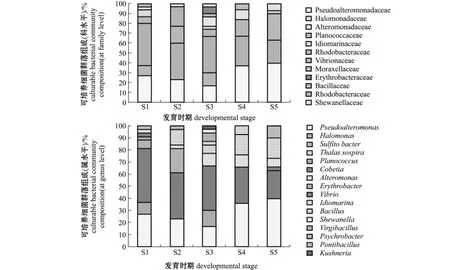
图1 虾夷扇贝幼体不同发育时期可培养细菌群落组成 (科、属水平)Fig.1 Culturable bacterial community composition(at family and genus levels)in Yesso scallop larvae across different developmental stages
2.3扇贝幼体5个发育时期细菌群落多样性及相似性分析
所有菌株与相关菌株的16S rRNA基因序列相似性为99%。按16S rRNA基因序列相似性大于97%的菌株归于同一种计[9],150株细菌可以归为39种。虾夷扇贝幼体各个发育时期种水平细菌群落组成见表2。从Shannon指数和Pielou指数可以看出,不同发育时期细菌多样性存在一定差异,细菌种类分布较为均匀 (表3)。Sørensen指数表明,幼体发育S1时期与其他4个时期,S2时期与S3和S4时期,以及S3时期与S5时期细菌群落结构有较大差异 (表4)。

表2 虾夷扇贝幼体不同发育时期可培养细菌群落组成 (种水平)Tab.2 Culturable bacterial community composition(at species level)in Yesso scallop larvae across different developmentalstages
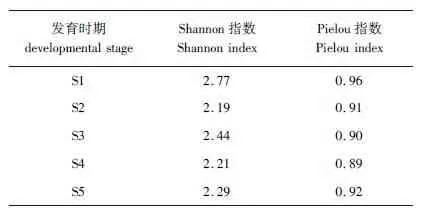
表3 虾夷扇贝幼体不同发育时期可培养细菌群落的Shannon指数和Pielou指数Tab.3 Shannon and Pielou indices of culturable bacterial communities in Yesso scallop larvae across differental developmental stages
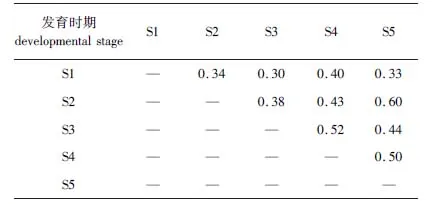
表4 虾夷扇贝幼体不同发育时期可培养细菌群落的Sørensen 相似性指数Tab. 4 Sørensen index of culturable bacterial communitiesin Yesso scallop larvae across different developmental stages
3 讨论
3.1扇贝幼体5个发育时期异养细菌数量及群落
变化
本研究中,随着生长发育,虾夷扇贝幼体各个发育时期的异养细菌数量从受精卵时期的103CFU/g逐渐增加到稚贝时期的105CFU/g,而从紫扇贝幼体发育阶段幼体中分离的可培养细菌数量在受精卵由0 d发育到3 d时增加不到一个数量级,3 d以后数量基本保持稳定[6],这一差异可能是由换水周期差异较大引起的。在受精卵时期,优势属是弧菌属 (43.3%),随着虾夷扇贝幼体的生长发育,优势属发生了变化 (图1)。这一结果与紫扇贝幼体发育阶段幼体中分离的可培养细菌群落动态相似[6]。Sandaa等[7]的研究表明,大扇贝幼体早期生长阶段相关细菌变性梯度凝胶电泳 (DGGE)图谱中的条带数目发生改变。
3.2扇贝幼体5个发育时期细菌群落组成
在虾夷扇贝幼体5个发育阶段,优势门为变形菌门,其次是厚壁菌门,在纲水平,优势纲为γ-变形菌纲,其次是芽孢杆菌纲。这与从紫扇贝幼体中分离的32株细菌结果一致[6]。变形菌门不仅在扇贝幼体中是优势门,在健康的虾夷扇贝成体中通常也是优势门[13-14]。
在属水平,共分离到16个属 (图1)。其中交替单胞菌属、芽孢杆菌属、弧菌属在紫扇贝幼体中也是优势属[6]。假交替单胞菌属的种类可在大扇贝幼体中检测出[7]。来源于紫扇贝幼体的L-07菌株与亚硫酸杆菌 IS1菌株相似性为95%[6]。假交替单胞菌属和希瓦氏菌属Shewanella也存在于健康虾夷 扇 贝 中[13]。Idiomarina、盐 单 胞 菌 属Halomonas、希瓦氏菌属、假交替单胞菌属、芽孢杆菌属、弧菌属和枝芽孢杆菌属在香港巨牡蛎Crassostrea hongkongensis成体相关可培养细菌中被发现[15]。动性球菌属可从双壳类Modiolus dificilus成体中分离出[16]。
前人研究表明,弧菌是扇贝幼体主要的致病菌[2,4,17-19]。在育苗过程中,壳顶幼虫(S4时期)出现较多死亡可能与弧菌有关。从虾夷扇贝幼体中分离出的灿烂弧菌 Vibrio splendidus、V.neocaledonicus和 V.kanaloae可能存在潜在致病性。Liu等[2]从獐子岛集团育苗室患病虾夷扇贝幼体中分离出灿烂弧菌,感染试验证实,此菌能使虾夷扇贝幼体大量死亡。该菌也是商业育苗场紫扇贝幼体大量死亡的病原菌[4]。V.neocaledonicus在S2、S3和S4时期出现频率较高 (20.0%~26.7%),该菌曾从弧菌病暴发的菲律宾蛤仔Ruditapes philippinarum幼体中分离出[20]。菱形蛤仔 Venerupis rhomboides成体容易被V.kanaloae菌和灿烂弧菌感染[21]。因此,在扇贝育苗过程中应十分重视对水温和水质的监测,保证营养供给,减少潜在致病菌感染的机会。
本研究中,从虾夷扇贝幼体中分离出的若干假交替单胞菌、弧菌、芽孢杆菌和交替单胞菌可能对扇贝幼体产生有益的影响。假交替单胞菌D41菌株,可提高大扇贝幼体对灿烂弧菌感染的抵抗力[22]。实验室研究结果表明,添加弧菌OY15菌株可使2 d美洲牡蛎Crassostrea virginica幼体经病原菌弧菌B183菌株攻毒后48 h的存活率提高[23]。商业规模试验结果显示,当用或不用病原菌弧菌B183菌株攻毒时,添加候选益生菌弧菌OY15菌株能显著提高美洲牡蛎在幼体变态过程中的存活率[24]。混合菌 (弧菌C33菌株、假单胞菌11菌株和芽孢杆菌B2菌株)能够提高紫扇贝幼体存活率,使其在不使用抗生素的情况下顺利度过浮游幼体阶段[25]。Douillet等[26]发现,添加交替单胞菌CA2菌株可提高太平洋牡蛎Crassostrea gigas幼体的存活率和生长。本试验中分离的若干假交替单胞菌、弧菌、交替单胞菌和芽孢杆菌是否可作为益生菌添加在虾夷扇贝育苗池中有待进一步研究。
[1] 李文姬,谭克非.日本解决虾夷扇贝大规模死亡的启示[J].水产科学,2009,28(10):609-612.
[2] Liu Jichen,Sun Xueying,Li Ming,et al.Vibrio infections associated with Yesso scallop(Patinopecten yessoensis)larval culture[J].Journal of Shellfish Research,2015,34(2):213-216.
[3] Paillard C,Le Roux F,Borreg J J.Bacterial disease in marine bivalves,a review of recent studies:trends and evolution[J].A-quatic Living Resources,2004,17:477-498.
[4] Rojas R,Miranda C D,Opazo R,et al.Characterization and pathogenicity of Vibrio splendidus strains associated with massive mortalities of commercial hatchery-reared larvae of scallop Argopecten purpuratus(Lamarck,1819)[J].Journal of Invertebrate Pathology,2015,124:61-69.
[5] Jorquera M A,Silva F R,Riquelme C E.Bacteria in the culture of the scallop Argopecten purpuratus(Lamarck,1819)[J].Aquaculture International,2001,9(4):285-303.
[6] Godoy F,Espinoza M,Wittwer G,et al.Characterization of culturable bacteria in larval cultures of the Chilean scallop Argopecten purpuratus[J].Ciencias Marinas,2011,37(3):339-348.
[7] Sandaa R A,Magnesen T,Torkildsen L,et al.Characterisation of the bacterial community associated with early stages of great scallop (Pecten maximus),using denaturing gradient gel electrophoresis (DGGE)[J].Systematic and Applied Microbiology,2003,26 (2):302-311.
[8] Stackebrandt E,Goodfellow M.Nucleic Acid Techniques in Bacterial Systematics[M].Chichester:John Wiley&Sons Press,1991:115-175.
[9] Stackebrandt E,Goebel B M.Taxonomic note:a place for DNADNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J].International Journal of Systematic and Evolutionary Microbiology,1994,44(4):846-849.
[10] Shannon C E.A mathematical theory of communication[J].The Bell System Technical Journal,1948,27(3):379-423.
[11] Pielou E C.The measurement of diversity in different types of biological collections[J].Journal of Theoretical Biology,1996,13:131-144.
[12] Sørensen T.A method of establishing groups of equal amplitude in plant sociology based on similarity of species content and its application to analyses of the vegetation on Danish commons[J]. Kongelige Danske Videnskabernes Selskabs Biologiske Skrifter,1948,5(4):1-34.
[13] Schulze A D,Alabi A O,Tattersall-Sheldrake A R,et al.Bacterial diversity in a marine hatchery:balance between pathogenic and potentially probiotic bacterial strains[J].Aquaculture,2006,256 (1-4):50-73.
[14] 丁君,窦妍,徐高蓉,等.基于454焦磷酸测序分析虾夷扇贝外套膜菌群多样性[J].应用生态学报,2014,25(11):3344-3348.
[15] 肖建青,朱泓溢,刘祝祥,等.硇洲岛潮汐带牡蛎相关可培养细菌多样性[J].微生物学通报,2013,40(6):939-950.
[16] Beleneva I A,Zhukova N V.Seasonal dynamics of cell numbers and biodiversity of marine heterotrophic bacteria inhabiting invertebrates and water ecosystems of the Peter the Great Bay,Sea of Japan[J].Microbiology,2009,78(3):369-375.
[17] Nicolas J L,Corre S,Gauthier G,et al.Bacterial problems associated with scallop Pecten maximus larval culture[J].Diseases of Aquatic Organisms,1996,27(1):67-76.
[18] Torkildsen L,Lambert C,Nylund A,et al.Bacteria associated with early life stages of the great scallop,Pecten maximus:impact on larval survival[J].Aquaculture International,2005,13(6):575-592.
[19] Sandlund N,Torkildsen L,Magnesen T,et al.Immunohistochemistry of great scallop Pecten maximus larvae experimentally challenged with pathogenic bacteria[J].Diseases of Aquatic Organisms,2006,69(2-3):163-173.
[20] Dubert J,Osorio C R,Prado S,et al.Persistence of antibiotic resistant Vibrio spp.in shellfish hatchery environment[J].Microbial Ecology,2015,doi:10.1007/s00248-015-0705-5
[21] Guisande J A,Pérez Lago E,Prado S,et al.Genotypic diversity of culturable Vibrio species associated with the culture of oysters and clams in Galicia and screening of their pathogenic potential[J]. Journal of Shellfish Research,2008,27(4):801-809.
[22] Kesarcodi-Watson A,Miner P,Nicolas J L,et al.Protective effect of four potential probiotics against pathogen-challenge of the larvae of three bivalves:Pacific oyster(Crassostrea gigas),flat oyster (Ostrea edulis)and scallop(Pecten maximus)[J].Aquaculture,2012,344-349:29-34.
[23] Lim H J,Kapareiko D,Schott E J,et al.Isolation and evaluation of new,probiotic bacteria for use in shellfish hatcheries:I.isolation and screening for bioactivity[J].Journal of Shellfish Research,2011,30(3):609-615.
[24] Kapareiko D,Lim H G,Schott E J,et al.Isolation and evaluation of new probiotic bacteria for use in shellfish hatcheries:II.effects of a Vibrio sp.probiotic candidate upon survival of oyster larvae (Crassostrea virginica)in pilot-scale trials[J].Journal of Shellfish Research,2011,30(3):617-625.
[25] Riquelme C,Jorquera M,Rojas A,et al.Addition of inhibitorproducing bacteria to mass cultures of Argopecten purpuratus larvae(Lamarck,1819)[J].Aquaculture,2001,192(2):111-119. [26] Douillet P,Langdon C J.Effects of marine bacteria on the culture of axenic oyster Crassostrea gigas(Thunberg)larvae[J].Biological Bulletin,1993,184:36-51.
李明1,刘继晨2,孙雪莹2,赵学伟1,梁峻1,孙丕海3,马悦欣2
(1.獐子岛集团股份有限公司,辽宁大连116001;2.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;3.大连海洋大学海珍品苗种培育基地,辽宁大连116023)
Culturable bacterial diversity in larval breeding in Yesso scallop Patinopecten yessoensis
LI Ming1,LIU Ji-chen2,SUN Xue-ying2,ZHAO Xue-wei1,LIANG Jun1,SUN Pi-hai3,MA Yue-xin2
(1.Zhangzidao Group Co.Ltd.,Dalian 116001,China;2.Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China;3.Seafood Seedling Breeding Base,Dalian Ocean University,Dalian 116023,China)
The present study was aimed to examine the cultivable bacterial community associated with Yesso scallop Patinopecten yessoensis larval development stages(fertilized egg S1,trochophora S2,D-shaped larva S3,umbo larva S4,and juvenile scallop S5).Thirty bacterial strains were isolated from samples in each larval stage by Zobell 2216E,and 150 bacterial strains were identified by polymerase chain reaction and partial 16S rRNA gene sequencing.Results showed that all isolates were found to be in 2 phyla,3 classes,8 orders,12 families,16 genera and 39 species,with the most abundant Proteobacteria,followed by Firmicutes across the five developmental stages.At genus level,the dominant genera were Vibrio(51/150),Pseudoalteromonas(43/150),Bacillus(16/150)and Alteromonas(9/150),accounting for 79.3%of the total.Vibrio was dominant genus in stages of S1(43.3%),S2 (36.7%),S3(36.7%),followed by Pseudoalteromonas(26.7%),Planococcus(10.0%)and Virgibacillus (6.7%)in stage S1,Pseudoalteromonas(23.3%),Sulfitobacter(20.0%)and Bacillus(13.3%)in stage S2,and Pseudoalteromonas(16.7%),Planococcus(13.3%)and Alteromonas(10.0%)in stage S3.However,Pseudoalteromonas became the dominant in stages of S4(36.7%)and S5(40.0%),followed by Vibrio(30.0%),Bacillus(16.7%)and Alteromonas(10.0%)in stage S4,and Vibrio(23.3%),Bacillus(16.7%)and Pontibacillus (10.0%)in stage S5.The findings showed that there were abundant bacterial diversities and different communities among various larval development stages.
Patinopecten yessoensis larva;16S rRNA gene;bacterial diversity
Q938.1
A
10.16535/j.cnki.dlhyxb.2016.04.005
2095-1388(2016)04-0374-06
2015-11-03
獐子岛集团资助项目 (99801214);辽宁省科技攻关重大项目 (2015203003)
李明 (1987—),男,工程师。E-mail:goudanliming@163.com
马悦欣 (1963—),女,博士,教授。E-mail:mayuexin@dlou.edu.cn
