内毒素在高糖高脂饮食诱导的非酒精性脂肪性肝炎大鼠中的作用机制研究*
2016-09-26王文军郭建红张杨韩德五
王文军郭建红张杨韩德五
内毒素在高糖高脂饮食诱导的非酒精性脂肪性肝炎大鼠中的作用机制研究*
王文军①郭建红①张杨①韩德五①
目的:观察高糖高脂饮食诱导的非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)大鼠肝脏巨噬细胞、血浆肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达及肝细胞凋亡变化特点,探讨内毒素(LPS)在大鼠NASH发生发展中的作用机制。方法:雄性SD大鼠随机分为9周组:Synthetic diet+saline组、Synthetic diet+LPS组、Regular diet+LPS组和Regular diet+saline组;以及5周组:Synthetic diet组和Regular diet组,并在第5周末处死以观察高糖高脂饮食对大鼠肝脏影响。自第6周开始,9周组大鼠隔日皮下注射LPS 0.5 mg/kg或相同剂量的0.9%氯化钠注射液,在9周末处死检测其血浆LPS、ALT与TNF-α水平,并观察肝脏病理变化、测定肝脏CD68的表达与肝细胞凋亡水平。结果:5周Synthetic diet组肝脏有轻度脂肪变性。9周Synthetic diet+LPS组与其对照组Synthetic diet+saline组和Regular diet+LPS组相比,血浆LPS、ALT与TNF-α表达水平、CD68表达与细胞凋亡率均显著升高,差异均有统计学意义(P<0.05);Synthetic diet+saline组和Regular diet+saline组相比血浆LPS、ALT及TNF-α显著升高,差异有统计学意义(P<0.05)。CD68阳性表达与TNF-α水平呈显著正相关(r=0.64,P<0.05)结论:高糖高脂饮食诱导的NASH大鼠模型体内形成了LPS血症,LPS可对肝脏形成第二次打击,当CD68增加,TNF-α的表达也明显提高,两者呈现明显正相关,同时细胞凋亡率也明显增多,推断LPS可能通过激活巨噬细胞分泌促炎因子TNF-α介导肝细胞凋亡,进一步促进NASH的发展。
内毒素; 非酒精性脂肪性肝炎; 巨噬细胞; TNF-α; 凋亡
目前肥胖及其相关疾病在全球呈现流行趋势,是医学界面临的一大挑战,非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是一临床和病理学术语,疾病范围包括从简单的甘油三酯在肝细胞积累,肝脂肪变性和炎症、纤维化和肝硬化,常见于肥胖患者[1]。非酒精性脂肪性肝炎(nonalcoho lic steatohepatitis,NASH)是NAFLD的一种,为发达国家引起慢性肝脏疾病的最常见原因,它会导致肝硬化和肝细胞癌的风险增加[2-4]。因此明确NASH发病机制,阻止其病情进一步恶化,已成为当今医学界研究热点。
近年来的许多研究已证实肠源性内毒素(LPS)血症在NASH的形成发展中有着重要作用[5],在前期研究笔者发现在NASH中肝细胞凋亡率随病情加重而升高,提示肝细胞凋亡在NASH的病理发展过程中是一个极为重要的因素[6],但是目前LPS引起肝细胞凋亡机制尚不明确,本研究旨在通过高脂高糖饮食诱导建立NASH大鼠模型,多次小剂量注射LPS观察肝脏巨噬细胞与肿瘤坏死因子-α(tumor necrosis factor-a,TNF-α)的表达及肝细胞凋亡变化特点来探讨LPS在NASH大鼠中的作用机制。
1 材料与方法
1.1 实验动物 雄性SD大鼠30只,体重200~250 g,由山西医科大学实验动物中心提供。
1.2 主要试剂 丙氨酸氨基转移酶(alanine aminotransferase,ALT)测定试剂盒(南京建成生物工程研究所);LPS测定鲎试剂盒(上海伊华临床医学科技公司);TNF-α放免试剂盒(解放军总医院科技开发中心放免所);CD68小鼠抗大鼠单克隆抗体(Abcame公司),二抗免疫组化试剂盒(武汉博士德生物工程有限公司),TUNEL检测试剂盒(江苏凯基生物技术股份有限公司)。
1.3 方法
1.3.1 实验动物分组及模型建立 30只雄性SD大鼠均给予标准基础饲料,自由进食饮水3d后,设立9周组:Synthetic diet+saline 组、Synthetic diet+LPS组、Regular diet+LPS组、Regular
diet+saline组, 每组5只。 另外设立5周组,Synthetic diet组与Regular diet组,每组5只,在第5周末麻醉处死该组大鼠以观察高糖高脂对大鼠肝脏影响。Synthetic饮食配方为含68.75%普通饲料+20%猪油+10%蔗糖+1%胆固醇+0.25%胆酸。自第6周开始,9周组大鼠在相同条件下隔天皮下注射LPS 0.5 mg/kg或相同剂量的0.9%氯化钠注射液,所有大鼠自由进食与饮水。在实验第9周末,1%戊巴比妥钠3 mL/kg腹腔注射麻醉动物,无菌无热原条件下取腹主动脉血,3500 rpm离心后取血浆备用,取肝左叶10%福尔马林固定,石蜡包埋5 μm切片备用,余肝组织置于-70 ℃冰箱备用。
1.3.2 病理学检查 石蜡切片做HE染色,在光镜下观察肝组织病理变化。
1.3.3 生化指标检测 放免法测定血浆TNF-α水平;赖氏2、4-二硝基苯肼比色法测定血浆ALT活性,鲎试剂法测定血浆LPS水平,实验过程均严格按照试剂盒说明书进行检测。
1.3.4 免疫组织化学方法 石蜡切片免疫组化检测肝组织中CD68(巨噬细胞分子标记物)的表达,在400倍光镜下,每组取5张,每张随机选取取5个视野,运用Image-Pro Plus 6.0软件进行光密度值的测定。CD68表达阳性为光镜下细胞腺呈棕黄色颗粒。
1.3.5 TUNEL染色法 在400倍光镜下,每组取5张,每张切片随机选取5个视野,计算凋亡细胞数与总细胞数比值,测定细胞凋亡率。
1.4 统计学处理 本实验数据均采用SPSS 15.0统计学软件处理,计量资料以(±s)表示,比较采用t检验或单因素方差分析,计数资料的比较采用χ2检验,采用Pearson’s相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 肝脏组织学观察 光镜下5周Regular diet组大鼠正常肝组织肝小叶结构完整,肝细胞核圆位于中央,呈条索状排列整齐,以中央静脉为中心呈放射状排列,肝细胞内未见脂滴(图1A);而5周Synthetic diet组肝细胞体积增大,胞浆内可见小泡脂滴,肝细胞呈轻度脂肪变性,细胞轮廓模糊(图1B)。

图1 5周组大鼠肝组织病理变化(HE,×100)
2.2 各组生化指标检测结果比较 Synthetic diet+LPS组血浆LPS、ALT、TNF-α水平均显著高于Regular diet+LPS组和Synthetic diet+saline组比较差异均有统计学意义(P<0.05),血浆LPS、ALT、TNF-α表达水平分别为后两者的1.4~3倍、1.2~4倍、1.3~2倍。Synthetic diet+saline组与Regular diet+saline组相比血浆LPS、ALT、TNF-α均显著升高,差异均有统计学意义(P<0.05)。而Regular diet+LPS组血浆LPS、ALT与TNF-α水平与Regular diet+saline组比较差异均无统计学意义(P>0.05),见表1。
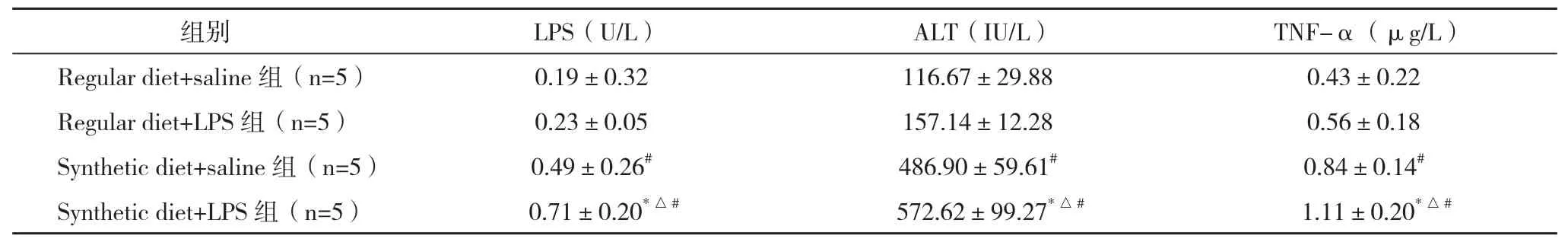
表1 9周组大鼠各生化指标的比较(x-±s)
2.3 各组免疫组化检测结果比较 Regular diet+saline组肝组织较少见CD68阳性单核巨噬细胞浸润,Regular diet+LPS组阳性表达量也无明显变化,与Regular diet+saline组比较差异无统计学意义(P>0.05);Synthetic diet+saline组CD68阳性表达量与Regular diet+saline组比较明显增多(P<0.05);而在Synthetic diet+LPS组可见大量巨噬细胞浸润,Synthetic diet+LPS组(1.24±0.36)与Synthetic diet+saline 组(0.76±0.18)、Regular diet+LPS组(0.41±0.11)比较差异均有统计学意义(P<0.05),见图2~3。

图2 各组大鼠肝组织中CD68的表达(IHC,X400)
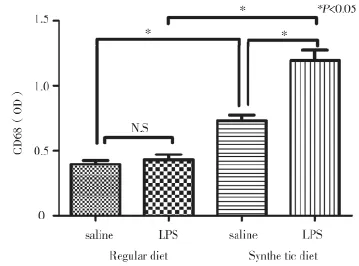
图3 各组大鼠CD68阳性表达平均光密度值比
2.4 各组肝细胞凋亡变化比较 在光镜下,正常肝细胞细胞核为蓝色,凋亡细胞细胞核为棕黄色,正常对照组(Regular diet+saline组)偶见少量的肝细胞凋亡,Regular diet+LPS组可以看到肝细胞凋亡数量无明显变化,凋亡率与Regular diet+saline组比较差异无统计学意义(P>0.05);而在Synthetic diet诱导建立的NASH大鼠模型中,肝细胞凋亡率明显升高,Synthetic diet+LPS组肝细胞凋亡率达到最高值,与Synthetic diet+saline组、Regular diet+LPS组比较差异均有统计学意义(P<0.05),见图4~5。

图4 各组大鼠肝细胞凋亡的变化(TUNEL,X400)
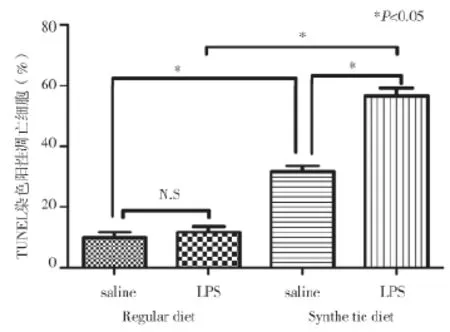
图5 各组大鼠TUNEL染色阳性凋亡细胞变化
2.5 相关性分析 经Pearson’s相关性分析,CD68阳性表达与TNF-α水平呈显著正相关(r=0.64,P<0.05)。
3 讨论
本研究采用高脂高糖饮食诱导建立大鼠非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)模型,在喂饲5周高脂高糖饮食的基础上,自第6周开始隔天皮下注射内毒素(LPS)0.5 mg/kg或相同剂量的0.9%氯化钠注射液,来观察肝脏细胞凋亡变化特点。研究结果显示Regular diet+LPS组大鼠肝脏并无明显脂肪病变,血浆LPS水平和肝损伤指标血浆ALT表达与Regular diet+saline组相比亦无显著变化;Synthetic diet+LPS组血浆LPS水平进一步升高、ALT表达亦明显进一步增加,肝功能受损加重,与Synthetic diet+saline组相比差异有统计学意义(P<0.05),提示同样剂量的LPS对正常肝脏不具损伤作用,而对在高糖高脂饮食的作用下发生轻度脂肪变性的肝脏造成了进一步损伤,使肝脏原有疾病加重,对肝脏形成第二次大击,促进了大鼠NASH的病情进展。
CD68是巨噬细胞的标志物,能较好的反映巨噬细胞在组织中的浸润程度,通常采用免疫组化检测CD68阳性表达[7-8]。Mita等[9]的研究显示,肝内过多表达的巨噬细胞在暴发性肝衰竭患者发病机制中会起到关键性作用。本研究显示,Regular diet+saline组肝组织较少见CD68标记的阳性单核巨噬细胞浸润,经LPS处理后Reyular+diet+LPS组数量并无明显变化,差异无统计学意义(P>0.05),而Synthetic diet+LPS组肝内CD68标记的阳性细胞数量明显高于Synthetic diet+saline组及Regular diet+LPS组,差异均有统计学意义(P<0.05),提示CD68分子标记的肝脏巨噬细胞在NASH的发病机制中发挥了一定的作用。
肿瘤死因子-α(tumor necrosis factor-α,TNF-α)具有促炎活性和免疫调节作用,是机体免疫反应和炎症反应的重要介质[10-11],可由激活的肝脏巨噬细胞分泌产生。革兰氏阴性杆菌细胞壁的主要成分LPS是肠源性内毒素的主要成分,是肝脏巨噬细胞最敏感的活化剂。据研究报道TNF-α的高表达与肝细胞凋亡具有显著的相关性[12],Kudo等[13]的研究显示LPS 上调了TNF-α 在NASH小鼠中的表达,并表明由TNF-α诱导的肝细胞凋亡增多。本研究结果发现Regular diet+LPS组与Regular diet+saline组比较,TNF-α的表达无明显变化,凋亡率也无明显差异,而在Synthetic diet+LPS组TNF-α的表达达到最大值,同时凋亡率也升到最高值,与Synthetic diet+saline组相比差异有统计学意义(P<0.05),本研究结果与Kudo等[13]的研究结果相一致,并进一步证实了在NASH中LPS会上调TNF-α表达,由TNF-α介导引起的肝细胞凋亡在NASH大鼠的发病机制中起着重要作用。
笔者认为在NASH大鼠中,因肠道黏膜屏障受损等原因,肠源性内毒素很容易进入全身血液循环,研究结果显示,Synthetic diet+LPS组血浆LPS水平与Synthetic diet+saline组相比显著升高,差异有统计学意义(P<0.05),提示NASH模型大鼠体内形成了LPS血症。据Rivera等[14]的研究报道,在NASH小鼠模型中CD14 mRNA的表达增强了细胞对LPS的敏感性,从而使LPS的生物活性大大增强[15-16],LPS进入血循环后,其脂质A部分与LPS结合蛋白(lipopolysaccharide binding protein,LBP)形成复合物,通过与表达在巨噬细胞表面的相应受体结合,激活单核-巨噬细胞释放大量的TNF-α[17],与表达在肝细胞膜的TNF受体结合导致肝细胞损伤,并由此介导肝细胞的凋亡,最终促进NASH的发展。
在对TNF-α水平的表达和CD68标记的阳性细胞表达进行Pearson’s相关性分析后,笔者发现在NASH中TNF-α的表达与CD68的表达呈明显的正相关[18-19],推测NASH中LPS可激活巨噬细胞释放大量TNF-α,从而增强了TNF-α介导的肝细胞凋亡[20-21],未来还需要做进一步研究来探讨LPS在NASH中的确切机制,为治疗NASH和肝硬化等疾病提供理论依据。
[1] Fukunishi S,Nishio H,Fukuda A,et al.Development of fibrosis in nonalcoholic steatosis through combination of a synthetic diet rich in disaccharide and low-dose lipopolysaccharides in the livers of Zucker (fa/fa) rats[J].Journal of Clinical Biochemistry and Nutrition,2009,45(3):322-328.
[2] Caldwell S H,Crespo D M.The spectrum expanded: cryptogenic cirrhosis and the natural history of non-alcoholic fatty liver disease[J].J Hepatol,2004,40(4):578-584.
[3] Suzuki D,Hashimoto E,Kaneda K,et al.Liver failure caused by non-alcoholic steatohepatitis in an obese young male[J]. J Gastroenterol Hepatol,2005,20(2):327-329.
[4]赵丽琴,赵龙凤,李红.130例非酒精性脂肪肝患者临床分析[J].中国医学创新,2014,11(12):46-48.
[5] Vanni E,Bugianesi E.The gut-liver axis in nonalcoholic fatty liver disease:Another pathway to insulin resistance[J].J Hepatology,2009,49(6):1790-1792.
[6]郭建红,杨丽红,脂多糖对非酒精性脂肪性肝炎大鼠肝细胞凋亡的影响[J].山西医科大学学报,2011,42(7):529-531.
[7] Shi S H,Jiang L,Xie H Y,et al.The effect of secondary cholestasis on the CD68-positive and CD163-positive macrophage population,cellular proliferation,and apoptosis in rat testis[J]. Journal of Reproductive Immunology,2015,110(20):36-47.
[8] Akbarshahi H,Menzel M,Bauden M P,et al.Enrichment of murine CD68+CCR2+and CD68+CD206+lung macrophages in acute pancreatitis-associated acute lung injury[J].PLoS One,2012,7(10):e42 654.
[9] Mita A,Hashikura Y,Tagawa Y I,et al.Expression of Fas ligand by hepatic macrophages in patients with fulminant hepatic failure[J].Am J Gastroenterol,2005,100(11):2551-2559.
[10]韩德五.肠源性内毒素血症与肝病[M].北京:中国科学技术出版社,2004:450-488.
[11] Wu X,Terumi T,Yutaka Y, et al.TNF-a mediated inflammatory macrophage polarization contributes to the pathogenesis of steroid-induced osteonecrosis in mice[J]. International Journal of Immunopathology and Pharmacology,2015,28(3):351-361.
[12] Tao Y Y,Yan X C,Zhou T,et al.Fuzheng Huayu recipe alleviates hepatic fibrosis via inhibiting TNF-α induced hepatocyte apoptosis[J].BMC Complementary and Alternative Medicine,2014,14(1):1-13.
[13] Kudo H,Takahara T,Yata Y,et al.Lipopolysaccharide triggered TNF-α-induced hepatocyte apoptosis in a murine non-alcoholic steatohepatitis model[J].J Hepatology,2009,58 (1):168-175.
[14] Rivera C A,Adegboyega P,van Rooijen N,et al.Tolllikereceptor-4 signaling and Kupffer cells play pivotal roles in the pathogenesis of non-alcoholic steatohepatitis[J].J Hepatol,2007,56(4):571-579.
[15] He Y,Liu S,Kling D E,et al.The human milk oligosaccharide 2’-fucosyllactose modulates CD14 expression in human enterocytes, thereby attenuating LPS-induced inflammation[J]. Gut,2016,65(1):33-46.
[16]夏耘.银屑病患者外周血白细胞膜CD14及血浆可溶性CD14表达的临床意义分析[J].中国医学创新,2014,11 (8):3-5.
[17] Su G L,Lipopolysaccharides in liver injury:molecular mechanisms of Kupffer cell activation[J].Am J Physiol Gastrointest Liver Physiol,2002,283(2):G256-265.
[18]鲁晓岚,罗金燕,王文勇,等.TNFα、Leptin-Rb、NF-κB 和PPAR-γ在酒精性肝病大鼠肝细胞中的表达[J].西安交通大学学报:医学版,2008,29(5):508-512.
[19]李宏云.脂多糖诱导大鼠肺泡巨噬细胞NF-κB活化及TNF-α 释放的实验研究[J].郑州:郑州大学,2003.
[20]刘欣,韩德五,郭建红,等.内毒素在NASH发展为肝纤维化中的作用[J].山西医科大学学报, 2010, 41(6):488-491.
[21]魏艳玲,陈东风. NASH的免疫学发病机制研究现状[J].实用肝脏病杂志,2013,18(6):571-573.
Pathogenesis Study of Lipopolysaccharide on High Fat and High Sugar-induced Non-alcoholic
Steatohepatitis in Rats
/WANG Wen-jun,GUO J ian-hong,ZHANG Yang,et al.//Medical Innovation of China,2016,13(25):019-023
Objective:To observe liver macrophages,tumor necrosis factor-α(TNF-α) expression of high-sugar high-fat diet-induced non-alcoholic steatohepatitis (NASH) rat and liver changes of cell apoptosis,to explore LPS development mechanism occurs in the rat NASH.Method:SD rats were randomly divided into nine weeks group:Synthetic diet+saline group,Synthetic diet+LPS group,Regular diet+LPS group and Regular diet+saline group.The establishment of five additional weeks group:Synthetic diet group and the Regular diet group,and in the fifth week were sacrificed in order to observe the effects on the liver Synthetic diet.Since the first 6 weeks,the 9 weeks group of rats injected subcutaneously every other day LPS 0.5 mg/kg or the same dose of saline,were killed in the weekend 9 detected in plasma LPS,ALT and TNF-α levels and liver pathology observed,measured liver CD68 expression and the level of apoptosis.Result:The 5 weeks Synthetic diet group had mild liver steatosis.The 9 weeks Synthetic diet+LPS group compared to the control group Synthetic diet+saline group and Regular diet+LPS,plasma LPS、ALT and TNF-α expression levels,CD68 expression and cell apoptosis rate significantly increased,and were statistically significant(P<0.05).Synthetic diet+saline group compared to Regular diet+saline group,plasma LPS,ALT and TNF-α significantly increased,with statistical significance(P<0.05).CD68 positive expression and TNF-α levels were positively related(r=0.64,P<0.05). Conclusion:High-sugar high-fat diet-induced rat model of NASH in vivo formation of endotoxemia,LPS can form “two-hit” to the liver,when CD68 increased expression of TNF-α are also significantly improved,both show significant positive correlation,while apoptosis rate is significantly increased,we infer that LPS can activated macrophages to secrete TNF and induced apoptosis in liver cells,further promote the development of NASH.
Lipopolysaccharide; Non-alcoholic steatohepatitis; Macrophage; Tumor necrosis factor-α; Apoptosis
10.3969/j.issn.1674-4985.2016.25.006
2016-04-26) (本文编辑:蔡元元)
山西省基础研究项目(2013011054-2)
①山西医科大学 山西 太原 030001
郭建红
First-author’s address:Shanxi Medical University,Taiyuan 030001,China
