疏血通注射液的抗凝生物活性测定方法及其机制研究△
2016-09-25张忠兵王思瑶郑顺亮夏柯李志川陈艳明
张忠兵,王思瑶,郑顺亮,夏柯,李志川,陈艳明,4
(1.北京友博药业有限责任公司,北京 101300;2.牡丹江友搏药业股份有限公司,黑龙江 牡丹江 157013;3.美国TOLEDO大学,美国 俄亥俄州 43614;4.天津大学 药物科学与技术学院,天津 300192)
疏血通注射液的抗凝生物活性测定方法及其机制研究△
张忠兵1,2*,王思瑶1,2,郑顺亮1,2,夏柯1,2,李志川3,陈艳明1,2,4
(1.北京友博药业有限责任公司,北京 101300;2.牡丹江友搏药业股份有限公司,黑龙江 牡丹江 157013;3.美国TOLEDO大学,美国 俄亥俄州 43614;4.天津大学 药物科学与技术学院,天津 300192)
目的:建立适合的疏血通注射液抗凝生物活性测定的方法,并探索疏血通注射液的抗凝作用机理。方法:通过实验建立了疏血通注射液生物活性测定的3钟方法,即《中华人民共和国药典》上收载的凝血酶滴定法(挑丝法)、临床上常用的凝血仪测定法、以及国际上通用的测定凝血酶活性的荧光共振能量转移(FRET)法,并进行了3种方法的比较。结果:确定3种方法都可以使用,但以FRET法比较稳定,受人工操作误差影响小,灵敏度最高。结论:建立了适合疏血通注射液的3种抗凝生物活性方法。通过测定疏血通注射液对活化部分凝血酶时间(APTT)、凝血酶原时间(PT)、凝血酶时间(TT)的影响,以及对凝血酶活性的抑制作用,推测凝血酶可能是疏血通注射液抗凝作用的主要靶点。
疏血通注射液;抗凝;凝血酶
疏血通注射液是由水蛭、地龙两味中药组方,采用低温浸渍、超微研磨、反复冻融、热压处理和超滤等现代工艺提取有效成分精制而成的中药注射剂,临床用于急性脑梗死的治疗,安全性较好,疗效确切[1-2]。研究表明疏血通注射液具有抗凝、溶栓、调节血脂、改善血液流变学、细胞保护等药理作用[3-6]。
研究已经证明疏血通注射液体内给药后具有一定的抗凝活性,能明显延长小鼠的凝血时间[3]。目前《中华人民共和国药典》对于水蛭药材的抗凝生物活性采用凝血酶滴定法(挑丝法),该方法适合于具有较强抗凝活性的样品测定。疏血通注射液由于仅保留了药材中的活性小分子成分,其药理作用相对温和,本研究采用体外试验为主,比较了传统的挑丝法、临床上常用的血凝仪测定法、以及高灵敏度的荧光共振能量转移(FRET)抗凝血酶生物活性测定法,以求探索建立适合疏血通注射液的抗凝生物活性测定方法,并对其抗凝机制进行一定的探讨。
1 仪器与材料
1.1 仪器与试剂
EnSpireTMMultilabel Plate Reader微孔板检测仪配备Wallac EnVision Manager 1.12软件系统(Perkin Elmer公司),C2000-4半自动血凝仪(北京普利生仪器有限公司)。
1.2 材料
凝血酶、牛纤维蛋白原(中国食品药品检定研究院),SensoLyte®520凝血酶活性测定试剂盒(美国AnaSpec公司),活化部分凝血酶时间(APTT)、凝血酶原时间(PT)、凝血酶时间(TT)测定试剂盒(北京普利生仪器有限公司)。疏血通注射液(牡丹江友搏药业股份有限公司生产,批号:12040312,12051821,12052621)。
1.3 动物
雄性SD大鼠,SPF级,体重250 g左右(北京华阜康生物科技股份有限公司),实验动物许可证号:SCX(京)2012-0001。
2 方法
2.1 凝血酶滴定法(挑丝法)
方法并适当调整[7],精密量取本品6.0 mL,减压浓缩(50~60 ℃)至干,残渣加水溶解并完全转移至2 mL量瓶中,加水至刻度,摇匀,精密量取100 μL,置适宜白瓷板中,加入含0.5%(牛)纤维蛋白原的三羟甲基氨基甲烷盐酸缓冲液(临用配制)200 μL,搅匀,置水浴(37±0.5)℃温热5 min,滴加每1mL中含10单位的凝血酶溶液(每1 min滴加1次,每次5 μL,边滴加边轻轻搅匀)至出现整块可挑起透明凝胶状沉淀,记录消耗凝血酶溶液的体积,按公式(1)计算。
U=C1V1/(C2V2)
(1)
式中:U—每1 mL疏血通原液中含抗凝血酶活性单位,中和一个单位的凝血酶的量为一个抗凝血酶活性单位;C1—凝血酶溶液的浓度,U·mL-1;C2—供试品溶液的浓度,为3.0 mL原液·mL-1;V1—消耗凝血酶溶液的体积,μL;V2—供试品溶液的加入量,μL。
2.2 血凝仪测定法
SD大鼠10%水合氯醛麻醉后,腹主动脉取血,加3.2%枸橼酸钠溶液(1∶9)抗凝,静置1 h后,3000 r·min-1离心15 min制备大鼠血浆,在测量杯中加入大鼠血浆50 μL后,加入不同浓度的疏血通注射液以及相关测定试剂,按北京普利生公司APTT、PT、TT试剂盒方法操作,以肝素钠作为阳性对照,测定血液凝固时间。
2.3 荧光共振能量转移(FRET)法
采用AnaSpec公司试剂盒,照试剂盒说明书中微孔板方法操作,先后将测试缓冲液、凝血酶、疏血通注射液(必要时将注射液冻干成粉,并用蒸馏水溶解适当稀释至所需剂量)加入底部透明的黑色96孔板(Perkin Elmer公司)测试孔中(总体积为50 μL),37 ℃预热微孔板15 min后,加入50 μL凝血酶荧光底物溶液使反应总体积为100 μL,37 ℃避光反应30 min后,加入反应终止液50 μL。设定激发光485 nm、发射光535 nm,立即测定荧光密度(RFU)。按公式(2)计算疏血通注射液的抗凝血酶活性。
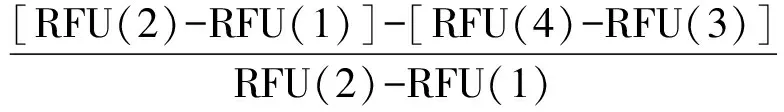
(2)
式中:RFU(1)—不加入凝血酶以及疏血通注射液测试孔荧光读数; RFU(2)—加入凝血酶,不加入疏血通注射液的测试孔荧光读数; RFU(3)—不加入凝血酶,加入疏血通注射液的测试孔荧光读数; RFU(4)—加入凝血酶以及疏血通注射液的测试孔荧光读数。
3 结果与讨论
3.1 凝血酶滴定法测定疏血通注射液抗凝血酶活性量效关系
取50 mL(批号:12040312)疏血通注射液,减压浓缩(50~60 ℃)至干,残渣加水溶解并完全转移至5 mL量瓶中,加水至刻度,摇匀,则浓缩药液浓度为10 mL原液·mL-1;将浓缩药液与纯水以相应比例混合,制成10个剂量梯度疏血通药液作为测试用样品溶液,依次编号为1~10号。精密量取以上测试用样品溶液各100 μL,置适宜白瓷板中,照凝血酶滴定法操作,记录滴定终点时间和消耗凝血酶活性单位,按公式计算抗凝血酶活性。活性测定结果见表1,消耗凝血酶活性单位、抗凝血酶活性与疏血通注射液的量效关系曲线见图1。

表1 不同剂量疏血通注射液抗凝血酶活性测定
注:*表示加入滴定体系中测试用样品溶液相当于注射液原液的体积(mL)。

图1 不同剂量疏血通注射液消耗凝血酶活性单位曲线图
由图1可见,当滴定体系中加入疏血通注射液0.20~0.22 mL时,其滴定终点时间和消耗凝血酶活性单位与0.9%氯化钠溶液相当,此为凝血酶滴定液的空白消耗;而当加入疏血通注射液剂量在0.28~0.44 mL时,疏血通注射液剂量与消耗的凝血酶活性单位均呈良好线性关系,因此在此区间内可以较准确测定抗凝血活性,当疏血通注射液剂量大于0.6 mL时,其抗凝血酶活性太强,需消耗较多的凝血酶滴定液,会在一定程度上扩大滴定体系(酶反应体系),出现无法确定滴定终点的现象。
3.2 凝血酶滴定法测定疏血通注射液抗凝血酶活性
分别精密量取3批疏血通注射液样品各6.0 mL,按2.1中方法操作,计算抗凝血酶活性,测定结果见表2。
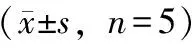
表2 疏血通注射液抗凝血酶活性测定表
3.3 血凝仪测定法测定疏血通注射液的抗凝活性
SD大鼠10%水合氯醛麻醉后,腹主动脉取血,静置1 h后,3000 r·min-1离心15 min制备大鼠血浆,在测量杯中加入10~50 μL疏血通注射液后,以肝素钠(2 U·mL-1)作为阳性对照,按北京普利生公司APTT、PT、TT试剂盒方法操作,测定各自血液凝固时间。结果发现,疏血通注射液在10~50 μL均不能有效延长APTT和PT,而对于TT的延长呈现一定的量效关系,见表3。TT按说明书操作,加入50 μL疏血通注射液后,测定3批疏血通注射液的大鼠血浆TT,见表4。
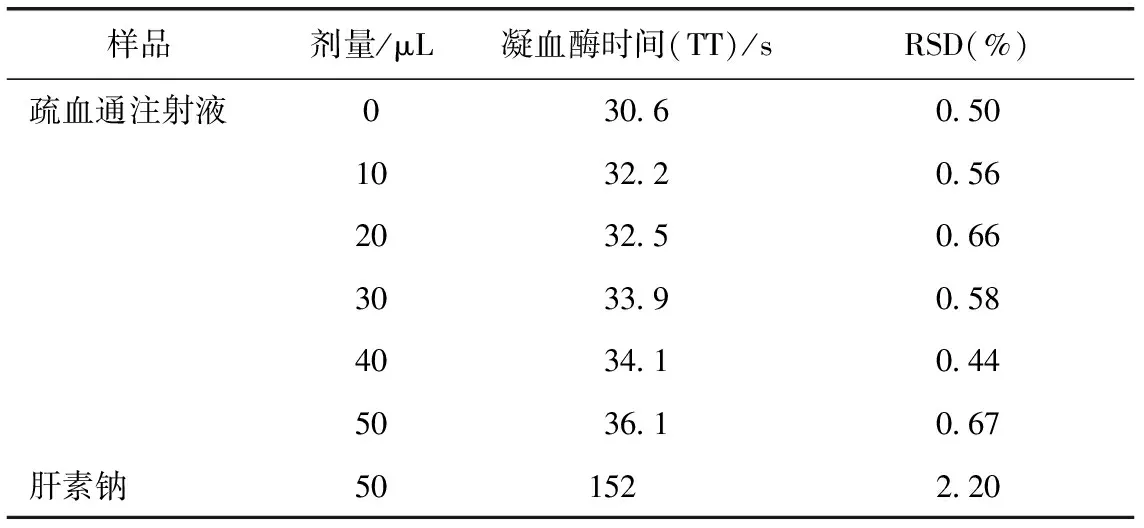
表3 不同剂量疏血通注射液对大鼠血浆凝血酶时间的影响(n=5)
注:疏血通注射液批号为12040312。
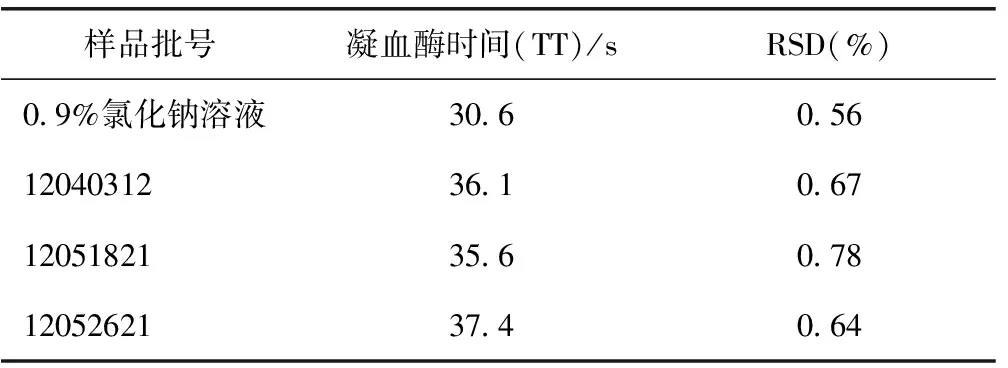
表4 3批疏血通注射液的大鼠血浆凝血酶时间(n=5)
图2所示的凝血酶凝血过程是一系列凝血因子被相继酶解激活的过程,最终生成凝血酶,形成纤维蛋白凝块[8]。凝血过程通常分为内源性凝血途径、外源性凝血途径和共同凝血途径。临床上常以APTT来反映体内内源性凝血途径的状况,以PT测定来反映外源性凝血途径的状况。APTT涉及到凝血因子Ⅱ、Ⅴ、Ⅷ、Ⅹ、Ⅺ、Ⅻ,前血管舒张素及高分子量激肽酶;PT涉及的凝血因子主要有Ⅱ、Ⅴ、Ⅶ、Ⅹ。从因子Ⅹ被激活至纤维蛋白形成,是内源、外源凝血的共同凝血途径,涉及到的凝血因子主要是Ⅹ、Ⅱ。从实验分析,疏血通注射液对于APTT和PT均没有作用,只能延长TT,其作用的凝血过程应该是共同凝血途径阶段,凝血酶可能是其主要的抗凝作用靶点。
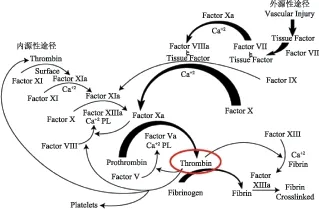
图2 凝血因子参与的凝血过程示意图
3.4 FRET法检测疏血通注射液的抗凝血酶活性
按前述AnaSpec公司试剂盒方法操作,考察疏血通注射液(批号:12040312)对凝血酶活性的量效关系,结果见图3。由图3可见,疏血通注射液在低浓度时对凝血酶活性的影响存在较大的误差,且抑制曲线不规则;高浓度的疏血通注射液(体系中加入16 μL以上时)对凝血酶的抑制呈现类似的线性关系,这与3.1中凝血酶滴定法所得结果一致。水蛭中的水蛭素为迄今为止发现的最强的天然凝血酶抑制剂,水蛭素对凝血酶的抑制作用相对独立,无需其他凝血因子或血浆成分参与,与凝血酶和纤维蛋白原以特定比例结合成复合物,通过对凝血酶特异性的直接抑制作用阻断其凝血功能[9]。笔者曾运用本法测定水蛭素对凝血酶的抑制作用,呈现比较完美的线性关系。推测疏血通注射液中可能含有水蛭素相似的肽类分子,对于凝血酶有类似的线性抑制。
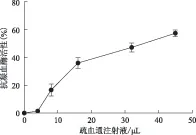
图3 疏血通注射液抗凝血酶活性的量效关系图
运用上述方法,对3批疏血通注射液进行测定(加入样品量16 μL),发现3批疏血通注射液抗凝血酶活性比较接近,说明产品具有良好的均一性。相关数据见表5。
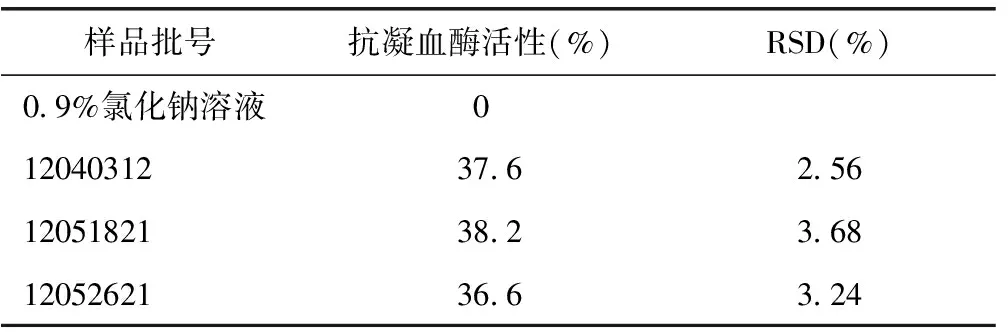
表5 疏血通注射液的抗凝血酶活性
4 结论
疏血通注射液由于其制备工艺中仅保留了水蛭、地龙药材中的活性小分子成分,其药理作用相对温和,临床使用过程中出血性倾向等不良反应较少,但这也给其活性测定方法的开发带来一定的难度。本研究采用体外试验为主,比较了传统的凝血酶滴定法(挑丝法)、临床上常用的血凝仪测定法、以及FRET抗凝血酶生物活性测定法。凝血酶滴定法(挑丝法)操作相对简单,不需要复杂的仪器设备,但该方法靠人工挑丝来肉眼观察滴定终点,存在一定的操作误差。且该方法灵敏度较低,需疏血通注射液冻干浓缩后在一定的剂量范围内方可使用本方法。血凝仪测定方法需要采取新鲜血浆进行测定,受血浆来源影响其方法的实施和推广有一定的难度。FRET法灵敏度相对较高,采用注射液原液即可测定,方法比较稳定,是一种可靠的生物活性测定方法,但需要具备一定的仪器和试剂条件。
对疏血通注射液的抗凝机制分析可以发现,疏血通注射液对APTT和PT均没有影响,仅对TT有一定的延长,说明其作用的凝血过程应该是共同凝血途径阶段。而挑丝法和FRET方法均针对凝血酶进行测定,因此推测凝血酶可能是疏血通注射液主要的抗凝作用靶点。
参考文献
[1] 丁玉峰,胡敦梅,徐传新,等.疏血通注射液治疗急性脑梗死的系统评价[J].中国医院药学杂志,2011,31(22):1846-1850.
[2] 吴永明,姬仲,王静新,等.疏血通注射液治疗急性脑梗死疗效的汇总分析[J].国际脑血管病杂志,2010,18(3):193-198.
[3] 刘晓晶,李振国,黄清梅.疏血通注射液抗凝溶栓作用的实验研究[J].中医药信息,2002,19(3):66-68.
[4] 张璇,肖兵,胡长林.疏血通注射液抗栓、溶栓作用机制的研究[J].中国中药杂志,2005,30(24):1950-1952.
[5] 徐巨海,朱贵爱,杜丽娟,等.疏血通对肾病综合征患者血脂、血液流变学的影响[J].宁夏医学杂志,2003,25(3):156-157.
[6] 朱欢丽.疏血通对糖尿病患者血液流变学的影响[J].医药导报,2004,23(11):823-824.
[7] 刘义梅,喻珊,崔瑞勤,等.凝血酶滴定法测定宽体金线蛭抗凝血活性的影响因素[J].中国药师,2014,17(5):789-793.
[8] Davie EW1.A brief historical review of the waterfall/cascade of blood coagulation[J].J Biol Chem,2003,278(51):50819-50832.
[9] 张和韡,王丽萍.水蛭素的研究进展[J].中国中西医结合肾病杂志,2013,14(1):76-78.
StudyonAssayMethodsandMechanismofAnticoagulantActivityofShuxuetongInjection
ZHANG Zhongbing1,2*,WANGSiyao1,2,ZHENGShunliang1,2,XIAKe1,2,LIZhichuan3,CHENYanming1,2,4
(1.BeijingYouboPharmaceuticalCorporation,Ltd.,Beijing101300,China;2.MudanjiangYouboPharmaceuticalCorporation,Ltd.,Mudanjiang157013,China;3.UniversityofToledo,Ohio43614,theUnitedStatesofAmerica;4.CollegeofPharmaceuticalScienceandTechnology,TianjinUniversity,Tianjin300192,China)
Objective:To establish the methods of Shuxuetong Injection’s anticoagulant activity assay and study the mechanism of its anticoagulation.Methods:Three test methods were developed and compared,which werethrombin titration method included in Chinese Pharmacopoeia,determination of plasma coagulation by analyzer commonly used in clinical and thrombin activity assaythrough fluorescence resonance energy transfer(FRET) kit.Results:All the methods couldbe used to determine the Shuxuetong Injection’s activity,but the FRET method wasmore stable and sensitive,with less human operation error.Conclusion:Three anticoagulant activityassay methods were established.Through determination of the activated partial thromboplastintime(APTT),prothrombin time(PT),thrombin time(PT),and the inhibition of the thrombin activity,thrombinhad been identified as the anticoagulant target of Shuxuetong Injection.
Shuxuetong Injection;anticoagulant;thrombin
2015-06-12)
重大新药创制国家科技重大专项(2014ZX09201022-010)
*
张忠兵,博士,高级工程师,研究方向:心血管药理学,Tel:(010)89491757,E-mail:okzzb2000@sina.com
10.13313/j.issn.1673-4890.2016.5.006
