草麻黄茎中一个黄酮苷的NMR数据归属及活性研究
2016-09-25赵巍胡琴马林秦海林
赵巍,胡琴,马林,秦海林*
(1.北京市药品检验所 北京市保健食品化妆品检验中心,北京 102206;2.中国医学科学院 北京协和医学院 药物研究所 天然药物活性物质与功能国家重点实验室,北京 100050)
·基础研究·
草麻黄茎中一个黄酮苷的NMR数据归属及活性研究
赵巍1,2,胡琴1,马林2,秦海林2*
(1.北京市药品检验所 北京市保健食品化妆品检验中心,北京 102206;2.中国医学科学院 北京协和医学院 药物研究所 天然药物活性物质与功能国家重点实验室,北京 100050)
目的:对化合物3-O-α-L-吡喃鼠李糖基-7-O-β-D-吡喃葡萄糖基山柰酚进行DMSO-d6中核磁共振波谱数据归属并对其活性进行研究。方法:利用溶剂提取法和硅胶柱色谱法对草麻黄茎中的化学成分进行分离,得到一个黄酮糖苷类化合物;本文选用DMSO-d6为溶剂,采用一维和二维核磁共振(1D和2D NMR)技术完成了其1H-和13C-NMR化学位移的全归属。通过降血脂细胞模型实验与具有较强降脂能力的阳性对照相比进行评价。结果:通过波谱分析鉴定其结构为3-O-α-L-吡喃鼠李糖基-7-O-β-D-吡喃葡萄糖基山柰酚,该化合物对三酰甘油有明显的抑制作用。结论:本研究获得了分辨比较清晰的β-D-吡喃葡萄糖基和α-L-吡喃鼠李糖基的1H-NMR信号,发现该化合物与阳性对照物比较对三酰甘油有明显的抑制作用,本文首次报道了其药理活性。
草麻黄;3-O-α-L-吡喃鼠李糖基-7-O-β-D-吡喃葡萄糖基山柰酚;NMR数据归属;DMSO-d6;降脂活性
草麻黄是中药麻黄的基原植物之一,为麻黄科Ephedraceae麻黄属植物草麻黄EphedrasinicaStapf的干燥草质茎,主要分布于辽宁、吉林、内蒙古、河北、山西、河南西北部及陕西等省区,有发汗、散寒、平喘、利水的功效,中医用于治疗风寒感冒、咳喘、支气管哮喘、水肿等症[1]。在对包括草麻黄在内的麻黄属植物的化学成分研究方面,已报道了苯异丙胺生物碱、N-取代乙酰胺糖苷、黄酮类化合物和有机酸等多类成分[2-5]。在我们深入研究草麻黄的化学成分过程中,又得到了一个黄酮类化合物,通过波谱分析鉴定其结构为3-O-α-L-吡喃鼠李糖基-7-O-β-D-吡喃葡萄糖基山柰酚。已有文献报道了其以氘代甲醇为溶剂的核磁共振波谱数据,但报道的数据中存在糖单元信号分辨不清的问题[6]。因此,本文选用DMSO-d6为溶剂,测定了该化合物的1H 和13C-NMR图谱,并采用二维核磁共振(2D NMR)技术完成了其1H和13C-NMR化学位移的全归属。特别是采用1D TOCSY实验对β-D-吡喃葡萄糖基和α-L-吡喃鼠李糖基的1H-NMR信号的偶合常数进行了补充。此外,本文还采用降脂细胞模型评价了3-O-α-L-吡喃鼠李糖基-7-O-β-D-吡喃葡萄糖基山柰酚对血脂的影响,结果表明该化合物对三酰甘油(TG)的抑制率明显高于阳性药物的抑制率。
1 仪器与试药
Q-STAR型质谱仪,Bruker Avance-Ⅲ-600型核磁共振波谱仪;柱色谱硅胶(200~300目)和薄层色谱用硅胶GF254均为青岛海洋化工厂产品。实验所用试剂均为分析纯。
实验药材购于安徽亳州药材市场,由中国医学科学院药物研究所马林副研究员鉴定为麻黄科麻黄属植物草麻黄EphedrasinicaStapf的干燥草质茎。
对照药物:罗格列酮(江苏恒瑞医药股份有限公司)。HepG2细胞(美国ATCC细胞库)。
2 方法与结果
2.1 提取与分离
取草麻黄的干燥草质茎30 kg,用80%乙醇回流提取3次,每次加热回流时间分别为2、1、1 h;合并提取液,减压浓缩后得到提取粗浸膏(4.2 kg)。将此粗浸膏与800 mL蒸馏水和1300 mL 80%乙醇水溶液混悬,先连续用石油醚和乙酸乙酯萃取,继用正丁醇萃取,减压回收溶剂后得到正丁醇萃取物(67 g),该萃取物用200~300目硅胶柱色谱分离,用三氯甲烷-甲醇混合溶剂进行梯度洗脱(100∶0-100∶1-50∶1-25∶1-15∶1-10∶1-5∶1-3∶1-1∶1-0∶1)分离,得到不同的部分。将三氯甲烷-甲醇(5∶1-3∶1)洗脱部分,再进行硅胶柱色谱分离,三氯甲烷-甲醇系统梯度洗脱(5∶1),得到化合物1(8 mg)。
2.2 结构鉴定
化合物1为黄色粉末,负离子模式ESIMS给出准分子离子峰m/z593.4 [M-H]-。在1H-NMR 谱中,芳香区显示典型的苯环AA′BB′偶合系统质子共振峰δ 7.73 (2H,d,J=8.4 Hz,H-2′,6′)和6.90 (2H,d,J=8.4 Hz,H-3′,5′)以及典型的1、2、3、5四取代的苯环质子共振峰δ 7.73 (1H,d,J=1、8 Hz,H-8)和6.43 (1H,d,J=1.8 Hz,H-6)信号。结合在1H-NMR谱上没有黄酮类化合物H-3的信号,但显示有两个酚羟基信号δ 12.61 (1H,s,OH-5)和10.26 (1H,s,OH-4′),可以确定化合物1为4′、3、5、7-四氧取代的黄酮醇类化合物。在HSQC谱上,上述两个羟基质子均没有与任何碳信号相关,进一步确证了其为酚羟基。在1H-NMR谱上还给出两个糖端基质子信号δ 5.23 (1H,br s,H-1″)和4.98 (1H,d,J=7.2 Hz,H-1‴),以及一个与次甲基相连的甲基质子信号δ 0.74 (3H,d,J=6.0 Hz,6″-CH3),结合在δ 3.11~3.96共有10个质子的多重峰,可以确定化合物1含1个六碳糖和1个6-去氧六碳糖。通过1D TOCSY实验准确确定了两个糖的各个质子的1H-NMR共振峰,各共振峰的偶合常数见表1。因此,根据偶合常数可以明确确定一个糖为β-吡喃葡萄糖,另一个为α-吡喃鼠李糖。在13C-NMR 谱中共有27个碳信号,结合HSQC实验,将其分类为1个羰基、8个不连氢芳香碳、16个次甲基、1个亚甲基和1个甲基;这些数据与1H-NMR数据完全对应。因此,通过HMBC实验中H-6与C-5、C-7、C-8、C-10,H-8与C-6、C-7、C-9、C-10,H-2′/6′与C-2、C-1′、C-3′/5′、C-4′,以及H-3′/5′与C-1′、C-2′/6′、C-4′有远程碳氢相关,可以确定化合物1的黄酮醇母核为山柰酚。特别是通过HMBC实验中葡萄糖基的端基质子信号与C-7的远程相关以及鼠李糖基端基质子的信号与C-3的远程相关可以明确确定葡萄糖基与C-7相连,而鼠李糖基与C-3相连(见图1)。在IDNOE差谱中,通过照射δH4.98的氢核,发现δH6.73(H-8)出现增益,进一步证实葡萄糖基连在7位。因此化合物1的结构确定为3-O-α-吡喃鼠李糖基-7-O-β-吡喃葡萄糖基山柰酚,其1H和13C-NMR数据归属见表1。
2.3 药理活性
相关文献表明黄酮类化合物具有降脂活性,为此采用降脂细胞模型进行研究。取0.25 mmol·L-1油酸(OA)刺激HepG2肝癌细胞,24 h后能够导致细胞内脂质堆积,接种于96孔板中,培养条件37 ℃,5% CO2。每孔100 μL培养基,设置不含细胞的对照孔,分别加入对照物罗格列酮10-5mmol·L-1和筛选物10-5、10-6mmol·L-1,孵育24 h后测定胞内TG水平。结果显示,筛选物能够使胞内TG分别降低23.9%和16.2%,阳性药能够使TG降低14.9%。表明同一浓度和低浓度下,筛选物对TG的抑制率明显高于阳性药物的抑制率。

表 1 化合物1的1H (600 MHz,DMSO-d6) 和 13C (150 MHz,DMSO-d6) NMR 数据
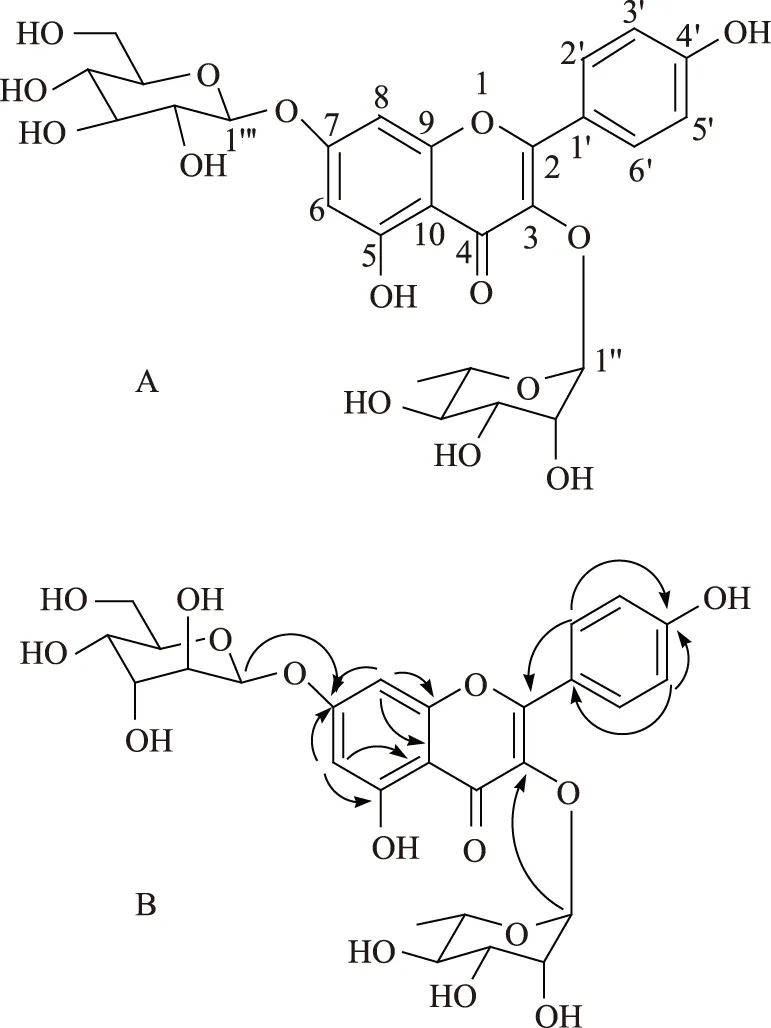
注:A.化学结构;B.HMBC相关。图1 化合物1的结构和关键的HMBC相关(H→C)
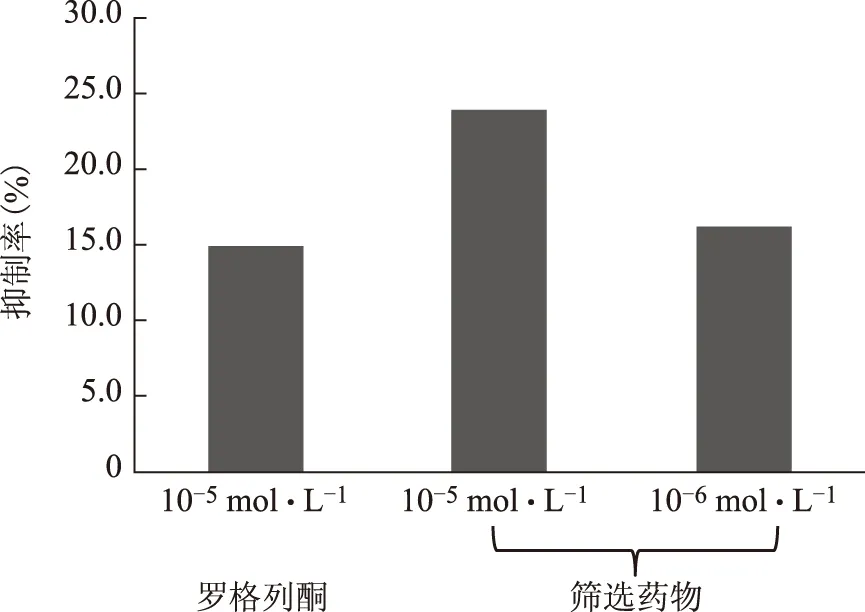
图2 筛选物与对照物对TG的抑制率
3 讨论
已有文献报道了3-O-α-L-吡喃鼠李糖基-7-O-β-D-吡喃葡萄糖基山柰酚以氘代甲醇为溶剂的核磁共振波谱数据,但报道的数据中存在糖单元信号分辨不清的问题。本研究选用DMSO-d6为溶剂,采用一维和二维核磁共振(1D和2D NMR)技术完成了其1H和13C-NMR化学位移的全归属,并获得了分辨比较清晰的β-D-吡喃葡萄糖基和α-L-吡喃鼠李糖基的1H-NMR信号。此外,发现该化合物与阳性对照物比较,对TG有明显的抑制作用,本文首次报道了其药理活性,上述研究对于麻黄植物的基础研究具有积极意义。
[1] 肖培根.新编中药志:第三卷[M].北京:化学工业出版社,2001:297.
[2] 丁丽丽,施松善,崔健,等. 麻黄化学成分与药理作用研究进展[J].中国中药杂志,2006,31(20):1661-1664.
[3] Zhao W,Deng A J,Du G H,et al.Chemical Constituents of the Stems ofEphedraSinica[J].J Asian Nat Prod Res,2009,11(2):168-171.
[4] Zhang D,Deng A J,Ma L,et al.N-Substituted Acetamide Glycosides from the Stems ofEphedrasinica[J].Phytochem Lett,2015,12:320-327.
[5] Zhang D,Deng A J,Ma L,et al.Phenylpropanoids from the stems ofEphedrasinica[J].J Asian Nat Prod Res,2015,18(3):260-267.
[6] Chen Y H,Chang F R,Lin Y J,et al.Identification of phenolic antioxidants from Sword Brake fern (Pteris ensiformis Burm.)[J].Food Chem,2007,105(1):48-56.
AssignmentofNMRDataofaFlavonolGlycosidefromEphedrasinicaandActivityStudy
ZHAOWei1,2,HUQin1,MALin2,QINHailin2*
(1.BeijingInstituteforDrugControl,BeijingCenterforHealthandCosmeticsControl,Beijing102206,China;2.StateKeyLaboratoryofBioactiveSubstanceandFunctionofNaturalMedicines,InstituteofMateriaMedica,ChineseAcademyofMedicalSciencesandPekingUnionMedicalCollege,Beijing100050,China)
Objective:To obtain clear nuclear magnetic spectrum signals of 3-O-α-L-rhamnopyranosyl-7-O-β-D-glucopyranosylkaempferol and study its activity.Methods:One glycoside of flavonoid was isolated from the stems ofEphedrasinicaby solvent extraction and column chromatographies over silica gel.Results:The structure of this compound was elucidated to be 3-O-α-L-rhamnopyranosyl-7-O-β-D-glucopyranosylkaempferol,and the full assignment of the NMR data in DMSO-d6was accomplished through 1D and 2D NMR techniques.Conclusion:The compound is found to have hypolipidemic activity for the first time.
Ephedrasinica;3-O-α-L-rhamnopyranosyl-7-O-β-D-glucopyranosylkaempferol;structure identification;DMSO-d6;hypolipidemic activity
10.13313/j.issn.1673-4890.2016.11.012
2015-10-16)
*
秦海林,研究员,研究方向:药物化学;E-mail:qinhailin@imm.ac.cn
