46,XY单纯性腺发育不全合并性腺肿瘤5例分析
2016-09-23楼伟珍田秦杰孙爱军陈蓉郁琦万希润潘凌娅
楼伟珍,田秦杰,孙爱军,陈蓉,郁琦,万希润,潘凌娅
(中国医学科学院 北京协和医学院 北京协和医院妇产科,北京 100730)
·临床研究·
46,XY单纯性腺发育不全合并性腺肿瘤5例分析
楼伟珍,田秦杰*,孙爱军,陈蓉,郁琦,万希润,潘凌娅
(中国医学科学院北京协和医学院北京协和医院妇产科,北京100730)
目的探讨46,XY单纯性腺发育不全(PGD)合并性腺肿瘤的临床特点、诊断和治疗。方法北京协和医院妇产科2009年1月至2013年8月收治且行手术治疗的PGD病例16例,其中合并性腺肿瘤病例5例,对其临床病例资料进行回顾性分析。结果PGD的性腺肿瘤发生率为31.2%(5/16),肿瘤类型为性腺母细胞瘤(1例)、精原细胞瘤合并性腺母细胞瘤(2例)、无性细胞瘤(1例)及绒毛膜上皮癌(1例),平均发现肿瘤年龄(16.0±2.9)岁(13~20岁),临床表现包括原发性闭经(4例),无阴腋毛、乳房不发育(2例),不同程度阴腋毛或乳房发育(3例),其中3例以性腺肿瘤为首要表现。4例血清卵泡刺激素(FSH)水平升高明显(范围44.7~161.9 U/L),而肿瘤标记物包括甲胎蛋白(AFP)、糖链抗原125(CA125)、β-HCG水平正常。所有病例均手术切除双侧性腺:2例为初次手术后诊断为PGD,行再次手术切除条索性腺;1例术前诊断,肿瘤分期手术同时行双侧性腺切除;另2例行性腺切除时发现性腺肿瘤。结论46,XY单纯性腺发育不全的性腺发生肿瘤风险高,一经诊断应尽早预防性手术切除双侧性腺;青少年女性生殖细胞肿瘤患者存在第二性征不发育或发育欠佳、原发闭经或FSH水平异常升高时,应及时进行染色体核型分析明确是否为PGD,以减少不必要的再次手术风险。
46,XY;单纯性腺发育不全;性腺母细胞瘤;无性细胞瘤
【Abstract】
Objective:To investigate the clinical presentations,diagnosis and therapy for 46,XY pure gonadal dysgenesis(PGD) complicated with tumors.
Methods:A total of 16 patients of PGD underwent surgery in Peking Union Medical College Hospital from Jan 2009 to Aug 2013. Among them,5 patients were complicated gonadal tumor and their clinical manifestations were analyzed.
Results:The gonadal tumor risk of PGD was 31.2% (5/16). Tumors profiles included gonadoblastoma (n=1),seminoma coexist with gonadoblastoma (n=2),dysgerminoma (n=1),choriocarcinoma (n=1). The average age at diagnosis was 16.0±2.9 years (13-20 years). Four patients manifested with primary amenorrhea. Pubertal development (female armpit hair,breast development) was absent in 2 patients,while varying degrees of development was present in 3 patients. Three patients presented gonadal tumors at the first sight. FSH levels were very high (range from 44.7 to 161.9 U/L) in 4 patients,while tumor markers including alfa-fetoprotein (AFP),cancer antigen 125 (CA125) and β-HCG were in normal range. Surgical removal of both gonads were in all patients. Two patients diagnosed as PGD postoperatively received the second surgical procedures to remove the remained gonad.
Conclusions:The patients with PGD have a high risks of gonadal malignancy. Upon diagnoses prophylactic gonadectomies should be considered. In the case of a suspected ovarian tumor,with delayed pubertal development,primary amenorrhea and elevated FSH level,karyotype analysis should be prompted before surgery in order to avoid multiple surgical procedures.
(JReprodMed2016,25(9):771-775)
46,XY单纯性腺发育不全(46,XY Pure Gonadal Disgenesis,PGD)是一种性腺发育异常,其染色体检查为46,XY,因在胚胎发育过程中,受某些因素影响在不同时期发生不同程度的性腺发育不全或退化,从而导致性发育异常。其典型临床表现为原发闭经、青春期无第二性征发育、阴腋毛无或稀少、无乳房发育,内外生殖器发育幼稚,有输卵管、子宫及阴道,以及条索状性腺。其条索状性腺易于发生肿瘤,原因与条索状性腺的异常组织以及腹腔内的环境相互促进诱导有关[1]。本文就北京协和医院2009年1月至2013年8月收治的PGD合并性腺肿瘤的5个病例进行总结分析,探讨PGD合并性腺肿瘤时的临床特征、诊断和治疗。
资料与方法
一、病例资料
北京协和医院妇产科2009年1月至2013年8月收治且行手术治疗的16例PGD病例,最后病理证实合并性腺肿瘤的病例5例。收集其病例资料,包括临床表现、体格检查、实验室及影像学的检查结果、手术治疗情况及随访资料进行回顾性总结分析。
二、实验室检查
所有病例均进行性激素水平检测,包括血清卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)、睾酮(T)水平;相关肿瘤标记物包括甲胎蛋白(AFP)、糖链抗原125(CA125)、β-HCG;所有病例均进行外周血白细胞染色体核型分析。
三、影像学检查
盆腔超声是主要手段,用以评价子宫及性腺大小、性腺肿瘤有无及大小。若病例需要,则行腹盆腔、胸部及头颅电子计算机断层扫描(CT)。
结 果
一、一般资料
PGD性腺肿瘤的发生率为31.2%(5/16),就诊年龄为12~20岁,平均(17.0±3.5)岁;发现性腺肿瘤年龄13~20岁,平均(16.0±2.9)岁。患者均自幼发育良好,身高及智力与同龄儿相似,患者母亲孕期均无特殊用药史。
二、临床特征
PGD患者的社会性别均为女性。
5例中2例因原发闭经就诊,其中1例于6年前因无性细胞瘤行左附件切除术,术后予长春新碱、顺铂、博来霉素联合(PVB)化疗5疗程;1例因发现盆腔包块就诊,同时发现存在原发闭经情况;1例为原发闭经患者,因出现不规则阴道出血、下腹痛并发现盆腔包块于外院行手术,病理诊断为原发性绒毛上皮癌转诊;1例患者因家族中有PGD病例,于手术前1年行染色体筛查时发现为46,XY而就诊(表1)。
体格检查中2例无乳房发育、无阴腋毛,外阴为幼女型;另3例乳房发育Ⅲ~Ⅴ期,1例阴腋毛稀疏,2例阴毛Ⅲ级且有腋毛,外阴发育均尚可。5例均无阴蒂增大,均有阴道。3例肛门检查可及小子宫,1例盆腔可及正常大小子宫及包块;另1例盆腔不规则包块,子宫触不清(表1)。
三、辅助检查
外周血白细胞染色体检查均为46,XY。性激素水平测定2例为典型高FSH/LH、低E2,2例为高FSH/LH、E2轻度升高。4例超声均探及小子宫,其中2例同时存在附件区占位,AFP、CA125水平正常(表1)。
病例3中FSH/LH为低水平,E2升高、β-HCG水平明显升高,但其在10月前外院初诊时的性激素水平为高FSH/LH、低E2,超声探及正常大小子宫、左附件区占位,胸部CT存在多发肺转移,CA125水平轻度升高,AFP水平正常(表1)。
四、治疗及病理诊断
入院后病例1、2、5行腹腔镜探查及性腺切除术,术中均见发育不良子宫,右侧均为条索状性腺,其中病例1、5见左侧性腺增大,分别为3 cm及5 cm,病理分别为性腺母细胞瘤及精原细胞瘤,病例2左侧性腺缺如;病例4行剖腹探查术,术中见发育不良子宫及左侧条索性腺,右侧条索性腺一极为直
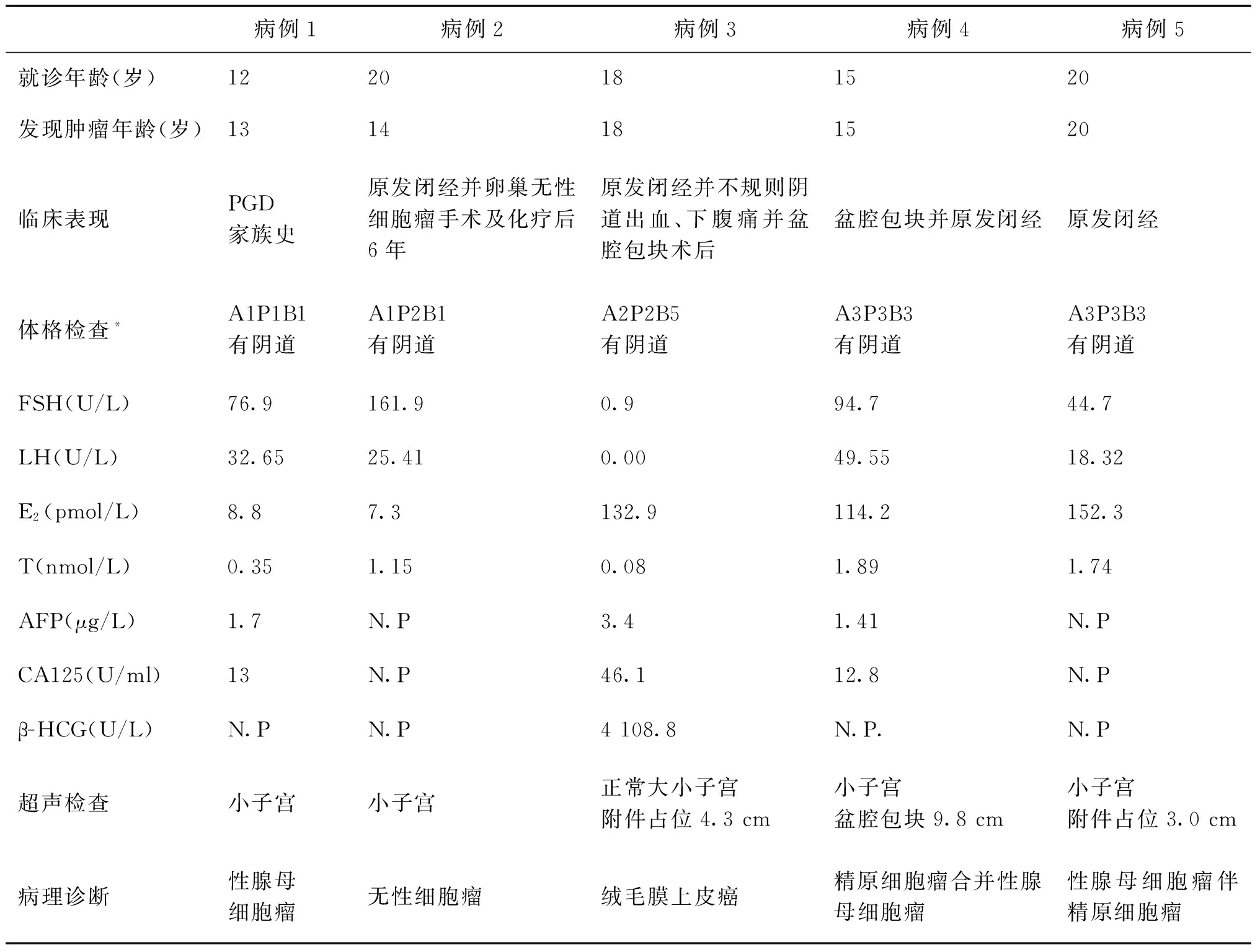
表1 46,XY单纯性腺发育不全合并性腺肿瘤的临床病例资料
注:*Tanner分级:A:腋毛,P:阴毛,B:乳房,分1~5级;N.P:未查
径10 cm实性肿物占据,切除后冰冻回报为无性细胞瘤,行保留子宫的全面分期术,术后病理为右侧精原细胞瘤合并性腺母细胞瘤;病例3行氟脲嘧啶、放线菌素D及依托泊苷联合化疗4疗程后第5程化疗中行腹腔镜下左侧性腺切除术,术中见子宫发育不良,左侧条索性腺,右侧缺如,后续巩固化疗2程后停化疗。
五、随诊及性激素替代治疗
除病例3外,余4例定期随访至术后2年,肿瘤无复发。病例1诊断时年龄仅13岁,术后定期随诊观察18个月后开始加用利维爱,暂未采用人工周期;另3例术后单纯补充雌激素6~11个月后开始人工周期,其中2例来月经,1例无月经来潮,均有不同程度第二性征发育。病例3术后巩固化疗2程,长期随访30个月,肿瘤无复发,未加用性激素替代治疗。
讨 论
一、PGD和性腺肿瘤
46,XY单纯性腺发育不全(PGD)是由Sywer于1955年首次描述的一种性腺发育异常,故又名Sywer综合征。其确切的发生率因条件所限并不是很清楚,Michala等[2]的报道中,大致估计其发生率约为1∶80 000次出生,约等于雄激素不敏感综合征发生率的一半左右。研究认为,SRY基因的相关突变与性腺发育不全有关[3-4],在近15%的性腺发育不全病例中存在SRY基因的各种突变[5-6]。目前普遍认为,存在Y染色体的发育不全的性腺有较高的发生性腺母细胞瘤的风险,PGD中性腺肿瘤的发生率高于其他性腺发育异常,文献报道约为15%~35%[7],而雄激素不敏感综合征或17α羟化酶缺乏均为7%左右[8]。本研究的PGD病例中,性腺肿瘤的发生率为31.2%,与文献报道相符,肿瘤类型为性腺母细胞瘤、精原细胞瘤、无性细胞瘤及绒癌。发育不全的性腺发生性腺母细胞瘤的机制阐述的并不是很清晰。性腺母细胞瘤位点(GBY,gonadoblastoma locus,Y chrosome)基因是位于人Y染色体上唯一的癌基因,在正常的男性睾丸中其发挥正常的生理作用,而在发育不全的性腺当中,其被认为会表现出癌基因的作用[9]。研究发现,Y编码睾丸特异蛋白(testis-specific protein Y-encoded,TSPY)基因是GBY的主要基因,TSPY在男性生殖干细胞的增殖和分化中发挥正常的生理作用,而其在发育不良的生殖细胞中出现高表达,阻断了细胞的正常周期调节而使细胞具肿瘤原性,从而导致发育不全的性腺有较高的发生性腺母细胞瘤的风险[10]。而性腺母细胞瘤可能为错构畸形,有较高的发展为恶性生殖细胞肿瘤的风险[11],50%~60%的性腺母细胞瘤与恶性生殖细胞肿瘤相关,大多表现为无性细胞瘤、未成熟畸胎瘤、内胚窦瘤、胚胎癌及绒毛膜癌[8]。本组病例中发现性腺肿瘤的年龄最小13岁,平均年龄16岁,而且几乎均为就诊之初就发现有性腺肿物,提示一经诊断为PGD,即应尽早手术切除性腺以避免肿瘤的发生。
二、性腺合并肿瘤时对PGD临床表现的影响
PGD患者的社会性别均为女性,临床主要表现为原发闭经,也是患者就诊的主要原因,同时伴有青春期第二性征不发育,包括乳房不发育,阴腋毛无或稀少,外生殖器幼稚,但有阴道、幼稚子宫、输卵管及条索性腺,人工周期可撤退出血,结合实验室高FSH、LH,低E2的典型表现,进一步染色体检查为46,XY即可明确诊断。在本研究中,有3例患者出现了不同程度的第二性征,包括乳腺、阴腋毛的发育,这与典型的PGD表现不是很一致,而且3例出现轻度的E2水平的升高,也给临床明确诊断造成了一定困扰。有文献报道,在15%的性腺母细胞瘤病例中可以出现自主甾体激素的分泌,这与性腺母细胞瘤组织中常混合存在生殖细胞及性索间质细胞成分,而性索间质细胞具有自主分泌甾体激素的功能有关,当其主要的分泌激素是雌激素时,就可以引起异源性的假性的女性性征发育[12-13],病例4、5的性腺中均存在性腺母细胞瘤成分,其出现E2水平升高、性征发育可能与此有关。而当性腺肿瘤为绒毛膜癌时,也可以改变典型的低雌激素、高促性腺激素的表现,为诊断增加困难。绒毛膜癌是一种具有HCG分泌功能的生殖细胞肿瘤,研究发现,HCG可能具有卵泡刺激素样的作用,所以,HCG水平升高可以引起假性青春期发育,比如乳房发育、出现青春期快速生长期,一旦高水平的HCG突然下降还会引起撤退性阴道出血,容易误认为月经来潮[14-15],本文中的病例3也出现了乳房发育及不规则阴道出血。因此,生殖细胞肿瘤病人出现性征发育及阴道出血,仍不能排除PGD 的诊断,而PGD患者出现不同程度的第二性征发育时,应考虑到性腺合并肿瘤的可能。
三、青少年卵巢肿瘤诊断的新角度
青少年女性中卵巢肿瘤的发生率很低,一旦发生则60%~70%为生殖细胞肿瘤[16],其中无性细胞瘤是发生率最高的恶性生殖细胞肿瘤[17]。本研究5例患者中,有3例是以“卵巢”肿瘤为首发症状,2例分别为无性细胞瘤和原发绒癌的患者,初次手术后方明确了PGD的诊断,因此均进行了再次手术切除剩余侧条索性腺,另1例因在术前即明确了PGD的诊断,因此手术同时切除了双侧性腺,术后也避免了不必要的化学治疗。因此对于青少年女性的卵巢肿瘤患者,应想到是否合并存在性发育异常的可能,这样可以一次性手术切除双侧性腺,省却了多次手术的风险。Capito等[18]的文章指出,当无性细胞瘤患者存在下述表现时,应想到合并PGD的可能:青春期无第二性征发育或发育不全,出现血清FSH水平异常升高。在10岁以下的女性中,FSH水平一般在4 U/L以下,具有正常月经周期的青少年女性,FSH的基础水平约为4 U/L,而排卵前的峰值约为15 U/L,PGD患者血清FSH水平大大高于上述水平。
综上所述,PGD有较高的发生性腺肿瘤的风险,一经诊断应尽早手术切除双侧性腺,而怀疑为生殖细胞肿瘤的青少年女性患者,应关注第二性征发育及月经情况,当存在原发闭经或第二性征不发育或发育欠佳时,应及时进行性激素水平检测及染色体核型分析,以便在术前明确是否为PGD,以减少不必要的再次手术风险。
[1]郁琦,鹿卿,孙爱军,等. 46,XY单纯性腺发育不全10例分析[J]. 中国实用妇科与产科杂志,2006,22:685-687.
[2]Michala L,Goswami D,Creighton SM,et al. Sywer syndrome:presentation and outcomes[J]. BJOG,2008,115:737-741.
[3]McElreavey K,Vilain E,Abbas N,et al. XY sex reversal associated with deletion 5 to the SRY HMG-box in the testis determining region[J]. Proc Natl Acad Sci USA,1992,89:11016-11020.
[4]Schmitt-Ney M,Thiele H,Kaltwaber P,et al. Two novel SRY missense mutation reducing DNA binding identied in XY females and their mosaic father[J]. Am J Hum Genet,1995,56:862-869.
[5]Cameron FJ,Sinclair AH. Mutations in SRY,SOX9:testisdetermining gene[J]. Hum Mutat,1997,9:388-395.
[6]Assumpcao JG,Benedetti CE,Maciel-Guerra AT,et al. Novel mutations affecting SRY DNA-binding activity:the HMG box N65H associated with 46,XY pure gonadal dysgenesis and the familial non-HMG box R30I associated with variable phenotype[J]. J Mol Med,2002,80:782-790.
[7]Hughes IA,Houk C,Ahmed SF,et al. Consensus statement on management of intersex disorders[J]. Arch Dis Child,2006,91:554-563.
[8]丁西来,孙爱军,周远征,等. 79例XY性腺发育异常患者性腺肿瘤发生情况分析[J]. 中华妇产科杂志,2008,43:442-444.
[9]Page DC. Hypothesis:a Y-chromosomal gene causes gonadoblastoma in dysgenetic gonads[J]. Development,1987,101 (suppl):151-155.
[10]Lau YF,Li Y,Kido T. Gonadoblastoma locus and the TSPY gene on the human Y chromosome[J]. Birth Defects Res C Embryo Today,2009,87:114-122.
[11]Pauls K,Franke FE,Butner R,et al. Gonadoblastoma:evidence for a steowise progression to dysgerminoma in dysgenetic ovary[J]. Virchows Arch,2005,447:603-609.
[12]Robboy SJ,Jaubert F. Neoplasms and pathology of sexual developmental disorders(intersex)[J]. Pathology,2007,39:147-163.
[13]Zielinska D,Zajaczek S,Rzepka-Gorska I. Tumors of dysgenetic gonads in Swyer syndrome[J]. J Pediatr Surg,2007,42:1721-1724.
[14]Kitanaka C,Matsutani M,Sora S,et al. Precocious puberty in a girl with an hCG-secreting suprasellar immature teratoma. Case report[J]. J Neurosurg,1994,81:601-604.
[15]Lee AC,Fong CM. Ovarian choriocarcinoma as the first manifestation of 46,XY pure gonadal dysgenesis[J]. J Pediatr Hematol Oncol,2011,33:29-31.
[16]von Allmen D. Malignant lesions of the ovary in childhood[J]. Semin Pediatr Surg,2005,14:100-105.
[17]Andres MM,Costa E,Canete A,et al. Solid ovarian tumours in childhood:a 35-year review in a single institution[J]. Clin Transl Oncol,2010,12:287-291.
[18]Capito C,Arnaud A,Hameury F,et al. Dysgerminoma and gonadal dysgenesis:the need diagnosis tree for suspected ovarian tumors[J]. J Pediatr Urol,2011,7:367-372.
[编辑:罗宏志]
Analysis of 5 cases of 46,XY pure gonadal dysgenesis complicated with tumors
LOU Wei-zhen,TIAN Qin-jie*,SUN Ai-jun,CHEN Rong,YU Qi,WAN Xi-run,PAN Lin-ya
DepartmentofObstetrics&Gynecology,PekingUnionMedicalCollegeHospital,PekingUnionMedicalCollege/ChineseAcademyofMedicalSciences,Beijing100730
46,XY;Pure gonadal dysgenesis;Gonadoblastoma;Dysgerminoma
10.3969/j.issn.1004-3845.2016.09.002
2016-05-15;
2016-05-27
楼伟珍,女,北京人,副主任医师,妇产科专业.(*
)
