CRISPR/Cas9系统的研究进展及其在水稻上的应用
2016-09-23彭亚琼陈光辉李懿星
彭亚琼,陈光辉,李懿星,李 莉*
(1.衡阳市农业科学研究所,湖南衡阳 421101; 2.湖南农业大学农学院,湖南长沙 410128;3.湖南省杂交水稻研究中心,湖南长沙 410125)
CRISPR/Cas9系统的研究进展及其在水稻上的应用
彭亚琼1,陈光辉2,李懿星3,李 莉3*
(1.衡阳市农业科学研究所,湖南衡阳 421101; 2.湖南农业大学农学院,湖南长沙 410128;3.湖南省杂交水稻研究中心,湖南长沙 410125)
综述了CRISPR/Cas9系统的结构、定点突变原理、载体构建类型及介导突变的可遗传性,着重分析了影响突变效率的因素,介绍该系统目前在水稻上的研究,并展望其应用前景。
CRISPR/Cas9;基因组编辑;基因打靶;水稻
在自然选择的压力下,水稻个体优胜劣汰,适应环境且性状优良的野生水稻品种相对较少,难以满足人们对水稻多样性的需求。对水稻诱变材料进行精细定位,获得控制优良性状的突变基因,为实际运用奠定理论基础;同时将性状优良的突变材料大量繁殖,以作为优良亲本推广运用。然而诱变突变的产生是随机性的、无方向性的,突变概率较低,且难以集中多个理想性状。因此,育种家常为获得一个理想单株/个体需经过多次突变、多次选择,存在浪费人力和物力的风险,如突变体的表型可能由环境引起,其优良性状无法遗传等。随着近年来各国的交流和探索,尝试利用定点编辑基因序列反向研究基因的功能。锌指核酸酶(zinc finger nucleases,ZFn)、转录激活因子样效应物核酸酶(transcription activator-like effector nucleases,TALENs)和规律性重复短回文序列簇(clustered regularly interspaced short palindromic repeat,CRISPRs)等可靠、高效且准确的基因组编辑技术相继出现,缩短了获得突变体的时间,加快了基因功能研究的步伐。
目前,ZFn技术的运用具有明显的局限性,对编辑的目的序列有严格要求,识别的结构域存在很强的上下文依赖效应,难以实现对任意序列设计出满足要求的打靶位点。即使设计出打靶位点,若无高特异性、高亲和性的锌指蛋白与其结合,也易出现脱靶现象[1]。筛选合适的锌指蛋白也需要庞大的锌指蛋白表达文库做支撑。因此,ZFn技术存在操作繁琐、工作量大、花费高昂等一系列问题。ZFn的脱靶切割对细胞有一定毒性,导致ZFn技术无法满足人们准确且快速编辑基因的要求,因此,选择合适的调控方式来降低脱靶切割是ZFn技术亟待解决的一个难题。与ZFn技术相比,TALENs技术靶点设计要求低,打靶位点选择较多,但TALENs技术也存在弊端,如载体构建繁琐,难度大,重组率低,周期长,成本高,且一旦脱靶,易对受体细胞产生毒性,这 限制了7ALENS技术进一步运用。
相较于人工核酸酶技术ZFn和TALEN,CRISPR/Cas9系统是天然存在的原核生物RNA干扰系统,对物种及序列无选择性,对打靶位点序列要求低,打靶效率较高,操作简单,周期短,成本低。通过CRISPR/Cas9系统获得突变体,多为单个碱基插入类型的突变体或几个碱基缺失类型的突变体,也存在小概率的6~100 bp的片段缺失突变体。CRISPR/Cas9系统能较快、准确地产生理想突变体,大大加快基因功能研究的进程。2013年,CRISPR/Cas9系统被Science杂志评为排名第一的十大突破技术[2],现已成为近年来基因编辑的首选手段。笔者综述了CRISPR/Cas9系统的结构、定点突变原理、载体构建类型及介导突变的可遗传性,分析了影响突变效率的因素,并展望了其应用前景。
1 CRISPR/Cas9系统的结构
CRISPR/Cas9系统的基本结构由切割域和结合域2部分组成。切割域位于结合域上游,主要原件为Cas基因,编码的蛋白具核酸相关功能,与Folk酶功能相似,即通过识别特异性位点切断入侵DNA,从而降解外来基因序列。Cas基因也参与CRISPR的转录、加工等过程。结合域主要包括位于上游的前导序列和位于下游的CRISPR位点。前导序列一般有300~500 bp,富含AT结构,可作为启动子,启动CRISPR序列的转录,产生非编码RNA(crRNA)。CRISPR位点主要由重复序列和间隔序列组成,以重复序列开始,以重复序列结束,且以2个重复序列之间穿插一个间隔序列的模式排列,因此,间隔序列的数量始终比重复序列少1个。不同物种拥有的重复序列个数不同,一般而言,重复序列的碱基个数为21~48个,具5~7 bp的回文序列,高度保守,间隔序列的碱基个数为2 672个。在已测序的细菌中,有40%的细菌其基因组存在CRISPR位点,进一步观察发现,CRISPR位点存在于细胞染色体上,极少部分存在于质粒中[3]。
2 CRISPR/Cas9系统定点突变的原理
1987年,研究者对大肠杆菌12K的iap基因进行研究,结果发现,CRISPR/Cas9系统在iap基因侧翼以成群的短回文重复序列存在,经试验证明,这些简单重复序列与很多病毒或质粒的DNA序列互补,2年,推断细菌中的CRISPR/Cas9系统是抵抗病毒入侵的一种免疫机制[4]。
CRISPR系统有I、II及III 3种类型,其中,I型和III型需要crRNA和多种Cas蛋白共同发挥作用才能顺利剪切外源DNA,而II型仅需要crRNA、tracrRNA和Cas9相互协作即可降解外源DNA,总体上,II型相对于I型和III型要求较低。截至目前,II型研究最透彻,运用最广泛[5]。
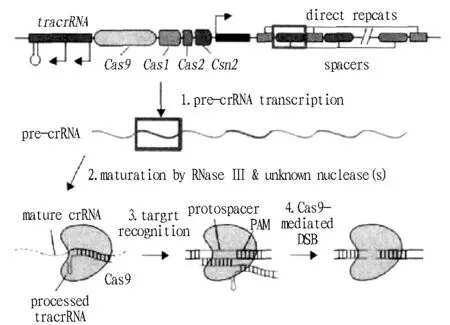
图1 II型CRISPR/Cas9结构示意Fig.1 Type II CRISPR/Cas9 structure diagram
根据细菌免疫抵抗外界病毒侵染的原理,构建了具CRISPR/Cas9系统的空载体。当需要定点编辑基因组序列时,将设计的目的片段连入空载体,形成最终打靶载体后,通过转化整合到受体基因组上发挥编辑作用。为简化实际操作,即用几个碱基将crRNA与tracrRNA连接起来,形成具发卡结构的回文序列,称之为SgRNA。改良的SgRNA-Cas9系统更容易完成基因靶向修饰。将连有目的片段的SgRNA-Cas9载体转入并整合到小鼠[7]、斑马鱼[8]、果蝇[9]、拟南芥[10]、烟草[11]、水稻[12]等物种的基因组上,利用转录的crRNA和tracrRNA进行互补配对形成双链,再与Cas蛋白组成复合体,通过复合体识别并剪切基因组,导致双链断裂。在双链修复过程中将产生突变,有如下2种突变类型:一是无同源片段存在,双链末端自身连接。与正常基因序列相比,不仅缺少被剪切的基因序列,且连接处也易发生碱基突变,导致编码的蛋白发生变化,最终可能引起基因功能发生变化;二是同源片段存在,碱基互补配对修复。若人为干扰加入同源片段,断裂处能根据同源片段序列通过碱基配对来修复,最终达到插入基因的目的。
通常CRISPR/Cas9系统只切割PAM(即NGG)前的3 bp,在无同源片段进行修复的情况下,产生突变的位置在切口附近[11]。研究表明,靠近5′端且处于目标序列一半的位置,发生单碱基突变的频率较高[13-14]。
3 CRISPR/Cas9系统的构建类型
相比TALENs载体构建,CRISPR/Cas9载体的构建方法简单较易,只需将设计的靶位点序列进行退火,再连入载体即可。根据最终打靶载体的不同,载体构建有细微的差别。
常见的最终打靶载体有3种类型:第一种是2个最终打靶载体,一个含有目的基因序列,行使识别功能,一个含有Cas9,行使切割功能。此类型需要2个载体均发挥其应有的功能才能打靶成功。构建时,需将目的靶位点序列进行退火,再连入识别目的基因的载体,含Cas9的载体无需改变;第二种是一个最终打靶载体,载体既包含识别目的基因序列的原件,又包括行使切割功能的Cas9原件。且识别目的基因的原件由一个启动子启动,可连接一个目的打靶位点序列。打靶时类似于单酶切,能导致某一处DNA双链发生断裂。第三种也是一个最终打靶载体,与第二种类似,但识别目的基因序列的原件包含2个启动子,每个启动子都可以连接一个目的打靶位点序列。打靶时类似于双酶切,能造成2处DNA双链的断裂,在DNA修复过程中,2切口之间的小片段可能被自身降解,最终造成一段序列的缺失,突变几率大大提高。若采用第三种打靶载体来编辑基因,其目的基因的序列应为5′-CCN-N20-N(若干个)-N20-NGG-3′,其中N为任意碱基,若士个n处于-2 ~30,其打靶效率较高[15]。
各CRISPR/Cas9打靶载体不同,其打靶效率也不同。第一种需2个载体共同作用才能产生突变,而第二、三种仅一个载体发挥作用即可,因此,理论上第一种效率较低,在植物方面的应用已逐渐被淘汰。第二种常产生1 bp突变,可能导致编码的蛋白不变,相应的功能也未发生变化。而与第二种相比,第三种更易产生大片段的缺失,导致移码突变,获得突变体,且表型突变的可能性较大。但第三种对打靶序列要求相对较高,因此,应用具有局限性。
4 影响CRISPR/Cas9系统突变效率的因素
4.1CRISPR/Cas9空载体的影响CRISPR/Cas9系统在发展与进步,空载体在运用过程中得到改良,不同人改造的原件不同,改造的序列不同,改造前与改造后,载体进入植物体内,能整合到基因组上并发挥作用的效率不同,最终对植物基因的打靶效率也不同[16]。且改造后的不同载体对目的序列的设计要求也不同,如水稻打靶载体的启动子有U3、U6、T7及CaMV35[17]。打靶载体若是以U6作为启动子,要想获得较高的打靶效率,则打靶目的片段5′端的第一个碱基必须为G[18-19],即5′-GN19NGG-3′。若以T7作为启动子,则打靶目的片段5′端的前2个碱基必须为(G/A)(G/A),即5′-(G/A)(G/A)N18NGG-3′[19]。
4.2打靶位点的影响
目前各院校推行的“现代学徒制”不仅限于订单式培养,工学结合顶岗实习等模式内容,但基本都在强调“在做中学”“在学中做”。“学徒”部分时间在实际生产服务一线岗位上,以“师傅带徒弟”的方式接受训练,部分时间学习必要的文化和专业理论知识,以期迅速成长为职业资格证书、职业教育学历证书双手握的高技能应用型人才,并在一定程度上解决企业招工难,成长难等问题。为企业稳定了职工队伍,创造了利润,同时培养年轻人对职业与企业的认同与归属感。
4.2.1相似。CRISPR/Cas9系统识别序列仅由20 bp组成,而在庞大的基因组序列中,存在较多与20 bp相似的序列。在CRISPR/Cas9系统识别目的基因序列过程中,可能发生错配现象,导致复合体与目标位置外的基因序列结合。与远离PAM端发生错配的情况相比,临近PAM端的碱基发生错配时对Cas9蛋白的切割能力影响较大,易发生脱靶现象[20]。因此,为降低脱靶率,设计的目的靶位点最好是唯一的,若找不到唯一,设计的目的序列应尽量避免植物基因组中存在与近PAM端同源的序列。
4.2.2长度。 目标打靶序列的长短对目标切割效应和低脱靶效应有影响。研究表明,缩短目标序列的长度能提高靶位点的识别准确度,从而减弱脱靶效应,但在一定程度上降低了对目的基因的切割能力[21]。因此,找到目标切割效应和低脱靶效应的平衡点,设置最佳目标序列长度,才能产生最佳的打靶突变效果。目前广泛应用的是将PAM(即NGG)前20个碱基做为目标序列。在这20 bp中,位于PAM上游的12个碱基对打靶突变起决定性作用[20]。
4.2.3位置。 大小为20 bp的目标序列,其位置不同,能被切割产生突变的概率也不同。如目的打靶位点设在非编码区,即使发生突变,也不能引起植物编码蛋白质的变化,自然植物的功能未发生改变,使试验无研究意义,只有目的打靶位点设在CDS区域,才能产生有意义的表型突变;如打靶位点处于第一个外显子,较第二个外显子更能引起蛋白的变化,产生较理想的突变[22];如靶位点靠近C′端,打靶效率低,即使靶位点有个别碱基发生变化,但处于编码蛋白将要结束的位置,较难打乱蛋白正常表达,最终不能引起表型及功能的变化[22]。
4.2.4序列。 有些序列易被CRISPR/Cas9系统打靶成功,而有些却很难被切割产生双链断裂。如打靶序列的重复序列高、GC含量太高或太低,其打靶效率均偏低[23],为得到理想的打靶效率,目标序列的GC含量应控制在20%~80%[24]。
目的打靶序列常设为5′-N20NGG-3′(N为任意碱基)。在组成NGG前的20 bp中,四类碱基排列顺序不同,其打靶效率相差较大。研究发现,最影响打靶效率的是5′端第16、20位的碱基,第16位为A或C碱基,能大大提高打靶效率,特别是C碱基,若为G碱基则打靶效率大大降低;第20位若为A或G碱基,能大大提高打靶效率,特别是C碱基,若为G碱基则打靶效率大大降低;PAM(即NGG)中的N适合选择G或C碱基,不宜选T碱基,且处于NGG下游,紧邻NGG的第一个碱基对打靶效果影响大,若为碱基G,易造成脱靶,因此,打靶最佳组合为CGG加T碱基,最不适宜组合为TGG加G碱基[22]。
4.3载体浓度在菌液转化受体材料的过程中,菌液体积一定,菌液所含打靶载体浓度大,最终导入植物中的打靶载体多,可成功打靶的概率高;相反,菌液所含打靶载体浓度小,成功打靶的概率较低。但打靶载体的浓度太高,也易起反作用,导致打靶位点在目标序列之外,常出现目标序列附近被Cas9切开。至目前为止,暂时尚未有明确的打靶载体适宜浓度[25]。
4.4愈伤时期愈伤组织将经历一个从对数生长到稳定再到衰亡的过程。对处于衰亡期的愈伤组织进行打靶,其能吸收营养并加以利用的能力差,分裂速度慢,经筛选、分化后,大部分走向死亡,可获得的幼苗少,自然获得阳性植株数量少,打靶成功的几率更小。相反,对处于对数增长期的愈伤组织进行打靶,恢复活力快,长成幼苗的较多,获得阳性植株数量较多,打靶成功的几率相对较高。而对处于稳定期愈伤组织的打靶成功率介于衰亡期和对数期之间。
5 CRISPR/Cas9系统介导突变的可遗传性
CRISPR/Cas9系统在动物上的应用非常广泛,常以动物胚胎干细胞作为受体细胞,以致在当代获得突变纯合子相对较高。然而植物不同于动物,经CRISPR/Cas9系统打靶产生的突变自然不同[10]。
CRISPR/Cas9系统介导的突变常发生在T0代植株的体细胞中,因此,T0代植株中存在突变纯合子的概率较低,主要出现的是野生型植株、突变杂合子植株、嵌合体植株(即在一植株的打靶位点处,PCR检测发现有3条或3条以上不同的序列,含野生型序列)及双等位基因植株4种类型,但在突变率较高的情况下,在T0代有可能出现纯合子突变[10,26-27]。
T1代植株除T0代的4种类型外,还存在突变纯合子植株。T0代纯合子遗传稳定,即使突变植株较野生型植株仅发生1 bp的变化,CRISPR/Cas9系统中具核酸内切酶作用的Cas9也不能在突变植株已发生突变的位置再次切割其基因双链序列,因此,在正常栽培条件下不会发生突变;T1代杂合子突变体的后代其分离比基本遵循孟德尔遗传定律1∶2∶1,但也存在发生新突变植株的情况,如以嵌合体形式出现的突变植株,嵌合体植株再将已产生的1个、2个或者0个突变传递到后代;T0代野生型传至T1代时,因被自身携带的CRISPR/Cas9系统切割其双链DNA,最终能产生T0代没有的新突变,但传至T2代,大部分植株不再产生新突变,即CRISPR/Cas9系统很难对其已产生突变的植株再次产生突变[10,26-27]。
6 CRISPR/Cas9系统在水稻中的应用
CRISPR/Cas9系统具有精度性高、系统构建简便和多靶位点切割等优势,常用于小鼠[7]、斑马鱼[8]、果蝇[9]等模式动物。随着CRISPR/Cas9技术的日趋成熟,该系统在植物方面的应用也相继出现,为提高模式植物研究的效率,逐渐将CRISPR/Cas9系统应用到水稻的理论研究和育种研究。
Miao等[28]在CAO1基因的第二个外显子里设计打靶位点,将CRISPR/Cas9系统转入水稻,产生的突变体因缺少叶绿素b的合成,表现为早期叶片呈淡绿色。Feng等[29]转化水稻原生质体突变YSA基因,发现10%的转基因植株在苗期表现叶片白化。在水稻相关的报道中,经打靶产生的植株突变率不高,Xie 等[30]推测CRISPR-Cas系统能对植物产生突变的概率在3%~8%。Shan等[31]用CRISPR/Cas9系统转化水稻愈伤,发现OsPDS-SP1和OsBADH2基因的突变率分别为9.4%和7.1%,转化原生质体,发现小麦基因TaMLO和3个水稻基因OsBADH2、Os02g23823、OsMPK2的突变率在26.5%~38%。Shan等[31]利用CRISPR/Cas9系统定点突变水稻OsPDS基因,产生的突变效率在10%以下,但在当代获得了纯合突变体,与野生型相比,纯合突变体表现出植株变矮和叶片转为白化的特点,与预期的表型一致。Zhang等[26]用CRISPR/Cas9系统突变不同功能的10个水稻基因,分别是OsMYB1、OsYSA、OsROC5、OsDERF1、OsPDS、OsMSH1、OsMYB5、OsSPP、OsPMS3和OsEPSPS,获得的突变率分别为66.7%、66.7%、65.1%、50.9%、41.9%、37%、31.9%、28.9%、26.3%、21.1%和44.4%,平均突变率达44.4%,其中,OsEPSPS基因是合成芳香族氨基酸过程中的一个关键酶,OsEPSPS的突变体因不能合成芳香族氨基酸,无法正常生长发育,最终死亡。Zhou等[27]用CRISPR/Cas9系统打靶了水稻中4个控制糖运输的基因,在T0代获得的突变率最高达87%,且突变植株大多为双等位基因类型。Feng等[10]研究发现,因CRISPR/Cas9系统的剪切,产生的突变率在T0代有71.2%,T2代有58.3%,T2代有79.4%。T1代中,突变纯合子的纯合率为22%,杂合子和嵌合体的突变率为58.3%。其中,将T1代所有突变植株的基因型与T0代突变植株基因型相比,与T0代相一致的突变植株仅占T1代总突变的50%[10]。
研究发现,CRSPR/Cas9系统能够对水稻基因组进行编辑,且编辑的序列无选择性,大大提高了研究基因功能的效率,使快速、准确编辑基因序列获得优良性状的植株成为可能。然而CRSPR/Cas9系统在水稻中打靶效率较低,因此,通过改良载体体系、转化体系等提高打靶效率成为亟待解决的一个重要的问题,有待进一步摸索。
7 展望
随着不同物种基因组测序的完成,探明基因组的功能显得尤为重要。基因组定点编辑技术是进行基因组定向改造与基因功能研究的一个新兴而重要的研究手段。
CRISPR/Cas9系统能够靶向性地编辑基因组,系统构建简便、精度高、周期短、成本低。相较于ZFn和TALENs人工核酸酶技术,CRISPR/Cas9系统更具优势,能够更加高效地获得遗传稳定的突变体,为基因功能研究提供技术和材料保障。同时,可利用CRISPR/Cas9技术在基因组水平上插入或敲除基因,筛选获得更多环境适应性强、性状更加优良的育种材料。然而CRISPR/Cas9系统目前尚处于运用和探索阶段,存在目标序列PAM邻近基序缺失、靶向序列切割特异性、不同物种打靶效率差异等问题,成为未来需要解决的一些关键问题。但其在高效便捷的基因操作中已表现出巨大优势,在水稻功能基因组研究中表现出巨大潜力,在创制优质高产的水稻品种中表现出广阔的应用前景,必将产生深远影响。
[1] MAEDER M L,THIBODEAU-BEGANNY S,OSIAK A,et al.Rapid“open-source engineering of customized zinc-finger nucleases for highly efficient gene modification[J].Molecular cell,2008,31(2):294-301.
[2] Breakthrough of the Year 2013[EB/OL].[2016-04-07].http://news.sciencemag.
[3] WEI C X,LIU J Y,YU Z S,et al.TALEN or Cas-rapid,efficient and specific choices for genome modifications[J].Genet genomics,2013,40(6):281-289.
[4] ISHINO Y,SHINAQAWA H,MAKINO K,et al.Nucleotide sequence of the iap gene,responsible for alkaline phosphatase isozyme conversion inEscherichiacoli,and identification of the gene product[J].Bacteriol,1987,169(12):5429-5433.
[5] CHYLINSKI K,LE RHUN A,CHARPENTIER E.The tracrRNA and Cas9 families of type II CRISPR-Cas immunity systems[J].RNA Biology,2013,10(5):726-737.
[6] 左其生,李东,张亚妮,等.CRISPR-Cas介导的基因编辑工具[J].生物技术通报,2014(7):37-43.
[7] WANG H Y,YANG H,SHIVALLIA C S,et al.One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering[J].Cell,2013,153(4):910-918.
[8] AUER T O,DEL BENE F.CRISPR/Cas9 and TALEN-mediated knock-in approaches in zebrafish[J].Methods,2014,69(2):142-150.
[9] GRATZ S J,WILDONGER J,HARRISON M M,et al.CRISPR/Cas9-mediated genome engineering and the promise of designer flies on demand[J].Fly,2013,7(4):249-255.
[10] FENG Z Y,MAO Y F,XU N F,et al.Multigeneration analysis reveals the inheritance,specificity,and patterns of CRISPR/Cas-induced gene modifications inArabidopsis[J].PNAS,2014,34(25):632-637.
[11] JIANG W Z,ZHOU H B,BI H H,et al.Demonstration of CRISPR/Cas9/sgRNA-mediated targeted gene modification inArabidopsis,tobacco,sorghum and rice[J].Nucleic acids research,2013,41(20):188.
[12] CHEN K L,SHAN Q W,GAO C X.An efficient TALEN mutagenesis system in rice[J].Methods,2014,69(1):2-8.
[13] WU X,SCOTT D A,KRIZ A J,et al.Genome-wide binding of the CRISPR endonuclease Cas9 in mammalian cells[J].Nature biotechnol,2014,32(7):670-676.
[14] HSU P D,SCOTT D A,WEINSTEIN J A,et al.DNA targeting specificity of RNA-guided Cas9 nucleases[J].Nature Biotechnol,2013,31(9):827-832.
[15] RAN F A,HSU P D,LIN C Y,et al.Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity[J].Cell,2013,154(6):1380-1389.
[16] WANG T,WEI J J,SABATINI D M,et al.Genetic screens in human cells using the CRISPR-Cas9 system[J].Science,2014,343(6166):80-84.
[17] BORTESI L,FISCHER R.The CRISPR/Cas9 system for plant genome editing and beyond[J].Biotechnology advances,2015,33(1):41-45.
[18] XIE S S,SHEN B,ZHANG C B,et al.sgRNAcas9:A software package for designing CRISPR sgRNA and evaluating potential off-target cleavage sites[J].PLoS ONE,2014,9(6):100448.
[19] 刘思也,夏海滨.一种新的由CRISPR/Cas系统介导的基因组靶向修饰技术[J].中国生物工程杂志,2013,33(10):117-123.
[20] MARRAFFINI L A,SONTHEIMER E J.CRISPR interference limits horizontal gene transfer in staphylococci by targeting DNA[J].Science,2008,322(5909):1843-1845.
[21] 颜雯,李海涛,向华,等.CRISPR-Cas基因组改造技术研究进展[J].广东农业科学,2014(2):149-152.
[22] DOENCH J G,HARTENIAN E,GRAHAM D B,et al.Rational design of highly active sgRNAs for CRISPR/Cas9-mediated gene inactivation[J].Nature Biotechnol,2014,32(12):1262-1267.
[23] GAGNON J A,VALEN E,THYME S B,et al.Efficient mutagenesis by Cas9 protein-mediated oligonucleotide insertion and large-scale assessment of single-guide RNAs[J].PLoS ONE,2014,9(5):98186.
[24] WANG T,WEI J J,SABATINI D M,et al.Genetic screens in human cells using the CRISPR/Cas9 system[J].Science,2014,343(3):80-84.
[25] PATTANAYAK V,LIN S,GUILINGER J P,et al.High-throughput profiling of off-target DNA cleavage reveals RNA-programmed Cas9 nuclease specificity[J].Nat Biotechnol,2013,31:839-843.
[26] ZHANG H,ZHANG J,WEI P,et al.The CRISPR/Cas9 system produces specific and homozygous targeted gene editing in rice in one generation[J].Plant biotechnology journal,2014,12(6):797-807.
[27] ZHOU H,LIU B,WEEKS D P,et al.Large chromosomal deletions and heritable small genetic changes induced by CRISPR/Cas9 in rice[J].Nucleic acids research,2014,42(17):10903.
[28] MIAO J,GUO D S,ZHANG J Z,et al.Targeted mutagenesis in rice using CRISPR-Cas system[J].Cell research,2013,23(10):1233-1236.
[29] FENG Z Y,ZHANG B T,DING W,et al.Efficient genome editing in plants using a CRISPR-Cas system[J].Cell research,2013,23(10):1229-1232.
[30] XIE K B,YANG Y N.RNA-guided genome editing in plants using a CRISPR-Cas system[J].Molecular plant,2013,6(6):1975-1983.
[31] SHAN Q W,WANG Y,LI J,et al.Targeted genome modification of crop plants using a CRISPR-Cas system[J].Nat Biotechnol,2013,31(8):686-688.
Research Progress of CRISPR/Cas9 System and Its Application on Rice
PENG Ya-qiong1, CHEN Guang-hui2, LI Yi-xing3, LI Li3*
(1. Hengyang Agricultural Science Research Institute, Hengyang, Hunan 421101; 2 College of Agronomy, Hunan Agricultural University, Changsha, Hunan 410128; 3. Hybrid Rice Research Center of Hunan Province, Changsha, Hunan 410125)
The structure of CRISPR/Cas9 system, the principle of fixed-point mutation, the type of building vectors and the heritability of mutation were reviewed. The factors that influence efficiency of mutations were emphatically analyzed, the current existing research on rice was introduced, and its application in the future was forecasted.
CRISPR/Cas9; Genome editing; Gene targeting; Rice
彭亚琼(1990- ),女,湖南衡山人,硕士研究生,研究方向:转基因水稻。*通讯作者,副研究员,博士,硕士生导师,从事水稻分子育种研究。
2016-06-06
S 188
A
0517-6611(2016)22-128-04
