自养型锰氧化菌的选育及除锰效果研究
2016-09-23侯荷霞
侯荷霞
(青岛理工大学,山东 青岛 266033)
自养型锰氧化菌的选育及除锰效果研究
侯荷霞
(青岛理工大学,山东 青岛 266033)
自养型生物除锰滤池可以有效地去除地下水中的锰,为了获取接种该滤池的菌种并探究其除锰效果,利用改良的JFM培养基对曝气池中的活性污泥进行驯化培养,筛选出了除锰率在90%以上的高效自养型锰氧化菌。通过平板培养和革兰氏染色,得到3种不同的菌落且均为阴性菌,16S rDNA基因组测序发现5种不同的科属。菌液经过2个周期的传代培养,探究其除锰效果,最高除锰率达到了98%。
自养型除锰菌;筛选;鉴定;16S rDNA;除锰效果
10.13358/j.issn.1008-813x.2016.04.22
锰是人体健康必需的微量元素,广泛存在于地下水中。我国人口多以地下水为主要饮用水水源,但我国地下水中的锰含量远超过生活饮用水标准,尤其是北方地区,地下水锰含量普遍在1 mg/L以上[1]。长期饮用锰含量高的水会对人类的身体健康产生恶劣的影响,造成人体生理疾病[2]。因此,构建生物除锰滤池去除地下水中的锰十分必要。地下水生物除锰滤池中,锰氧化菌是除锰功能的主体。但地下水中溶解性的有机物浓度很低,对于这种贫营养环境,自养型锰氧化菌较异养型锰氧化菌更易生存且拥有更好的除锰性能。因此,选择培养自养型锰氧化菌可为地下水生物除锰工艺提供更优质的除锰菌源。同时,鉴定自养型锰氧化菌的菌种,探究其生理生化特征以及除锰性能可为实际生物除锰滤池中构建高效除锰菌群提供理论参考。
除锰菌的来源主要有土壤、污水处理厂曝气池和含锰井壁泥[3-4]。不同来源的除锰菌的营养特性、生理习性、结构特征、培养方式和除锰效率等存在一定的差异。本实验选择污水处理厂曝气池中的活性污泥作为自养型除锰菌的菌源,选择合适的培养基进行筛选培养,并对筛选得到的高效自养型除锰菌的菌体形态、菌落特征以及除锰效果进行了初步的研究。
1 试验材料及方法
1.1主要仪器设备
振荡器PY-150(武汉汇诚科技有限公司);电子分析天平 FA2004N(上海精密科学仪器有限公司);光学显微镜DMB-1223(麦克奥迪实业集团有限公司);台式离心 Thermo Fishe(美国塞默飞世而科技公司);紫外分光光度计 UV759(上海皖宁精密科学仪器有限公司);光照培养箱SPX-250B-G(上海博讯实业有限公司)。
1.2菌种的来源
菌种来源:一是取自青岛市海泊河污水处理厂曝气池好氧区的活性污泥,该区含有较多的自养菌,将预处理后的活性污泥作为菌源;二是本实验室一直保存的自养型除锰菌菌种。
1.3培养基
本实验采用JFM培养基[5],采用NaHCO3和HCl调pH在6.8~7.2之间。其中JFM、JFM8、JFM6、JFM4、JFM2、JFM0分别表示培养基中柠檬酸铁铵浓度为10 g/L、8 g/L、6 g/L、4 g/L、2 g/L、0g/L,其他成分含量及pH值均相同。固体培养基是在液体培养基中加琼脂1.5%,湿热灭菌后使用。表1为各培养基的成分及说明。
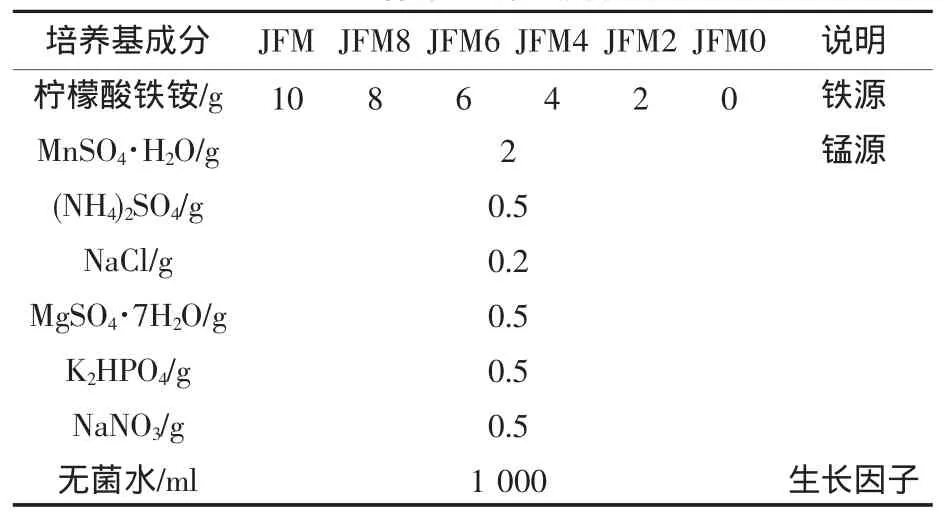
表1 培养基成分及说明
1.4细菌培养方式
摇瓶培养:室温下160 r/min连续震荡,7 d为一个周期。
平板培养:25℃恒温培养箱中培养3 d[5]。
1.5细菌鉴定方法
细菌表观鉴定:稀释涂布平板实验和革兰氏染色。
细菌菌种鉴定:16S rDNA基因组测序。
1.6锰离子的检测
采用高碘酸钾紫外分光光度法。
2 实验结果及分析
2.1培养基的选择
由JFM培养基的成分可以看出,该培养基中不含有机物,只含有相应的铁源、锰源及细菌所需的微量生长因子,是适合自养型锰氧化菌生长的培养基。该培养基中柠檬酸铁铵的浓度为10 g/L,铁含量较高,可能会造成铁细菌生长优于锰细菌,但是诸多研究表明锰细菌是伴随着铁细菌一起生长的,因此需要找到一个合适的柠檬酸铁铵浓度来保证锰细菌在培养基中是优势菌。
改变JFM培养基中柠檬酸铁铵的浓度,分别为10 g/L、8 g/L、6 g/L、4 g/L、2 g/L、0 g/L,其他成分完全相同,对应培养基名称为JFM、JFM8、JFM6、JFM4、JFM2、JFM0。分别配置以上6种培养基各300 ml,于18个150 ml的锥形瓶中各100 ml,且在每个锥形瓶中加入10 ml实验室保留的菌种,室温下置于160 r/min摇床上连续震荡。每天同一时间检测锥形瓶中剩余锰浓度,观察培养基的颜色变化、浑浊度以及锥形瓶壁的粘附物。
连续培养5 d后从摇床上取下锥形瓶,静止观察,所有锥形瓶上均出现了棕褐色的菌圈。但是,含JFM0和JFM2培养基的锥形瓶壁上的菌圈较其他锥形瓶上的小且没有牢固的粘附在瓶壁上,轻轻摇晃,菌圈就会消失,而其他瓶壁上的菌圈比较牢固,有实验已经证明该菌圈为锰氧化物[6]。此外JFM、JFM8、JFM6锥形瓶静止5min即出现了沉淀,10min后沉淀与上清液已经出现明显的分离。JFM6锥形瓶中的培养基培养前后变化见图1。
培养过程中各培养基对锰离子的去除率变化见图2,从图中可以看出JFM、JFM8和JFM6对锰的去除率最高,2 d后去除率即达到90%以上,而JFM4、JFM2和JFM0对锰的去除率较低,2 d后去除率分别为71%、43%、10%。第三天和第四天锥形瓶的去除率基本上维持恒定,没有再变化。从而确定JFM、JFM8和JFM6是适合自养型锰氧化菌生长的培养基,考虑到JFM和JFM8中柠檬酸铁铵的浓度较高,故采用JFM6培养基培养自养型锰氧化菌。

图1 JFM 6锥形瓶摇床培养前后变化
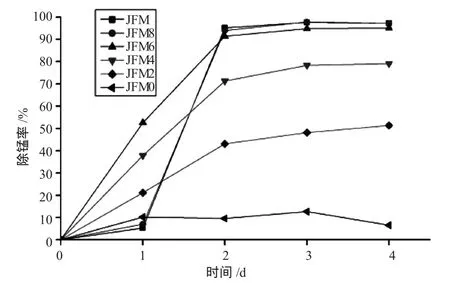
图2 不同培养基对自养型锰氧化菌的除锰率
2.2活性污泥的预处理
取20 ml活性污泥混合液,加入含有100 mlNaCl(0.8%)溶液的150ml锥形瓶中,加数粒玻璃珠,置于180 r/min摇床震荡20 min,沉淀10 min,取上部悬浊液30 ml进行离心分离。将30 ml悬浊液分别注入3个离心管,每个离心管中均含有10 ml悬浊液,将离心管置于3 000 r/min的离心机中离心10min,倒掉上清液,每个离心管均用NaCl(0.8%)溶液悬浮成10ml菌液备用。
2.3自养型锰氧化菌的筛选
采用JFM6培养基筛选自养型除锰菌:共4个150 ml锥形瓶,编号为0#、1#、2#、3#,每瓶含有100 ml的培养基。将灭菌后的培养基置于无菌操作台上,打开紫外和通风,进行二次灭菌。待培养基冷却至室温时,将制备好的3个10 ml的菌液分别加入到编号为1#、2#、3#的锥形瓶中,3个锥形瓶为平行试验,0#锥形瓶中加入10 mlNaCl(0.8%) 溶液,作为空白试验。将锥形瓶置于室温下160 r/min摇床上连续震荡,7 d为一代,进行传代培养,每天同一时间检测锥形瓶中锰浓度。
每代结束后更换新的培养基,接种上一代培养的菌液,接种量为10%,采用相同的方法进行培养,循环下一代,直到自养型锰氧化菌拥有较高的除锰率,结束训化培养,筛选出高效自养型除锰菌。图3为预处理的活性污泥在JFM6培养基中经过2代的筛选过程中对锰的去除率的变化曲线图。
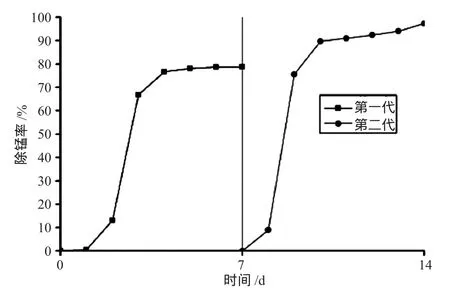
图3 利用JFM 6培养基对自养型锰氧化菌的筛选
由图3可以看出,预处理的活性污泥在JFM6培养基中经过两个周期的培养,对锰的去除率都表现为先增高后平稳的趋势。其中第一周期的第一天锰氧化菌对锰基本上没有去除率,分析原因是锰氧化菌从活性污泥到JFM6培养基,环境改变太大,大部分锰氧化细菌还不适应培养基环境,生长缓慢,对锰基本没有去除作用。第二天时,锰的去除率开始升高,锰氧化细菌开始适应培养基的环境,其他不适应JFM6培养基环境的杂菌开始死亡。第三天,锰的去除率呈直线上升,从13%上升到66%,表明锰氧化细菌进入对数生长期。第四天去除率上升缓慢,之后的3 d除锰率基本维持在78%,因为培养基中的营养物质已被锰氧化细菌消耗完,且锰氧化细菌分泌的代谢物及其他死亡菌裂解出的有毒物质抑制了锰氧化菌的新陈代谢,锰氧化菌进入稳定期。第二周期的除锰率较第一周期有所升高,最高达到了90%以上,较高的除锰率也说明自养型锰氧化菌已经筛选培养成功。
2.4自养型锰氧化菌的表型鉴定
对筛选得到的高效自养型除锰菌进行涂布平板实验,观察自养型锰氧化菌的菌落特征并对自养型锰氧化菌进行革兰氏染色,观察菌体形态。
2.4.1涂布平板实验
配制固体培养基(JFM6培养基+1.5%的琼脂),梯度稀释JFM6中菌液稀释倍数分别为10-3、10-4和10-5倍,然后取适量稀释后的菌液均匀分散在平板表面,干燥后放在25℃培养箱中培养3 d。每个稀释度做3个平行样。
2.4.2革兰氏染色
刮取培养皿中的少量菌落进行涂片,然后经过固定、初染、水洗、媒染、脱色、复染、水洗、干燥等一系列过程,放于光学显微镜下观察,若菌体呈紫色则为革兰氏阳性菌(G+),若菌体呈红色则为革兰氏阴性菌(G-)。

图5 自养型除锰菌革兰氏染色
观察固体培养基上长出的菌落,如图4,发现有3种不同形态特征的菌落,分别命名为J-1、J-2、J-3。挑取菌落对其进行革兰氏染色,观察细菌形态。表2为自养型除锰菌菌落特征和细菌形态。

表2 自养型除锰菌菌落特征和细菌形态
2.5自养型锰氧化菌的菌种鉴定
对培养得到的高效自养型锰氧化菌采用分子遗传学鉴定法,通过PCR技术和16S rDNA测序,从核酸水平上鉴定自养型除锰菌菌种。
首先采用土壤DNA抽提试剂盒提取细菌基因组DNA,然后利用PCR扩增技术,以细菌16S rDNA的通用引物27F-1492R对该菌的16S rDNA基因组进行扩增,之后对16S rDNA基因组进行测序。最后通过NCBI软件对该菌的16S rDNA基因序列进行BLAST对比分析。其中16S rDNA基因组的PCR扩增和测序均由青岛擎科榟熙生物技术有限公司完成。
通过分析发现该高效自养型除锰菌涉及到Alcaligenes产碱杆菌科、Derxia德克斯氏菌属、Pseudomonas假单胞菌属、Nitrosomonadaceae亚硝化单胞菌科、Crenotrichaceae铁细菌科5种不同的科属。其中Derxia和Pseudomonas[7]属于兼性自养菌。
2.5自养型锰氧化菌的除锰效果
对筛选得到的高效自养型锰氧化菌进行传代培养,探究其除锰效果。具体操作为:对筛选得到的菌液进行离心分离,调转速为3 000 r/min,时间为10min,弃掉90%的上清液,然后用NaCl (0.8%)溶液将沉淀悬浮为10ml,添加到100ml新的培养基中,室温下放在160 r/min摇床上连续震荡培养,每天检测培养基中剩余的锰浓度,探究其除锰效果。图6为筛选得到的自养型锰氧化菌在JFM6培养基中经过2个周期的培养过程中,对锰的去除效果的变化曲线图。

图6 自养型锰氧化菌的除锰效果
从图6可以看出,自养型锰氧化菌在两个周期的传代培养过程中,最终除锰率都能达到90%以上,具有良好的除锰效果。且两个周期培养过程中锰氧化菌的适应期都仅为1 d,第二天便进入对数生长期,最后4 d进入稳定期,两个周期稳定期的除锰率分别为94%和98%。
3 结论
(1)改变JFM培养基中柠檬酸铁铵的浓度,选择出最适合筛选、富集自养型除锰菌的培养基,该培养基中柠檬酸铁铵的浓度为6 g/L,其他成分含量均与JFM培养基一致。
(2)对筛选得到的高效自养型除锰菌进行稀释涂布平板培养,得到3种不同的菌落,分别为J-1、J-2和J-3,分别对其进行革兰氏染色,发现自养型锰氧化菌为G-。
(3)对筛选得到的高效自养型除锰菌进行16S rDNA测序发现该菌种涉及到产碱杆菌科、德克斯氏菌属、假单胞菌属、亚硝化单胞菌科、铁细菌科5种不同的科属,其中德克斯氏菌属、假单胞菌属属于兼性自养菌。
(4)对筛选得到的高效自养型锰氧化菌进行传代培养,研究其对锰离子的去除效果,发现两个周期的最高除锰率分别为94%和98%,说明筛选得到的自养型锰氧化菌具有良好的除锰效果。
[1]狄效斌.浅析地下水污染研究[J].科技情报开发与经济,2008,18 (22):131-132.
[2]刘凤娟,黄贤仪,张月明,等.锰对细胞免疫功能的影响[J].环境与职业医学,2002,19(3):139-142.
[3]姚远,周志华,许旭萍,等.铁锰氧化菌的筛选及其生物学特性研究[J].福建师范大学学报:自然科学版,2009,25(4):100-104.
[4]吴小莉.固定化微生物处理含铁含锰地下水效能的研究[D].哈尔滨:哈尔滨工业大学,2008.
[5]杨宏,张杰,赵丹丹,等.生物固锰除锰技术的微生物学研究[J].给水排水,2004,30(5):25-29.
[6]杨良.生物除锰滤层启动与运行的实验研究[D].青岛:青岛理工大学,2014.
[7]GREGORY JD,YIFAN E L,BRADLEY M T.Manganese(Ⅱ)-oxidizing bacillus spores in guaymas basin hydrothermal sediments and plumes[J].Appl Environ Microbiol,2006,72(5):3184-3190.
(编辑:程俊)
A Research on Screening and Identifying Autotrophic M anganese-oxidizing Bacteria and M anganese Removal Effect
Hou Hexia
(Qingdao Technological University,Qingdao Shandong 266033,China)
The autotrophic biologicalmanganese removal filter can removemanganese in groundwater effectively.In order to get vaccinated strains of the filter and explore its effect ofmanganese removal,used the improved JFM medium to train the activated sludge from the aeration tank,and selected the efficient autotrophic manganese oxidation bacteria whosemanganese removal rate was above 90%.Three different negative bacteria colonies were obtained through plate culture and Gram stain,as well five different genera were found by 16S rDNA genome sequencing.After two cycles of subculture,the microbial manganese removal rate of the broth containing the above bacteria reached 98%.
autotrophicmanganese bacteria,screen,identify,16S rDNA,manganese removal
X523
A
1008-813X(2016)04-0085-05
2016-06-14
侯荷霞(1990-),女,山东省菏泽市人,青岛理工大学建筑与土木工程专业(市政)在读硕士研究生,主要从事水处理技术方面的研究工作。
