葛根饮片标准汤剂的研究
2016-09-22孙宝莹李西文陈士林
孙宝莹 郭 涛 李西文 陈士林 孙 奕
(1 中国中医科学院中药研究所,北京,100700; 2 兰州理工大学生命科学与工程学院,兰州,730050)
中药研究
葛根饮片标准汤剂的研究
孙宝莹1,2郭涛2李西文1陈士林1孙奕1
(1 中国中医科学院中药研究所,北京,100700; 2 兰州理工大学生命科学与工程学院,兰州,730050)
目的:制备葛根饮片标准汤剂,并进行质量标准研究。方法:药材经DNA条形码基原鉴定,均为豆科植物葛根Puerarialobata(willd.)Ohwi的干燥根。采用水煎煮的方法制备葛根饮片的标准汤剂,并考察葛根标准汤剂中葛根素含量测定的色谱条件,对不同地区的葛根水煎液进行指纹图谱测定,并分别计算葛根素的转移率和葛根饮片标准汤剂的出膏率。结果:通过对10批不同产地葛根的标准汤剂及其饮片样品进行测定,葛根素转移率范围为54.3%~79.1%,出膏率范围为19.0%~38.5%;同时对10批葛根饮片制作出相应的指纹图谱,标定了5个共有峰,计算出其相似度在94%以上。结论:10批次不同产地的葛根标准汤剂与葛根饮片的基本属性相一致,建立本研究的葛根标准汤剂制备方法规范,质量符合标准要求。
葛根;标准汤剂;质量标准;指纹图谱
葛根是2015版《中华人民共和国药典(一部)》收载品种[1],为豆科植物Puerarialobata(willd.)Ohwi的干燥根,习称野葛[2]。始载于《神农本草经》,味甘、辛,性平,归脾、胃经,具有解肌退热、生津、透疹、升阳止泻之功[3]。葛根具有增加脑及冠状动脉血流量、降低血管阻力、降血糖及解热等多种功效[4-6]。葛根中的有效成分主要包括异黄酮类(如葛根素、大豆苷元、大豆苷等)、葛根苷类、三萜皂苷类及生物碱类等[7-10],一般以葛根素、大豆苷等含量较高的异黄酮类成分来评价葛根的质量[11]。
中药饮片标准汤剂是以饮片投料,用水为溶媒加热提取,以物理方法分离、浓缩后所得到的中药饮片水煎剂。中药饮片标准汤剂需要充分考虑药材来源、工艺及质量控制等各个环节的影响因素,以达到与饮片的基本属性相一致的质量标准[12]。我们的研究遵循了《中药饮片标准汤剂研究策略》中所制订的标准汤剂制备以及质量标准建立的方法[13],对10批不同产地的葛根制备了相应的标准汤剂,进行了10批葛根标准汤剂的含量测定和指纹图谱研究,并考察了标准汤剂的出膏率和有效成分葛根素的转移率。
1 材料
Agilent 1260高效液相色谱仪(安捷伦公司);WRX-1S型BP110S电子分析天平(德国赛多利斯公司);Thermo BDS Hypersil C18色谱柱(4.6 mm×250 mm,5 μm)。
葛根素(含量≥98%,批号S90068),购自北京索莱宝科技有限公司。葛根购自河北省安国药材市场和安徽省亳州药材市场。见表1。甲醇为色谱纯(美国Fisher),水为娃哈哈纯净水,其他试剂为分析纯。
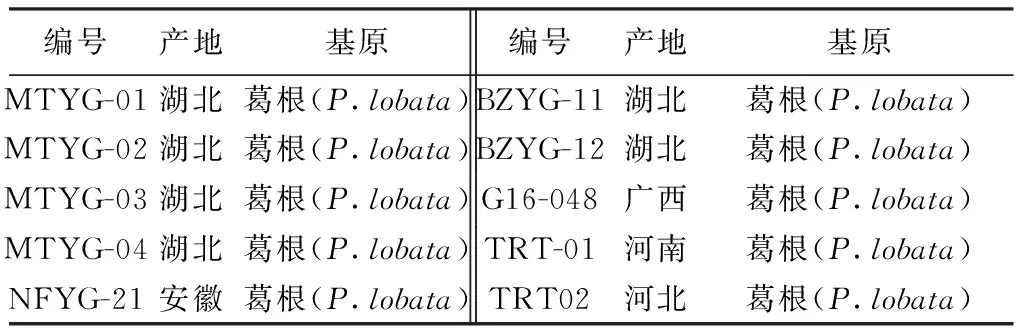
表1 样品来源及基原鉴定
2 方法与结果
2.1基原鉴定每批次葛根基原鉴定检测按药材和饮片取样法(《中华人民共和国药典》附录IIA)取样,采用天根植物基因组试剂盒提取DNA,ITS2序列扩增正向引物ITS2F:5′-ATGCGATACTTGGTGTGAAT-3′;反向引物ITS3R:5′-GACGCTTCTCCAGACTACAAT-3′。PCR扩增条件为:94 ℃,5 min;94 ℃,30 s,56 ℃,30 s,72 ℃,45 s,35~40个循环;72 ℃,10 min。使用DNA测序仪(ABI,3730)对目的条带进行双向测序,PCR扩增引物作为测序引物。序列拼接采用CodonCode Aligner,将获得的序列在中药材DNA条形码鉴定系统(http://www.tcmbarcode.cn)中应用BLAST(Basic Local Alignment Search Tool)方法进行结果比对,同时与《中国药典中药材DNA条形码标准序列》中的葛根ITS2标准序列进行比对。
测序后拼接序列经2种方法判定,结果显示10批次样品均为豆科植物Pueraria lobata(willd.)Ohwi的干燥根。葛根检测序列如下。
CACATCGTTACCCCAACGCAAACAGACGTCCCACA
CGACGGCCGTTGCGTGGTAGGGTGCACGCTGACCT
CCCGCGAGCGGCGTCTCGCGGTTGGTTGAAAATCG
AGTTCGCGGCCGAGCACGCCGTGATAAAATGGTGG
ATGAGCAACGCTCGAGACCAATCACGCGCTGCGA
CTCGGTCCGCGAAGGACTCCCTGATTGATGACGAC
CCTACAGTGCGCCTCCTCTCCGGAGACGCTCTCTA
CGAGA。
2.2对照品溶液的制备取葛根素对照品适量,精密称定,加30%乙醇制成含葛根素0.08 mg/mL的对照品溶液。置冰箱中,4 ℃保存,备用。
2.3供试品溶液的制备
2.3.1葛根饮片样品溶液制备精密称取表1中各批次葛根饮片粉末0.1 g,按照2015版《中华人民共和国药典》规定的方法制备各样品溶液。
2.3.2葛根饮片标准汤剂的制备精密称取表1各批次葛根饮片100 g,分别加入7倍量的水,先浸泡30 min,然后加热回流提取30 min,趁热过滤(200目筛网),分离出煎煮液后,药渣再加入6倍量的水回流提取20 min,趁热过滤(200目筛网),合并2次煎煮液,浓缩成500 mL溶液,即浓度为0.2 g/mL的葛根饮片标准汤剂。
2.3.3葛根饮片标准汤剂的制备供试品的制备取2.3.2项下制得的葛根标准汤剂摇匀,取该浓缩液1 mL至50 mL的容量瓶中,用30%甲醇稀释至刻度,静置20 min,分出上清液,即得供试品,进样前用0.45 μm滤膜过滤。
2.4色谱条件色谱柱为Thermo BDS Hypersil C18色谱柱(4.6 mm×250 mm,5 μm);流动相为0.2%冰醋酸水溶液(A)-甲醇(B),梯度洗脱:0—5 min,15% B;5—23 min,15%~40% B;23—28 min,40% B;28—46 min,40%~70% B,46—56 min,70%~95% B,56—60 min,95%~95% B,流速0.8 mL/min,进样量10 μL,柱温35 ℃,检测波长为250 nm。
2.5方法学研究
2.5.1线性关系考察精密吸取上述对照品贮备液2、4、6、8、10 μL,分别按2.3中所述色谱条件测定各成分的峰面积,以峰面积积分值为纵坐标(Y),对照品进样量为横坐标(X)进行回归分析,绘制标准曲线,计算回归方程为Y=6 316.375 0 x+3.900 0,R2=0.999 9。实验表明,葛根素的进样浓度在0.16~0.64 μg范围内线性关系良好,见图1。

图1 葛根素表标准曲线
2.5.2精密度考察精密吸取2.3.3项下的同一供试品溶液适量,按照2.4色谱条件进样,连续6次,结果平均峰面积为5 727.4,测定并计算葛根素峰面积的RSD值为0.1%,表明仪器精密度良好。见表2。
2.5.3稳定性试验精密吸取2.3.3项下的同一供试品溶液适量,制备供试品溶液,按照2.4色谱条件进样,分别于配制后的0、4、8、10、12、24 h进样,测定并计算葛根素平均峰面积为5 673.3,RSD值为0.4%。结果表明供试品溶液在24 h内稳定性良好。见表3。
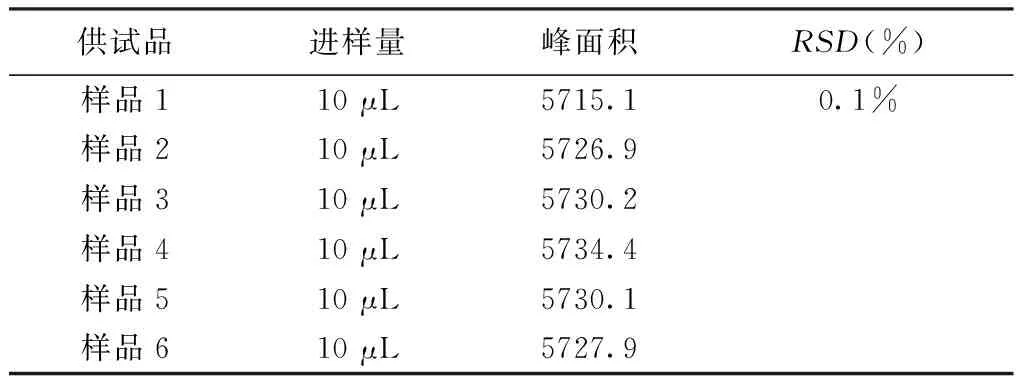
表2 精密度试验结果

表3 稳定性试验结果
2.5.4重复性试验精密量取同一批次葛根素标准汤剂6份,按照2.4色谱条件进样,测定并计算葛根素平均峰面积为5 787.02,RSD值为0.6%。实验表明本方法重复性良好。见表4。
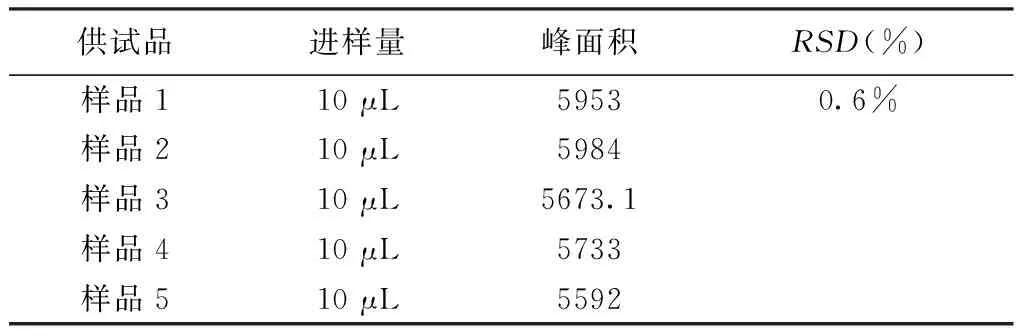
表4 重复性试验结果
2.5.5加样回收率试验精密称取6份相同的样品,分别精密加入等量葛根素对照品溶液1 mL(浓度为0.11 mg/mL),按供试品溶液制备方法制备,按照上述色谱条件测定含量,结果葛根素的平均回收率为97.0%,RSD值为1.64%。见表5。

表5 加样回收率试验结果
2.6转移率及出膏率考察
2.6.1葛根样品中葛根素含量测定按照2015版《中华人民共和国药典》制备各样品溶液,分别精密吸取各溶液10 μL进样。按照2.4色谱条件测定峰面积,根据外标法计算葛根素含量,结果见表6。
2.6.2葛根饮片标准汤剂中葛根素含量测定分别精密吸取2.3.1中供试品溶液各10 μL进样,按照2.4色谱条件测定峰面积,根据外标法计算葛根素含量,结果见表6。

表6 葛根素在葛根饮片和标准汤剂中的含量
2.6.3葛根素出膏率与转移率1)葛根素出膏率计算精密称取葛根水煎液10 mL,置已恒重的蒸发皿中,水浴蒸干,105 ℃烘箱干燥3 h,取出后置干燥器中冷却30 min,称重,计算出膏率,结果见表7。2)葛根素转移率计算根据2.6.2项下测定的葛根饮片和葛根饮片标准汤剂的葛根素含量,由以下公式计算葛根素转移率,结果见表7。
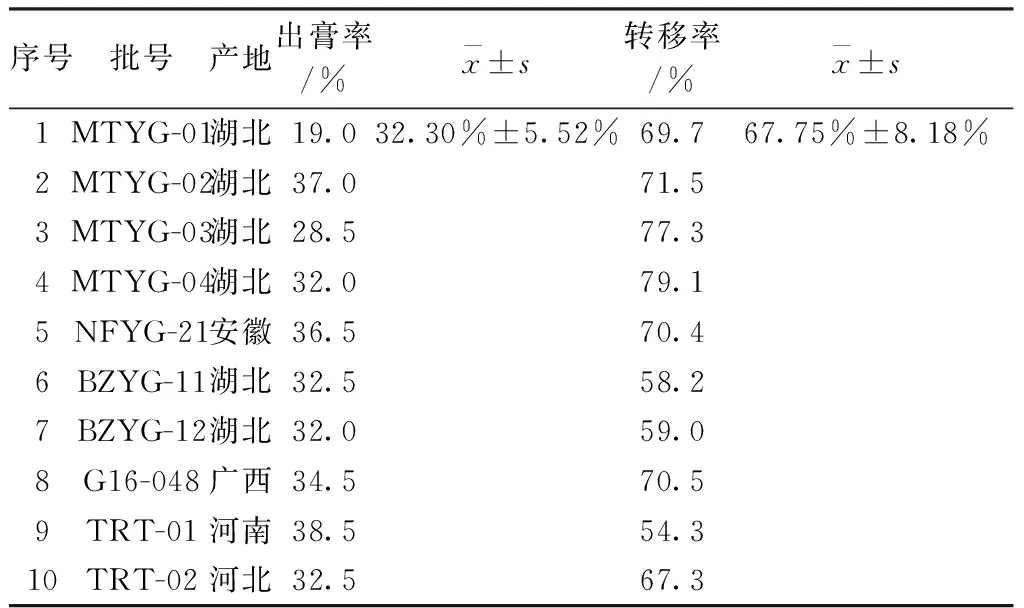
表7 葛根素的出膏率与转移率(%)
2.7葛根HPLC指纹图谱共有模式的建立及主要色谱峰的辨认根据10批葛根饮片标准汤剂HPLC指纹图谱,建立了其对照指纹图谱(图),共标定了5个峰;对照品色谱图,见图2中,显示出3′-羟基葛根素(峰1)、葛根素(峰2)、3-甲氧基葛根素(峰3)、大豆苷(峰4)、大豆苷元(峰5)色谱峰的保留时间和峰面积,选择葛根素为参照峰,计算各峰的相对保留时间和峰面积比值(表8)。10批葛根标准汤剂指纹图谱相似度大于95%(图3和表9)。
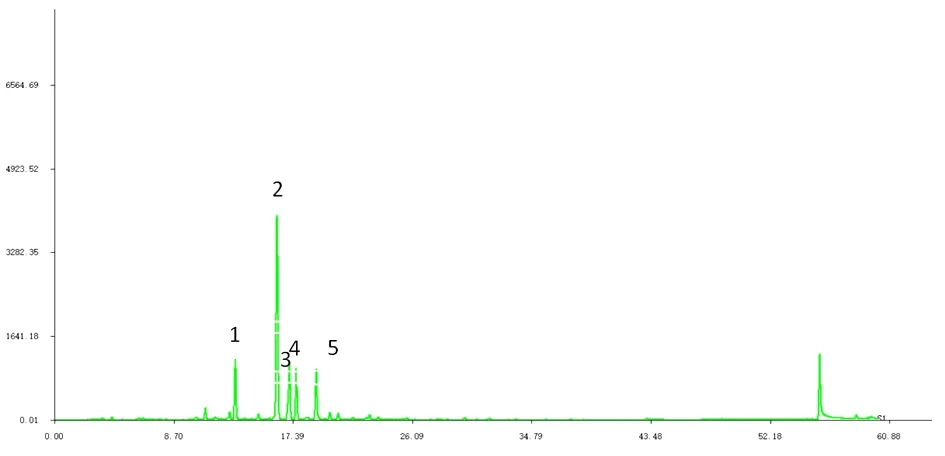
图2 葛根对照品HPLC指纹图谱

图3 10批葛根样品HPLC指纹图谱表8 各对照品及其保留时间

编号物质名称保留时间/min13'-羟基葛根素13.132葛根素16.2333-甲氧基葛根素17.134大豆苷17.645大豆苷元19.10
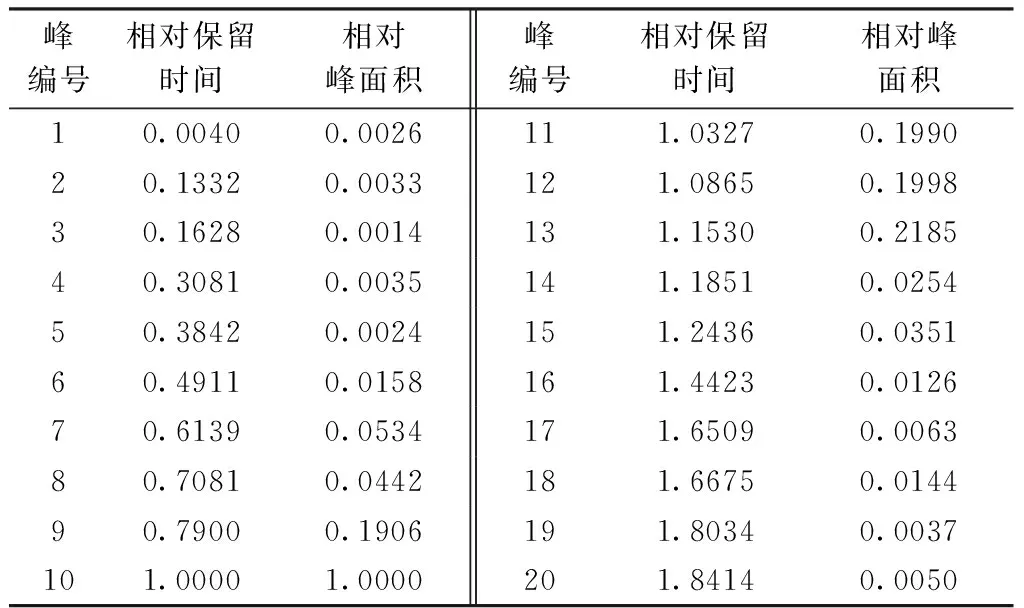
表9 共有峰相对保留时间和相对峰面积(见图3)
3 讨论
1)本文对10批不同产地的葛根制备了标准汤剂,并考察了葛根饮片及其标准汤剂的质量,药材中葛根素的含量从2.89%~4.58%,均符合药典标准。同时,对葛根素等5个成分进行了含量测定与指纹图谱分析。实验结果表明,葛根的标准汤剂与其饮片具有属性的一致性。
2)葛根素是《中华人民共和国药典》规定的葛根饮片测量指标成分,含葛根素(C21H20O9)不得少于2.4%,而且能够被水提取出来,产率较为稳定,因而本文以葛根素作为标准汤剂的指标成分,用于质量标准的建立和成分转移率的评价。
3)评价工艺的稳定性,出膏率和指标成分转移率的建立作为相应的评价质量标准。由研究结果可以看出出膏率范围为19.0%~38.5%,平均值为32.30%,幅度变化范围为5.52%;葛根素转移率范围为58.19%~79.14%,平均值为67.75%,幅度变化范围为8.18%。实验表明,本文所选用饮片具有较好的代表性。如果生产过程中没有进行严格的控制,可能会导致出膏率和成分转移率变化范围较大。因而,对于工业化的中药饮片产品,其应严格控制生产过程,使其出膏率和成分转移率范围在正常范围内。
本文按照《中药饮片标准汤剂研究策略》的有关阐述[13],明确相应工艺参数,建立了葛根饮片标准汤剂制备工艺;经研究所建立的葛根饮片标准汤剂制备方法与临床应用一致、质量稳定,所建立的质量标准可靠,可以在实际中推广应用。
[1]国家药典委员会.中华人民共和国药典一部[S].北京:中国医药科技出版社,2015.
[2]刘向前.药食同源植物资源(Plant Resources of Homology of Medicine and Food)[M].北京:中医古籍出版社,2012.
[3]李天星,李新民.中药葛根的研究进展[J].湖南中医杂志,2013,29(8):151-153.
[4]尹丽红,李艳枫,孟繁琳.葛根的化学成分、药理作用和临床应用[J].黑龙江医药,2010,23(3):371-373.
[5]修虹,沈诗景.注射用葛根素在小鼠体内的药动学研究[J].海峡药学,2010,22(12):24-27.
[6]白东义,佟春玲,韩慧,等.葛根素的药理作用及其临床应用研究进展[J].江苏中医药,2009,41(3):76-78.
[7]张晓珞,王明奎,彭树林,等.葛根的化学成分研究[J].中草药,2002,33(1):1-14.
[8]张德武,戴胜军,李贵海,等.野葛藤的化学成分研究[J].中草药,2011,42(4):649-651.
[9]焦豪妍.葛根的研究概况[J].海峡药学,2010,22(8):47-50.
[10]Prasain J K,Jones K,Kirk M,et al.Profiling and quantification of isoflavonoids in kudzu dietary supplements by high-performance liquid chromatography and electroscopy ionization tandem mass spectrometry[J].Agricultural and Food Chemistry,2003,51(15):4213-4218.
[11]赖玲.葛根的研究进展[J].海峡药学,2013,25(1):10-14.
[12]李学林,孟菲.浅谈影响汤剂煎煮质量的因素[J].中医杂志,2006,47(6):421-427.
[13]陈士林,刘安,李琦,等.中药饮片标准汤剂研究策略[J].中国中药杂志,2016,41(8):1367-1375.
(2016-04-12收稿责任编辑:洪志强)
Preparation and Quality Standard Study on the Kudzuvine Root Standard Decoction
Sun Baoying1,2, GuoTao2, Li Xiwen1, Chen Shilin1, Sun Yi1
(1InstituteofChineseMateriaMedica,ChinaAcademyofChineseMedicalSciences,Beijing100700,China;2LanZhouUniversityofTechnology,SchoolofLifeScienceandEngineering,Lanzhou730050,China)
Objective: To prepare standard decoction and to study the quality standards of Kudzuvine Root. Methods: The medicinal medica was evaluated by DNA bar code to make sure the medica was Kudzuvine Root′s dry root. The The method of standard decoction preparation of Kudzuvine Root and its determination of chromatogram conditions were adopted so as to determine the fingerprint of standard decoction and calculate the transfer rate and the extractum rate of the standard decoction. Results: After the measurement of standard decoction of 10 batches of Kudzuvine Root from different regions and sample pieces, the transfer rate ranged from 54.3% to 79.1% and extractum rate was at the range of 19.0%~38.5%; Moreover, the 10 batches of Kudzuvine Root produced the corresponding fingerprint, 5 common peaks were calibrated, and the similarity was more than 94%. Conclusion: The basic properties of 10 batches of Kudzuvine Root Decoction are consistent with its prepared herbal medicine standard. Therefore, it can be used to establish the standard decoction of Kudzuvine Root.
Kudzuvine Root; Quality standard; Standard decoction; Fingerprint
中国中医科学院综合性大平台项目(编号:Z2014003)
孙奕,博士,副研究员,研究方向:主要从事天然活性成分、中药分析等研究,电话(010)64021051,E-mail:ysun@icmm.ac.cn
R282
A
10.3969/j.issn.1673-7202.2016.08.053
