乙酸乙酯的水溶性及制备时碳酸钠溶液的作用
2016-09-21吴朝辉
吴朝辉
摘要:经实验探究发现,乙酸乙酯能溶于水,并简要分析了它能溶于水的原因。同时结合实验探究和理论分析,探讨了在乙酸乙酯制备实验中饱和碳酸钠溶液的两个重要作用:溶解乙醇、减少酯的溶解。旨在为中学教学提供有益的参考。
关键词:乙酸乙酯;水溶性;制备实验;碳酸钠;化学教材
文章编号:1005–6629(2016)8–0050–03 中图分类号:G633.8 文献标识码:B
1 乙酸乙酸的水溶性问题
1.1 问题提出
现行的部分化学教材中写道:“液面上有透明的不溶于水的油状液体产生,并可以闻到香味。这种有香味的液体叫乙酸乙酯[人教版《化学2(第3版)》第76页]”;“乙酸(CH3COOH)和甲酸甲酯(HCOOCH3)互为同分异构体,前者易溶于水且具有酸性,后者难溶于水且没有酸性[苏教版《有机化学基础(第4版)》第25页]”。因此,部分教师认为,将乙酸乙酯加入水中会分层,不溶于水且密度较小的乙酸乙酯浮在上层。但有些教学辅助用书,如《大学化学手册》[1]、《中学教学全书·化学卷》[2]却认为乙酸乙酯能溶于水。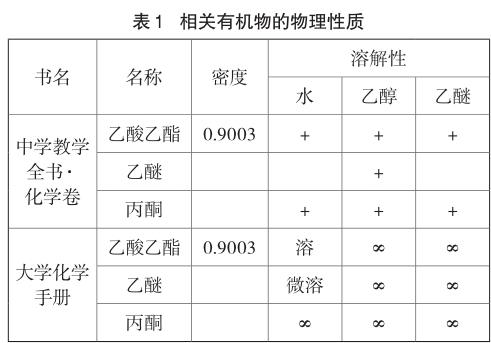
另外在百度百科也介绍乙酸乙酯[3]:“溶于水(10%mL/mL)”“水溶性:8.3g/100mL(20℃)”。
乙酸乙酯到底能不能溶于水?笔者决定围绕这个问题进行实验求证,希望能找出乙酸乙酯水溶性的真相。
1.2 实验探究与结论
实验1 向锥形瓶1中加40mL蒸馏水,再加 4滴管乙酸乙酯,塞上橡皮塞,振荡。10min后可见油层体积明显减少。1h后,分层现象消失,摇动锥形瓶,液体均匀透明,无任何乳浊现象。
实验2 向锥形瓶2中加40mL饱和Na2CO3溶液,再加4滴管乙酸乙酯,塞上橡皮塞,振荡。10min后上层液体体积无明显变化。放置3天后仍无明显变化。
通过对比可知,锥形瓶1中分层现象消失不是酯挥发造成的。因为两个锥形瓶始终并排放置,环境完全相同(室温9℃),而且打开橡皮塞仍能闻到明显香味。也不可能是酯水解造成的。如果是的话,锥形瓶2中的Na2CO3溶液更有利于酯水解,分层现象应更易消失。所以锥形瓶1中分层现象消失的原因是乙酸乙酸分散到了水中。
如果4滴管乙酸乙酯按4mL计,则根据(4×0.9003):40=S:100,S=9g(9℃),说明百度百科提供的数据是有参考价值的。笔者又搜索了甲酸甲酯,发现20℃时它的溶解度为300 g/L[4]。所以教材中对它们的水溶性的说法存在不妥之处。
1.3 乙酸乙酯能溶于水的原因分析
已知丙酮极易溶于水、乙醚微溶于水(见表1),根据“相似相溶原理”可知丙酮是极性分子、乙醚为弱极性分子。再根据两者结构可知:羰基是极性基团,醚键是弱极性基团。因为酯基中含有羰基,导致羰基的影响占主导的低级酯分子具有一定的极性,因而低级酯能溶于水。随着碳原子增多,烃基的憎水作用增强,酯的水溶性逐渐降低。以上仅是根据“结构相似、性质相似”的原理进行推理,科学与否有待证实。
2 制备乙酸乙酯时饱和碳酸钠溶液的作用
在高中的乙酸乙酯的制备实验中,要用饱和Na2CO3溶液收集生成物蒸气,Na2CO3溶液的作用被认为是吸收乙醇、中和乙酸、降低乙酸乙酯的溶解度[5]。学生能理解作用之一的“中和乙酸”,但对其他作用却“说不清,道不明”。
2.1 饱和Na2CO3溶液能减少乙酸乙酯溶解的原因分析
在教学中,经常有学生表示不解:既然酯不溶于水,为什么要用Na2CO3溶液减少其溶解?为什么Na2CO3溶液能减小其溶解?正是这些疑问不断出现,才促使笔者去查找相关资料。现在通过实验1、实验2知道乙酸乙酯是能溶于水的,所以要用饱和Na2CO3溶液来降低其溶解。
那Na2CO3溶液为什么能降低酯的水溶性?有文献提到[6]:纯化有机物时,常用饱和食盐水洗涤,而不用水直接洗涤,这是利用其盐析效应,可降低有机物在水中的溶解度,并能加快水、油的分层。笔者又用NaCl代替Na2CO3重复了实验2,实验现象完全相同,说明是Na2CO3的盐析效应抑制了乙酸乙酯的溶解。
2.2 饱和Na2CO3溶液能溶解乙醇的原因分析
2.2.1 其他观点介绍与质疑
对于Na2CO3溶液能溶解乙醇,有学者通过实验3提出了反对观点[7]:“饱和Na2CO3溶液不能除去混在酯中的醇,相反的是,由于乙酸乙酯中混有乙醇的缘故,反而会使部分的碳酸钠溶液进入有机相。”
实验3 将3mL乙酸乙酯、3mL乙醇与3mL饱和Na2CO3溶液混合,振荡后没有分层。
笔者认为实验3没有分层是因为乙醇用量偏大造成的,因为乙醇是优良溶剂,既能溶解盐类化合物,又能溶解一般有机物[8]。乙酸乙酯的制备实验中,沸点较高的乙酸、乙醇在长导管的作用下冷凝回流(实验环节时可见明显的回流现象),所以在粗产物中含量并不高(实验结束后振荡,上层液体的体积变化较小)。当乙酸乙酯中只含少量乙醇时,它能被饱和Na2CO3溶液萃取出来吗?
2.2.2 对质疑的实验求证
实验4 用5mL移液管量取3mL饱和Na2CO3溶液,用1mL移液管量取0.5mL无水乙醇,同时加入10mL量筒中,充分振荡,液体互溶且总体积为3.6mL。
实验5 用5mL移液管量取3mL乙酸乙酯,用1mL移液管加入0.5mL无水乙醇,同时加到10mL量筒中混匀。用5mL移液管量取3mL饱和Na2CO3溶液加入量筒,充分振荡后静置。液体分层,下层3.6mL,总体积6.6mL。
实验证实,在乙醇含量较小时,饱和Na2CO3溶液可以将其从乙酸乙酯中萃取出来,即饱和Na2CO3溶液可以“溶解乙醇”。
2.2.3 对饱和Na2CO3溶液能溶解乙醇的原因分析
为什么乙醇会进入Na2CO3溶液?因为“醇分子和醇分子间能形成氢键,醇分子和水分子之间也能形成氢键,这样,醇分子就有可能在水分子间取得位置。反过来,水分子也可在醇分子间取得位置。因此,低级醇(三个碳以下)能以任何比例与水混溶”[9]。由于氢键作用力要远大于一般分子间作用力,所以,醇分子在水分子的吸引下自发地从酯中分离出来,进入水层。
通过上述分析可知,用饱和Na2CO3溶液收集产物是乙酸乙酯制备实验的精心选择。
3 小结
教材是实现课程目标的重要载体,是教学的重要中介,是学生获取知识的主要途径之一,这些知识也是学生进入后续学习的铺路石,所以教材对教学的重要性不言而喻。求真、求实,追求知识的科学性、准确性和严谨性是编写教材的根本。我们不禁要反思:“乙酸乙酯能溶于水”这个事实并不复杂,为什么这个错误会如此随意地出现在教材中?我们需要科学严谨地表述,但更期待背后所缺失的求真求实的科学态度。
在“互联网+”时代,学生获取知识越来越方便,途径也会越来越多,这就迫使我们教师在教学中必须更加严谨和认真,切不可迷信教材,要注重对教材提供的结论进行推敲和论证,不能唯教材是从。
参考文献:
[1]印永嘉.大学化学手册[M].济南:山东科学技术出版社,1985:189,194,171.
[2]杨德壬.中学教学全书·化学卷[M].上海:上海教育出版社,1996:930,930,940.
[3]百度百科(乙酸乙酯http://baike.baidu.com).
[4]百度百科(甲酸甲酯http://baike.baidu.com).
[5]郑雅敏,胡慧闵.高中化学“伪”实验成因分析[J].化学教学,2012,(3):55~56.
[6]林敏.对一道高考有机实验题的思考和质疑[J].化学教学,2009,(12):73~74.
[7]席宗超.碳酸钠溶液能从乙酸乙酯中除去乙醇吗[J].中学化学教学参考,2011,(11):61.
[8][9]王积涛,张宝申,王永梅等编著.有机化学(第二版)[M].天津:南开大学出版社:264,263.
