茶黄素对BSA/MDA羰-氨交联反应体系中的蛋白质羰基化及其聚集化抑制作用研究
2016-09-21张静蔡淑娴黄建安李娟钟妮阳衡刘仲华
张静,蔡淑娴,黄建安,3,4,李娟,3,4,钟妮,阳衡,刘仲华,3,4*
1.湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;2.北京大学医学部,北京 100191;
3.国家植物功能成分利用工程技术研究中心,湖南 长沙 410128;4.植物功能成分利用协同创新中心,湖南 长沙 410128
茶黄素对BSA/MDA羰-氨交联反应体系中的蛋白质羰基化及其聚集化抑制作用研究
张静1,蔡淑娴2,黄建安1,3,4,李娟1,3,4,钟妮1,阳衡1,刘仲华1,3,4*
1.湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;2.北京大学医学部,北京 100191;
3.国家植物功能成分利用工程技术研究中心,湖南 长沙 410128;4.植物功能成分利用协同创新中心,湖南 长沙 410128
本实验构建了羰-氨交联反应形成老年色素的体外反应模型,通过ThT荧光、扫描电子显微镜、透射电镜、SDS-PAGE及 NBT染色等检测手段,结果表明,茶黄素不仅可以抑制此模型中由于蛋白质羰基化产生的老年色素,还可以抑制此模型中因蛋白质聚集化产生的β-sheet结构。上述结果揭示了衰老机制中的蛋白质羰基化与导致神经退行性疾病的蛋白质聚集化之间存在一定的相关性。
茶黄素;羰-氨交联;老年色素;蛋白质聚集化
茶黄素是红茶中决定色香味及品质的主要功能成分,是由儿茶素和没食子酸等酚类物质经发酵、氧化后形成的一类能溶于乙酸乙酯,具有苯并卓酚酮的化合物总称。红茶茶黄素中一般以茶黄素(Theaflavin,TF)、茶黄素-3-没食子酸酯(Theaflavin-3-gallate,TF-3-G),茶黄素-3'-没食子酸酯(Theaflavin-3'-gallate,TF-3'-G)和茶黄素双没食子酸酯(Theaflavin-3,3'-gallate,TF-DG)4种为主体成分,分子结构如图1。茶黄素化合物的许多生物活性主要来源于它们含有的较多酚羟基结构的抗氧化活性。现已发现,茶黄素具有调节血脂[1]、抗氧化、抗肿瘤[2]及调节机体免疫、抗菌[3]、神经保护[4]等多方面的药理作用。
蛋白质老年色素荧光物质是脂质过氧化和非酶糖基化过程中产生的一系列具有毒性的不饱和活性羰基化合物与蛋白质氨基酸(主要是赖氨酸、精氨酸、半胱氨酸)的氨基基团反应,从而产生的羰-氨交联反应产物[5-6],随着年龄增长这种生物体衰老标志物——老年色素也随之积累。越来越多的研究表明,蛋白质羰基化与神经退行性疾病,如阿尔茨海默病、帕金森症及亨廷顿舞蹈症等疾病的发生和发展密切相关[7],此类疾病伴随着蛋白质错误折叠,同时产生富含 β折叠结构的不溶性淀粉样沉积。有研究表明,阿尔茨海默病患者脑内蛋白羰基含量大大提高,羰氨交联产生的老年色素的量与痴呆严重程度存在相关性[8]。大多数研究表明[4,9-11],以EGCG为主的绿茶多酚类化合物以及红茶提取物能直接结合到松散无折叠的淀粉样蛋白上,并能促进其形成无毒性单体结构而不是形成具有毒性的β折叠结构,同时这些功能成分也具有清除羰基化合物的作用[12-14],儿茶素尤其是酯型儿茶素能显著抑制MDA诱导的蛋白质类老年色素物质生成,同时其抑制作用与其结构的亲核性有关[15],但目前对堪称茶中“软黄金”的茶黄素单体的相关研究较为少见。因此,基于以上所述研究结论,本实验通过构建羰-氨交联反应形成老年色素的体外模型,分析红茶功能活性成分中的4种主要茶黄素单体对此模型中羰-氨交联反应过程中羰基化蛋白及毒性 β折叠结构生成的抑制作用。
注:a:茶黄素;b:茶黄素-3-没食子酸酯;c:茶黄素-3'-没食子酸酯;d:茶黄素双没食子酸酯。Note:a:TF,b:TF-3-G,c:TF-3'-G,d:TF-DG.图1 4种茶黄素分子结构示意图Fig.1 Structure of theaflavins
1 材料与方法
1.1材料与试剂
茶黄素单体(TF、TF-3-G、TF-3'-G、TF-DG含量>98%,北京工商大学提供),1,1,3,3-四甲基氧基丙烷(1,1,3,3-tetranethoxypropane,TMP)购自和光纯药工业株式会社,牛血清白蛋白(Bovine Serum Albumin,BSA)及硫磺素-T(Thioflavin T,ThT)均购自Sigma公司,丙烯酰胺、N,N-甲叉丙烯酰胺、十二烷基硫酸钠(SDS)、过硫酸铵、四甲基乙二胺(TEMED)、氯化硝基四氮唑蓝(Nitroblue tetrazolium chloride,NBT)、甘氨酸、Tris-Base、考马斯亮蓝 R250、甘油、溴酚蓝购自生工生物工程(上海)有限公司,即用型蛋白质分子量标准marker购自Takara公司,彩色预染蛋白质分子量标准Marker、Tris-HCl购自碧云天生物技术有限公司,甲醇、冰乙酸、氢氧化钾等试剂为分析纯级。
1.2主要仪器
SKY-200B摇床、水浴锅、Christ ALPHA 1-2 LD冷冻干燥机、GS-800扫描仪、PowerPac 2000电泳仪(Bio-Rad)、Thermo Scientific Varioskan Flash光谱扫描多功能酶标仪、JSM-1230扫描电子显微镜、Zeiss 900透射电镜。
1.3实验方法
1.3.1BSA/MDA反应体系造模条件优化
根据参考文献[15]制备10 mmol·L-1MDA 及0.1 mol·L-1PBS磷酸缓冲液,将1 mg·mL-1BSA与不同浓度(0、1、2、3、4、5、8 mmol·L-1)的MDA置于PBS中反应,将体系在37℃、180 r·min-1摇床中孵育 3 d,取 0、1、2、3 d不同时间点样品进行检测,全过程无菌操作。
1.3.2药物处理BSA/MDA反应体系
实验设置空白对照组(control)、模型组(model)、药物对照组(用于排除药物干预组茶黄素本身对体系产生的影响)、药物干预组,各组BSA最终质量浓度1 mg·mL-1,模型组和药物干预组MDA终浓度4 mmol·L-1,药物对照组及干预组分别加入 TF、TF-3-G、TF-3'-G、TF-DG 4种茶黄素,各干预组浓度设置分别为60、120、180、240、300 µmol·L-1,用 0.1 mol·L-1PBS配制各组反应体系总体积为500 μL,体系置于摇床(37℃,180 r·min-1)中孵育48 h。
1.3.3ThT荧光检测蛋白寡聚体形成与老年色素荧光值检测
ThT是一种苯并咪唑盐,ThT可以与富含β-sheet结构的分子相结合发出荧光,发射光谱呈现红移的特点,ThT发出的荧光强度与被测分子β-sheet结构的含量呈正相关,因此在蛋白质错误折叠的研究领域 ThT荧光探针是一种较为理想的检测淀粉样蛋白聚集体的方法。
取反应样品溶液用ThT检测反应体系中β折叠结构,每孔40 µL样品与160 µL浓度为40 µmol·L-1ThT(ThT溶液用50 mmol·L-1甘氨酸,NaOH调pH至8.0的缓冲液配制)混合后用 96孔板于激发波长为 440 nm(band pass 5 nm),发射波长为485 nm的全自动酶标仪检测荧光值。取一定量样品用 PBS稀释10倍,于酶标仪检测老年色素荧光值,激发波长为395 nm,发射波长为460 nm。
1.3.4扫描电镜
如 1.3.2制备样品,经冷冻干燥后将固体样品做扫描电镜检测,观察各组蛋白质形态。
1.3.5透射电镜
如1.3.2制备样品,取control组、model组及TF处理组各10 µL,用双蒸水稀释的样品滴于镀膜铜网上,10 min后用滤纸沿边缘吸干,滴加2%双氧铀负染色10 min后再次用滤纸吸干,透射电镜下观察蛋白质形态并拍照(电压100 kV)。
1.3.6SDS-PAGE电泳实验
根据 1.3.2选择药物浓度为 240 µmol·L-1的反应体系制备样品进行 SDS-PAGE电泳实验。聚丙烯酰胺凝胶(厚度0.75 mm)为10%分离胶,5%浓缩胶。电泳缓冲液为甘氨酸缓冲液。将 5×变性上样缓冲液与样品溶液按体积比为1︰4混合,于沸水中煮10 min,取5 µL上样,全程先施加80 V电压至溴酚蓝显色剂跑过浓缩胶,再调整电压至120 V,待溴酚蓝指示剂接近凝胶边缘停止电泳,取出凝胶置于水中漂洗数分钟后固定45 min(固定液:10 mL冰乙酸、40 mL甲醇、50 mL水),水洗2次,每次10 min,考马斯亮蓝染色4 h,水洗至背景颜色褪去,用扫描仪成像拍照。
1.3.7电转及NBT染色实验
电转实验:将 SDS-PAGE电泳后凝胶切去周边未点样部分,剪取与之相同大小的硝酸纤维素膜,并于甲醇中浸泡1 min,将电转装置于电转液中浸泡10 min,按照负极板-泡沫-三层滤纸-凝胶-硝酸纤维素膜-三层滤纸-泡沫-正极板的顺序放置,叠放时去除气泡,合紧电极板后倒满电转液,电压定为30 V,转移2.5 h后取出。
NBT染色:配制浓度为2 mol·L-1的甘氨酸-KOH缓冲液(pH10),在避光条件下,称取 NBT溶于 2 mol·L-1甘氨酸缓冲液(KOH 调pH至10)中制成0.24 mmol·L-1染色液,将已转好的硝酸纤维素膜置于染色液中3 h后用双蒸水清洗数分钟,将膜转移至洁净玻璃片进行拍照。
2 结果与分析
2.1BSA/MDA反应体系模型建立
由图2可知,BSA与不同浓度MDA产生羰-氨交联反应体系,生成老年色素及 β-sheet结构的量随着MDA浓度增大及时间的延长均有所升高,两者增长趋势相近,表明羰-氨交联反应中老年色素的产生与蛋白质聚集化存在一定相关性。综合老年色素荧光值及 ThT荧光值两个指标,可选择较佳造模反应体系条件,即选择4 mmol·L-1MDA与1 mg·mL-1BSA反应体系,37℃、180 r·min-1摇床孵育2 d。
2.2茶黄素对BSA/MDA体系蛋白质羰基化的保护作用
荧光值检测结果(图3)表明,model组BSA与MDA孵育之后产生的荧光值与control组相比存在极显著差异(P<0.01);而加入不同浓度茶黄素干预能有效抑制荧光值的增加,各加药组与 model组相比,差异极显著(P<0.01),且药物浓度越高,荧光值越小,存在一定的剂量依赖关系。整体而言,茶黄素 4种单体对体系产生的老年色素的抑制效果,大致为 TF-DG>TF-3-G>TF-3'-G>TF。由此可见,MDA能绞杀蛋白质,生成老年色素荧光物质,但茶黄素能较好地保护蛋白,抑制 MDA与活性蛋白发生羰-氨交联反应并产生老年色素。
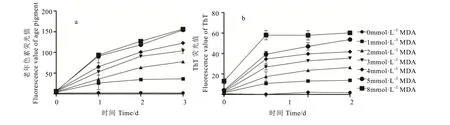
图2 BSA与不同浓度MDA混合不同时间后老年色素荧光值(a)及ThT荧光值(b)结果Fig.2 Fluorescence value of age pigment and ThT of the reaction with different concentrations of MDA at different time
2.3茶黄素对BSA/MDA体系蛋白质聚集化的保护作用
从ThT荧光检测结果(图4)可以看出,model组MDA与BSA反应产生β-sheet结构与control组相比,以及各不同浓度药物干预组与model组相比,均存在极显著差异(P<0.01)。表明此体系中MDA与BSA产生羰-氨交联反应的同时发生蛋白质聚集化,并产生大量β-sheet结构,此外,茶黄素能在一定程度上抑制MDA与BSA反应体系产生β-sheet结构,并存在一定剂量依赖关系。通过比较得出,茶黄素对 MDA/BSA体系蛋白质聚集化抑制效果极为显著,尤以TF-DG效果最佳。
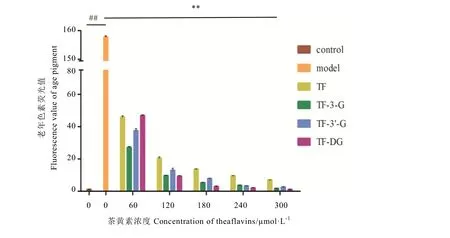
注:##表示空白对照组与模型组之间在P<0.01水平差异显著,**表示药物干预组与模型组之间在P<0.01水平差异显著。下同。Note:## indicates significantly different at P<0.01 between control and model group.** indicates significantly different at P<0.01 between drug-mediated group and model group.The same below.图3 不同浓度茶黄素对BSA/MDA羰-氨交联反应老年色素荧光物质生成的抑制作用Fig.3 Inhibition of different concentration of theaflavins on generation of age pigment in the reaction of BSA/MDA
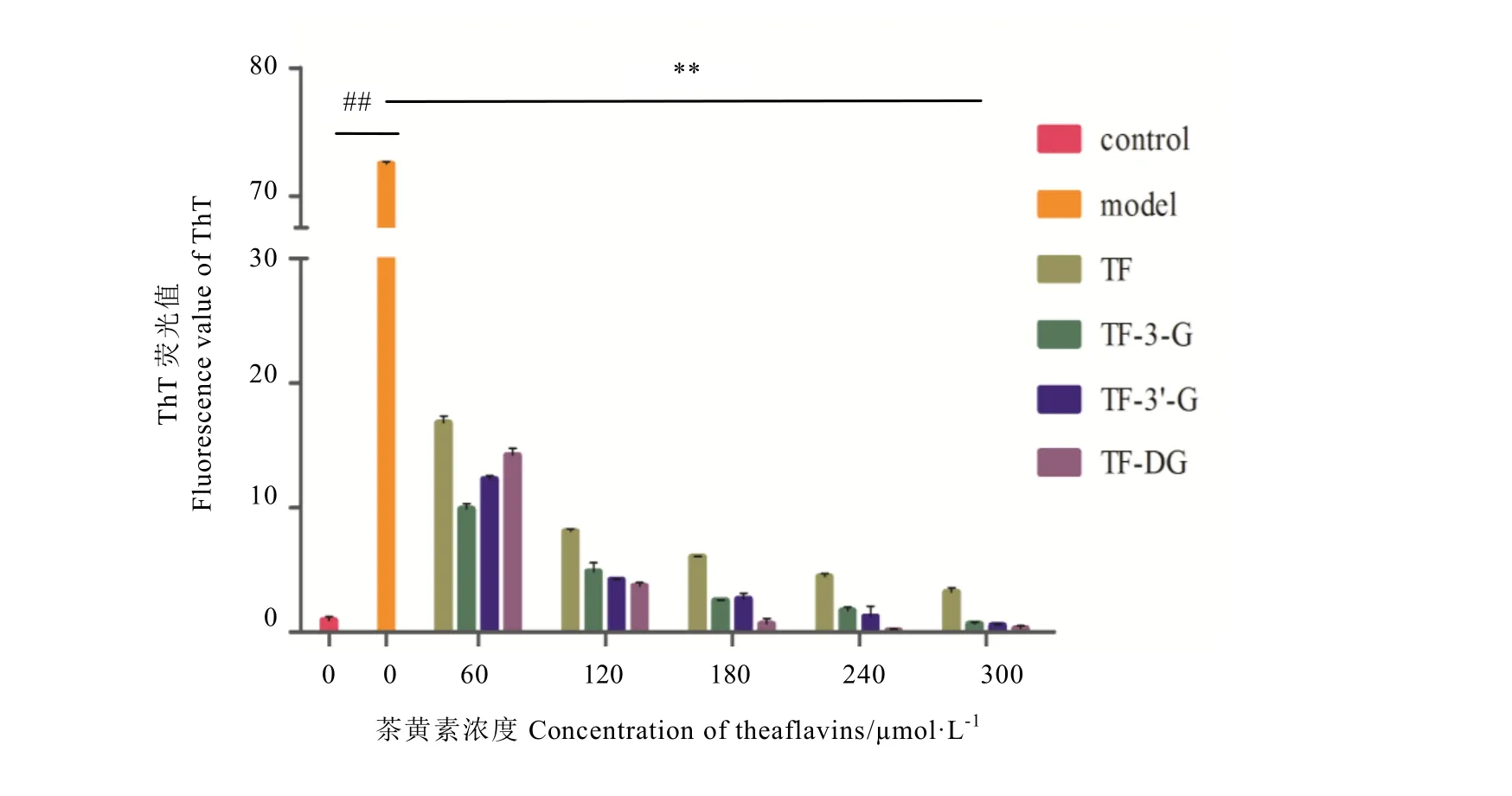
图4 不同浓度茶黄素对BSA/MDA羰-氨交联反应中β-sheet生成的抑制作用Fig.4 Inhibition of different concentration of theaflavins on generation of β-sheet in the reaction of BSA/MDA
2.4扫描电镜及透射电镜成像
通过扫描电镜和透射电镜(图5)对处理样品进行观察分析,未经处理的control组(图5-A、5-G)蛋白质呈较规则的圆形颗粒状,model组(图5-B、5-H)蛋白质呈现纤维状,经茶黄素处理后(图5-C、5-D、5-E、5-F、5-J),蛋白质形态变得较为松散,且不同程度出现紧密的颗粒球状蛋白,表明在BSA/MDA羰-氨交联反应体系产生老年斑过程中,茶黄素单体成分使蛋白质构象发生改变,在一定程度上抑制了蛋白质纤维化及淀粉状蛋白的生成。

注:A-F:扫描电镜成像图,G-J:透射电镜成像图。A、G:control;B、H:model;C、J:BSA/MDA+TF;D:BSA/MDA+TF-3-G;E:BSA/MDA+TF-3'-G;F:BSA/MDA+TF-DG。Note:A-F:image map of SEM,G-J:image map of TEM.A,G:control.B,H:model.C,J:BSA/MDA+TF.D:BSA/MDA+TF-3-G.E:BSA/MDA+TF-3'-G.F:BSA/MDA+TF-DG.图5 茶黄素处理BSA/MDA羰-氨交联体系的扫描电镜和透射电镜成像图Fig.5 Scanning electron microscopeand transmission electric microscope graphs of samplesin SEM and TEM treated with theaflavins
2.5茶黄素影响BSA/MDA体系蛋白质聚集化SDS-PAGE及NBT染色结果
由SDS-PAGE电泳图(图6)可知,Ⅴ、Ⅵ、Ⅶ组48 h所对应的条带浓缩胶出现了大分子聚集体(图 6黑色箭头所指),这些聚集体是高分子量蛋白质,药物干预组经茶黄素处理 48 h后主条带向大分子与小分子弥散开且高分子量条带更加明显。从电转染色情况来看,茶黄素组主条带向高分子量部分弥散并堆积,且这些部分均可在纤维素膜上NBT染色,而control组及model组浓缩胶部分并未出现高分子量蛋白或发生弥散,且NBT并未染色,说明茶黄素可直接结合于未折叠或预折叠的蛋白质上,从而使结构发生变化并拥有醌式结构,这种作用使蛋白质在聚集化中变为无定形大分子量纤维态沉积,而不是富含 β-sheet结构的毒性中间体(图 6白色箭头所指)。
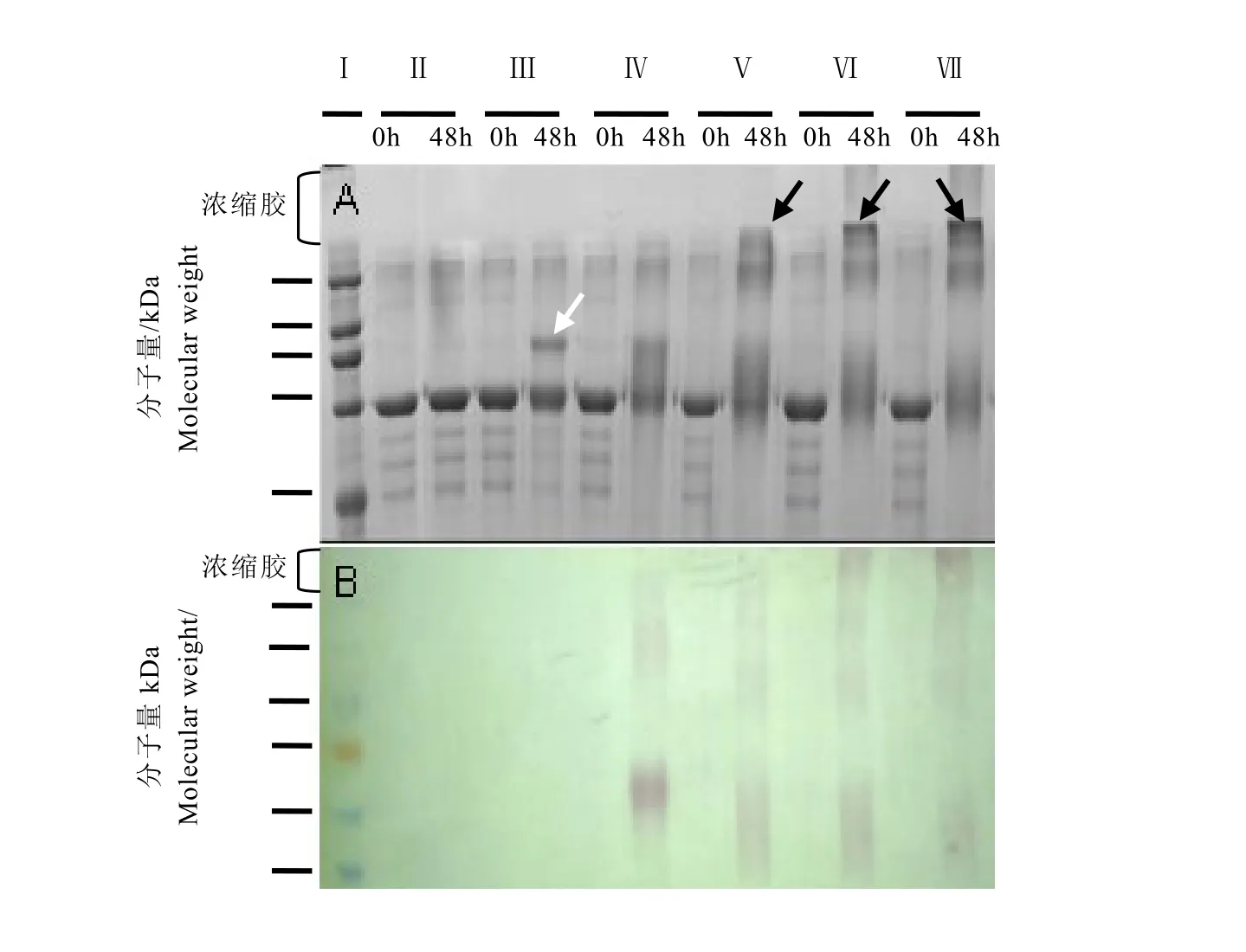
注:Ⅰ:Marker;Ⅱ:Control;Ⅲ:Model;Ⅳ:BSA/MDA+TF;Ⅴ:BSA/MDA+TF-3-G;Ⅵ:BSA/MDA+TF-3'-G;Ⅶ:BSA/MDA+TF-DG。Note:Ⅰ:Marker,Ⅱ:Control,Ⅲ:Model,Ⅳ:BSA/MDA+TF,Ⅴ:BSA/MDA+TF-3-G,Ⅵ:BSA/MDA+TF-3'-G,Ⅶ:BSA/MDA+TF-DG.图6 BSA/MDA反应体系经茶黄素处理后的SDS-PAGE电泳图谱(A)和NBT染色图谱(B)Fig.6 SDS-PAGE(A)and NBT staining(B)analysis of samples in SEM and TEM treated with theaflavins
3 讨论
本实验成功构建BSA/MDA羰-氨交联反应体系体外模型,筛选出最佳MDA反应浓度为 4 mmol·L-1,与 BSA于 37℃、180 r·min-1摇床环境下孵育 2 d。实验结果显示,反应体系的ThT及老年色素产物荧光值随MDA浓度及孵育时间的增加而升高,表明羰-氨交联反应过程中 β-sheet结构与老年色素的生成量在一定程度上呈正相关。
茶黄素 4种主要单体对羰-氨交联反应体系进行干预实验,通过设置药物对照组排除茶黄素自氧化以及颜色背景等自身产生的影响,在此前提下所得实验结果表明,茶叶中这些功能成分对体系羰基化产物即老年色素荧光物质的产生均具有一定抑制作用,同时,也能降低 β-sheet结构生成。从实验结果可得出茶黄素抑制效果较为明显,且茶黄素4种单体中以TF-DG效果最佳。有研究表明,没食子酰基是抑制羰-氨交联反应的核心功能基,在氧化还原活性基团的协同作用下能更有效地清除MDA等毒性羰基化合物,从而延缓甚至逆转羰-氨交联反应的进行与恶化[15],同时,C6-C6结构可能是抑制淀粉样蛋白聚集化的有效新型多酚类的活性官能团[16],茶黄素不仅具有与儿茶素分子相类似的酚羟基结构,并且其分子结构中的苯并卓酚酮结构共轭体系空间更大,具有更多的酚羟基团,TF-DG是茶黄素类中酚羟基团最多的化合物[17]。由此推测,茶黄素可能因具有这些优势结构而对老年色素荧光物质及 β-sheet结构具有显著抑制作用,且TF-DG效果最佳,具体哪一个或哪几个功能基团产生作用需待进一步实验加以验证。
通过SDS-PAGE电泳和NBT染色结果进一步说明了茶黄素能直接结合蛋白生成醌类物质,减少蛋白质纤维化过程中产生的富含β-sheet结构的毒性寡聚体,促进生成毒性较弱的大分子量蛋白,从 SDS-PAGE电泳图可知茶黄素加药组在孵育 48 h后条带弥散程度以及NBT染色程度均较明显,由此说明茶黄素抑制效果十分显著,且与 ThT荧光检测结果相符。经扫描电子显微镜以及透射电镜对各组进行成像观察,进一步说明药物可直接改变蛋白质构象从而抑制蛋白质纤维化及老年斑的形成。
老年性痴呆发生发展的早期分子病因与人体衰老过程的共性生化过程一脉相承,占据衰老生化机理首要位置的“羰基应激”[18]也是与增龄相关的淀粉样蛋白形成、神经纤维缠结、共核蛋白富集、神经元自噬导致脂褐素堆积的重要生化基础,但至今对两者相关性分子机制研究较为少见。在医药领域,许多防治阿尔茨海默病等神经退行性疾病药物中的功效成分或功能团因子大多都是具有阻抑羰基化合物毒性的生化基团,本实验表明了茶黄素不仅能抑制羰基应激产生的老年色素,从而具有潜在的减缓衰老作用,同时也能抑制蛋白质聚集化从而可能具有预防老年痴呆等神经退行性疾病功效,因此暗示了加强对生物体抗羰基应激可以成为一种颇有功效的抗神经退行性等老年疾病的早期防治措施。
[1]Chen N,Bezzina R,Hinch E,et al.Green tea,black tea,and epigallocatechin modify body composition,improve glucose tolerance,and differentially alter metabolic gene expression in rats fed a high-fat diet [J].Nutrition Research,2009,29(11):784-793.
[2]Kundu T,Dey S,Roy M,et al.Induction of apoptosis in human leukemia cells by black tea and its polyphenol theaflavin [J].Cancer Letters,2005,230(1):111-121.
[3]Friedman M,Henika P R,Levin C E,et al.Antimicrobial activities of tea catechins and theaflavins and tea extracts against Bacillus cereus [J].Journal of Food Protection,2006,69(2):354-361.
[4]Bastianetto S,Yao Z X,Papadopoulos V,et al.Neuroprotective effects of green and black teas and their catechin gallate esters against β-amyloid-induced toxicity [J].European Journal of Neuroscience,2006,23(1):55-64.
[5]Yin D.Biochemical basis of lipofuscin,ceroid,and age pigment-like fluorophores [J].Free Radical Biology and Medicine,1996,21(6):871-888.
[6]Yin D.Studies on age pigments evolving into a new theory of biological aging [J].Gerontology,1995,41(Supp.2):159-172.
[7]陈刚领,唐宁,薛永亮.蛋白质羰基化与疾病关系的研究进展[J].辽宁中医药大学学报,2009,11(7):58-60.
[8]Roth M,Tomlinson B,Blessed G.The relationship between quantitative measures of dementia and of degenerative changes in the cerebral grey matter of elderly subjects [J].Proceedings of the Royal Society of Medicine,1967,60(3):254.
[9]Ahmad N,Gupta S,Mukhtar H.Green tea polyphenol epigallocatechin-3-gallate differentially modulates nuclear factor kappaB in cancer cells versus normal cells [J].Archives of Biochemistry and Biophysics,2000,376(2):338-346.
[10]Caruana M,Neuner J,Hogen T,et al.Polyphenolic compounds are novel protective agents against lipid membrane damage by α-synuclein aggregates in vitro [J].Biochimica et Biophysica Acta(BBA)-Biomembranes,2012,1818(11):2502-2510.
[11]Katiyar S K,Bergamo B M,Vyalil P K,et al.Green tea polyphenols:DNA photodamage and photoimmunology [J].Journal of Photochemistry and Photobiology B,Biology,2001,65(2/3):109-114.
[12]Cheng K W,Wong C C,Chao J,et al.Inhibition of mutagenic PhIP formation by epigallocatechin gallate via scavenging of phenylacetaldehyde [J].Molecular Nutrition & Food Research,2009,53(6):716-725.
[13]Sang S,Shao X,Bai N,et al.Tea polyphenol(-)-epigallocatechin-3-gallate:a new trapping agent ofreactive dicarbonyl species [J].Chemical Research in Toxicology,2007,20(12):1862-1870.
[14]Zhu Q,Liang C P,Cheng K W,et al.Trapping effects of green and black tea extracts on peroxidation-derived carbonyl substances of seal blubber oil [J].Journal of Agricultural and Food Chemistry,2009.57(3):1065-1069.
[15]蔡淑娴,刘仲华,黄建安,等.儿茶素抑制蛋白质类老年色素荧光物质生成活性的研究[J].茶叶科学,2010,30(1):1-8.
[16]Riviere C,Richard T,Vitrac X,et al.New polyphenols active on β-amyloid aggregation [J].Bioorganic & Medicinal Chemistry Letters,2008,18(2):828-831.
[17]江和源,袁新跃,王川丕.茶黄素双没食子酸酯的抗癌活性及其作用机理研究[J].茶叶科学,2007,27(1):33-38.
[18]李国林,印大中.蛋白质羰基化与衰老[J].中国老年学杂志,2008,28(20):2070-2073.
Inhibition of Theaflavins on Protein Carbonylation and Aggregation in the System of BSA/MDA Carbonyl-ammonia Cross Linking Reaction in vitro
ZHANG Jing1,CAI Shuxian2,HUANG Jian'an1,3,4,LI Juan1,3,4,ZHONG Ni1,YANG Heng1,LIU Zhonghua1,3,4*
1.Key Laboratory of Ministry of Education for Tea Science,Hunan Agricultural University,Changsha 410128,China;
2.Peking University Health Science Center,Beijing 100191,China;
3.National Research Center of Engineering Technology for Utilization of Botanical Functional Ingredients,Changsha 410128,China;
4.Collaborative Innovation Center of Utilization of Functional Ingredients from Botanicals,Changsha 410128,China
A model of age pigment generation was builted by carbonyl-ammonia cross linking reaction in vitro,the datas indicate that theaflavins can not only inhibit the generation of age pigment in protein carbonylation,but also supress β-sheet-rich in aggregate protein in this model by thioflavin T-based fluorometric assay,scanning electron microscope,transmission electric microscope,SDS-PAGE and NBT staining,there are postive relationship between protein carbonylation on mechanism of aging and protein aggregation that lead to neurodegenerative disease.
theaflavin,carbonyl-ammonia cross linking reaction,age pigment,protein aggregation
Q946.84+1;Q51
A
1000-369X(2016)04-363-09
2016-02-28
2016-04-13
国家自然科学基金项目(31471590)、湖南省研究生科研创新项目(CX2015B245)、国家茶叶产业技术体系项目(CARS-23-11B)。
张静,女,博士,主要从事茶叶功能成分药理研究。*通讯作者:larkin-liu@163.com
