茶多糖对氟离子的吸附特性研究
2016-09-21高慧敏朱晓静李攀攀倪德江陈玉琼
高慧敏,朱晓静,李攀攀,倪德江,陈玉琼
园艺植物生物学教育部重点实验室,华中农业大学园艺林学学院茶学系,湖北 武汉430070
茶多糖对氟离子的吸附特性研究
高慧敏,朱晓静,李攀攀,倪德江,陈玉琼*
园艺植物生物学教育部重点实验室,华中农业大学园艺林学学院茶学系,湖北 武汉430070
为研究茶多糖对氟的吸附特性,分析了不同温度、不同加氟量条件下,多糖吸附氟的能力,并对多糖吸附氟的等温吸附模型进行了拟合,分析了多糖结构和组成可能对吸附氟的影响。结果表明:温度对多糖结合氟的影响较大,40℃下多糖表面空松,吸附氟的能力最强,随着温度的升高,多糖表面逐渐变得致密,结合氟的能力下降,温度高于 70℃后,多糖吸附氟量又会有所增加;40℃下,随着氟添加量的增加,多糖吸附氟量增加,当添加量达到多糖量 1.8倍后,多糖吸附氟量不再增加。多糖吸附氟符合 Langmuir等温吸附模型,分配因子 RL均大于 0小于 1,属于有利的吸附。粗多糖脱蛋白脱色后,结构和组成发生较大变化,表面变得光滑平整,F-、Al3+、Mn2+和Fe3+的含量都急剧下降,吸附氟的能力也下降。说明多糖吸附氟的能力与多糖的组成、结构有关,蛋白质及Mn2+、Fe3+、Al3+在多糖结合氟中起到较重要作用。
茶多糖;氟;吸附特性
氟是自然界中的重要元素,以氟化物的形式广泛存在。氟对人体具有双重作用,适量的氟摄入能维持机体正常的钙磷代谢,有助于钙和磷形成羟基磷灰石,有效预防龋齿和骨质疏松。氟摄入不足时,参与钙磷代谢的酶的活性降低,影响代谢过程[1-3]。但长期摄入过量的氟,氟将会在体内不断累积,会造成慢性全身中毒[4]。自然界中的氟以无机氟和有机氟两种形态存在,大多以萤石无机氟存在,萤石的主要成分有氟化钙、冰晶石以及氟磷酸钙等[5]。人体摄入的氟只有一部分以氟化物的形式进入组织、唾液和肾脏,并聚集在骨骼和牙齿内,另外一部分将通过尿液排出体外。成人尿液排氟量约占吸收总氟的50%,而儿童尿氟排泄量占吸收总氟的30%~50%[6-7]。影响人体对氟吸收量的主要因素是含氟量,其次为摄入氟的存在形态[8]。
茶树是富集氟能力较强的植物,尤其是叶片对氟具有特别的累积特性[9],且老叶大于嫩叶,茶树老叶与嫩叶氟含量的差异可达到12~36倍[10]。人们从茶叶中摄入氟的量达到2.7~5.9 mg·d-1就可能出现氟中毒的现象[11],饮茶型氟中毒近年来引起了人们的广泛关注。本实验室前期研究表明,不同茶树品种、不同嫩度茶叶原料氟含量差异较大;在研究茶叶氟的可能存在形态时,发现茶叶水提物中 50%以上的氟都聚集在多糖组分中[12]。茶叶多糖是一种酸性多糖,具有多种保健功能[13-14],是茶叶的重要功能成分[15]。茶多糖聚集氟的现象则是首次发现,为弄清多糖聚集氟的机理,本文探讨了多糖与氟的结合特性,可能的影响因素,为进一步明确茶树聚氟机理及今后茶叶降氟提供理论参考。
1 材料与方法
1.1实验仪器
HH-6型恒温水浴锅,常州国华仪器有限公司;RE52-99型旋转蒸发仪,上海亚荣生化仪器厂;CooLSafe110-4真空冷冻干燥机,丹麦ScanVac公司;TDL-5-A型离心机,北京时代北利离心机厂;9609BNWP Thermo型氟离子选择电极,长沙益名实验仪器公司;KSW-5D-12型马弗炉,武汉亚华电炉有限公司;DeLta320型pH计,美国Thermo公司;超纯水仪,贝铼美生物科技有限公司;差示扫描量热仪 STA449F3,德国耐驰仪器公司;JSM-IT300扫描电镜,日本电子株式会社;金属离子测定仪iCAPQ,Thermo Fisher。
1.2主要试剂和药品
氟化钠、盐酸、氢氧化钠、冰醋酸、乙酸钠、柠檬酸钠、高氯酸等试剂均为分析纯,氟标准液(上海计量测试技术研究院)、金属离子混标(国家有色金属及电子材料分析测试中心)。
1.3样品制备
茶叶原料:鲜叶采自华中农业大学品种园乌牛早茶树品种的成熟叶片,220℃滚筒杀青后,80℃左右烘干,粉碎过0.38 mm筛备用。
粗茶多糖(RTPS):按上述方法制备得到的茶粉采用水提乙醇沉淀法提取茶多糖,经截留分子量 1 000 Da的膜透析后冷冻干燥得粗茶多糖[16]。
脱蛋白多糖(DPTPS):采用Sevag法[17]将上述多糖用水溶解于 1 L锥形瓶中,加入1/5体积的氯仿和1/25体积的正丁醇,剧烈摇动20 min,离心,弃去蛋白质和氯仿层,上层水溶液再次重复脱蛋白6次后,浓缩、透析、冷冻干燥得脱蛋白多糖。
脱色多糖(DCTPS):采用过氧化氢脱色法[17]。脱蛋白后的多糖溶液用氨水调 pH为8.0左右,50℃下滴加脱蛋白多糖溶液 1/5体积的H2O2,保温2 h,每30 min搅拌1次,得脱色多糖溶液,浓缩、透析、冷冻干燥得脱色多糖。
1.4多糖与氟离子的结合特性实验
1.4.1温度和氟离子浓度对多糖吸附氟的影响
分别称取 0.3 g粗多糖于 50 mL锥形瓶中,加入 30 mL蒸馏水进行溶解,分别加入氟化钠0(CK)、0.3、0.6、0.9、1.2、1.5、2.0 g(相当于加氟量为0、0.14、0.27、0.41、0.54、0.68、0.90 g),搅拌后置于温度为40、55、70、85、100℃的水浴锅内水浴 3 h,每 30 min搅拌1次,结束后按上法透析至透析水中氟离子含量与蒸馏水中无差异后,冷冻干燥。
1.4.2不同纯度多糖与氟的结合特性
分别称取0.3 g的RTPS、DPTPS、DCTPS样品于50 mL锥形瓶中,加入30 mL蒸馏水溶解后加入1.5 g氟化钠,对照处理不加氟化钠,置于40℃水浴锅内3 h,每30 min搅拌1次,结束后反应液经透析、冷冻干燥得样品。每个处理重复3次。
1.5化学成分测定
中性糖含量测定采用硫酸-蒽酮法[18],糖醛酸含量测定采用硫酸-咔唑法[18],蛋白质含量测定采用Bradford比色法[19]。
氟含量测定参照参考文献[12]。
样品前处理:准确称取0.05 g被测样品,置于镍坩埚中,加入少量水润湿样品后加入0.75 mL 16.75 mol·L-1NaOH,轻轻摇晃坩埚使样品分散均匀,150℃烘箱烘1 h,放入300℃马弗炉,保持30 min,再将温度升至600℃,保持1 h。取出冷却至室温,加2.5 mL水浸润,缓慢加入HCl,调pH至8左右,用超纯水定容至25 mL。
氟含量测定:取10 mL待测液加入10 mL TISAB[(按 3 mol·L-1乙酸钠与 0.75 mol·L-1柠檬酸钠溶液1∶1配制(3 mol·L-1乙酸钠:204 g乙酸钠溶于 300 mL超纯水,加乙酸调pH7.0,定容至 500 mL;0.75 mol·L-1柠檬酸钠:110 g柠檬酸钠溶于 300 mL超纯水,加14 mL高氯酸,定容至500 mL)],用氟离子选择电极测定。
1.6茶多糖的形貌特征分析[20]
取大小厚度合适的茶多糖样品,粘着于样品台上,然后置于真空喷镀仪内,镀导电膜(金)20 min后,置于 JSM-IT300扫描电镜下观察其形貌结构并在低、高倍镜下拍照。
1.7数据处理
2 结果与分析
2.1添加量和温度对多糖结合氟的影响
2.1.1添加量和温度对多糖结合氟量的影响
多糖在不同温度和添加不同氟量条件下,与氟的结合能力如图1所示。结果表明,随着氟添加量的增加,多糖结合氟的量也在不断增加,达到一定程度后不再增加,甚至降低。温度对多糖结合氟的影响不尽相同。40℃下,添加小于多糖1.8倍的氟量,多糖结合氟能力随添加量增加极显著增加,超过1.8倍氟添加量,多糖结合氟不再增加。55℃和100℃条件下,添加氟为多糖 1.37倍的量时,多糖结合氟量即达最大值;70℃下,添加氟量达到多糖2.27倍量时,多糖结合氟量才显著增加。40℃条件有利于多糖结合氟,是所有温度中结合氟量最大的,70℃条件下相对不利于多糖与氟的结合。
2.1.2多糖吸附氟的等温吸附模型
Langmuir和 Freundlich是常用的等温吸附模型,既可用于物理吸附又可用化学吸附的模拟[21]。Langmuir的表达式为:

式中Qm是最大饱和吸附量(mg·kg-1),b 为 Langmuir吸附平衡常数,Ce是氟的浓度(g·L-1)。对Ce作图进行数据拟合处理,得到结果如图2所示。
Freundiich的表达式为:
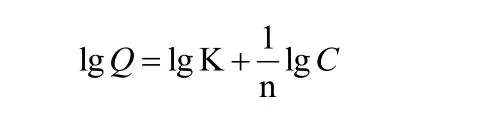
式中K和1/n分别是吸附能力和吸附效率相关的常数。lgQ对lgC作图进行数据拟合处理,拟合效果图见图3。
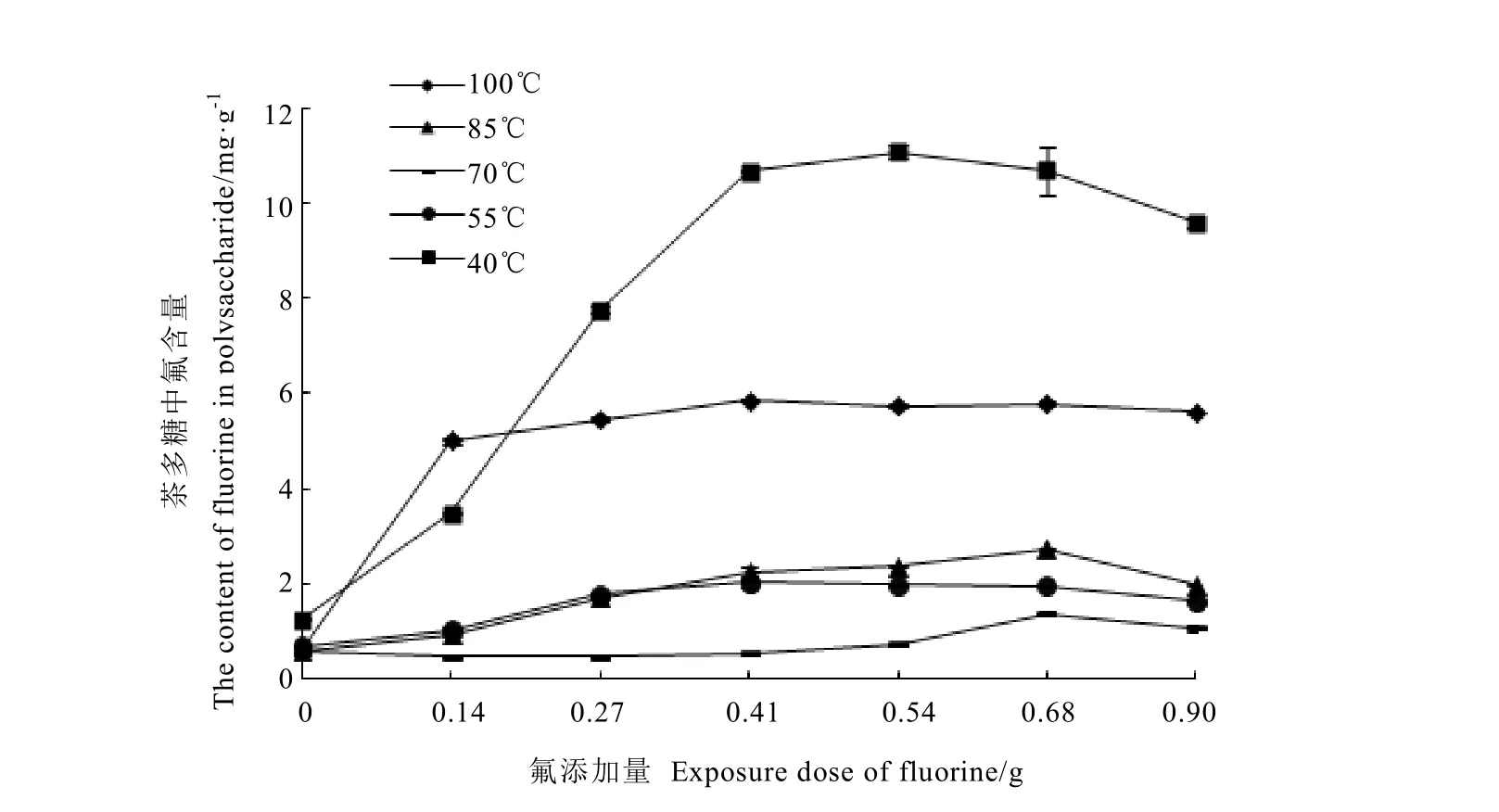
图1 添加量和温度对多糖吸附氟的影响Fig.1 The fluorine adsorption of polysaccharides under different dose of F and temperatures
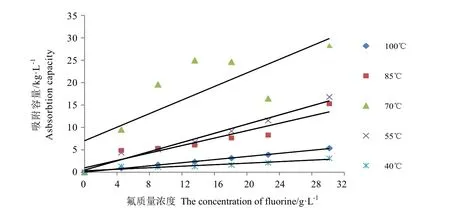
图2 Langmuir吸附等温方程拟合曲线Fig.2 Langmuir isotherm curve
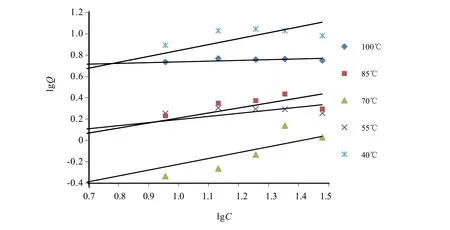
图3 Freundlieh吸附等温方程拟合曲线Fig.3 Freundlieh isotherm curve
Langmuir和Freundlich等温吸附模型的参数见表1。表1中的Langmuir参数Qm与Q实非常接近,决定系数 R2也显示方程拟合效果较好,除 70℃外,其他温度拟合的等温吸附方程的 R2都在 0.8以上。Freundlich方程的R2均小于 0.8,结合图 2和图 3可知,用Langmuir方程比Freundlich方程拟合效果好,说明根据单分子层吸附模型建立 Langmuir等温吸附方程能很好地表示该吸附过程。
Langmuir等温式的重要特性可以用分配因子RL来表示RL=1/(1+b×C)。RL值有4种可能性:RL>1为不利的吸附;RL=1为线性吸附;0<RL<1时为有利的吸附;RL=0为不可逆吸附。从图4中可以看出RL均大于0小于1,因此茶多糖吸附氟为有利的吸附。
2.1.3茶多糖吸附氟的形貌特征变化
不同温度下茶多糖添加氟处理前后形貌特征变化如图 5所示。多糖经 40℃处理后,在 200倍低倍镜下呈不规则粒状、块状,在10 000倍高倍镜下呈疏松的分枝状;55℃处理多糖低倍镜下呈粒状,高倍镜下呈网孔状,70℃、85℃处理多糖都呈致密的块状;100℃处理多糖低倍镜下呈块状,高倍镜下表面凹凸不平。多糖添加氟化钠后所有处理,在 200倍低倍镜下,呈不规则的块状,10 000倍高倍镜下表面致密,更光滑平整。
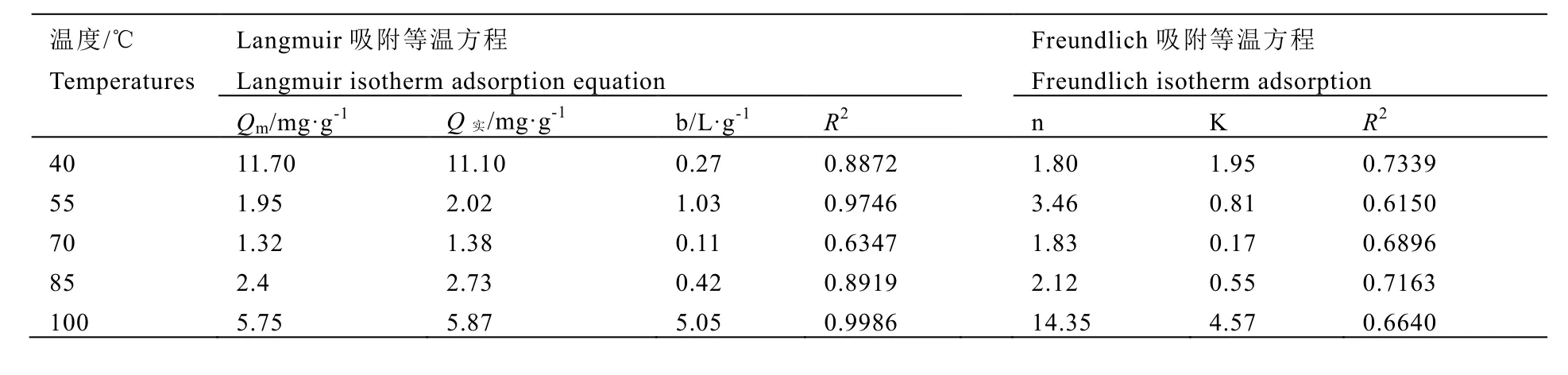
表1 多糖吸附氟等温方程拟合参数Table 1 Fitting parameters of the isotherm adsorption equation of fluorine absorption of polysaccharide under different temperatures

图4 Langmuir等温方程分配因子RL曲线Fig.4 RLCurve of Langmuir
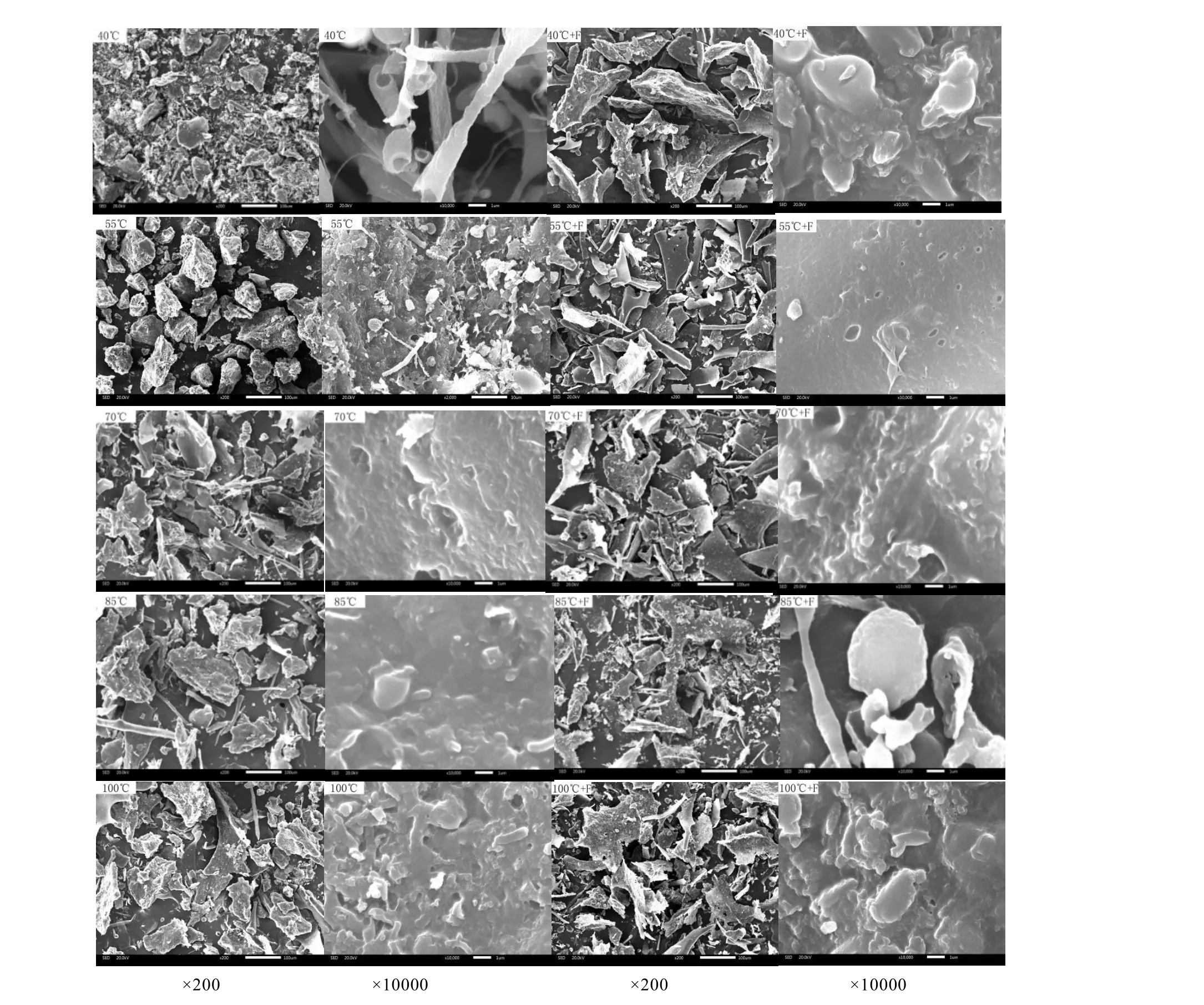
注:同一放大倍数下左边为对照,右边为处理。Note:Controls on the left,treatments on the right under the same magnification.图5 茶多糖在不同温度下吸附氟前后的SEM图Fig.5 SEM images of tea polysaccharides under different dose of fluorine and temperatures
2.2多糖结构及组成对其结合氟离子的影响
2.2.1多糖组成及其结合氟离子特性
对粗多糖进行脱蛋白与脱蛋白脱色处理,分析多糖组成变化对氟的结合特性(表2)。结果表明,不同类型多糖结合氟的能力相差较大,其中,未脱蛋白多糖比脱蛋白多糖结合氟的能力更强,脱蛋白多糖和脱蛋白脱色多糖结合氟的能力相当,说明多糖组成和结构可能影响对氟的结合。对茶多糖的主要成分进行分析(表3),表明不同类型多糖本身氟含量、糖醛酸、中性糖、蛋白质含量差异明显。经脱蛋白、脱色处理,多糖中糖醛酸、中性糖含量显著上升,蛋白质和氟含量显著下降。相关性分析表明,多糖氟含量与蛋白质含量呈极显著正相关,而与醛糖酸、中性糖则呈极显著负相关,说明多糖中结合的氟与蛋白质关系密切。
金属成分分析结果显示(表 4),多糖中含有较多的金属元素,包括Mg、Ca、Mn、Fe3+、Al3+等。各金属离子含量之间差异很大。粗多糖中以 Al3+含量最高,达到 23 533.2 mg·kg-1,其次是Mn2+(4 193.5 mg·kg-1),Mg2+(915.4 mg·kg-1)含量最低。经过脱蛋白、脱色纯化后,多糖中各金属离子含量变化不一。Al3+、Mn2+和Fe3+在多糖脱蛋白过程中大幅度下降,Mg2+和 Ca2+含量则显著升高;脱色促进多糖中Ca2+、Mg2+、Fe3+含量减少,而Mn2+、Al含量则变化不大。结合多糖纯化过程中氟含量的变化,Al3+、Mn2+和Fe3+含量与氟含量呈极显著正相关,相关系数分别为0.99、0.99 和0.81;Ca2+、Mg2+含量则与氟含量呈负相关,相关系数分别为-0.37、-0.32。由此可见,多糖在脱蛋白纯化过程中,随着蛋白质的去除,金属离子Al3+、Mn2+、Fe3+与氟相继减少,因此,多糖中结合的氟可能很大程度与这些物质有关。

表2 不同纯度茶多糖结合氟能力的比较Table 2 Comparison of fluorine absorption in different types of tea polysaccharide
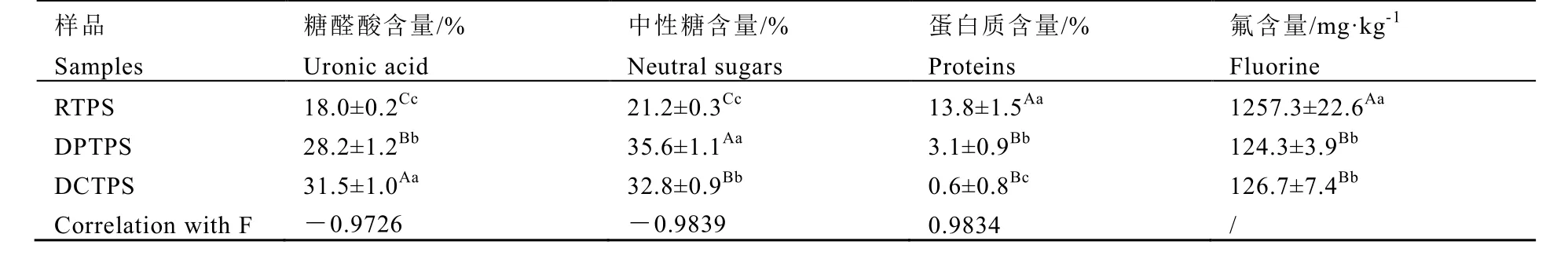
表3 不同纯度茶多糖主要成分含量Table 3 The contents of main components in different types of polysaccharide

表4 不同纯度茶多糖主要金属离子含量Table 4 The contents of metal ion in different types of polysaccharides
2.2.2不同纯度多糖结构变化
为进一步分析多糖结构变化可能对结合氟产生的影响,就不同类型多糖的形貌特征和热特性进行了分析,结果如图6所示。在1万倍高倍镜下粗多糖呈疏松的分枝状,脱蛋白多糖为致密平伏状,表面有较细小的突起,脱色多糖为致密的凹凸形。由此可以看出,多糖脱蛋白、脱色后,结构更致密,表面变得更光滑。

注:RTPS:粗多糖,DPTPS:脱蛋白多糖,DCTPS:脱色多糖。Note:RTPS:Raw tea polysaccharide,DPTPS:Deproteinization tea polysaccharide,DCTPS:Decolorizing tea polysaccharide.图6 不同纯度多糖的SEM图(×10000)Fig.6 SEM images of different types of polysaccharides(×10000)
3 讨论
氟的存在形态可分为无机态和有机态,在生理作用下两者可以相互转化[22]。茶树是一聚氟植物,叶片是其主要聚集部位,茶叶中的氟存在形态复杂,至今没有明确的研究结果。本实验室前期研究发现茶叶水提取物中的氟有相当一部分集中在茶多糖组分中[12]。茶多糖是一类结构和组成较复杂的物质,含有蛋白质、糖醛酸、中性糖、金属离子等多种物质,这些物质的组成及比例直接影响其结构和各种羧基、氨基、羟基等活性基团的数量,从而影响其与氟的结合。从多糖化学组成分析显示,粗多糖中蛋白质,金属离子中Al3+、Mn2+含量都非常高,而经过脱蛋白后,伴随着蛋白质的大量去除,氟含量和Al3+、Mn2+含量都急剧下降,提示多糖中蛋白质、Al3+、Mn2+与氟可能存在某种关系。而已有研究也表明,茶树中氟与铝高度相关,他们以络合物形式或以形成某种稳定态化学基团结合存在[23-28]。本研究结果进一步证实了茶叶中氟与铝的高度相关。除铝元素外,本研究发现多糖中Mn元素与氟同样关系密切,前期本实验室在分析茶叶原料和细胞壁氟与金属元素关系时也发现同样规律。Mn元素是岩石圈和土壤中普遍存在的化学元素,也是动植物和人类必需的微量营养元素,摄入Mn元素不足或过量均会对人和动植物产生明显的危害[29]。茶树也是一种富锰植物,Mn元素是否是茶叶吸附氟的又一重要相关元素还有待进一步研究。从多糖的扫描电镜观察到的形貌特征可以看出,粗多糖表面疏松多孔,而经脱蛋白后,表面变得致密、光滑,比表面积变小,降低了与其他物质可能的结合。
多糖结构受多种因素的影响,其中温度是一重要影响因素,从而影响多糖与氟的结合。茶多糖与氟在不同温度下的结合结果反映出,多糖在 40℃低温下最易与氟离子结合,随着温度的升高,多糖结合氟的能力下降,而温度超过 85℃后,多糖结合氟能力又有所升高,这可能与多糖在不同温度下的结构变化有关。通过扫描电镜分析发现,40℃条件下,多糖呈致密的块状、片状,疏松多孔,表面积大,暴露在外基团增加,吸附能力强;55℃条件下呈粒状,表面呈蜂窝状,表面积也较大,但比40℃的多糖致密;70℃条件下,多糖呈块状,表面致密,多糖的立体空间结构可能遭到破坏,表面积及暴露在外的基团数量显然受到影响;而85℃、100℃等高温条件下,茶多糖表面增加了凹凸状,其结构可能进一步遭到破坏,包括部分链结构分解。多糖的这种结构变化可能直接影响多糖吸附氟的能力,相关研究还有待进一步深入。
[1]曹进,赵燕,列箭卫,等.西藏高海拔地区儿童的砖茶型氟中毒[J].中国公共卫生,2000,16(2):174-175.
[2]蔡洪远.茶叶中氟化物含量的调查[J].职业与健康,2003,19(10):60-70.
[3]孙殿军,刘立志.我国饮茶型氟中毒研究的回顾与展望[J].中国地方病学杂志,2005,24(1):1-2.
[4]阮建云,杨亚军,马立锋.茶叶氟研究进展:累积特性、含量及安全性评价[J].茶叶科学,2007,27(1):1-7.
[5]刘晓静.茶园土壤-茶树-茶汤系统中氟和铝的迁移、转化特征及饮茶型氟中毒的防治探索[D].杭州:中国科学院研究生院,2006.
[6]Haftenberger M,Viergutz G,Neumeister V,et al.Total fluorine intake and urinary excretion in German children aged 3-6 years [J].Caries research,2001,35(6):451-457.
[7]Ketley CE,Lennon MA.Determination of fluorine intake from urinary fluorine excretion data in children drinking fluoridated school milk [J].Caries Research,2000,35(4):252-257.
[8]张景强,龚正礼.砖茶型氟中毒的研究进展[J].茶业通报,2001,23(2),16-18.
[9]Ruan J,Ma L,Shi Y,et al.Uptake of fluorine by tea plant(Camellia sinensis L)and the impact of aluminium [J].Journal of the Science of Food and Agriculture,2003,83(13):1342-1348.
[10]白信学.砖茶高氟的原因调查[J].茶叶科学,2000,20(1):77-79.
[11]Cao J,Bai X,Zhao Y,et al.Fluorosis induced by drinking brick tea [J].Fluoride,1996,29:139-143.
[12]朱晓静,房峰祥,张月华,等.茶叶及茶多糖中氟测定前处理方法比较研究[J].茶叶科学,2015,35(2):145-150.
[13]陈海霞,谢笔钧.茶多糖对小鼠实验性糖尿病的防治作用[J].营养学报,2002,24(1):85-86.
[14]Tadakazu T,Tomoki U,Hitoshi K,et al.The chemical properties and functional effects of polysaccharides dissolved in green tea infusion [J].Nippon Shokuhin Kagaku Kaishi,1998,45(4):270-272.
[15]王瑞芳,蓝伟光,张世文,等.茶叶中有效成分的开发利用进展[J].亚热带农业研究,2005(3):64-69.
[16]郑德勇,杨江帆,林清霞,等.白茶多糖的提取与结构初探[J].茶叶科学,2010,30(增刊1):551-555.
[17]倪德江,陈玉琼,谢笔钧,等.乌龙茶多糖 OTPS2-1的光谱特性、形貌特征及热特性研究[J].高等学校化学学报,2004,25(12):2263-2268.
[18]高林,施秀芳,张文博.中性糖、糖醛酸的含量测定[J].化学工业与工程,2005,22(6):487.
[19]叶伟民,韩焕兴,范列英,等.Bradford比色法简便、快速测定微量蛋白检验医学[J].检验医学,1996(4):207-208.
[20]Ding X,Feng S,Cao M,et al.Structure characterization of polysaccharide isolated from the fruiting bodies of Tricholoma matsutake [J].Carbohydrate Polymers,2010(81):942-947.
[21]马宏飞,李薇,韩秋菊,等.废茶渣对 Cr(VI)的等温吸附模型研究[J].科学技术与工程,2012,12(27):7149-7152.
[22]Stevens DP,Mclaughlin MJ,Alston AM.Phytotoxicity of the fluoride ion and its uptake from solution culture by Avena sativa and Lycopersicon esculentum [J].Plant and Soil,1998,200(2):119-129.
[23]Alva A K,Sumner M E,Noble A D.Effects of fluoride on colorimetric measurement of solution aluminum [J].Soil Science Society of America Journal,1988,52(2):374-378.
[24]Nagata T,Hayatsu M,Kosuge N.Aluminium kinetics in the tea plant using 27Al and 19F NMR [J].Phytochemistry,1993,32(4):771-775.
[25]Ruan JY,Wong M H.Accumulation of fluoride and aluminium reated to different varieties of tea plant [J].Environmental Geochemistry and Health,2001,23:53-63.
[26]Shu W,Zhang Z,Lan C,et al.Fluoride and aluminum concentrations of tea plants and tea products from Sichuan Province [J].PR China Chemosphere,2003,52:1475-1482.
[27]赵强.氟/铝在茶树叶片和根部的累积与分布规律研究[D].合肥:安徽农业大学,2013.
[28]马士成,何绪文.石灰沉淀法对重金属矿坑水中氟离子的去除[J].环境工程,2013,31(3):18-20.
[29]吴名宇,李顺义,张杨珠.土壤锰研究进展与展望[J].作物研究,2005,9(2):137-142.
Research on Adsorption Characteristics of Tea Polysaccharides to Fluorine
GAO Huimin,ZHU Xiaojing,LI Panpan,NI Dejiang,CHEN Yuqiong*
Key Laboratory of Horticultural Plant Biology ,Ministry of Education/College of Horticulture and Forestry Sciences,Huazhong Agricultural University,Wuhan 430070,China
The adsorption characteristics of tea polysaccharides(TPS)to fluorine under different temperatures and dose of fluoride was studied.The adsorption models were established and the structure and composition of TPS were analyzed.The results showed that the temperature was an important factor influencing fluorine adsorption of TPS.Loose surface structure was observed in TPS under 40℃ by SEM,which showed the strongest adsorption ability to fluorine.With the increase of temperature,the surface structure of TPS gradually became dense,while the adsorption ability to fluorine descended.However,the adsorption ability to fluorine increased after 70℃.The amount of fluorine absorption by TPS increased with the increasing of exposure amount of fluoride with its peak at 1.8 times of polysaccharide under 40℃.The adsorption behavior was in accordance with Langmuir model with the distribution factors(RL)between 0 and 1 and belonged to a favorable adsorption.As proteins and pigments were removed,,structure and composition of crude polysaccharides changed greatly,with sharp decrease of F-,Al3+,Fe3+and Mn2+contents and fluorine adsorption capacity.The results suggest that the characteristics of fluorine absorption is related to the composition and structure of polysaccharides.Proteins,Mn2+,Al3+and Fe3+might also play important roles in it.
tea polysaccharide,fluorine,adsorption characteristics
TS272.2;Q946.8
A
1000-369X(2016)04-396-09
2016-03-08
2016-05-23
国家自然科学基金项目(31170646/C161104)
高慧敏,女,硕士研究生,主要从事茶叶生物化学研究。*通讯作者:chenyq@mail.hzau.edu.cn
