猪凝血酶C端衍生肽抑菌活性和膜作用机制研究
2016-09-21单安山吕希婷马清泉邵长轩东北农业大学动物营养研究所哈尔滨150030
单安山,吕希婷,马清泉,邵长轩(东北农业大学动物营养研究所,哈尔滨 150030)
猪凝血酶C端衍生肽抑菌活性和膜作用机制研究
单安山,吕希婷,马清泉,邵长轩
(东北农业大学动物营养研究所,哈尔滨150030)
猪凝血酶C末端富含正电荷和疏水性氨基酸残基,通过结构参数分析获得截短肽RD27,测定相应指标。探讨猪凝血酶C末端肽段抑菌活性及作用机制。结果表明,RD27对革兰氏阴性和阳性菌最小抑菌浓度为4~ 8 μmol·L-1,对血细胞最小溶血浓度为45.9 μmol·L-1,显示较强的抑菌活性和较低的溶血活性,治疗指数为10,大于蜂毒素。RD27在模拟膜环境中呈现α-螺旋结构,优先与模拟细菌脂质体作用,使E.coli UB1005膜产生去极化作用,并存在时间和剂量依赖效应。揭示其膜作用机制,拓宽抗菌肽设计方法,探究凝血与免疫系统联系。
抗菌肽;猪凝血酶;抑菌活性;作用机制
单安山,吕希婷,马清泉,等.猪凝血酶C端衍生肽抑菌活性和膜作用机制研究[J].东北农业大学学报,2016,47(4):1-9.
Shan Anshan,Lv Xiting,Ma Qingquan,et al.Study on antimicrobial activity andmembrane-mediatedmechanism of porcine thrombin C-terminal peptide derivative[J].Journal of Northeast Agricultural University,2016,47(4):1-9.(in Chinese with English abstract)
网络出版时间2016-4-22 10:01:22[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160422.1001.026.html
抗生素可预防和治疗感染性疾病,但抗生素非特异性极易引起内源性感染或二重感染;使细菌产生耐药性,致“超级细菌”出现[1];畜产品残留给人类健康和环境保护带来风险。欧盟等国家和地区已全面禁止动物性产品中使用抗生素。
抗菌肽普遍存在于生命机体防御系统并广泛参与非特异性免疫,是大多数生物体感染初始阶段主要防护机制[2-3]。作用于细菌、真菌、病毒、寄生虫,甚至肿瘤细胞[4-7]。以抗菌肽作为重要替代物,开展新药物研发,替代抗生素防止多重耐药菌出现[8-10],成为研究热点。
丝氨酸蛋白酶是一类以丝氨酸为活性中心的蛋白水解酶,在生物有机体中发挥重要生理作用,尤其在消化系统、免疫反应、血液凝固、补体系统中[11-13]。丝氨酸蛋白酶通过激活或抑制蛋白酶原起调节因子作用,在胚胎发育、细胞分化、组织重建、血管形成和抵御病原侵入等过程中均具有重要作用[14-15]。Hu等研究表明,丝氨酸蛋白酶重要功能位点位于C端结构域,如稳定催化中间产物的氧离子孔(Gly 193&Ser 195),底物特异性口袋(Ser 189、Gly 216&Gly 226),主链底物结合位点(Ser 214,Trp 215&Gly216)[16]。Satoh等研究表明,丝氨酸蛋白酶可在无脊椎动物免疫防御系统中发挥作用[17]。人类丝氨酸蛋白酶C端序列能编码宿主防御功能,这些肽显示抑菌作用及免疫调节功能。Nordahl等研究发现补体系统激活过程中的C3a及其衍生物C3a-desArg具有抗菌活性,有效杀灭革兰氏阴性菌,如大肠杆菌(Escherichia coli)、绿脓杆菌(Pseudomonas aeruginosa)和革兰氏阳性菌,如粪肠球菌(Enterococcus faecalis),阻止化脓性链球菌(Streptococcus pyogenes)在小鼠体内感染[18]。凝血系统是丝氨酸蛋白酶中一大类,凝血反应过程是由机体创伤或感染活化的一个基本宿主防御反应[19-20]。Bode研究表明,凝血酶作为凝血系统关键酶,在促进凝血和血小板凝集中发挥重要作用,具有抗凝和抗纤维蛋白原溶解功能[19]。此外,凝血酶在宿主防御方面具有关键作用,能引起各种细胞反应,包括提高CAM因子表达、刺激内皮细胞生长因子释放及成纤维细胞生长[20]。Papareddy等研究发现人凝血酶C端截取的序列片段可发挥抗菌肽功能,这些C端衍生肽能以溶解膜方式有效杀灭细菌,表现免疫调节及中和内毒素功能[21]。哺乳动物间凝血酶序列具有高度保守性,蛋白质C端序列具有两亲性、阳离子性并显示螺旋结构[22]。
目前国内外有关猪凝血酶在抑菌和宿主防御系统方面研究未见报道。基于丝氨酸蛋白酶研究及猪凝血酶C端序列生物信息学分析,本研究探究猪凝血酶C端多肽段抑菌活性,揭示猪凝血酶C端衍生肽抑菌活性及膜作用机制。
1 材料与方法
1.1材料
1.1.1菌株
革兰氏阳性菌:金黄色葡萄球菌(Staphylococ⁃cus aureus ATCC 29213)、枯草芽孢杆菌(Bacillus subtilis CMCC 63501)。
革兰氏阴性菌:大肠杆菌(Escherich coli ATCC 25922,Escherich coli UB1005)、鸡白痢沙门氏菌(Salmonella pullorum C7913)。
1.1.2试剂
Mueller Hilton琼脂(MHA)、Mueller Hilton肉汤(MHB)培养基均购自AoBoX(中国);葡萄糖购自Zhiyuan(中国);十二烷基硫酸钠(SDS)购自Amresco(美国);牛血清白蛋白(Bovine Serum Albumin,BSA)、三氟乙醇(TFE)、Triton X-100、3,3'-dipropylthiadicarbocyanine iodide(diSC3-5)、HEPES、磷脂酰胆碱(Egg yolk L-α-phosphatidyl⁃choline,PC)、磷脂酰甘油(Egg yolk L-α-phospha⁃tidyl-DL-glycerol,PG)、磷脂酰乙醇胺(Egg yolk L-α-phosphatidylethanolamine,PE)、胆固醇(Cho⁃lesterol)、乙酸(分析级,99%)均购自Sigma-Al⁃drich(中国)。
1.2方法
1.2.1肽的设计
猪凝血酶原前体蛋白由623个氨基酸残基组成(见图1),从N端第44号氨基酸开始是猪凝血酶原序列,负电荷氨基酸残基用灰色标记,正电荷氨基酸用红色和紫色标记,从序列中可发现,正电荷氨基酸残基在C端较为集中,由图2可知,其C端呈现螺旋结构,具有较好结构稳定性。本试验利用抗菌肽设计方法中的序列截取法,从第44号氨基酸开始截取一系列长度在20~30个氨基酸残基的肽段,通过抗菌肽理化参数在线工具(http://heli⁃quest.ipmc.cnrs.fr/cgi-bin/ComputParamsV2.py)逐一筛选,发现偏于C端的肽段疏水性和两亲性数值较为适中,多具有正电性,与抗菌肽一般特征[23]符合,与Papareddy等研究一致[21]。哺乳动物凝血酶序列具有很高保守性,人凝血酶序列第565号半胱氨酸残基和第595号半胱氨酸残基形成二硫键[22],猪凝血酶C端该部分序列氨基酸排布与人凝血酶相同,故猪凝血酶也在这个位置形成二硫键,考虑到二硫键在肽合成方面的较高成本,本研究舍掉二硫键区域,考虑螺旋结构稳定性,在第597号氨基酸位置截断,得到肽RD27(RDG KYGFYTHVFRLKKWMQKVIDRFGG),研究其抑菌活性及作用机制。
1.2.2二级结构
将肽加入配制的10mmol·L-1PBS(pH 7.2)、50%TFE和30mmol·L-1SDS溶液中,使其终浓度为150 μmol·L-1,将配制的抗菌肽溶液于圆二色(CD)光谱仪上的比色池中,比色池长度为10mm,光径为1mm,室温条件下测定,扫描波长范围为190~250 nm,扫描速度为100 nm·min-1。根据公式(1)计算抗菌肽的平均残基椭圆率。
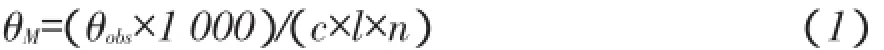
其中,θM-平均残基椭圆率(deg·cm2·dmol-1),θobs-实测椭圆率(mdeg),c-抗菌肽浓度(mmol· L-1),l-光径(cm),n-抗菌肽氨基酸数。

图1 猪凝血酶原前体序列模板Fig.1 Sequence template of porcine prepro-prothrombin

图2 猪凝血酶原前体立体结构Fig.2 Stereochemical structure of porcine prepro-prothrombin
1.2.3最小抑菌浓度
抑菌活性试验采用美国临床实验室标准化研究所(Clinical and Laboratory Standards Institute,CLSI)推荐的微量滴定稀释法测定,根据抗菌肽分子特征,参考Ma等改进方法[24]。待测菌接种于MHB中,220 r·min-1、37℃过夜培养,转接至新MHB中直至细菌处于对数生长期。MHB校正细菌浓度至OD600=0.5,将细菌数调整为约105cfu·mL-1。将肽溶解于50 μL 0.2%BSA(包含0.01%乙酸),加入96孔板中,使肽浓度变化为128~0.25 μmol·L-1依次倍比递减,每孔终体积100 μL(50 μL接种菌液+50 μL肽稀释液)。混匀,加盖后置于37℃培养16~18 h。未加菌孔作为阴性对照,加菌液和MHB孔作为阳性对照。3~5次独立试验。测试孔若无肉眼可见生长菌,其对应最低肽浓度即为抗菌肽最小抑菌浓度。
1.2.4溶血活性
通过溶血活性检测肽对哺乳动物血红细胞溶解能力,测定参照文献[25],肝素钠抗凝管收集健康人血液,1 000 g条件下离心5min,弃除上清,收集血红细胞,PBS冲洗3遍,重悬后,得到血红细胞悬液。将肽溶解于PBS中,肽浓度为128~0.25 μmol·L-1,以只加PBS为阴性对照,以含0.2%Tri⁃ton X-100为阳性对照。37°C孵育1 h,然后1 000 g,4°C条件下离心5min,吸取上清。酶标仪测定OD570条件下吸光值。3~5次独立试验。将引起5%溶血活性对应的最低肽浓度定义为最小溶血浓度(Minimal hemolytic concentration,MHC)。
1.2.5与脂质体作用
1.2.5.1脂质体制备
选择PE/PG(7 ϑ3,W/W)组分模拟细菌膜组成,通过PC/cholesterol(10 ϑ 1,W/W)组分模拟真核细胞、主要是人血红细胞膜组分,通过制备脂质体检测真核或原核细胞膜与抗菌肽作用关系,探讨抗菌肽作用机制[26]。根据模拟膜组成比例(W/ W)=7 ϑ3,PC/cholesterol(W/W)=10 ϑ1称取相应磷脂,溶于氯仿,混合后,将溶解于氯仿中磷脂用氮气、旋转蒸发仪或真空干燥过夜,将除尽氯仿的磷脂使用Tris-HCl或者PBS缓冲液溶解,将溶液放于振荡器上振荡,超声波细胞粉碎机破碎,始终将溶液置于冰浴,功率200 W,间歇式超声20~30min,直至溶液不分层、均一、透明、清澈为止。
1.2.5.2色氨酸蓝移
将制备的脂质体与抗菌肽混合,使脂肽物质的量比为50 ϑ 1,室温下作用3~5min,将其放到石英比色杯中,用F-4500荧光分光光度计(Hitachi,Japan),在激发波长(Exitation)为280 nm,从300 到400 nm对发射波长(Emission)扫描,记录最大发射波长(Emissionmaxima)。
1.2.5.3色氨酸淬灭
为进一步检测抗菌肽与膜结合程度,加入淬灭剂丙烯酰胺对荧光淬灭。将4mol·L-1丙烯酰胺逐渐滴定,反应池中丙烯酰胺浓度由0.01逐渐增加到0.4mol·L-1。为降低丙烯酰胺吸收,将激发波长由原来的280变为295 nm,仍从300~400 nm对发射波长扫描。淬灭剂丙烯酰胺对抗菌肽荧光谱影响可通过Stern-Volmer方程评价,即

其中,F0和F分别代表无或有丙烯酰胺存在时荧光强度值,Q代表丙烯酰胺浓度,而Ksv代表Stern-Volmer淬灭常数。
1.2.6细胞质膜去极化
参照文献[27]方法,利用细胞膜电势能敏感型荧光染料diSC3-5,测定抗菌肽对细胞膜电势能影响。将大肠杆菌E.coli UB 1005培养至指数生长期,5 000 g离心5min,收集细菌沉淀,5mmol·L-1HEPES缓冲液(pH 7.2,含20mmol·L-1葡萄糖和5mmol·L-1EDTA)冲洗3遍,重悬至OD600= 0.05。向配制好的细菌悬浮液中加入终浓度为0.4 μmol·L-1的diSC3-5,室温避光振荡孵育1 h。再加入终浓度为0.1mol·L-1的KCl,室温振荡避光孵育30min;取2mL细菌悬浮液于石英比色皿中,加入不同浓度抗菌肽,在激发波长622 nm,发射波长670 nm条件下测定荧光强度。
2 结果与分析
2.1肽的设计与合成
RD27是在猪凝血酶C端截取得到的肽,从N端开始编号,其对应编号为597~623,由图3可知,亲水性氨基酸偏于集中在螺旋轮一侧形成亲水性区域,疏水性氨基酸偏于集中在螺旋轮另一侧形成疏水性区域(图3箭头所指区域),亲水性氨基酸和疏水性氨基酸在螺旋轮中呈对侧分布,体现肽RD27两亲性。

图3 肽RD27螺旋轮Fig.3 Helical wheel projection of the peptide RD27
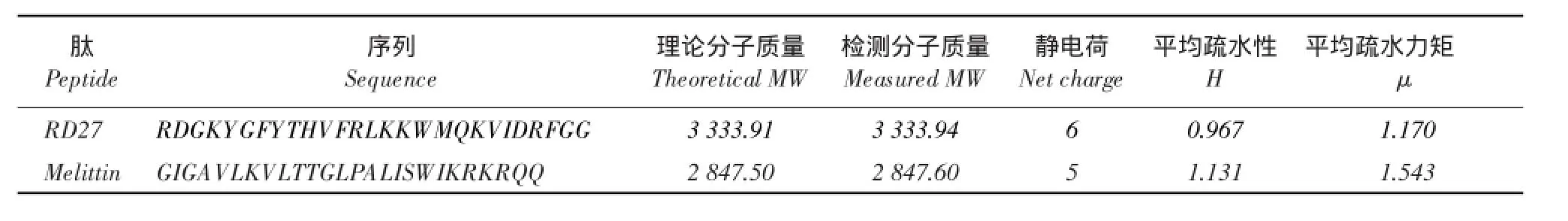
表1 肽的物理化学参数Table 1 Physicochemical parameters of the peptides
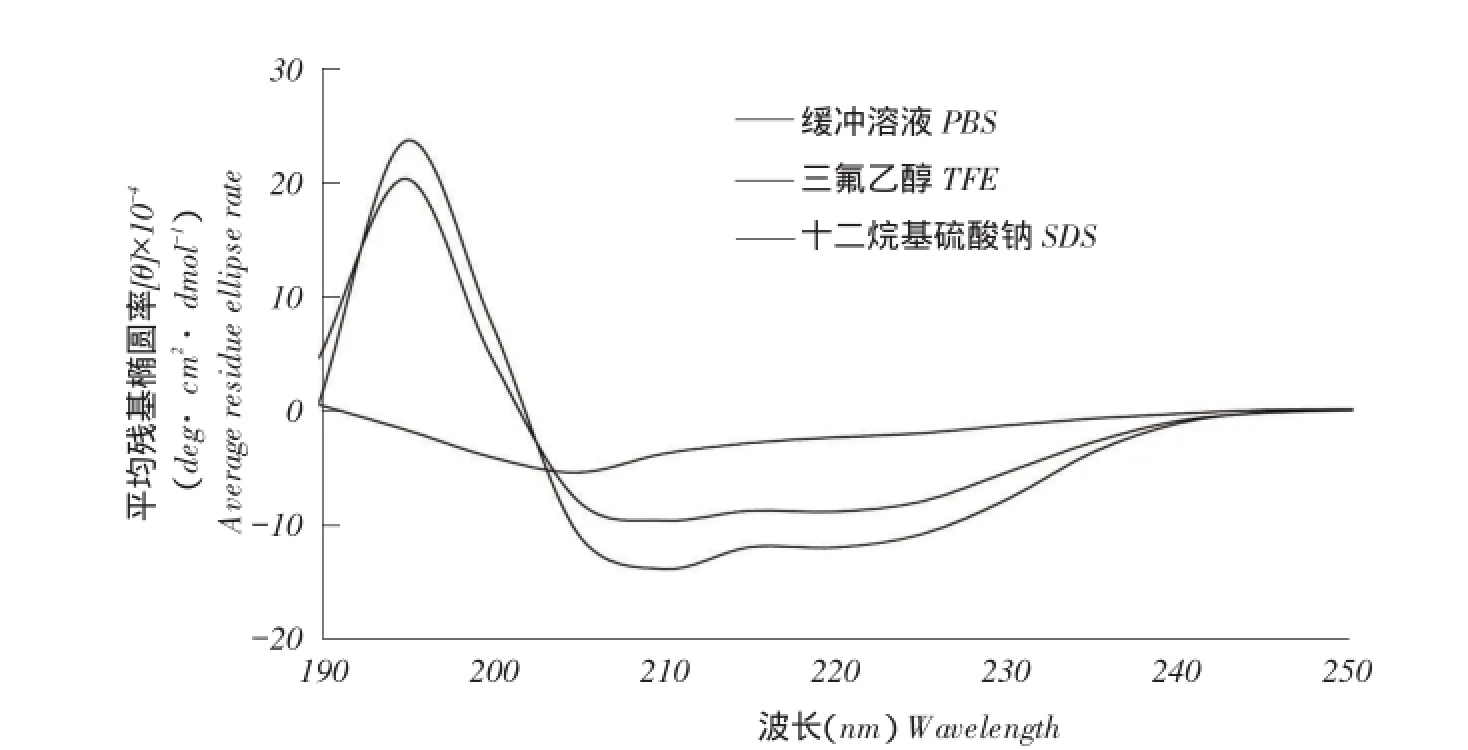
图4 肽的CD光谱Fig.4 CD spectra of the peptide
由表1可知,通过基质辅助激光解吸电离飞行时间质谱(MALDI-TOFmS)检测得到肽分子质量与肽理论分子质量一致,表明肽合成成功。肽平均疏水性和平均疏水力矩利用CCS方法检测。由图3可知,RD27疏水性和两亲性数值均较为适中。
2.2肽的二级结构
RD27在含有10mmol·L-1PBS缓冲液(模拟水环境)、50%TFE(模拟微生物膜的疏水环境)和30mmol·L-1SDS(模拟带负电荷的原核生物膜)环境中的圆二色谱(OD)见图4,RD27在水环境中呈现无规卷曲二级结构;在模拟膜环境中,192 nm波长附近出现一个正谱带,208和222 nm波长附近有两个负特征肩峰谱带出现,表明RD27在此环境中形成典型的ɑ-螺旋结构[28-29]。与二级结构预测结果一致(见图5)。
2.3抑菌活性和溶血活性
RD27对革兰氏阳性菌和革兰氏阴性菌抑菌活性见表2,从表中可知,RD27对待测菌均表现较强抑菌活性,最小抑菌浓度为4~8 μmol·L-1,与对照肽蜂毒素(Melittin)相比,RD27活性整体略差,但对金黄色葡萄球菌显示活性更强。
对于RD27溶血活性,由表2可知,引起人血红细胞发生5%溶血的肽最小浓度为45.9 μmol·L-1,相对于对照肽蜂毒素(Melittin)最小溶血浓度0.25 μmol·L-1,降低对人血红细胞毒性作用。
治疗指数是指肽的最小溶血浓度与最小抑菌浓度几何平均数比值。治疗指数越大说明细胞选择性越强。
由表2可知,RD27治疗指数是对照肽蜂毒素的100倍,表明RD27具有较好细胞选择性。

图5 RD27二级结构预测Fig.5 Predicted secondary structure of RD27

表2 肽的抑菌活性和溶血活性Table 2 Antimicrobial and hemolytic activities of the peptides
2.4色氨酸蓝移及淬灭
为检测含色氨酸残基的RD27对模拟微生物膜作用,本试验检测在亲水和模拟细胞膜磷脂疏水环境中的色氨酸谱(见表3)。
由表3可知,Tris缓冲液中,检测肽最大发射波长约为350 nm,当将这些肽放置于含有PE/PG磷脂环境后,最大发射谱发生不同程度变化,Melittin和RD27分别产生18和13 nm蓝移;当将这些肽放于含有PC/cholesterol环境中后,蓝移较小,分别为8和3 nm。
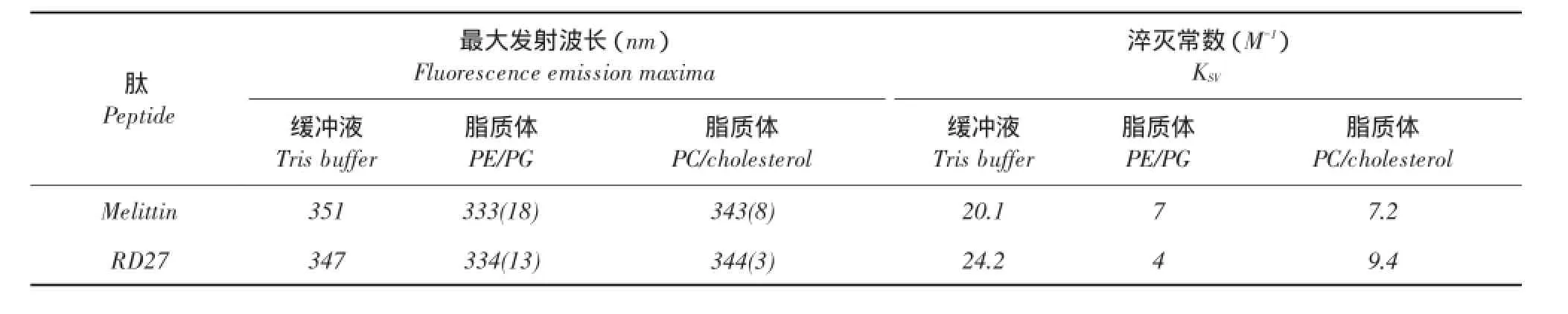
表3 肽在缓冲液、模拟细胞膜磷脂PE/PG或PC/cholesterol中的蓝移和淬灭常数Table 3 Blue shifts and Ksv values of the peptides in buffer,PE/PG or PC/cholesterol vesicles
利用丙烯酰胺淬灭试验,检测不同肽深入磷脂环境中或与磷脂结合程度。用KSV值描述抗菌肽中色氨酸残基淬灭程度,KSV值越小,代表色氨酸残基被保护程度越高。当将丙烯酰胺加入含有PE/ PG磷脂中时,RD27的KSV值相对于缓冲液中值降低,且低于Melittin对应KSV值,说明RD27能识别微生物膜并与微生物膜发生结合。而处于PC/cho⁃lesterol环境中RD27的KSV值高于PE/PG磷脂中值,说明RD27细胞选择性较好。Melittin的KSV值反映其溶血活性较高。
2.5细胞质膜去极化
为评价肽对细菌细胞膜去极化程度和对细胞质膜破坏程度,常用膜电位敏感染料diSC3-5标示。RD27对细菌膜去极化作用结果见图6。结果发现,RD27能使E.coli UB1005细胞膜产生去极化作用,存在时间和剂量依赖效应。

图6 肽对E.coli UB1005细胞膜去极化作用Fig.6 Cytoplasmicmembrane depolarization of the peptide against E.coli UB1005
3 讨论
抗生素滥用导致耐药菌株出现、药物残留、环境污染等问题。因此,寻找抗生素替代物成为研究热点。抗菌肽具有破膜特殊机制,不易产生耐药性[30-31],其鉴定、分离和研发受关注。目前从生物体内分离[32-33],肽库构建[34],功能域杂合[35-36],截取/替换[37]等方法均可得到抗菌肽。
当组织损伤或外源病原体感染时,机体可通过凝血系统级联反应产生血液凝块,防止机体过量流血并阻止病原体入侵。凝血过程伴随炎症反应。凝血酶作为凝血系统关键酶,在促进凝血和血小板凝集中发挥重要作用,具有抗凝和抗纤维蛋白原溶解功能。此外,凝血酶在宿主防御方面具有关键性作用[19]。本研究以凝血酶为研究对象,对猪凝血酶序列中氨基酸位置和属性进行理论分析并借助抗菌肽理化参数在线工具(http://heliquest. ipmc.cnrs.fr/cgi-bin/ComputParamsV2.py),利用序列截取法,逐一筛选,在猪凝血酶原N端第597号位置处截断得到含有27个氨基酸残基的肽RD27(RDG KYGFYTHVFRLKKWMQKVIDRFGG),探究其抑菌活性及作用机制。
α-螺旋抗菌肽在不同环境中构象变化对其生物学活性具有重要作用[38]。通过检测RD27在PBS缓冲液和膜模拟环境中的CD光谱得到RD27在不同环境中二级结构变化(见图4),结果表明,RD27在膜模拟环境中呈现典型α-螺旋结构,与二级结构预测结果一致(见图5)。两亲性是抗菌肽发挥抗菌作用关键因素,α-螺旋两亲性结构是指疏水性氨基酸和亲水性氨基酸呈扇形对称分布于螺旋轮映射图相对两侧。有利于抗菌肽与细菌膜发生作用。但也有研究表明高两亲性并不一定提高抗菌肽抑菌活性,反而影响抗菌肽安全性。Zhu等研究证明过高的两亲性和螺旋度反而会降低抗菌肽细胞特异性选择,提高其对正常细胞毒性,适当破坏两亲性不会使抑菌活性降低,且会提高其细胞选择性[39]。从螺旋轮映射图(见图3)可知,RD27疏水性区域和亲水性区域并非标准扇形对称分布,即非完美两亲性结构。RD27较强的抑菌活性和对模拟不同细胞类型脂质体作用的较大差异性与该结论一致。抑菌活性试验结果显示,RD27对待测菌株均表现较强活性,但活性低于对照肽Melit⁃tin。Yin等研究证明,正电荷增加对于抗菌肽与负电性的微生物膜表面相互作用非常重要,但正电荷数与抑菌活性间并非简单线性关系,电荷数在+6~+7范围内最佳,更高的正电性会降低活性[40]。本研究中,电荷数为+6的RD27活性并未高于电荷数为+5的对照肽Melittin,说明抑菌活性是电荷数、疏水性及两亲性综合作用结果。Chen等研究表明,在相对较低疏水性范围内,抗菌肽抑菌活性随疏水性增加而提高,因为疏水性增加将促进肽插入到膜磷脂层中[41]。本试验中检测到RD27与Melittin抑菌活性随其疏水性变化趋势与该结论一致。溶血活性通常评价抗菌肽对真核细胞毒性,本研究以人体血红细胞代表哺乳动物的宿主细胞,检测肽对其损伤作用和生存率影响,评估抗菌肽对正常细胞破坏程度。疏水性是影响抗菌肽溶血活性重要指标,Chen等研究表明高疏水性会引起较强溶血活性,较高的疏水性促使肽穿透血红细胞膜形成疏水性孔洞[41]。本试验中RD27引起5%溶血的最小肽浓度为45.9 μmol·L-1,高于对照肽Melittin的最小溶血浓度(0.25 μmol·L-1),通过比较两条肽疏水性可知,可能由于RD27具有较低疏水性,不易破坏血红细胞的细胞膜。与Chen等研究结果一致。
为探讨RD27与细菌微生物和真核生物细胞膜间相互作用及其是否具有差异性,通过细胞膜组成特点,利用不同磷脂组分分别制成脂质体模拟不同细胞膜。RD27氨基酸序列中含有可作为内在探针的色氨酸,可间接推测肽所处环境变化,阐明抗菌肽与细胞膜作用能力和程度,揭示肽作用机理[27,42]。本研究中,RD27在模拟细菌等微生物膜脂质体PE/PG中产生的蓝移大于模拟真核细胞膜脂质体PC/cholesterol,表明RD27更易与微生物膜发生作用,利用丙烯酰胺淬灭与模拟细胞膜相结合肽的色氨酸荧光,评估不同磷脂膜与肽紧密程度和深度,结果发现,RD27与脂质体PE/PG结合程度高于其与脂质体PC/cholesterol结合程度,说明RD27能识别并结合微生物膜,细胞选择性较好。细菌质膜是细菌维持生命活动的重要保护屏障,受到干扰或破坏时,细菌生长受抑制,甚至死亡。细菌细胞膜电势能被破坏,是细菌活性下降或死亡重要特征。细胞质膜去极化试验中,RD27能使大肠杆菌(E.coli UB1005)细胞质膜发生去极化,破坏其电势平衡。结果表明RD27通过破坏细菌细胞膜发挥抑菌作用。
4 结论
本研究以猪凝血酶为研究对象,通过生物信息学方法分析,在其C端截取得到具有高抑菌活性、低细胞毒性的抗菌肽RD27,验证其破坏细胞膜的抑菌作用机制,为替代饲用抗生素新型抗菌药物研制奠定基础。
[1]Breidenstein E B,Fuente-Núñez C,Hancock R E.Pseudomonas aeruginosa:All roads lead to resistance[J].Trends inmicrobiolo⁃gy,2011,19:419-426.
[2]Brown K L,Hancock R E W.Cationic host defense(antimicrobial) peptides[J].Current Opinion In Immunology,2006,18:24-30.
[3]Shai Y.Mode of action ofmembrane active antimicrobial peptides [J].Peptide Science,2002,66:236-248.
[4]Teixeira V,Feiom J,Bastosm.Role of lipids in the interaction of antimicrobial peptides withmembranes[J].Progress in Lipid Re⁃search,2012,51:149-77.
[5]Yount N Y,Yeamanm R.Peptide antimicrobials:Cell wall as a bacterial target[J].Antimicrobial Therapeutics Reviews:The Bac⁃terial Cell Wall as an Antimicrobial Target,2013,1277:127-138.
[6]Tripathi S,Wang G,Whitem,et al.Antiviral activity of the human cathelicidin,LL-37,and derived peptides on seasonal and pandemic influenza A viruses[J].PloS One,2015,10(4): e0124706.
[7]Chen H L,Su P Y,Chang Y S,et al.Identification of a novel anti⁃microbial peptide from human hepatitis B virus core protein argi⁃nine-rich domain(ARD)[J].PLos Pathogens,2013,9(6):371-376.
[8]Fjell C D,Hiss J A,Hancock R E W,et al.Designing antimicrobi⁃al peptides:form follows function[J].Nature Reviews Drug Dis⁃covery,2012(11):124.
[9]Brogden N K,Brogden K A.Will new generations ofmodified anti⁃microbial peptides improve their potential as pharmaceuticals?[J]. International Journal of Antimicrobial Agents,2011,38:217-225.
[10]Giuliani A,Rinaldi A C.Beyond natural antimicrobial peptides:multimeric peptides and other peptidomimetic approaches[J].Cel⁃lular andmolecular Life Sciences,2011,68:2255-2266.
[11]Wang H,Liang J,Zhao Y,et al.Molecular cloning,characteriza⁃tion and expression analysis of trypsin-like serine protease from triangle-shell pearlmussel(Hyriopsis cumingii)[J].Fish Shellfish Immunology,2014,40:603-608.
[12]Arlaud G J,Volanakis J E,Thielens Nm,et al.The atypical ser⁃ine proteases of the complement system[J].Advances in Immunol⁃ogy,1998,69:249-307.
[13]Hedstrom L.Serine proteasemechanism and specificity[J].Chemi⁃cal Reviews,2002,102:4501-4524.
[14]何智,陈政良.补体系统丝氨酸蛋白酶的结构与功能[J].国际免疫学杂志,2004,27:316-319.
[15]陈晓翔,杨程德,顾越英.纤溶酶功能研究进展[J].诊断学理论与实践,2005(4):430-432.
[16]Hu Y C.Baculovirus as a highly efficient expression vector in in⁃sect andmammalian cells[J].Acta Pharmacologica Sinica,2005, 26:405-416.
[17]Satoh D,Horii A,Ochiaim,et al.Prophenoloxidase-activatingen⁃zyme of the silkworm,Bombyxmori.purification,characterization, and cDNA cloning[J].Journal of Biological Chemistry,1999,274: 7441-7453.
[18]Nordahl E A,Rydengard V,Nyberg P,et al.Activation of the com⁃plement system generates antibacterial peptides[J].Proceedings of the National Academy of Sciences of the United States of Amer⁃ica,2004,101:16879-16884.
[19]Bode W.The structure of thrombin:A janus-headed proteinase [J].Seminars in Thrombosis and Hemostasis,2006,32:16-31.
[20]张智明.凝血酶的研究进展[J].海峡药学,2006,18(6):1-3.
[21]Papareddy P,Rydengard V,Pasupuletim,et al.Proteolysis of hu⁃man thrombin generates novel host defense peptides[J].PLos Pathogens,2010,6(4):123.
[22]Davie E W,Kulman J D.An overview of the structure and func⁃tion of thrombin[J].Seminars in Thrombosis and Hemostasis, 2006,32:3-15.
[23]Wang Y P,Ren L.insect antimicrobial peptides:Structures,prop⁃erties and gene regulation[J].Protein&Peptide Letters,2010,31 (1):27-34.
[24]Ma Q Q,Dong N,Shan A S,et al.Biochemical property andmem⁃brane-peptide interactions of de novo antimicrobial peptides de⁃signed by helix-forming units[J].Amino Acids,2012,43:2527-2536.
[25]Starkm,Liu L P,Deber Cm.Cationic hydrophobic peptides with antimicrobial activity[J].Antimicrobial Agents and Chemothera⁃py,2002,46:3585-3590.
[26]Lee K H,Lee D G,Park Y,et al.Interactions between the plasmamembrane and the antimicrobial peptide HP(2-20)and its ana⁃logues derived from Helicobacter pylori[J].Biochemical Journal, 2006,394:105.
[27]Dong N,Ma Q,Shan A,et al.Strand length-dependent antimicro⁃bial activity andmembrane-activemechanism of arginine-and valine-rich beta-hairpin-like antimicrobial peptides[J].Antimi⁃crobial Agents and Chemotherapy,2012,56:2994-3003.
[28]黄汉昌,姜招峰,朱宏吉.紫外圆二色光谱预测蛋白质结构的研究方法[J].化学通报,2007(7):501-506.
[29]Zhu X,Zhang L C,Wang J,et al.Characterization of antimicrobi⁃al activity andmechanisms of low amphipathic peptides with dif⁃ferent alpha-helical propensity[J].Acta Biomaterialia,2015,18: 155-167.
[30]Huang Y,Wiradharma N,Xu K,et al.Cationic amphiphilic al⁃pha-helical peptides for the treatment of carbapenem-resistant Acinetobacter baumannii infection[J].Biomaterials,2012,33: 8841-8847.
[31]Chen Z J,Wang Dm,Cong Y G,et al.Recombinant antimicrobial peptide hPAB-beta expressed in Pichia pastoris,a potential agent active againstmethicillin-resistant Staphylococcus aureus[J].Ap⁃pliedmicrobiology and Biotechnology,2011,89:281-291.
[32]Hou F,Li J,Pan P,et al.Isolation and characterisation of a new antimicrobial peptide from the skin of Xenopus laevis[J].Interna⁃tional Journal of Antimicrobial Agents,2011,38:510-515.
[33]Su Y.Isolation and identification of pelteobagrin,a novel antimi⁃crobial peptide from the skinmucus of yellow catfish(Pelteo⁃bagrus fulvidraco)[J].Comparative Biochemistry and Physiology B-Biochemistry&Molecular Biology,2011,58:149-154.
[34]Blondelle S E,Lohner K.Combinatorial libraries:A tool to design antimicrobial and antifungal peptide analogues having lytic speci⁃ficities for structure-activity relationship studies[J].Biopolymers, 2000,55(1):74-87.
[35]Ma Z,Wei D,Yan P,et al.Characterization of cell selectivity, physiological stability and endotoxin neutralization capabilities of alpha-helix-based peptide amphiphiles[J].Biomaterials,2015,52 (1):517-530.
[36]Xi D,Teng D,Wang X,et al.Design,expression and characteriza⁃tion of the hybrid antimicrobial peptide LHP7,connected by a flexible linker,against Staphylococcus and Streptococcus[J].Pro⁃cess Biochemistry,2013,48:453-461.
[37]Lv Y,Wang J,Gao H,et al.Antimicrobial properties andmem⁃brane-activemechanism of a potential alpha-helical antimicro⁃bial derived from cathelicidin PMAP-36[J].PloS One,2014,9(1): e86364.
[38]Gopal R,Seo C H,Song P I,et al.Effect of repetitive lysine-tryp⁃tophanmotifs on the bactericidal activity of antimicrobial peptides [J].Amino Acids,2013,44:645-660.
[39]Zhu X,Dong N,Wang Z Y,et al.Design of imperfectly amphipa⁃thic alpha-helical antimicrobial peptides with enhanced cell se⁃lectivity[J].ActaBiomaterialia,2014(10):244-257.
[40]Yin Lm,Edwardsm A,Li J,et al.Roles of hydrophobicity and charge distribution of cationic antimicrobial peptides in peptidemembrane interactions[J].Journal of Biological Chemistry,2012, 287:7738-7745.
[41]Chen Y,Guarnierim T,Vasil A I,et al.Role of peptide hydropho⁃bicity in themechanism of action of alpha-helical antimicrobial peptides[J].Antimicrobial Agents and Chemotherapy,2007,51: 1398-1406.
[42]Ma Q Q,Shan A S,Dong N,et al.Cell selectivity and interaction withmodelmembranes of Val/Arg-rich peptides[J].Journal of Peptide Science,2011,17:520-526.
Study on antimicrobial activity andmembrane-mediatedmechanism of porcine thrombin C-terminal peptide derivative
SHAN Anshan,LV Xiting,MA Qingquan,SHAO Changxuan(Institute of Animal Nutrition,Northeast Agricultural University,Harbin 150030,China)
The C-terminal sequences of porcine thrombin contain a series of amino acid residues with the characteristics of net positive charge and hydrophobicity.The study aimed to investigate the antimicrobial potential and reveal the actionmechanism.The truncated peptide RD27 was obtained through the analysis of the structure parameters of porcine thrombin C-terminus.And,the relevant indices were investigated.The results showed that theminimum inhibitory concentration(MIC)of RD27 to Gram-negative and Gram-positive bacteria was 4-8 μmol·L-1,theminimal hemolytic concentration(MHC)of RD27 was 45.9 μmol·L-1, which demonstrated strong antimicrobial activity and low hemolytic activity.The therapeutic index of RD27 was 10,much higher than that ofmelittin.α-helical conformation was observed in amembrane-mimicking environment.RD27 interacted preferentially with the liposomemimicking bacteria.RD27 was able to depolarize the cellmembrane ofE.coliUB1005 in a dose-dependent and time-dependentmanner.These findings revealed themembrane-mediatedmechanism of RD27.The study expended the approaches of designing AMPs and provided a link between the coagulation and immune system.
antimicrobial peptides;porcine thrombin;antimicrobial activity;actionmechanism
S828;O629.72
A
1005-9369(2016)04-0001-09
2016-03-01
国家自然科学基金项目(31272453,31472104);中国博士后科学基金项目(2012M510082,2013T60342);中国高等教育博士点基金项目(20132325120003);东北农业大学“青年才俊”项目(14QC16);国家科学技术支持项目(2013BAD10B03);农业技术产业体系项目(CARS-36)
单安山(1958-),男,教授,博士,博士生导师,研究方向为动物营养与饲料科学。E-mail:asshan@neau.edu.cn
