外源Ca2+对盐胁迫下唐古特白刺光合作用影响
2016-09-21闫永庆高彦博杜玉玲赵奕翔东北农业大学园艺学院哈尔滨150030
闫永庆,高彦博,刘 威,杜玉玲,赵奕翔(东北农业大学园艺学院,哈尔滨 150030)
外源Ca2+对盐胁迫下唐古特白刺光合作用影响
闫永庆,高彦博,刘威,杜玉玲,赵奕翔
(东北农业大学园艺学院,哈尔滨150030)
为探究Ca2+对盐生植物耐盐调节机理,以唐古特白刺(Nitraria tangutorum)为试验材料,研究施加不同浓度外源Ca2+对盐胁迫下唐古特白刺光合作用影响。结果表明,盐浓度不高于300mmol·L-1时,施加一定浓度Ca2+(≤15mmol·L-1)可增加唐古特白刺叶片相对含水量、叶绿素含量,提升净光合速率,增大气孔导度,降低胞间CO2浓度,同时提高PSⅡ最大光化学效率、PSⅡ实际光化学效率及光化学猝灭系数,且这种趋势随Ca2+浓度增加而增加,而高浓度Ca2+(>15mmol·L-1)对盐胁迫下唐古特白刺光合作用表现不同程度抑制作用。说明盐浓度低于300mmol·L-1时,施加一定浓度Ca2+能有效缓解盐胁迫对唐古特白刺光合作用影响;盐浓度超过300mmol·L-1时,外施Ca2+调节作用不明显,高浓度Ca2+甚至对光合作用表现抑制作用。
盐胁迫;Ca2+;光合作用;唐古特白刺
闫永庆,高彦博,刘威,等.外源Ca2+对盐胁迫下唐古特白刺光合作用影响[J].东北农业大学学报,2016,47(4):57-64.
Yan Yongqing,Gao Yanbo,Liu Wei,et al.Effect of exogenous Ca2+on photosynthesis ofNitraria tangutorumduring salt stress[J].Journal of Northeast Agricultural University,2016,47(4):00-00.(in Chinese with English abstract)
网络出版时间2016-4-22 10:01:17[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160422.1001.018.html
土壤盐渍化是影响农业生产及生态环境的全球性问题,是土地资源利用与开发主要障碍之一[1],次生盐渍化土壤面积及潜在盐碱土壤面积扩大,抑制植物生长,给农业生产带来重大影响[2]。因此,加强盐碱土改良,研究植物抗盐性对于农业生产及生态环境具有重要意义。
钙是生物体不可或缺的矿物质元素,是偶联细胞外信号的第二信使,在维持细胞膜结构及细胞膜结合蛋白稳定性,调控多种酶活性方面具有重要作用[3-4]。研究表明,盐胁迫通过抑制光合作用影响植物生长发育,且浓度越高,时间越长,效果越明显[5-6]。NaCl胁迫下盐敏感型高粱光合速率大幅下降,显著大于耐盐品种[7]。营养液中施加外源Ca2+能有效防护盐胁迫所致氧化损伤,维持较高酶活性,保护光系统Ⅱ功能,保持较高光合效率[8]。外源Ca2+还能增强细胞膜透性,改善水稻光合能力[9]。外施Ca2+对盐胁迫的调节作用主要因Ca2+能稳定质膜结构[10],降低植物对Na+吸收,促进K+吸收[11-12],对一些酶类物质起保护作用[13],改善植物光合能力。但外源Ca2+调节作用也存在局限,适宜Ca2+能促进植物生长,缓解胁迫,Ca2+浓度过高,促进作用减弱,甚至抑制植物生长[14]。目前,外源Ca2+对光合作用调控多见于非盐生植物[15-16],针对盐生植物鲜见报道。本研究以唐古特白刺(Nitraria tangutorum)为材料,探究不同浓度盐胁迫对唐古特光合作用的影响及Ca2+对光合作用的调控,为后续研究奠定理论基础。
1 材料与方法
1.1材料培养与处理
唐古特白刺(Nitraria tangutorum Bobr.)一年生实生苗。2014年3月将种子浸泡24 h后,东北农业大学温室中播种于装有纯净河沙的育苗盘中,幼苗长至3~5片真叶后,定植到口径为15 cm塑料花盆中,栽培基质为园土ϑ蛭石=1 ϑ 1。2015年5月选取长势一致,叶片充分展开的唐古特白刺,蒸馏水清洗根部,栽植于口径为20 cm塑料花盆中,栽培基质为纯净河沙,每盆1株,1/2浓度Hoagland营养液浇灌培养,待缓苗充分后,盐胁迫处理。
对唐古特白刺胁迫处理,NaCl溶液浓度设为100、200、300、400mmol·L-1,CaCl2溶液浓度设0、5、10、15、20mmol·L-1,采用完全随机试验设计,模拟20个盐浓度及Ca2+混合处理,每个处理设3个重复,共60盆。为防止盐激效应,每盆均以Hoagland全营养液+50mmol·L-1NaCl作起始盐浓度浇灌,每天递增50mmol·L-1NaCl浓度[17],达到预设浓度后,再分别用预设浓度的CaCl2溶液浇灌,连续7 d,为保持盐浓度恒定,浇灌量为每盆300mL,其中约2/3溶液渗出,将前1 d累积于细沙中的盐分冲洗掉。处理结束后于次日早9:00取样测定。
1.2相关指标测定
参照高俊凤烘干称重法[18],测定叶片相对含水量;丙酮乙醇1 ϑ 1混合法测定叶绿素含量;于晴天上午9:00~11:00,用便携式光合速率测定仪(Li-6400型;Li-Cor公司,美国),测定完全展开功能叶片净光合速率(Pn),气孔导度(Gs)和胞间二氧化碳浓度(Ci);用德国Walz公司生产便携式调制叶绿素荧光仪PAM2500测量并计算PSⅡ最大光化学效率Fv/Fm,PSⅡ实际光化学效率ΦPSⅡ,光化学淬灭系数qP。
运用SPSS 19.0作数据显著性分析,Excel 2010作数据处理和绘图。
2 结果与分析
2.1外源Ca2+对盐胁迫下唐古特白刺相对含水量影响
由图1可知,随外源Ca2+浓度升高,叶片相对含水量增加,且趋势随盐浓度升高而减弱。NaCl浓度为400mmol·L-1时,叶片相对含水量随Ca2+浓度增加呈升降升波动性变化,Ca2+浓度为15mmol·L-1时降到最低61.85%,之后又上升。NaCl浓度分别为100、200、300mmol·L-1时,叶片相对含水量在Ca2+浓度为20mmol·L-1时达到最大,且均与不施加Ca2+相比差异显著(P<0.05),与其他处理间差异不显著。说明一定浓度外源Ca2+能提高盐胁迫(NaCl<300mmol·L-1)下唐古特白刺叶片相对含水量。
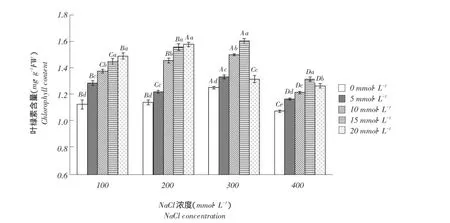
2.2外源Ca2+对盐胁迫下唐古特白刺叶绿素含量影响
由图2可知,叶片叶绿素含量随盐浓度升高呈先增后降趋势,盐浓度为300mmol·L-1时达到最大值,且与其他盐处理相比差异显著(P<0.05)。施加Ca2+情况下,当盐浓度≤200mmol·L-1时,叶片叶绿素含量随外源Ca2+浓度增加呈增长趋势,Ca2+浓度为20mmol·L-1时达最大值,100、200mmol· L-1下分别比不施加Ca2+时增加32.3%和37.8%;盐浓度不低于300mmol·L-1时,叶片叶绿素含量则随外源Ca2+浓度增加呈先升后降趋势,且Ca2+浓度达到15mmol·L-1时,叶绿素含量达到最大值,分别比不施Ca2+时增加28.1%和22.3%,随后降低。说明施加适宜浓度外源Ca2+可促进白刺叶片叶绿素合成。

图1 外源Ca2+对盐胁迫下唐古特白刺叶片相对含水量影响Fig.1 Effects of exogenous Ca2+on the leaf relative water content of N.tangutorum under salt stress
2.3外源Ca2+对盐胁迫下唐古特白刺气体交换参数影响
外源Ca2+对盐胁迫下唐古特白刺气体交换参数影响见图3。
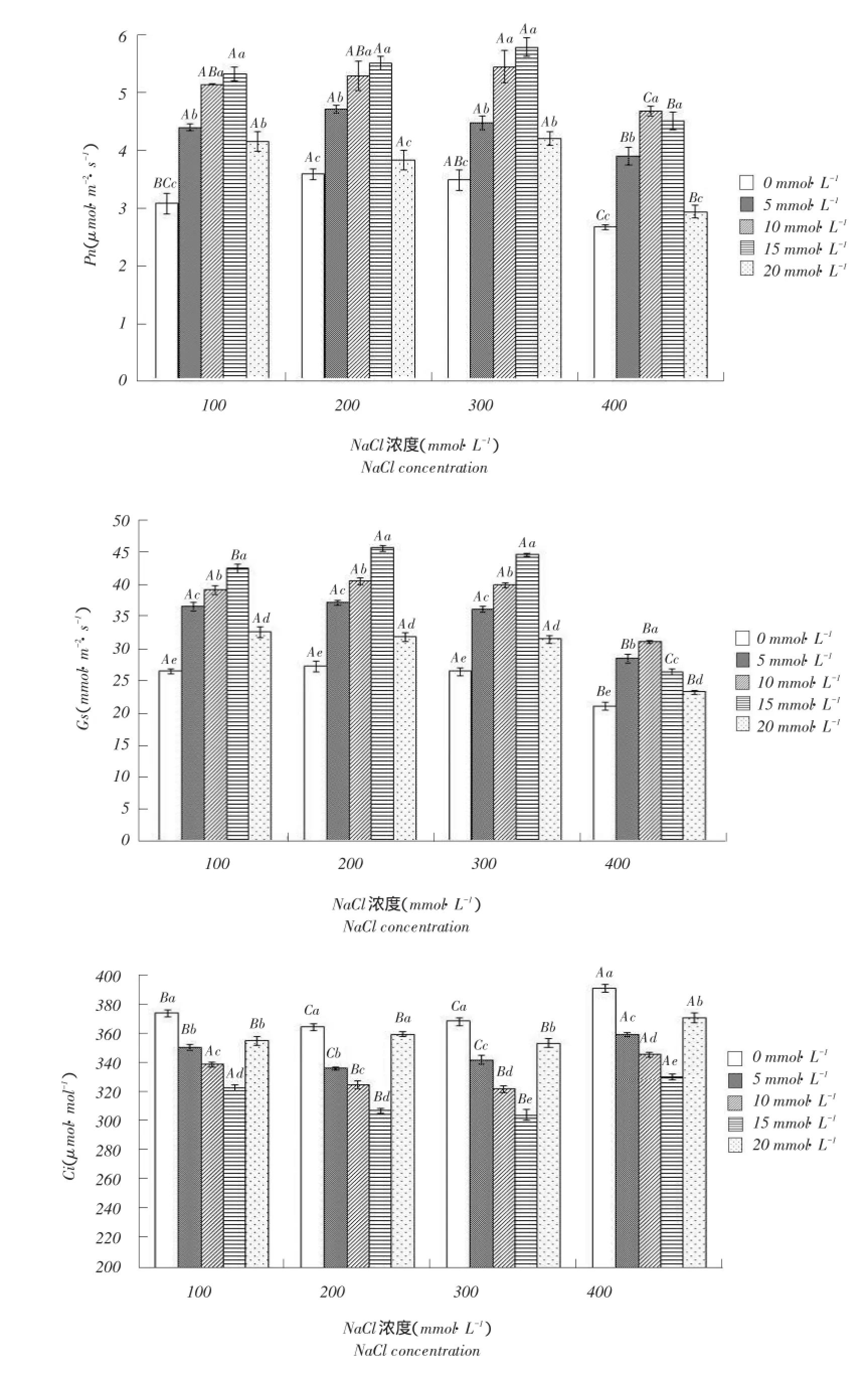
图3 外源Ca2+对盐胁迫下唐古特白刺气体交换参数影响Fig.3 Effects of exogenous Ca2+on the gas exchange characteristic ofN.tangutorumunder salt stress
2.3.1净光合速率
由图3可知,随NaCl浓度增加,净光合速率(Pn)呈先升后降趋势,NaCl浓度为300mmol·L-1时达到最大值,随后降低。当外源Ca2+浓度增加时,净光合速率有不同程度增加,100、200、300mmol·L-1盐处理下均在Ca2+浓度为15mmol·L-1时分别比不添加Ca2+对照组增加73.9%、54.3%、66.9%,400mmol·L-1盐处理后,Pn则在Ca2+浓度为10mmol·L-1时升至4.7 μmol·m-2·s-1,随后降低。说明施加适宜浓度Ca2+可提高唐古特白刺净光合速率,促进光合作用。
2.3.2气孔导度
由图3可知,气孔导度(Gs)随Ca2+浓度升高,呈先升后降趋势。当NaCl浓度为400mmol·L-1时,Gs下降明显,与其他盐浓度处理相比差异显著(P<0.05),其他盐浓度处理间则无显著变化。当NaCl浓度≤300mmol·L-1时,Gs在Ca2+浓度15mmol·L-1时达到最大值,随后降低。说明唐古特白刺在盐浓度≤300mmol·L-1时有较强抗性,而一定浓度Ca2+(≤15mmol·L-1)可缓解盐胁迫,调节气孔开度。
2.3.3胞间CO2浓度
由图3可知,随NaCl浓度和外源Ca2+浓度升高,Ci先降后升,当外源Ca2+浓度达到15mmol·L-1时,Ci降到最低值,随后升高。当NaCl浓度达到400mmol·L-1时,Ci显著升高,超过其他盐浓度处理(P<0.05),说明当盐浓度超过300mmol·L-1时,唐古特白刺Ci显著上升,使植物气孔内外CO2浓度差减小,气孔吸收CO2量减少,光合速率降低。而一定浓度外源Ca2+可缓解盐胁迫,降低Ci,最适浓度为15mmol·L-1。
2.4外源Ca2+对盐胁迫下唐古特白刺叶绿素荧光参数影响
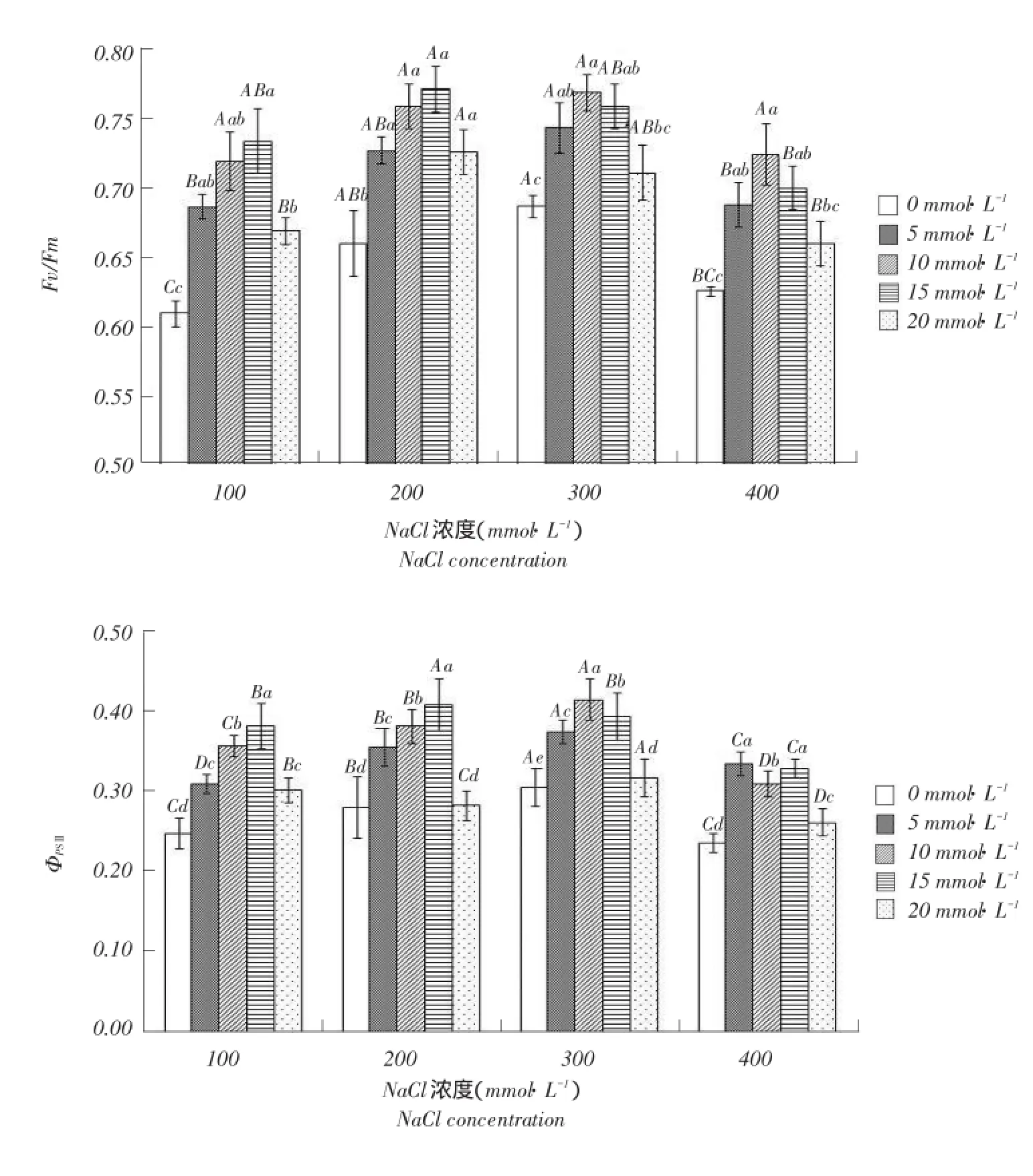
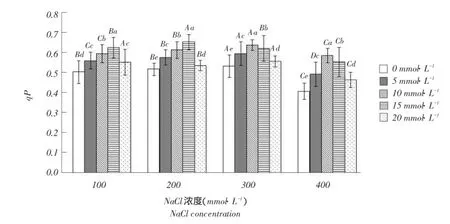
图4 外源Ca2+对盐胁迫下唐古特白刺叶绿素荧光参数影响Fig.4 Effects of exogenous Ca2+on the chlorophyll fluorescence parameters ofN.tangutorumunder salt stress
外源Ca2+对盐胁迫下唐古特白刺叶绿素荧光参数影响见图4。
2.4.1最大光化学效率
由图4可知,随NaCl浓度升高,PSⅡ最大光化学效率(Fv/Fm)呈先升后降趋势。200、300mmol·L-1NaCl处理下Fv/Fm显著高于100、400mmol·L-1NaCl浓度处理,说明唐古特白刺能适应一定NaCl浓度(<300mmol·L-1)胁迫,通过自身调节提高光能利用效率对抗盐胁迫。100、200mmol·L-1NaCl处理下,Fv/Fm在Ca2+浓度为15mmol·L-1时达到最大值,300、400mmol·L-1Na⁃Cl处理下Fv/Fm在Ca2+浓度为10mmol·L-1时达到峰值,后又下降,且各盐浓度下,Ca2+浓度为10、15mmol·L-1时Fv/Fm显著高于其他处理(P< 0.05)。说明一定浓度外源Ca2+可提升PSⅡ最大光能利用效率,以10、15mmol·L-1为最佳浓度。
2.4.2实际光化学效率
由图4可知,随盐浓度升高,PSⅡ实际光化学效率(ΦPSⅡ)呈先升后降趋势,NaCl浓度为100、200mmol·L-1时,ΦPSⅡ在Ca2+浓度为15mmol·L-1时达到最大,300mmol·L-1NaCl处理则在10mmol· L-1时达到最大,这与Fv/Fm值相似,当NaCl浓度为400mmol·L-1时,随Ca2+浓度升高,ΦPSⅡ呈升降升波动性变化。结果表明,过高的盐浓度严重损伤光反应系统,降低光化学效率。而一定浓度外源Ca2+(≤15mmol·L-1)可缓解盐胁迫,提升植物在PSⅡ阶段反应中心原初光能捕获效率;过高Ca2+(> 15mmol·L-1)浓度则会对PSⅡ反应起抑制作用。
2.4.3光化学猝灭系数
光化学猝灭系数(qP)在一定程度上反映PSⅡ反应中心开放程度,其值表示PSⅡ天线色素吸收光能用于光化学反应电子传递的份额,值越大说明PSⅡ电子传递越活跃。由图4可知,随Ca2+浓度升高,不同盐浓度处理下qP先升后降,100、200mmol·L-1NaCl处理下,qP在Ca2+浓度为15mmol· L-1时达到最大值,300、400mmol·L-1NaCl处理下则是在10mmol·L-1时达到最大值,后又下降,且各处理间差异显著(P<0.05)。说明外源Ca2+能有效提升PSⅡ电子传递活跃程度,提升植物光合效率,而Ca2+浓度以10、15mmol·L-1为最佳。
3 讨论与结论
Shabala等指出,钙离子可改善细胞内外环境,减轻盐胁迫中钠离子对植物毒害作用[19],当植物受到盐胁迫时,植物体内钙离子不足,与盐胁迫抑制植物对钙离子吸收和利用有关[20]。光合作用是植物有机物合成最主要途径,光合能力与植物对有机物积累直接相关。盐胁迫影响光合作用碳同化进程,降低碳同化效率和植物有机物积累。因此,施加一定浓度钙离子可调节因钙缺失所致植物非正常生长发育,通过维持钙信号系统正常发生和传递,调节相关酶活性,改善植物光合能力。
本研究结果表明,唐古特白刺遇到盐胁迫时,通过细胞内生理生化代谢反应,调节自身酶活性,抵御一定浓度盐胁迫。外源Ca2+可增加唐古特白刺叶片叶绿素含量,随盐浓度升高,叶片叶绿素含量先升后降。施加一定浓度外源Ca2+后,各盐浓度下叶绿素含量均有不同程度增加,与袁晓婷等研究结果一致[21]。
净光合速率(Pn)值反映植物同化作用强弱,并决定产量积累,逆境下植物Pn降低因素有两种:气孔限制和非气孔限制,而气孔导度(Gs)和胞间CO2浓度(Ci)则是判断气孔与非气孔限制的重要因素[22]。随盐浓度升高,唐古特白刺Pn和Gs先升后降,而Ci先降后升,当盐浓度为400mmol· L-1时,Pn和Gs显著下降,而Ci显著上升,说明此时影响光合速率的因素由气孔转变为非气孔因素,与Farquhar等观点相同[23]。当盐浓度<300mmol· L-1时,施加外源Ca2+,Pn和Gs随Ca2+浓度先升后降,Ci则先降后升,说明适宜Ca2+浓度可显著提高植物净光合速率,过高Ca2+浓度可能形成离子毒害,对植物产生胁迫[24],抑制光合作用。
叶绿素荧光参数是研究植物光合生理对周围环境因子变化响应的重要参数[25-26],Fv/Fm是叶片暗适应后,PSⅡ反应中心处于开放状态下的最大光化学效率,是研究光抑制或环境胁迫对PSⅡ影响的重要指标[27],ΦPSⅡ为在环境胁迫时部分关闭情况下的实际原初光能捕获效率,反映PSⅡ反应中心实际光化学反应效率[28]。本研究表明,盐胁迫不高于300mmol·L-1时Fv/Fm和ΦPSⅡ均随Ca2+浓度升高呈先升后降趋势,在Ca2+最适浓度时与不施加Ca2+差异显著,说明一定浓度Ca2+可有效调节盐胁迫造成的光抑制现象,提高原初光能捕获效率,保护光合器官免遭破坏,提升光合效率。
[1]杨劲松.中国盐渍土研究的发展历程与展望[J].土壤学报, 2008,45(5):837-845.
[2]Munns R.Comparative physiology of salt and water stress[J].Plant Cell and Environment,2002,25:239-250.
[3]Bush D S.Calcium regulation in plant cells and its role in signal⁃ing[J].Annual Review of Plant Physiology andmolecular Biology, 1995,46:95-112.
[4]余叔文,汤章城.植物生理与分子生物学[M].2版.北京:科学出版社,1998:123-133.
[5]Bethke P C,Drewm C.Stomatal and nonstomatal components to inhibition of photosynthesis in leaves of Capsicum annuum during progressive exposure to NaCl salinity[J].Plant Physiology,1992, 99:219-226.
[6]Sultana N,Ikeda T,Itoh R.Effect of NaCl salinity on photosynthe⁃sis and drymatter accumulation in developing rice grains[J].Envi⁃ronmental and Experimental Botany,1999,42(3):211-220.
[7]孙璐,周宇飞,李丰先,等.盐胁迫对高粱幼苗光合作用和荧光特性的影响[J].中国农业科学,2012,45(16):3265-3272.
[8]薛延丰,刘兆普.钙离子对盐胁迫下菊芋幼苗的生长、生理反应和光合能力的影响[J].农业工程学报,2006(9):44-47.
[9]朱晓军,杨劲松,梁永超,等.盐胁迫下钙对水稻幼苗光合作用及相关生理特性的影响[J].中国农业科学,2004,37(10):1497-1503.
[10]Cramer G R,Läuchli A,Polito V S.Displacement of Ca2+by Na+from the plasmalemma of root cells-A primary response to salt stress[J].Plant Physiology,1985,79:207-211.
[11]Nakamura Y K,Tanaka E,Sakata Om.Protective effects of exter⁃nal Ca2+on elongation and intracellular concentration of K+in in⁃tactmung bean roots under high NaCl stress[J].Plant and Cell Physiology,1990,31:815-821.
[12]闫永庆,袁晓婷,刘威,等.盐胁迫及外源Ca2+对白刺离子吸收、运输的影响[J].东北农业大学学报,2014,45(3):71-78.
[13]关军锋.Ca2+对苹果果实细胞膜透性、保护酶活性和保护物质含量的影响[J].植物学通报,1999,16(1):72-74.
[14]Murillo-Amador B,Jones H G,Kaya C,et al.Effects of foliar ap⁃plication of calcium nitrate on growth and physiological attributes of cowpea(Vigna unguiculata L.Walp.)grown under salt stress [J].Environ Exp Bot,2006,58:188-196.
[15]Patel N T,Vaghela Pm,Patel A D,et al.Implications of calcium nutrition on the response of Caesalpinia crista(Fabaceae)to soil salinity[J].ActaEcol Sin,2011,31:24-30.
[16]Nasir Khanm,Siddiquim H,Mohammad F,et al.Interactive role of nitric oxide and calcium chloride in enhancing tolerance to salt stress[J].Nitric Oxide,2012,27:210-218.
[17]弋良朋,王祖伟.盐胁迫下3种滨海盐生植物的根系生长和分布[J].生态学报,2011,31(5):1195-1202.
[18]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006: 15-16.
[19]Shabala S,Demidchik V.Extracellular Ca2+ameliorates NaCl-in⁃duced K+loss from Arabidopsis root and leaf cells by controlling plasmamembrane K+-permeable channels[J].Plant Physiology, 2006(8):1653-1665.
[20]Epstein E,Rains D W.Advances in salt tolerance[J].Plant Soil,1987,99:17-29.
[21]袁晓婷,刘威,宣亚楠,等.盐胁迫下唐古特白刺对外源Ca2+的生理响应[J].植物生理学报,2014,50(1):88-94
[22]Farquhar G D,von Caemmerer S,Berry J A.A biochemicalmodel of photosynthetic CO2assimilation in leaves of C3species[J].Plan⁃ta,1980,149(1):78-90.
[23]Farquhar G D,Sharkey T D.Stomatal conductance and photosyn⁃thesis[J].Annual Review of Plant Physiology,1982,33(1):317-345.
[24]罗绪强,王世杰,张桂玲,等.钙离子浓度对两种蕨类植物光合作用的影响[J].生态环境学报,2013,22(2):258-262.
[25]Lichtenthaler H K,Rinderle U.The role of chlorophyll fluores⁃cence in the detection of stress conditions in plants[J].CRC Criti⁃cal Reviews in Analytical Chemistry,1988,19(1):29-35.
[26]Öquist G.Microprocessor operated instrument formeasuring chlo⁃rophyll fluorescence kinetics in stress physiology[J].Physiologia Plantarum,1988,73(2):211-217.
[27]赵会杰,邹琦.叶绿素荧光分析技术及其在植物光合机理研究中的应用[J].河南农业大学学报,2000,34(3):248-251.
[28]林世青,许春辉,张其德.叶绿素荧光动力学在植物抗性生理、生态学和农业现代化中的应用[J].植物学通报,1992,9(1): 1-16.
Effect of exogenous Ca2+on photosynthesis ofNitraria tangutorumdur⁃ing salt stress
YAN Yongqing,GAOYanbo,LIU Wei,DUYuling,ZHAOYixiang(School of Horticulture,NortheastAgricultural University,Harbin 150030,China)
In order to investigate the regulating effect of calcium against salt tolerance of halophytes,Nitraria tangutorumwas used to study the effects of different concentrations exogenous calcium on the photosynthesis during salt stress.The results showed that application of appropriate calcium(≤15mmol·L-1),with NaCl concentration no higher than 300mmol·L-1,was able to increase the leaf relative water content and chlorophyll content,enhance net photosynthetic rate and stomatal conductance,reduce intercellular carbon dioxide concentration,as well as increasedmaximal photochemical efficiency,actual photochemical efficiency and photochemical quenching coefficient.The trend under these conditions increased with rising of calcium concentrations.However,high concentration of calcium(>15mmol·L-1)was shown to inhibit the photosynthetic ofNitraria tangutorum,affecting the normal photosynthetic activity.The results suggested that appropriate calcium,with NaCl concentration no higher than 300mmol·L-1,could effectivelymediate the photosynthesis ofNitraria tangutorum. With NaCl concentration higher than 300mmol·L-1,exogenous calcium was not obvious and high concentration calcium was even shown to inhibit photosynthesis.
salt stress;calcium;photosynthesis;Nitraria tangutorum
S793.9;Q945.78
A
1005-9369(2016)04-0057-08
2015-11-03
黑龙江省自然科学基金项目(C201427);东北农业大学科技人才启动基金项目(2012RCB63)
闫永庆(1966-),男,教授,博士,硕士生导师,研究方向为园林植物逆境生理生态。E-mail:yanyongqing1966@163.com
