聚乙烯醇复合富血小板纤维蛋白创伤敷料体外细胞毒性测定
2016-09-21许方方戴太强徐海燕
许方方,戴太强,徐海燕,安 然,刘 斌
聚乙烯醇复合富血小板纤维蛋白创伤敷料体外细胞毒性测定
许方方,戴太强,徐海燕,安然,刘斌
目的检测聚乙烯醇复合富血小板纤维蛋白(PVA/PRF)创伤敷料的细胞毒性。方法制作PVA/PRF创伤敷料,利用小鼠成纤维细胞(L929)与不同浓度敷料浸提液共培养和直接黏附于敷料,通过MTT测定其相对增殖率;扫描电镜和荧光显微镜观察细胞形态。结果各浓度实验组细胞生长形态良好;细胞紧密地黏附于敷料上,形态正常,细胞毒性评价为0~1级。结论PVA/PRF创伤敷料无细胞毒性。
聚乙烯醇;富血小板纤维蛋白;敷料;细胞毒性
皮肤位于人体表面,平时多因运动损伤、交通事故;战争中多因刀枪伤和火器伤造成皮肤缺损性破坏和连续性破坏,必须及时进行闭合修复。敷料是能够起到暂时保护伤口、防止感染、促使愈合的医用材料,是不可或缺的一种皮肤替代物。运用生物材料与工程材料的复合而产生的新一代创伤敷料——复合敷料,是目前创伤敷料发展的趋势[1-2]。本研究通过MTT检测实验和细胞黏附实验,检测聚乙烯醇(PVA)和富血小板纤维蛋白(PRF)两种材料复合制作的PVA/PRF创伤敷料(已获得国家实用新型专利)对L929细胞活性的影响,评价其生物安全性,为此敷料下一步研究提供理论依据。
1 材料与方法
1.1主要材料与设备聚乙烯醇 (国药集团化学试剂有限公司,聚合度=1750±50,纯度≥99.0%);小鼠成纤维细胞株L-929细胞系 (第四军医大学口腔医学院生物教研室);DMEM培养基(Hyclone,USA);胎牛血清(杭州四季青公司);MTT(Sigma);酶标仪(Multiskan MK3,USA);波形丝蛋白抗体(Abcam,USA);羊抗鼠IgG/FITC标记(北京中彬金桥);新西兰兔(第四军医大学实验动物中心);冷冻干燥机(VirTis,USA);倒置显微镜(Olympus IX70-121,Japan),倒置荧光显微镜(Olympus IX71,Japan);扫描电镜(S-4800,日本)。
1.2实验方法
1.2.1PRF微粒的制备取兔耳中央动脉血10 ml,放入10 ml离心管中,3000 r/min离心10 min;离心后中层的淡黄色凝胶即是PRF,无菌镊子取出,冷冻干燥24h后,取出研磨,200目的不锈钢筛网过滤,进行微粒化。
1.2.2PVA/PRF创伤敷料的制备(1)分别取0.25、0.5、0.75、1 g的PRF微粒,放入10 ml的纯水中,在室温条件下,磁力搅拌1h,得到PRF微粒的悬浮液。(2)取10 g PVA颗粒,放入90 ml的纯水中,在磁力搅拌器上,在90℃下磁力搅拌3h,得到PVA的清亮液体。(3)将PVA液体冷却至室温,在磁力搅拌下,把PRF悬浮液缓慢加入,直至充分混匀成10%PVA含不同量的PRF微粒的混合液。取0.5 ml上述PVA/PRF混合液,加入模具内,置于-20℃下24h,室温下复融24h,即得到PVA/PRF水凝胶创伤敷料。
1.2.3PVA/PRF创伤敷料浸提液制备[3]上述制作的PVA/PRF创伤敷料,在紫外灯下消毒30 min,加入含有血清的培养液,细胞培养箱中放置24h后,浸提液经过0.22 mm滤器过滤,即可。
1.2.4MTT检测敷料浸提液对细胞增殖活性影响[4]
将对数生长期的小鼠L929细胞以1×104个/ml细胞悬液接种于96孔培养板,每孔 200 μl。设阴性对照组 (细胞+完全培养液)、阳性组(细胞+5% DMSO)、实验组(细胞+不同浓度敷料的浸提液),每组设5个复孔。置细胞培养箱中24h后,弃去原培养液,各组分别加入相应的浸提液,继续培养。分别在2、4、6 d后,按MTT的常规步骤进行,在酶标仪490 nm波长下测定吸光度值(A490 nm),并计算其相对增殖率(RGR)。RGR=各实验组A490nm/阴性组A490nm× 100%。毒性分级标准见表1[3]。

表1 相对增殖率(%)与毒性对应关系??????? ??????????? ?? ????? ?? ?????? ?? ?????? ?? ?????? ?? ?????
1.2.5细胞黏附于PVA/PRF创伤敷料生长情况将敷料(PRF与PVA的质量体积比为0.5%)裁剪成一定大小的试样,放入96孔内,彻底干燥后,在紫外灯下消毒30 min,然后每孔加入200 μl的1× 105个/ml的L929细胞悬液,置于细胞培养箱中培养24h。(1)倒置显微镜下观察活细胞在敷料上生长状态;(2)荧光显微镜下观察细胞在敷料上的形态(一抗为波形丝蛋白,二抗为IgG/FITC标记,空白组为细胞直接黏附于96孔板上);(3)扫描电镜观察细胞在敷料上的形态 (空白组为细胞直接接种于栽玻片上)。
1.3统计学方法采用SPSS19统计软件进行统计分析,采用单因素方差分析对各实验组和阴性对照组的A490 nm均值进行统计学分析,假设检验水准α=0.05。
2 结果
2.1PVA/PRF创伤敷料浸提液对细胞活性的影响
不同浓度的浸提液、不同培养时间,实验组与阴性对照组的A490 nm均值均无统计学差异 (P>0.05,表2)。实验组细胞的增殖率>88%,细胞毒性分级为0~1级;阳性对照组细胞增殖率<49%,细胞毒性为3~4级。见表3。

表2 各组不同培养时间A490nm值检测结果(n=5)??? ???? ???? ???? ?????? ???????????? ???????????? ???????????? ?????? ???????????? ???????????? ???????????? ???? ???????????? ???????????? ???????????? ??????????????? ???????????? ???????????? ???????????? ?????????????? ???????????? ???????????? ???????????? ??????????????? ???????????? ???????????? ???????????? ???????????? ???????????? ???????????? ???????????? ?
2.2PVA/PRF创伤敷料对细胞形态的影响
2.2.1细胞培养72h后实验组细胞形态良好,可见扁平多角形细胞和短梭形细胞,与阴性对照组相似。阳性对照组则可见细胞皱缩、变圆,漂浮在培养液中。见图1。
2.2.2细胞黏附于敷料24h后(1)倒置显微镜观察:敷料与96孔板接触界面处(箭头处)可观察到细胞呈梭形、三角形(图2B),与空白组形态相似(图2A)。(2)荧光显微镜观察:敷料因其透明度的原因,使图像模糊,但细胞分布均匀,呈黄绿色荧光、外形清晰,呈梭形、三角形(图3B),与空白组无差异(图3A)。(3)扫描电镜观察:细胞和敷料同时呈现,细胞紧密地贴附于敷料上,细胞边界清晰(图4B),与细胞在载玻片的形态相似(图4A)。
3 讨论
敷料含有生长因子可以发挥主动修复作用,但是价格昂贵,且所含生长因子种类少、半衰期短、多为人工重组[5-7],而得不到广泛的应用。PVA是一种亲水的高分子聚合物,具有良好的成膜性、机械强度和生物相容性,并可以释放生长因子[8-11],已广泛应用于生物医药、食品工业。PRF是第2代血小板浓缩产品,现已证实其内富含多种生长因子[12]。目前,虽有大量的文献和临床证明PRF具有促进创伤愈合和组织再生的作用[13-17],但将其作为创伤敷料的还未见报道。本课题组已将PRF应用于多种组织再生的研究[18-20],并且获得两项涉及PRF的国家发明专利,为研制PRF创伤敷料奠定了基础。

表3 各组不同培养时间PGR值及毒性平价结果(n=5)???? ???? ???? ??? ???????????????????????????????????? ?????? ??????? ?? ??????? ?? ??????? ?? ?????? ?????? ?? ?????? ?? ?????? ?? ???? ?????? ?? ?????? ?? ?????? ?? ?????? ???????? ?????? ?? ??????? ?? ?????? ?? ?????? ??????? ??????? ?? ?????? ?? ?????? ?? ?????? ???????? ?????? ?? ?????? ?? ?????? ?? ?????? ????? ?????? ?? ?????? ?? ?????? ?? ?
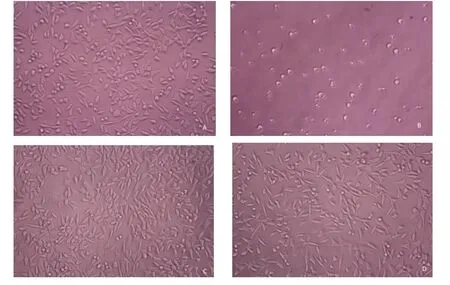
图1 各组细胞培养72h细胞照片(×200)
敷料由于直接与创口接触,必须具备良好的生物相容性[21]。通过MTT法检测敷料的浸提液对L929细胞活性的影响已得到国际标准化组织认可[4]。为了全面评价PVA/PRF敷料的细胞毒性,本研究设置了一定浓度梯度的敷料浸提液做MTT实验,结果表明,各组的敷料浸提液的细胞毒性为0~1级。通过倒置显微镜、荧光显微镜、扫描电镜观察L929细胞直接在敷料表面生长的形态,均显示细胞形态正常,符合生物材料应用的标准。
综上所述,本课题组新研发的PVA/PRF创伤敷料具有良好的生物相容性,为进一步动物皮肤创伤实验研究奠定了坚实基础。

图2 倒置显微镜观察细胞黏附于敷料表面(×100)

图3 荧光显微镜观察细胞黏附于敷料表面(×200)

图4 扫描电镜观察细胞黏附于敷料表面(×1000)
[1]Gonzalez JS,Luduena LN,Ponce A,et al.Poly(vinyl alcohol)/ cellulose nanowhiskers nanocompositehydrogels for potential wound dressings[J].Mater Sci Eng C Mater Biol Appl,2014,34: 54-61.
[2]Amin MA,Abdel-Raheem IT.Accelerated woundhealing and anti-inflammatory effects of physically cross linked polyvinyl alcohol-chitosanhydrogel containinghoney bee venom in diabetic rats[J].Arch Pharm Res,2014,37(8):1016-1031.
[3]黄经春,由少华,朱雪涛,等.医疗器械生物学评价 第12部分:样品制备与参照样品 GB/T 16886.12-2005/ISO 10993-12; 2002[M].北京:中国标准出版社,2005.
[4]由少华,朱雪涛,刘欣,等.医用输液、输血、注射器具检验方法第2部分:生物试验方法 GB/T 14233.2-2005[M].北京:中国标准出版社,2005.
[5]Ulubayram K,Nur CA,Korkusuz P,et al.EGF containing gelatin-based wound dressings[J].Biomaterials,2001,22(11): 1345-1356.
[6]Losi P,Briganti E,Errico C,et al.Fibrin-based scaffold incorporating VEGF-and bFGF-loaded nanoparticles stimulates woundhealing in diabetic mice[J].Acta Biomater,2013,9(8): 7814-7821.
[7]Mohandas A,Anisha BS,Chennazhi KP,et al.Chitosanhyaluronic acid/VEGF loaded fibrin nanoparticles composite sponges for enhancing angiogenesis in wounds[J].Colloids Surf B Biointerfaces,2015,127:105-113.
[8]JolantaStaskoMKAD.Poly(vinylalcohol)hydrogels[J]. Proceedings of the Estonian Academy of Sciences,2009,58(1): 63-66.
[9]Mongia NK,Anseth KS,Peppas NA.Mucoadhesive poly(vinyl alcohol)hydrogelsproducedbyfreezing/thawingprocesses: applications in the development of woundhealing systems[J].J Biomater Sci Polym Ed,1996,7(12):1055-1064.
[10]Bourke SL,Al-Khalili M,Briggs T,et al.A photo-crosslinked poly(vinyl alcohol)hydrogel growth factor release vehicle for woundhealing applications[J].AAPS PharmSci,2003,5(4):E33.
[11]Stasko J,Kalnin觢M,Dzene A,et al.Poly(vinyl alcohol)hydrogels[J].Proceedings of the Estonian Academy of Sciences, 2009,58(1):63-66.
[12]Dohan DM,Choukroun J,Diss A,et al.Platelet-rich fibrin(PRF): a second-generation platelet concentrate.PartⅡ:platelet-related biologic features[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2006,101(3):e45-e50.
[13]Mohanty S,Pathakh,Dabas J.Platelet rich fibrin:a new covering material for oral mucosal defects[J].J Oral Biol Craniofac Res,2014,4(2):144-146.
[14]Yuanzheng C,Yan G,Ting L,et al.Enhancement of the repair of dog alveolar cleft by autologous iliac bone,bone marrow-derived mesenchymal stem cells and platelet-rich fibrin mixture[J].Plast Reconstr Surg,2015,135(5):1405-1412.
[15]Mathur A,Bains VK,Gupta V,et al.Evaluation of intrabony defects treated with platelet-rich fibrin or autogenous bone graft: a comparative analysis[J].Eur J Dent,2015,9(1):100-108.
[16]ZhaoJH,TsaiCH,ChangYC.Clinicalapplicationof platelet-rich fibrin as the sole grafting material in maxillary sinus augmentation[J].J Formos Med Assoc,2015,http://dx.org/10.1016/ j.jfma.2015.02.009
[17]Yuanzheng C,Yan G,Ting L,et al.Enhancement of the repair of dogalveolarcleftbyanautologousiliacbone,bone marrow-derived mesenchymal stem cell,and platelet-rich fibrin mixture[J].Plast Reconstr Surg,2015,135(5):1405-1412.
[18]Liu B,Tan XY,Liu YP,et al.The adjuvant use of stromal vascular fraction and platelet-rich fibrin for autologous adipose tissue transplantation[J].Tissue Eng Part C Methods,2013,19(1): 1-14.
[19]杨勇,杨涛,刘斌,等.自体ADSCs复合PRF修复家兔耳软骨缺损的实验研究[J].现代生物医学进展,2013(12):2210-2214.
[20]王之发.基于细胞膜片技术复合富血小板纤维蛋白(PRF)构建可注射的组织工程骨的实验研究 [D].西安:第四军医大学, 2013.
[21]Harmand MF.In vitro study of biodegradation of a Co-Cr alloy using ahuman cell culture model[J].J Biomater Sci Polym Ed, 1995,6(9):809-814.
Cytotoxicity assay of polyvinyl alcohol/platelet-rich fibrin wound dressing in vitro
Xu Fangfang1,Dai Taiqiang1,Xuhaiyan2,An Ran2,Liu Bin21.State Key Laboratory of Military Stomatology,Department of Dentofacial Surgery;2.State Key Laboratory of Military Stomatology,Laboratory Animal Center,Dentalhospital of the Fourth Military Medical University,Xi'an,Shaanxi,710032,China
ObjectiveTo detect the cytotoxicity of polyvinyl alcohol/platelet-rich fibrin(PVA/PRF)wound dressing.Methods PVA/PRF wound dressing was prepared and co-cultured through L929 cells and dressing leaching liquor of different concentration. The relative growth rate was detected by MTT assay.Scanning electron microscope and fluorescence microscope were used to observe the cellular shapes.ResultsCell growth forms were in good condition in the groups of different concentration.L929 cells tightly adhered to the material with normal shape.The toxicity gradation of all the experimental groups was 0-1.ConclusionPVA/PRFhas no cytotoxicity.
polyvinyl alcohol;platelet-rich fibrin;dressing;cytotoxicity
Q813.1/R558.9
A
1004-0188(2016)01-0007-05
10.3969/j.issn.1004-0188.2016.01.003
国家自然科学基金资助课题(31170942)
710032西安,第四军医大学口腔医院颌面外科军事口腔医学国家重点实验室(许方方,戴太强),第四军医大学口腔医院实验动物中心军事口腔医学国家重点实验室(徐海燕,安然,刘斌)
刘斌,E-mail:kqyljd_liu@126.com
(2015-07-06)
