血清降钙素原与B型钠尿肽水平对危重患者医院获得性肺炎诊断与预后价值分析
2016-09-20何艳凛邢亚威陈俊卓刘志广杨兴肖孔洁羽
刘 晓, 何艳凛, 邢亚威, 王 媛, 陈俊卓, 刘志广, 杨兴肖, 孔洁羽
血清降钙素原与B型钠尿肽水平对危重患者医院获得性肺炎诊断与预后价值分析
刘 晓, 何艳凛, 邢亚威, 王 媛, 陈俊卓, 刘志广, 杨兴肖, 孔洁羽
目的 通过前瞻性分析,探讨危重患者血清降钙素原(PCT)及B型钠尿肽(BNP)动态变化水平在医院获得性肺炎(HAP)诊断及预后中的价值。方法 收集72例重症监护病房(ICU)发生HAP的患者,另选30例ICU内安全度过围手术期患者作为对照。于确诊HAP当天、第2、第3和第7天检测HAP患者PCT与BNP值,与对照组进行比较,评估2种指标的诊断价值;并根据28 d随访的生存情况将HAP患者分为死亡组(19例)与生存组(53例),比较2种指标的动态变化,评估其对预后的预测价值。结果 HAP组初始PCT与BNP值均高于对照组(P<0.05),对HAP诊断的受试者工作特征(ROC)曲线曲线下面积(AUC)分别为0.627±0.059(95%CI:0.511~0.742,P=0.045)与0.894±0.030(95%CI:0.835~0.954,P=0.000),灵敏度、特异度、阳性预测值、阴性预测值分别为PCT:65.3%、66.7%、82.5%、44.5%;BNP:72.2%、93.3%、96.3%、58.3%。生存组与死亡组PCT、BNP值确诊当天、第2天差异无统计学意义,但第3、第7天比较差异有统计学意义(P<0.05)。PCT与BNP的动态变化(ΔPCT、ΔBNP)与ICU住院天数无相关性(P>0.05),对预后预测的AUC分别为0.804±0.065(95%CI:0.605~0.861,P=0.003)与0.733±0.065(95%CI:0.677~0.932,P=0.000),灵敏度、特异度、阳性预测值、阴性预测值分别为ΔPCT:77.4%、78.9%、56.8%、90.7%;ΔBNP:75.5%、68.4%、46.1%、88.6%。结论 动态监测PCT与BNP的变化对危重患者HAP的发生及预后预测有一定作用,但价值有限。
降钙素原; B型钠尿肽; 医院获得性肺炎; 受试者工作特征曲线
医院获得性肺炎(HAP)是最常见的医院感染类型之一。重症监护病房(ICU)患者近90%在机械通气过程中发生HAP,不仅延长患者住院时间,而且严重影响预后[1-2]。鉴于HAP的早期诊断仍缺乏特异性,对病情变化的评估存在较大困难,大量研究试图探索新型生物学标志物协助解决上述难题[3-4]。
降钙素原(PCT) 是一种无激素活性的降钙素的前肽物质,当机体在炎性刺激下可由多种器官和细胞分泌产生,尤其在细菌感染的情况下。因此,PCT多用于细菌感染的早期诊断并可指导抗生素的应用。B型钠尿肽(BNP)又称脑钠素,主要由心室肌细胞受到压力和(或)容量负荷引起的室壁张力改变的刺激后分泌释放入血,是公认的心脏疾病标志物,但多种非心源性因素也影响其水平。据文献报道,严重感染或重度脓毒症时BNP水平升高[5-6],不仅如此,有关BNP与预后相关性的研究发现BNP水平为预测社区获得性肺炎(CAP)死亡及治疗失败的独立预后因素[7],但涉及HAP的变化目前研究仍较少。为探讨PCT和BNP水平在HAP患者中的早期诊断、动态变化及相互关系,本研究前瞻性分析危重HAP患者临床资料,以阐述两者的临床应用价值。
1 材料与方法
1.1研究对象
选取2014年3月—2015年2月我院ICU住院患者,纳入标准:①年龄≥18岁;②新入ICU并预计ICU住院时间超过1周;③重症患者,包括≥1个器官功能衰竭。排除多发伤、严重烧伤、心源性休克、多脏器功能障碍综合征、心肺复苏术、心力衰竭、心功能Ⅳ级、慢性肾功能不全与血液透析等可能引起PCT或BNP升高的情况。采用美国胸科学会与美国感染病学会推荐的HAP诊断方法[8]。
1.2方法
1.2.1HAP诊断标准 入院>48 h的患者,①新近出现的咳嗽、咯痰或原有呼吸道疾病症状加重,并出现脓性痰,伴或不伴胸痛;②发热;③肺实变体征和(或)闻及湿性啰音;④外周血白细胞计数>10.0×109/L或<4.0×109/L ,伴或不伴细胞核左移;⑤胸部X线检查显示肺片状、斑片状浸润阴影或间质性改变,伴或不伴胸腔积液。并除外肺结核、肺部肿瘤、非感染性肺间质性疾病、肺水肿、肺不张、肺栓塞、肺嗜酸性粒细胞浸润症及肺血管炎等后,可建立诊断。肺内出现浸润影是必要条件,无论有无微生物证据[9]。
1.2.2研究方法 采用前瞻性队列研究。收集ICU确诊HAP患者72例,其中男58例,女14例;年龄(68±13)岁。另选ICU内安全度过围手术期患者30例作为对照组,其中男20例,女10例;年龄(63±14)岁。两组年龄、性别差异无统计学意义(P值均>0.05)。HAP组分别于确诊当天、第2、第3和第7天检测PCT及BNP水平,并分别计算两种指标的变化率ΔPCT与ΔBNP。ΔPCT(或ΔBNP)=[确诊当天PCT(或BNP)值-第7 天PCT(或BNP)值] / 确诊当天PCT(或BNP)值。确诊当天PCT、BNP值为初始值。对照组仅于入院当天检测PCT及BNP水平。监测并随访28 d后,根据患者转归情况分为生存组与死亡组。
1.2.3PCT及BNP测定方法 血清PCT测定采用电化学发光法,使用德国罗氏电化学发光免疫分析仪Cobas 6000,试剂盒为罗氏公司产品。BNP采用荧光免疫法检测,使用Triage BNP诊断仪(美国Biosite公司)。
1.2.4统计学方法 采用SPSS13.0统计软件进行统计分析,数据采用中位数(四分位数间距)[M(QL,QU)]或均数±标准误(±)表示,组间比较采用独立样本Mann-Whitney U检验或Kruskal-Wallis H检验,相关关系采用Kendall秩相关分析,描绘受试者工作特征曲线(ROC曲线)并计算曲线下面积(AUC),应用Medcalc软件计算AUC的预测效能,PCT与BNP动态变化曲线图采用GraphPad Prism 5绘制。以P<0.05为差异有统计学意义。
2 结果
2.1HAP组与对照组初始PCT与BNP值比较
HAP组初始PCT与BNP值较对照组明显升高(P值分别为0.045和0.000)。相关分析显示HAP患者初始PCT与BNP值均与APACHE Ⅱ评分呈正相关(P值分别为0.003与0.001),相关系数r分别为0.207与0.228。
2.2初始PCT与BNP值对HAP的诊断价值
初始PCT值对HAP诊断价值的ROC曲线AUC为0.627±0.059(95%CI:0.511~0.742,P= 0.045),根据约登指数最大原则选取最佳截点为0.319,此时PCT为1.87 ng/mL,对HAP发生预测的灵敏度为65.3%,特异度为66.7%,阳性预测值为82.5%,阴性预测值为44.5%。
初始BNP值对HAP诊断价值的AUC 为 0.894± 0.030(95%CI:0.835~0.954,P=0.000),最佳截点为0.656,此时BNP为214.81 pg/mL,对HAP发生预测的灵敏度为72.2%,特异度为93.3%,阳性预测值为96.3%,阴性预测值为58.3%,见图1。
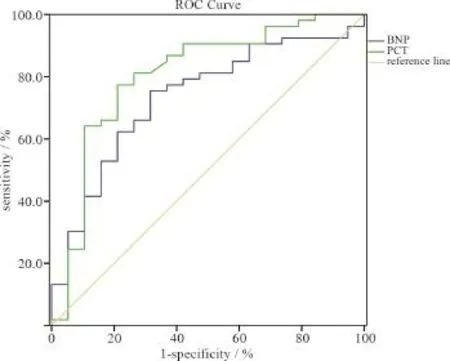
图1 初始PCT与BNP值对HAP诊断的ROC曲线Figure 1 The receiver operating characteristic curves of initial procalcitonin and B-type natriuretic peptide levels for prediction of hospital-acquired pneumonia
2.3生存组与死亡组不同时段PCT、BNP动态变化分析

表1 生存组与死亡组PCT、BNP各时段变化Table 1 The changes of procalcitonin and B-type natriuretic peptide levels in survivors compared with those in non-survivors over time [M(QL, QU)]
监测并随访28 d后,72例HAP患者生存53例,死亡19例。生存组与死亡组PCT及BNP各时段水平变化见表1。生存组与死亡组确诊当天与第2天PCT、BNP差异均无统计学意义,第3天与第7天差异均有统计学意义。根据各时段PCT动态变化图显示,生存组PCT值逐渐下降,至第7天降至最低值,而死亡组于确诊后第2天上升至最高值,之后虽然持续下降,但下降趋势平缓,至第7天仍保持在较高水平,见图2。生存组各时段BNP变化平缓,死亡组BNP持续上升,第3天升至最高值,至第7天仍无明显下降趋势,见图3。

图2 生存组与死亡组不同时段PCT的动态变化Figure 2 Change of procalcitonin level between survivor group and non-survivor group over time

图3 生存组与死亡组不同时段BNP的动态变化Figure 3 Change of B-type natriuretic peptide level between survivor group and non-survivor group over time
2.4生存组与死亡组ΔPCT、ΔBNP比较
生存组与死亡组ΔPCT分别为0.87(0.61,0.95)、-0.13(-1.13,0.56);ΔBNP分别为0.45(0.05,0.65)、-0.17(-1.12,0.39)。两组相比,Z值分别为-3.916与-2.996,差异均有统计学意义(P值分别为0.000与0.003)。
2.4.1ΔPCT、ΔBNP与ICU住院天数的关系 相关性分析显示,ΔPCT、ΔBNP与ICU住院天数不存在相关关系(P值分别为0.134与0.326)。
2.4.2ΔPCT、ΔBNP对HAP患者预后评估ROC曲线分析 ΔPCT对HAP预后评估的AUC为0.804± 0.065(95%CI:0.605~0.861,P=0.003),最佳截点为0.563,灵敏度为77.4%,特异度为78.9%,阳性预测值为56.8%,阴性预测值为90.7%。
ΔBNP对HAP预后评估的AUC为0.733±0.065 (95%CI:0.677~0.932,P=0.000),最佳截点为0.439,灵敏度为75.5%,特异度为68.4%,阳性预测值为46.1%,阴性预测值为88.6%,见图4。
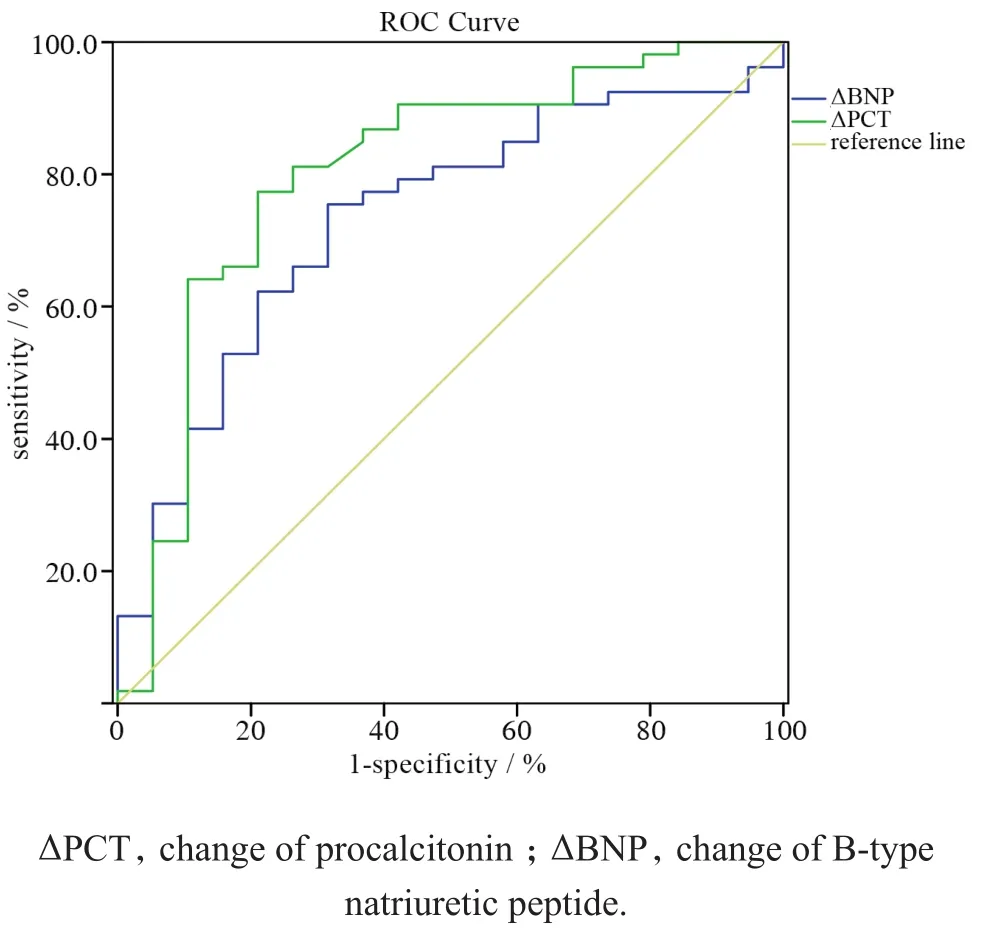
图4 ΔPCT、ΔBNP对HAP患者预后评估的ROC曲线Figure 4 The receiver operating characteristic curves of ΔPCT and ΔBNP for estimating the prognosis of hospital-acquired pneumonia in critically ill patients.
3 讨论
PCT作为炎性反应的指标,在感染早期即迅速增高,且半衰期较长,鉴于其对细菌感染的高度敏感性,目前多用于指导感染性疾病的诊断与抗菌药物的使用[10-12],对为患者提供及时准确的治疗具有重要意义。但目前有关PCT与HAP相关性的研究较少,DUFLO等[13]首次观察了血清中PCT对呼吸机相关肺炎(VAP)的诊断价值,结果显示VAP患者血清PCT浓度明显高于非VAP患者,VAP诊断的灵敏度为41%,特异度为100%,对VAP预后的灵敏度为74%,特异度为75%,可以作为早期诊断与预测预后的参考标志。
然而,ICU患者往往存在其他导致全身炎性反应的原因,如外科手术、急性呼吸窘迫综合征及其他部位的感染等,均可影响PCT水平,此外,患者的免疫功能状态也是影响PCT的重要因素。因此,PCT的诊断预后价值往往存在争议。如有关诊断方面TORRES等[14]在探讨PCT作为CAP的生物标志价值的研究中指出,PCT尽管可以指导抗菌药物治疗,但对CAP的诊断价值有限。预后方面的研究如PARK等[15]对126例CAP患者预后的研究结果显示,死亡组的PCT水平(1.96 ng/mL)显著高于生存组(0.18 ng/mL),病情严重者,平均PCT水平显著升高,ROC曲线AUC为0.828(95%CI 0.750~0.889),提示PCT是急诊科CAP患者预测死亡和严重程度的工具。而与之相反,UGAJIN等[16]开展的一项半定量PCT水平预测价值的回顾性研究,纳入213例CAP患者,结果显示不同半定量PCT水平的患者死亡率无显著差异。
BNP是公认的心力衰竭的诊断指标[17-18],对于鉴别急性呼吸困难是否为心源性原因有重要意义。除此之外,有研究表明BNP与脓毒症严重程度正相关,可用于严重烧伤脓毒症的预后评估[19]。PERMAN等[6]对825例患者开展的队列研究结果显示,BNP对72 h内发生重度脓毒症、感染性休克及死亡的预测AUC为0.69,当BNP>49 pg/mL时,3种结局发生风险显著升高(P值均=0.000 1),预测的灵敏度、特异度、阳性预测值、阴性预测值分别为63%(95%CI:58%~67%)、69%(95%CI:65%~73%)、69%(95%CI:65%~74%)、63% (95%CI:58%~67%),说明BNP与脓毒症预后相关,但预测价值有限。CHRIST-CRAIN等[7]探讨BNP在CAP风险分层中的应用,BNP随肺炎严重度指数(PSI)升高而显著上升(P=0.015),死亡患者BNP显著高于生存患者[439.2( 137.1,1 384.6)pg/mL对 114.3( 51.3,359.6) pg/mL, P<0.001],对预后预测的AUC为0.75,而联合PSI时,对预后的预测准确性可提高为0.78。李京等[20]得出相似的结果,并指出BNP>125.0 pg/mL的CAP患者应住院治疗,BNP >299.0 pg/mL的CAP患者则具有死亡高风险。说明BNP预测CAP严重程度具有一定实用性。
本研究结果显示HAP组确诊当天PCT与BNP均显著高于对照组,初始PCT值诊断HAP 的AUC为0.627,灵敏度、特异度仅为65.3%与66.7%,预测准确性均欠佳,价值有限。而初始BNP值的诊断AUC为0.894,敏感度、特异度分别为72.2%与93.3%,阳性预测值高达96.3%,两者相比,初始BNP对于预测HAP发生更为准确,当初始BNP>214.81 pg/mL时,患者发生HAP的风险升高。
鉴于初始PCT与BNP值对于预后预测的争议性,加之感染的进展是一个动态的过程,因此监测两指标的动态变化可能更有助于预后的判断。CHRIST-CRAIN等[21]发现在某些非感染情况下PCT水平可能升高,而在局限性感染的情况下反而水平低下。这种情况反映了随访的重要性,因为对于这类患者,PCT水平在随访期间可能会逐渐升高。HILLAS等[22]研究也发现PCT水平不能预测CAP患者的预后,而1周之内PCT水平的变化可以预测患者的预后。本研究监测确诊当天、第2天、第3天和第7天PCT与BNP的变化情况,并计算ΔPCT、ΔBNP,结果显示初始PCT与BNP值均与预后无关(P值均>0.05);在监测过程中死亡组无论PCT抑或BNP均无明显下降趋势,甚至后期PCT、BNP水平大于初始而使ΔPCT、ΔBNP出现负数的情况,说明炎性反应持续或增强,生存组则呈明显下降趋势。因此,初始的高水平并不意味着HAP患者必然预后不良,其动态变化程度比绝对值更有意义[23]。随病情变化或治疗进展,患者出现PCT或BNP仅有小幅下降、持续高水平或下降后大幅升高时,说明感染控制不佳或进展,病情严重出现反复,或治疗不当,此类患者常伴随死亡高风险,应引起临床医师高度重视。研究结果还显示ΔPCT与ΔBNP与ICU住院天数无明显相关性,且两者对预后的评估AUC分别为0.804与0.733,灵敏度与特异度在65%~80%,评估效能中等。因为ICU患者住院天数及预后受医院综合技术水平、病情进展程度、感染控制水平、后续治疗方案以及床位周转率制约,单独某因素难以在住院天数方面起决定作用,应重视诊治能力的综合提升、加强环节管理、积极防治医院感染及并发症,缩短ICU住院天数,提高生存率。
综上所述,PCT与BNP作为新型炎性反应生物标志物,与危重患者病情危重程度轻度相关,其动态变化可以反映病情进展,对HAP的发生及预后预测有一定作用,但价值有限,在临床实践中需要结合患者的临床特征、病原学送检结果以及其他辅助检查结果进行合理判断并给予相应治疗。
[1]ESPIRATTI M, FERRER M, THEESSEN A, et al. Nosocomial pneumonia in the intensive care unit acquired during mechanical ventilation or not[J]. Am J Respir Crit Care Med, 2010,182 (12):1533-1539.
[2]BURGMANN H, HIESMAYR JM, SAVEY A, et al. Impact of nosocomial infections on clinical outcome and resource consumption in critically ill patients[J]. Intensive Care Med,2010,36(9):1597-1601.
[3]Canadian Critical Care Trials Group. A randomized trial of diagnostic techniques for ventilator-associated pneumonia[J]. N Engl J Med,2006,355(25):2619-2630.
[4]GIBOT S, CRAVOISY A, LEVY B, et al. Soluble triggering receptor expressed on myeloid cells and the diagnosis of pneumonia[J]. N Engl J Med,2004,350(5):451-458.
[5]NIKOLAOU NI, GORITSAS C, DEDE M,et al. Brain natriuretic peptide increases in septic patients without severe sepsis or shock[J]. Eur J Intern Med, 2007,18(7):535-541.
[6]PERMAN SM, CHANG AM, HOLLANDER JE,et al. Relationship between B-type natriuretic peptide and adverse outcome in patients with clinical evidence of sepsis presenting to the emergency department[J]. Acad Emerg Med, 2011,18(2):219-222.
[7]CHRIST-CRAIN M, BREIDTHARDT T, STOLZ D,et al. Use of B-type natriuretic peptide in the risk stratification of community-acquired pneumonia[J]. J Intern Med,2008,264(2):166-176.
[8]American Thoracic Society; Infectious Diseases Society of America. Guidelines for the management of adults with hospitalacquired, ventilator-associated, and healthcare-associated pneumonia[J]. Am J Respir Crit Care Med, 2005,171(4):388-416.
[9]MANDELL LA, WUNDERINK RG, ANZUETO A, et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults[J]. Clin Infect Dis,2007,44( Suppl 2):s27-s72.
[10]LINDSTROM ST, WONG EK. Procalcitonin, a valuable biomarker assisting clinical decision-making in the management of community-acquired pneumonia[J]. Intern Med J,2014,44 (4):390-397.
[11]JULIÁN-JIMÉNEZ A, TIMÓN ZAPATA J, LASERNA MENDIETA EJ, et al. Diagnostic and prognostic power of biomarkers to improve the management of community acquired pneumoniain the emergency department [J]. Enferm Infecc Microbiol Clin, 2014,32(4):225-235.
[12]降钙素原急诊临床应用专家共识组.降钙素原(PCT)急诊临床应用的专家共识[J].中华急诊医学杂志,2012,21(9):944-951.
[13]DUFLO F, DEBON R, MONNERET G, et al. Alveolar and serum procalcitonin: diagnosis and prognostic value in ventilator-associated pneumonia[J]. Anesthesiology, 2002,96 (1):74-79.
[14]TORRES A, RAMIREZ P, MONTULL B, et al. Biomarkers and community-acquired pneumonia: tailoring management with biological data[J]. Semin Respir Crit Care Med,2012,33 (3):266-271.
[15]PARK JH, WEE JH, CHOI SP, et al. The value of procalcitonin level in community-acquired pneumonia in the ED[J]. Am J Emerg Med,2012,30(7):1248-1254.
[16]UGAJIN M, YAMAKI K, HIRASAWA N, et al. Predictive values of semi-quantitative procalcitonin test and common biomarkers for the clinical outcomes of community-acquired pneumonia[J]. Respir Care, 2014,59(4):564-573.
[17]赖丽仁,王臻,童朝晖.B型钠尿肽与机械通气的撤离[J].中华结核和呼吸杂志,2013,36(2):113-114.
[18]林笑女,姜晓霞,程青虹,等.脓毒症患者左心室舒缩功能的变化及B型钠尿肽诊断价值的探讨[J].中华医学杂志,2014,94(11):816-820.
[19]ZU H, LI Q, HUANG P,et al. Therapeutic value of blood purification and prognostic utilities of early serum procalcitonin,C reactive protein, and brain natriuretic peptide levels in severely burned patients with sepsis[J]. Cell Biochem Biophys,2015,72(1):259-263.
[20]李京,叶寰,赵丽.B型钠尿肽预测社区获得性肺炎严重程度的意义[J].中华急诊医学杂志,2014,23(10):1132-1137.
[21]CHRIST-CRAIN M, MüLLER B. Procalcitonin and pneumonia: is it a useful marker?[J]. Curr Infect Dis Rep, 2007,9(3):233-240.
[22]HILLAS G,VASSILAKOPOULOS T,PLANTZA P, et a1. C-reactive protein and procalcitonin aspredietors of survival and septic shock in ventilator-associated pneumonia[J]. Eur Respir J,2010,35(4):805-811.
[23]周炯,马小军.感染性疾病的病原学诊断与常见误区[J].中华内科杂志,2014,53(12):933-937.
Value of serum procalcitonin and B-type natriuretic peptide in diagnosis and predicting prognosis of hospital-acquired pneumonia in critically ill patients
LIU Xiao, HE Yanlin, XING Yawei, WANG Yuan, CHEN Junzhuo, LIU Zhiguang, YANG Xingxiao, KONG Jieyu. (Department of Hospital Infection Management, the Fourth Hospital of Hebei Medical University,Shijiazhuang 050011, China)
Objective To examine the value of serum procalcitonin (PCT) and B-type natriuretic peptide (BNP) in diagnosis and prognosis evaluation of hospital-acquired pneumonia (HAP) in critically ill patients prospectively. Methods A total of 72 critically ill HAP patients were enrolled in intensive care unit (ICU). Another 30 patients surviving the perioperative period in ICU were taken as control. Serum levels of PCT and BNP were determined on days 1, 2, 3 and 7 after HAP diagnosis and compared with control group. The value of the two indicators for diagnosis of HAP was analyzed by the area under receiver operating characteristic (ROC)curve (AUC). The HAP patients were assigned to survivor group (n=53) or non-survivor group (n=19) based on 28-day survival state after diagnosis. Dynamic change of PCT and BNP levels (ΔPCT, ΔBNP) was compared between two groups to assess the value of PCT and BNP change in predicting the prognosis of HAP. Results The initial PCT and BNP levels in HAP group were significantly higher than those in control group (P < 0.05). The AUC of PCT and BNP were 0.627±0.059 (95% CI:0.511-0.742, P=0.045), 0.894±0.030 (95% CI: 0.835-0.954,P=0.000), respectively. The sensitivity, specificity, positive predictive value and negative predictive value of PCT were65.3%, 66.7%, 82.5% and 44.5%, respectively; and of BNP were 72.2%, 93.3%, 96.3% and 58.3%, respectively. During the first two days after diagnosis, no significant difference was found beween survivor group and non-survivor group in terms of serum PCT or BNP level, but significant difference was found on Days 3 and 7 (P<0.05). There was no significant correlation beween ΔPCT or ΔBNP and ICU stay (P>0.05). The AUC of ΔPCT and ΔBNP was 0.804±0.065 (95% CI: 0.605-0.861, P=0.003) and 0.733±0.065 (95% CI: 0.677-0.932, P=0.000), respectively. The sensitivity, specificity, positive predictive value and negative predictive value of ΔPCT were 77.4%, 78.9%, 56.8% and 90.7%, respectively; and of ΔBNP were 75.5%, 68.4%, 46.1% and 88.6%, respectively. Conclusions Monitoring of the dynamic change of serum PCT and BNP levels only provides limited utility in diagnosis and prognosis evaluation of HAP in critically ill patients.
procalcitonin; B-type natriuretic peptide; hospital-acquired pneumonia; receiver operating characteristic curve
·论著·
R563.1
A
1009-7708(2016)01-0005-06
10.16718/j.1009-7708.2016.01.002
河北省重点科技支撑项目(132777166)。
河北医科大学第四医院感染管理科,石家庄 050011。
刘晓(1982—),女,硕士,主治医师,主要从事医院感染防控领域的研究。
刘晓,E-mail: liuxiao0121@126.com。
2015-05-06
2015-05-29
