江南卷柏Phi类谷胱甘肽S-转移酶的分子特性
2016-09-19张元杰杨志灵杨海灵
张元杰,杨志灵,杨海灵
江南卷柏Phi类谷胱甘肽-转移酶的分子特性
张元杰,杨志灵,杨海灵
北京林业大学 生物科学与技术学院,北京 100083
谷胱甘肽-转移酶 (Glutathione-transferase, GST) 在帮助植物抵抗各种胁迫中发挥重要作用。该研究从江南卷柏中克隆到两个Phi类GST基因,分别命名为和,两个基因均编码215个氨基酸残基的蛋白质。表达模式分析发现,这两个基因在江南卷柏根、茎和叶中均有表达。将这两个基因在大肠杆菌中诱导表达重组蛋白并纯化,酶学性质分析表明SmGSTF1和SmGSTF2对CDNB、NBD-Cl和NBC等3种底物都有活性。SmGSTF1对Fluorodifen和Cum-OOH也有活性,而SmGSTF2对它们没有活性。酶动力学分析表明SmGSTF1和SmGSTF2对GSH有较高的亲和力,而对CDNB的亲和力都相对较低。在不同pH及温度条件下对SmGSTF1和SmGSTF2重组蛋白进行活性测定,发现这两个蛋白在pH 7−8.5,45−55 ℃温度范围内有较高的催化活性。研究推测,SmGSTF1和SmGSTF2可能在江南卷柏的抗逆生理过程中有重要的作用。
江南卷柏,谷胱甘肽-转移酶,基因表达,酶学性质
蕨类植物起源于距今4亿年前,相比较苔藓植物,蕨类植物孢子体内部有明显的维管组织的分化,因而在原始维管植物的进化中具有重要意义[1]。江南卷柏是蕨类植物的现存种之一,在中国广泛分布于长江流域和长江以南各地[2],是一种常用的具有清热活血作用的药用植物[3]。对其进行研究有助于理解蕨类植物适应更复杂陆地环境的作用机制。
谷胱甘肽-转移酶 (Glutathione-transferase,GST,EC 2.5.1.18) 是一类具有多种生理功能的蛋白质超家族,广泛存在于哺乳动物、植物、鸟类、昆虫、寄生虫及微生物体内。最早在20世纪70年代,就在玉米中发现了GST[4-6],随后植物GST的基因结构、进化分析、表达模式和生物学功能等得到了广泛的研究[7-10]。GST在生物体内主要参与植物的解毒代谢,它能催化外源或内源的亲电子化合物与还原型谷胱甘肽 (Reduced glutathione) 结合形成R-SG复合物,增加其亲水性,使其能够被转运出细胞膜,达到解毒的作用[4-6]。植物GST基因家族主要分为8个类型,分别是Tau、Phi、DHAR、Zeta、Theta、Lambda、TCHQD和EF1Bγ[11],其中Phi类GST是植物特有的类型。植物中Tau、Phi和Zeta类GST的晶体结构已得到解析,蛋白结构比较发现植物GST的三维结构都比较保守[12],但其负责与特异性底物结合的C末端区域结构变化较大,这也说明不同的GST能结合特定底物而发挥不同的生理功能[13]。Phi类GST对于植物抵抗逆境胁迫具有重要作用,例如,在拟南芥中过量表达一个Phi类GST基因能显著提高其植株对紫外线的抗性[14];在烟草中过量表达玉米的Phi类GST基因明显增强了植株对除草剂的抗性[15]。
先前已经有对苔藓植物 (如小立碗藓)、裸子植物 (如油松) 和被子植物 (如杨树) 中Phi类GST的研究[11,16-17],但缺乏对于蕨类植物中Phi类GST的相关研究。本研究从江南卷柏中克隆得到两个Phi类GST基因,对它们的系统发育、基因结构、基因表达模式,以及所编码蛋白的结构和生化活性进行了深入的研究,为揭示Phi类GST在植物响应环境胁迫中的作用机制奠定了基础。
1 材料与方法
1.1 材料
本研究所用的江南卷柏取自重庆缙云山,用于RNA的提取。
1.2 江南卷柏Phi类GST的鉴定
以已发表的小立碗藓Phi类GST蛋白序列为模板[17],在NCBI的江南卷柏基因组数据库中进行TBLASTN搜索,然后对搜索得到的序列进行保守结构域分析。
1.3 江南卷柏和基因的克隆
将江南卷柏植株洗净,取约50 mg新鲜叶片,按照植物总RNA提取试剂盒 (BioTeKe公司) 说明书提取江南卷柏叶的总RNA,然后用TaKaRa公司的反转录试剂盒将RNA反转录为cDNA。根据和基因序列,分别设计引物对SmGSTF1-EX1/EX2和 SmGSTF2-EX1/EX2,以江南卷柏叶cDNA为模板,用Q5高保真DNA聚合酶 (NEB公司) 进行PCR扩增,然后用1%的琼脂糖凝胶电泳检测PCR产物,用DNA快速纯化/回收试剂盒 (鼎国公司) 回收目的条带。纯化后的PCR片段连接到pEASY-Blunt载体 (全式金公司),并转化1-T1感受态细胞 (全式金公司)。在X-gal/IPTG Amp平板上挑取多个菌落,进行菌落PCR,并对阳性克隆进行测序。
1.4 Phi类GST系统发生关系分析
将SmGSTF1和SmGSTF2,以及其他植物Phi类GST蛋白序列通过Clustal X 1.83进行氨基酸序列比对,然后在BioEdit中进行手动校对。利用MEGA 5.0的neighbour-joining (NJ) 模型构建进化树,Bootstrap值为1 000。
1.5和的表达模式分析
使用植物总RNA 提取试剂盒 (BioTeKe公司) 提取江南卷柏根、茎和叶3个部位的RNA,然后将RNA用反转录试剂盒 (TaKaRa公司) 反转录成cDNA。设计引物SmGSTF1-SP1/SP2和SmGSTF2-SP1/SP2,分别以江南卷柏根、茎和叶的cDNA为模板,以江南卷柏基因为内参进行半定量RT-PCR,以研究和在不同组织的表达情况 (表1)。PCR反应程序是:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 40 s,72 ℃ 1 min,分别进行24、26、28个循环;最后72 ℃延伸5 min。对PCR产物进行琼脂糖凝胶电泳检测,并将PCR产物送出测序,进一步验证扩增得到的PCR产物是否为目的基因。
表1 本研究所用的引物
Table 1 Primers used in this study
1.6 SmGSTF1和SmGSTF2蛋白结构模拟
以拟南芥的Phi类GST (PDB:1GNW) 的X射线衍射晶体结构为模板,在SWISS-MODEL上进行蛋白结构模拟,对模拟结果进一步用prolife-3D程序进行验证,选取最优的模拟结构。
1.7 SmGSTF1和SmGSTF2重组蛋白的表达和纯化
以SmGSTF1-EX1/EX2、SmGSTF2-EX1/EX2为引物,以叶cDNA为模板,进行PCR扩增得到目的基因片段。用限制性内切酶HⅠ和Ⅰ对PET-30a载体进行双酶切。利用无缝克隆试剂盒 (中美泰和公司) 将目的基因连接到双酶切后的载体上,再将重组载体转化到大肠杆菌BL21 (DE3) 感受态细胞中。挑取阳性菌落进行测序,然后将测序验证无突变的重组表达菌接种到含有卡那霉素的LB培养基中过夜培养,以1∶100的比例扩大培养至600为0.6左右,加入IPTG (终浓度为0.1 mmol/L) 诱导蛋白在大肠杆菌BL21中表达,37 ℃、200 r/min过夜培养。将诱导表达后的菌液4 ℃、10 000×离心3 min收集菌体,加入适量缓冲液A (20 mmol/L咪唑,0.5 mol/L NaCl,20 mmol/L Na3PO4, pH 7.5) 进行重悬,在冰上进行超声波破碎10 min,将破碎后的菌液在4 ℃、10 000×离心10 min,取少量菌液、超声破碎后的离心上清液和沉淀,经SDS-PAGE检测目的蛋白的表达情况。用缓冲液A平衡Ni 柱 (购自于Amersham Pharmacia Biotech公司),将超声破碎离心后的上清液上柱,待蛋白结合30 min后,用缓冲液A洗脱杂蛋白,再用缓冲液B (0.5 mol/L咪唑,0.5 mol/L NaCl,20 mmol/L Na3PO4,pH 7.5) 洗脱目的蛋白,收集目的蛋白洗脱峰进行下一步酶学活性分析。
1.8 SmGSTF1和SmGSTF2重组蛋白的酶学活性检测
参照Habig等[18]的方法测定重组蛋白对CDNB、DCNB和NBC的催化活性,参照Ricci等[19]的方法测定重组蛋白对NBD-Cl的催化活性,参照Edwards等[20]的方法测定重组蛋白对DHA、fluorodifen和Cum-OOH的催化活性。在25 ℃下,使用紫外分光光度计 (Evolution 300)进行所有的测活反应。以CDNB和GSH为底物,每5 ℃作为一个梯度,测定重组蛋白在15−65 ℃之间的活性。参照Yuen等[21]的方法,在pH 5−10范围内测定重组蛋白在不同pH下的催化活性。
通过测定重组蛋白在不同CDNB和GSH浓度下的催化活性分析其动力学常数。分析重组蛋白对于GSH的动力学时,CDNB的浓度保持1.0 mmol/L不变,测定重组蛋白在不同GSH浓度 (0.1−1.0 mmol/L) 时的催化活性。分析重组蛋白对于CDNB的动力学时,保持GSH浓度为1.0 mmol/L不变,测定其在不同CDNB浓度 (0.6−4.0 mmol/L) 时的催化活性。利用Hyper32程序,通过线性回归分析获得其酶动力学参数。
2 结果与分析
2.1 江南卷柏Phi类GST基因的克隆与基因结构分析
以江南卷柏cDNA为模板,利用引物SmGSTF1-EX1/EX2和SmGSTF2-EX1/EX2克隆得到和的cDNA序列。和都包含648个碱基的开放阅读框,编码215个氨基酸残基的蛋白质 (图1),预测的蛋白分子量分别为24.03 kDa和23.99 kDa。SmGSTF1和SmGSTF2之间只有4个氨基酸差异,氨基酸序列相似性为98.14%。通过保守结构域分析发现,扩增得到的2个基因都具有Phi类GST的保守结构域,说明我们扩增得到的是Phi类GST基因。和基因组序列全长都是768 bp,都含有2个内含子,2个内含子长度都为60 bp。

图1 SmGSTF1和SmGSTF2的氨基酸序列
2.2 江南卷柏Phi类GST基因的系统发生关系分析
将江南卷柏Phi类GST和苔藓植物小立碗藓、裸子植物油松、单子叶植物水稻、以及双子叶植物拟南芥和毛果杨的Phi类GST共同进行系统发生分析。系统发育树显示江南卷柏的两个Phi类GST与其他物种的Phi类GST聚在一起,而且其位于系统发育树的内部,说明本研究扩增得到的2个基因为Phi类GST (图2)。和聚在一起,说明和是在江南卷柏与其他物种分化之后通过基因重复产生的。
2.3 江南卷柏和基因的组织表达模式分析
采用半定量RT-PCR方法研究和基因在江南卷柏不同组织 (根、茎和叶) 中的表达分布。研究发现和基因在江南卷柏根、茎和叶中均表达,且这2个基因在所有的循环中都有表达 (图3),说明和可能是组成型表达基因,在江南卷柏的生长发育过程中发挥着重要作用。
2.4 江南卷柏SmGSTF1和SmGSTF2蛋白的三维结构
利用SWISS-MODEL网站模拟江南卷柏SmGSTF1和SmGSTF2的三维结构 (图4A)。优化后的构象用Profile-3D进行校验,可以看出绝大部分氨基酸残基得分都是正值 (图4B),位于合理的范围,表明模拟的结构具有比较高的可信度。SmGSTF1和SmGSTF2的三维结构包括2个结构域:由α螺旋和β折叠组成的N末端结构域 (N-domain) 以及由6个α螺旋组成的C末端结构域 (C-domain)。蛋白结构比较发现2个蛋白的结构高度相似。
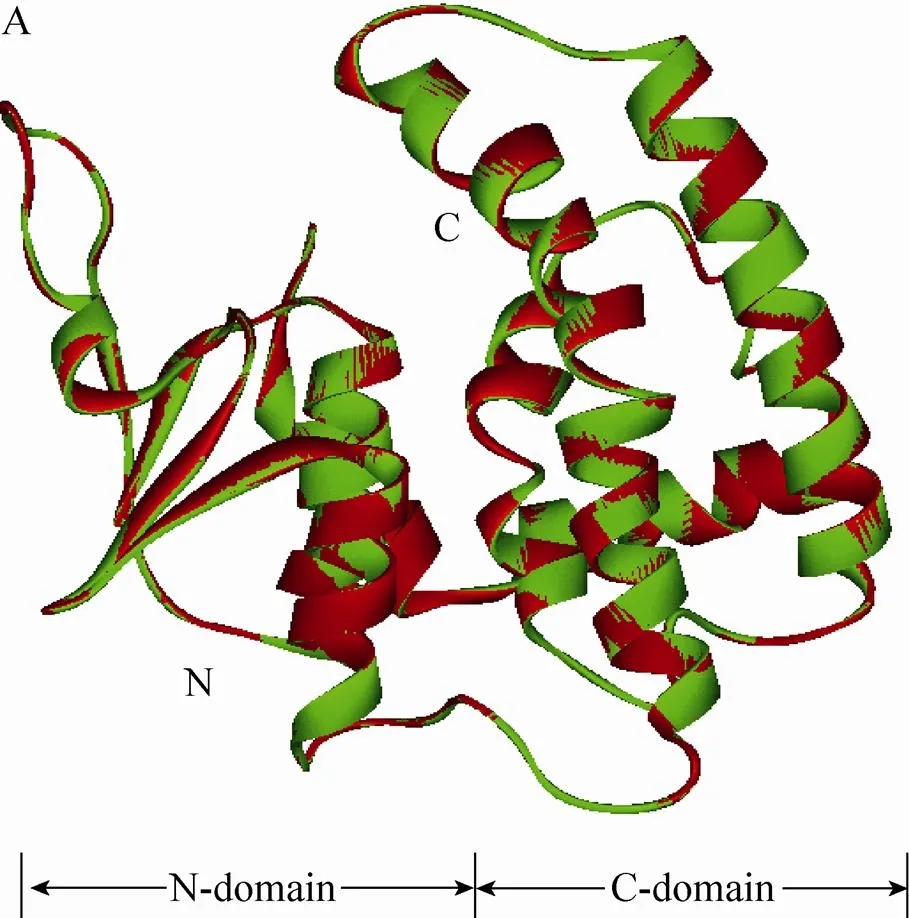
图4 SmGSTF1和SmGSTF2蛋白三维结构的比较
2.5 江南卷柏SmGSTF1和SmGSTF2重组蛋白的表达和纯化
将重组表达载体pET30a/SmGSTF1和pET30a/SmGSTF2分别转化大肠杆菌BL21感受态细胞,经IPTG诱导,SDS-PAGE检测发现SmGSTF1和SmGSTF2重组蛋白在大肠杆菌中可溶性表达 (图5)。将重组蛋白经Ni柱亲和层析纯化并进行蛋白凝胶电泳,SDS-PAGE结果显示重组蛋白的分子量与预测的SmGSTF1和SmGSTF2蛋白大小一致,而且杂带较少,表明纯化蛋白的纯度较高。

图5 SmGSTF1和SmGSTF2蛋白在大肠杆菌BL21中的表达和纯化
2.6 SmGSTF1和SmGSTF2蛋白的底物活性分析
SmGSTF1和SmGSTF2蛋白对不同底物的催化活性如表2所示,SmGSTF1和SmGSTF2对CDNB、NBD-Cl和NBC都具有酶学活性,对DCNB和DHA没有催化活性。另外SmGSTF1对Fluorodi 和Cum-OOH有活性,而SmGSTF2对它们没有活性。我们发现,同一蛋白对不同底物的活性相差很大,如SmGSTF2对CDNB的活性是其对NBC的22.3倍。不同蛋白对同一底物的活性变化也很大,例如,SmGSTF1和SmGSTF2对CDNB的活性相差不大,而SmGSTF1对NBC的活性是SmGSTF2的14.67倍。
表2 SmGSTF1和SmGSTF2蛋白的酶学活性
Table 2 Specific enzymatic activities of the recombinant SmGSTF1 and SmGSTF2 towards different substrates
Values shown are±, calculated from three replicates, n.d. represents no detected.
2.7 SmGSTF1和SmGSTF2蛋白的动力学分析
分别以GSH和CDNB为底物,对SmGSTF1和SmGSTF2蛋白进行酶动力学分析,结果如表3所示。米氏常数m表示酶对底物的亲和力,我们发现SmGSTF1和SmGSTF2蛋白对GSH的m值远小于它们对CDNB的m值,说明它们对GSH比CDNB有更高的亲和力,且SmGSTF1相比于SmGSTF2对GSH有更高的亲和力。catm表示酶对底物的催化效率,我们发现,SmGSTF1对GSH的催化效率是SmGSTF2的1.94倍,而它们对CDNB的催化效率没有差别。
表3 SmGSTF1和SmGSTF2蛋白对GSH和CDNB的动力学
Table 3 Kinetic constants of SmGSTF1 and SmGSTF2 towards GSH and CDNB (Values shown are±, calculated from three replicates)
2.8 SmGSTF1和SmGSTF2蛋白的pH依赖性和温度依赖性分析
以CDNB和GSH为底物,对SmGSTF1和SmGSTF2蛋白进行pH依赖性分析,结果如 图6所示。pH依赖性显示,在pH 5.0−8.0时,其催化活性逐渐升高,在pH 7.0−8.5时,两个蛋白都可以保持80%以上的相对活性,且在pH 8.0时达到最高活性,pH 9.5时仍都能保持40%以上的相对活性,说明SmGSTF1和SmGSTF2蛋白在偏碱性的条件下有更高的催化作用。
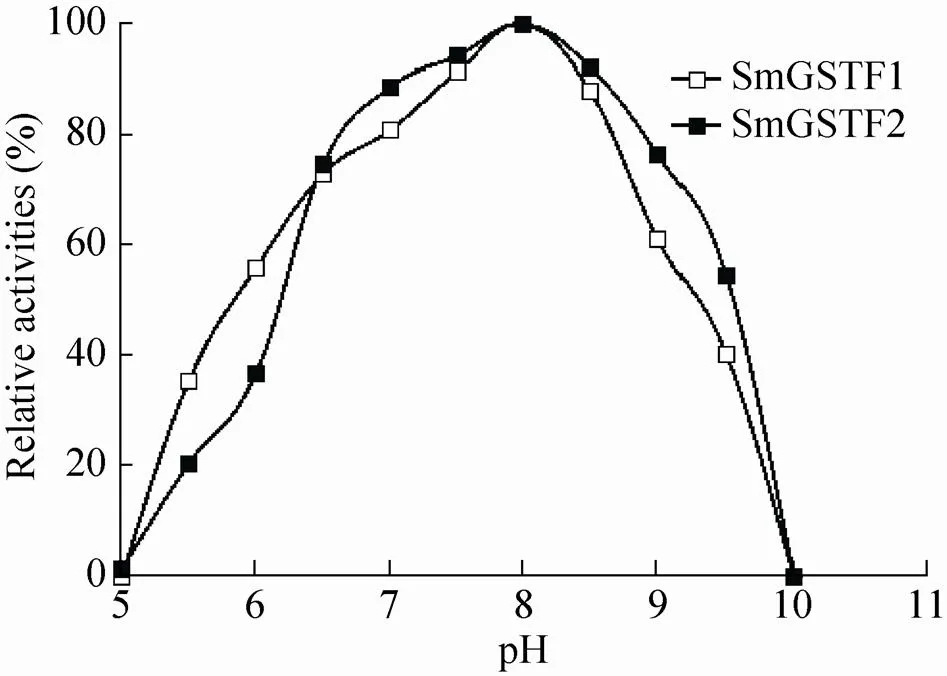
图6 SmGSTF1和SmGSTF2蛋白在不同pH下的活性
以CDNB为底物,检测SmGSTF1和SmGSTF2蛋白在不同温度下的催化活性,温度依赖性结果如图7所示,我们发现SmGSTF1和SmGSTF2蛋白在较高的温度下有比较高的催化活性,在15−45 ℃的范围内,SmGSTF1和SmGSTF2蛋白的催化活性不断增高。在40−55 ℃时,两种蛋白都保持了80%以上的相对活性,并在45 ℃时达到最高活性,且在65 ℃也仍保持40%以上的相对活性。
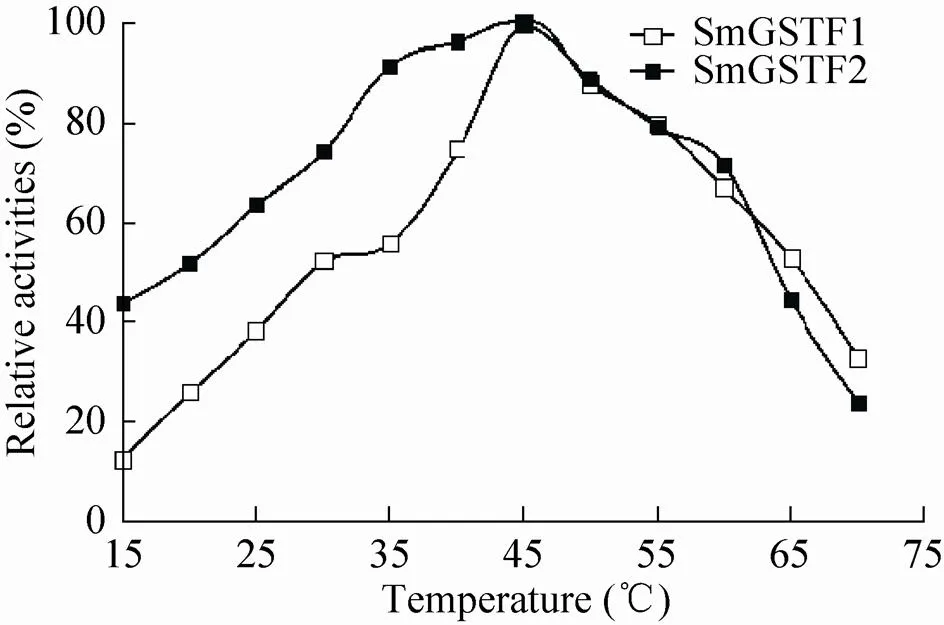
图7 SmGSTF1和SmGSTF2蛋白在不同温度下的活性
3 讨论
谷胱甘肽转移酶在植物体内发挥着重要作用,如响应环境胁迫,细胞信号转导和抵抗病原菌入侵等[22-26]。根据我们以前的研究发现,在双子叶植物毛果杨中共有9个Phi类GST基因,单子叶植物水稻中有17个Phi类GST基因,裸子植物油松中有7个Phi类GST基因,苔藓植物小立碗藓中有10个Phi类GST基因[16-17],而本研究中江南卷柏只有两个Phi类GST基因,说明相对于其他类型植物,蕨类植物可能需要更少的Phi类GST基因。另外,在毛果杨的9个Phi类GST基因中有7个是组成型表达[11],油松中的7个Phi类GST基因都是组成型表达[16],本研究克隆到的2个江南卷柏Phi类GST基因在根、茎和叶中均有表达,可能是组成型表达基因,预示着Phi类GST基因可能在江南卷柏生长发育过程中发挥着重要的作用。
系统发生关系分析发现,和在进化树上聚在一起,而且两个基因的序列高度相似,氨基酸序列相似性为98.14%,表明它们可能是在江南卷柏与其他类型植物分化之后最近通过基因重复产生的,然而蛋白活性分析发现,SmGSTF1蛋白对CDNB、NBD-Cl、NBC、Fluorodifen和Cum-OOH都有活性,而SmGSTF2蛋白只对CDNB、NBD-Cl和NBC有活性,说明这两个蛋白的底物谱已经发生了分化。对NBD-Cl的催化活性,SmGSTF1是SmGSTF2的1.89倍,对NBC的催化活性,SmGSTF1是SmGSTF2的14.67倍,蛋白生化活性差异预示着SmGSTF1和SmGSTF2存在着功能分化。
酶动力学分析发现,SmGSTF1蛋白对CDNB的亲和力是SmGSTF2 的2.4倍,然而由于SmGSTF1对CDNB的转换数cat值比SmGSTF2高,导致两种蛋白对CDNB的催化效率catm值没有差别,说明在SmGSTF1和 SmGSTF2对CDNB的催化反应中,与底物结合以及与底物结合后所发生的电子转移或者产物的释放速率对于两个蛋白的催化功能都很重要。
蕨类植物是最早脱离水体束缚,最早适应陆地生态环境和最早出现维管组织的类群。蕨类植物从水生到陆生,体内必然存在一套机制来适应复杂的陆地环境。对SmGSTF1和SmGSTF2在不同pH和温度条件下进行活性分析发现,它们在pH 6.0−9.5,以及30−65 ℃范围内均具有较高的催化活性,表明这两个蛋白能在比较宽的环境变化条件下发挥功能,预示着SmGSTF1和SmGSTF2对于江南卷柏适应复杂的陆地环境具有重要作用。
REFERENCES
[1] Weng JK, Tanurdzic M, Chapple C. Functional analysis and comparative genomics of expressed sequence tags from the lycophyte. BMC Genom, 2005, 6(1): 85.
[2] Cao Y, Tan NH, Chen JJ, et al. Bioactive flavones and biflavones fromHieron. Fitoterapia, 2010, 81(4): 253–258.
[3] Wan DR, Chen KL, Zhan YH. Investigations and studies on medicinal plants fromin Hubei province. China J Mater Med, 2005, 30(19): 1507−1510 (in Chinese).
万定荣, 陈科力, 詹亚华. 湖北省卷柏科药用植物调查与研究. 中国中药杂志, 2005, 30(19): 1507−1510.
[4] Marrs KA. The functions and regulation of glutathione-transferases in plants. Annu Rev Plant Physiol Plant Mol Biol, 1996, 47(1): 127–158.
[5] Edwards R, Dixon DP, Walbot V. Plant glutathione-transferases: enzymes with multiple functions in sickness and in health. Trends Plant Sci, 2000, 5(5): 193–198.
[6] Dixon DP, Lapthorn A, Edwards R. Plant glutathione transferases. Genome Biol, 2002, 3(3): 3004.1–3004.10.
[7] Dai LL, Ma JN, Ma MY, et al. Characterisation of GST genes from the Chinese white pine beetle(Curculionidae: Scolytinae) and their response to host chemical defence. Pest Manag Sci, 2016, 72(4): 816–827.
[8] Liu HJ, Tang ZX, Han XM, et al. Divergence in enzymatic activities in the soybean GST supergene family provides new insight into the evolutionary dynamics of whole-genome duplicates. Mol biol Evol, 2015, 32(11): 2844–2859.
[9] Yang GY, Wang YC, Xia DA, et al. Overexpression of a GST gene () fromimproves drought and salinity tolerance by enhancing the ability to scavenge reactive oxygen species. Plant Cell Tiss Organ Cult, 2014, 117(1): 99–112.
[10] Roncalli V, Cieslak MC, Passamaneck Y, et al. Glutathione-transferase (GST) gene diversity in the crustacean–contributors to cellular detoxification. PLoS ONE, 2015, 10(5): e0123322.
[11] Lan T, Yang ZL, Yang X, et al. Extensive functional diversification of theglutathione-transferase supergene family. Plant Cell, 2009, 21(12): 3749–3766.
[12] Thom R, Cummins I, Dixon DP, et al. Structure of a tau class glutathione-transferase from wheat active in herbicide detoxification. Biochemistry, 2002, 41(22): 7008–7020.
[13] Basantani M, Srivastava A. Plant glutathione transferases-a decade falls short. Canad J Bot, 2007, 85(5): 443–456.
[14] Liu XF, Li JY. Characterization of an ultra-violet inducible gene that encodes glutathione-transferase in. Acta Genet Sin, 2002, 29(5): 458–460 (in Chinese).刘新仿, 李家洋. 紫外线强烈诱导的谷胱甘肽转移酶基因的功能鉴定. 遗传学报, 2002, 29(5): 458–460.
[15] Karavangeli M, Labrou NE, Clonis YD, et al. Development of transgenic tobacco plants overexpressing maize glutathione-transferase I for chloroacetanilide herbicides phytoremediation. Biomol Eng, 2005, 22(4): 121–128.
[16] Lan T, Wang XR, Zeng QY. Structural and functional evolution of positively selected sites in pine glutathione-transferase enzyme family. J Biol Chem, 2013, 288(34): 24441–24451.
[17] Liu YJ, Han XM, Ren LL, et al. Functional divergence of the glutathione-transferase supergene family inreveals complex patterns of large gene family evolution in land plants. Plant Physiol, 2013, 161(2): 773–786.
[18] Habig WH, Pabst MJ, Jakoby WB. Glutathione-transferases. The first enzymatic step in mercapturic acid formation. J Biol Chem, 1974, 249(22): 7130–7139.
[19] Ricci G, Caccuri AM, Lobello M, et al. Colorimetric and fluorometric assays of glutathione transferase based on 7-chloro-4-nitrobenzo-2-oxa-1,3-diazole. Analyt Biochem, 1994, 218(2): 463–465.
[20] Edwards R, Dixon DP. Plant glutathione transferases. Methods Enzymol, 2005, 401: 169–186.
[21] Yuen WK, Ho JW. Purification and characterization of multiple glutathione S-transferase isozymes from Chironomidae larvae. Comp Biochem Physiol A Mol Integr Physiol, 2001, 129(2/3): 631–640.
[22] Hayes JD, Pulford DJ. The glut athione-transferase supergene family: regulation of GST and the contribution of the lsoenzymes to cancer chemoprotection and drug resistance part II. Crit Rev Biochem Mol Biol, 1995, 30(6): 521–600.
[23] Hayes JD, Flanagan JU, Jowsey IR. Glutathione transferases. Annu Rev Pharmacol Toxicol, 2005, 45: 51–88.
[24] Zeng XH, Morgenstern R, Nyström AM. Nanoparticle-directed sub-cellular localization of doxorubicin and the sensitization breast cancer cells by circumventing GST-Mediated drug resistance. Biomaterials, 2014, 35(4): 1227–1239.
[25] Csiszár J, Horváth E, Váry Z, et al. Glutathione transferase supergene family in tomato: salt stress-regulated expression of representative genes from distinct GST classes in plants primed with salicylic acid. Plant Physiol Biochem, 2014, 78: 15–26.
[26] Fletcher ME, Boshier PR, Wakabayashi K, et al. Influence of glutathione--transferase (GST) inhibition on lung epithelial cell injury: role of oxidative stress and metabolism. Am J Physiol-Lung Cell Mol Physiol, 2015, 308(12): L1274–L1285.
Molecular characteristics of two Phi glutathione-transferases in
Yuanjie Zhang, Zhiling Yang, and Hailing Yang
,,100083,
Glutathione-transferase (GST) is important in plants to resist various stresses. In this study, two Phi GST genes (and) were cloned from.andgenes encode proteins of 215 amino acid residues. Gene expression analysis showed that the two genes were expressed in roots, stems and leavesThe recombinant SmGSTF1 and SmGSTF2 proteins were overexpressed in, and purified by Ni-affinity chromatography. SmGSTF1 and SmGSTF2 had the catalytic activity towards 1-Chloro-2,4-Dieitrobenzene, 4-Chloro-7-nitro-1,2,3-benzoxadiazole (NBD-Cl), and 4-Nitrobenzyl chloride substrates. SmGSTF1 also had the activity towards Fluorodifen and Cumyl hydroperoxide (Cum-OOH), whereas SmGSTF2 not. The enzyme kinetics analysis showed that SmGSTF1 and SmGSTF2 had high affinity towards glutathione, and low affinity towards 1-Chloro-2, 4-Dieitrobenzene. The enzymatic activity of SmGSTF1 and SmGSTF2 had high catalytic activity between pH 7 and 8.5, and between 45 and 55 °C. SmGSTF1 and SmGSTF2 may have an important role in the resistance ofagainst stress.
, glutathione-transferase, gene expression, enzymatic activity
October 16, 2015; Accepted: January 6, 2016
农业生物技术
张元杰, 杨志灵, 杨海灵. 江南卷柏Phi类谷胱甘肽-转移酶的分子特性. 生物工程学报, 2016, 32(7): 927–936.
Zhang YJ, Yang ZL, Yang HL. Molecular characteristics of two Phi glutathione-transferases in. Chin J Biotech, 2016, 32(7): 927–936.
Supported by: National Natural Science Foundation of China (No. 31270641).
Corresponding author: Hailing Yang. Tel/Fax +86-10-62590843; E-mail: yhailing77@163.com
国家自然科学基金 (No. 31270641) 资助。
网络出版时间:2016-01-26 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20160126.0933.002.html
(本文责编 陈宏宇)
