长寿蛋白SIRT6在肿瘤发生发展中的作用
2016-09-19董振雷倩刘力超崔红娟
董振,雷倩,刘力超,崔红娟
长寿蛋白SIRT6在肿瘤发生发展中的作用
董振1,雷倩1,刘力超2,崔红娟1
1 西南大学 家蚕基因组生物学国家重点实验室 生物技术学院,重庆 400716 2 河北医科大学第三附属医院 皮肤科,河北 石家庄 050051
SIRT6作为组蛋白去乙酰化转移酶 (Histone deacetylases,HDACs) 第三家族长寿蛋白 (Sirtuins,SIRTs) 中的一员,具有多种催化酶活性,且在抗衰老、染色质调节、转录调控、糖脂代谢、DNA损伤修复等生物学过程中起着重要的作用。近年来的证据表明,SIRT6的表达与肿瘤的发生发展密切相关,且在多种肿瘤中起着关键的调节作用,比如肝癌、肺癌、乳腺癌和生殖系统肿瘤等。但是由于SIRT6功能的多样性,及其上下游信号通路的复杂性,SIRT6在肿瘤中可能扮演着双重角色。在大多数情况下,SIRT6扮演着抑癌基因的角色,少数情况下,SIRT6却又发挥着促癌作用。本文结合目前本实验室的研究,阐述了近几年来关于SIRT6在多种肿瘤发生及发展中的最新发现,总结了其作用机制,并对其研究及应用前景进行了展望。
SIRT6,肿瘤发生,肿瘤发展,沃伯格效应,去乙酰化转移酶
随着近年来肿瘤分子及细胞生物学研究的不断进展,表观遗传修饰在肿瘤的形成和发展中扮演着重要的角色。第Ⅲ类组蛋白去乙酰化转移酶 (Class Ⅲ histone deacetylases,Class Ⅲ HDACs),通常被称为长寿蛋白 (Sirtuins,SIRTs),是一类高度保守的蛋白,与啤酒酵母中的Sir2 (Silent information regulator 2,沉默信息调节蛋白2) 同源[1]。该类蛋白具有腺嘌呤二核苷酸 (Nicotinamide adenine dinucleotide,NAD+) 依赖的去乙酰化酶 (Deacetylases) 和/或单ADP-核糖基转移酶 (Mono-[ADP-ribosyl] transferases) 活性。在哺乳动物中,Sirtuins有7种,因其结构差异分为4类[2]:SIRT1、SIRT2和SIRT3属于Ⅰ类,SIRT4属于Ⅱ类,SIRT5 属于Ⅲ类,SIRT6和SIRT7属于Ⅳ类。它们的定位各不相同:SIRT6和SIRT7定位于细胞核中,SIRT1和SIRT2定位在细胞质中,SIRT3、SIRT4和SIRT5则定位在线粒体中,其中SIRT1和SIRT3也可以穿梭到细胞核中[3-4]。它们在细胞中靶标细胞质、线粒体或者细胞核中大量蛋白质的翻译后修饰,从而发挥不同的功能和作用。在酵母、线虫、果蝇和老鼠中,长寿蛋白都被证明在寿命的调节中起着关键的作用[1,5-7]。因为衰老与肿瘤的发生及发展密切相关,长寿蛋白也在肿瘤的病理形成和发展的重要通路中发挥着各种不同的功能。
作为一个长寿蛋白中的关键成员,SIRT6具有多种催化功能,包括去乙酰化 (Deacetylation)[3]、单ADP-核糖基化 (Mono adenosine diphosphate ribosylation)[8]以及去脂肪酰化 (De-fatty-acylation),如去N-豆蔻酰化 (De-N-myristoylation) 和去S-棕榈酰化 (De-S-palmitoylation) 等[9]。SIRT6参与多种生物学过程,包括衰老、染色质调节、转录调控、糖代谢、脂肪代谢、DNA损伤修复、rRNA合成、mRNA加工、干细胞分化、炎症反应、神经发育和生物节律等。而且SIRT6与多种疾病,如心血管疾病、慢性阻塞性肺病、糖尿病、骨骼相关疾病、视网膜病变、肝病等的发生及演进密切相关。除此之外,最近相关研究表明SIRT6与肿瘤的形成[10]和肿瘤的发展[11]也有密切的联系,并且与癌症患者的存活率显著相 关[12-13]。这篇综述中阐述了SIRT6在肿瘤发生及发展中的研究进展,总结了其作用机制,并对其研究和应用前景进行展望。
1 SIRT6简介
人类的SIRT6基因位于第19号染色体 (19p13.3),含有8个外显子。其序列由1 068个寡核苷酸组成,可以编码含有355个氨基酸的蛋白,蛋白分子质量约为39.1 kDa,等电点为9.12[14]。SIRT6的N端延伸 (N-terminal extension,NTE) 在核染色质的联会和核心域的催化过程中起着决定性的作用,而C端的延伸 (C-terminal extension,CTE) 在细胞核的定位中起着重要的作用[15]。SIRT6的CTE结构中含有一个7氨基酸序列的核定位信号,当这段序列突变后,SIRT6会定位于细胞质中[15]。但也有研究表明,SIRT6也会存在于细胞质的内质网中,从而行使其去脂肪酰化功能[9]。相对于Ⅰ型和Ⅱ型HDACs,Siruins中的Zn2+并不参与去乙酰化反应,而仅仅维持其具有催化活性的构型[16]。与其他Sirtuins不同的是,SIRT6拥有一个张开的锌指结构域,而无连接锌指基序和罗斯曼褶皱域的一个螺旋束 (Helix bundle),并且缺乏一个保守的、高度灵活的NAD+结合环,取而代之的只是一个稳定的单螺旋,这使得SIRT6不能向其他Sirtuins一样在缺乏乙酰化底物的同时也能结合NAD+,从而大大降低其去乙酰化酶的活性[17]。但是,SIRT6的晶体结构中含有一个比较大的疏水袋,可以容纳长链脂肪酰基团,并且与脂肪酰肽主链中的C=O和N-H以氢键相结合,从而使其具有去脂肪酰化酶的活性[9]。SIRT6主要表达在肝脏、心脏以及肌肉中[7]。SIRT6特殊的结构决定了其与众不同的功能,而且SIRT6功能多种多样,参与了多种生物学过程。
2 SIRT6与肿瘤
SIRT6在调节衰老及糖代谢中发挥着重要作用,而衰老和糖代谢与癌症的发生发展密不可分。癌细胞的持久分裂能力与导致人死亡的衰老过程看起来似乎是对立的,但是,癌变和衰老过程的分子及细胞生物学基础却是极为相似的。基因组不稳定、端粒功能、活性氧、自噬和代谢等都在癌症和衰老中扮演着类似的作用[18]。其中,糖代谢在癌症中的意义显得尤为重要。早在1930年,德国生物化学家奥托·沃伯格 (Otto Warburg,1883−1970) 就发现肿瘤细胞产生能量的方式与正常细胞有着很大的差异,正常细胞主要依靠线粒体氧化呼吸作用产生能量,而大多数肿瘤细胞即使在氧气充足的条件下依然通过产能率极低的糖酵解作用来供能,而且恶性肿瘤细胞通常的糖酵解率是正常组织的200倍[19],这一现象称为沃伯格效应 (Warburg effect)。沃伯格认为恶性肿瘤的这种代谢的变化是癌症发生的根本原因。近年来,随着研究的深入,人们越来越接受葡萄糖代谢的异常是癌症发生发展中重要的标志之一[20]。
作为糖代谢重要的调节子,SIRT6的功能决定了其在癌症中扮演的特殊角色。研究发现,SIRT6的缺失不需要激活其他已知癌基因的情况下就可以引起肿瘤的形成,且转化的SIRT6缺失细胞由于缺乏能够与MYC和HIF1α结合的并抑制其转录活性的SIRT6,使得糖酵解增加并上调糖酵解相关基因的表达,刺激核糖体生成,从而促进肿瘤的异常增殖[21],这表明SIRT6在肿瘤形成及维持过程中起着重要的作用。除此之外,临床样本分析也发现SIRT6在多种肿瘤中表达下调,且其表达水平与患者预后密切相关[10]。过表达SIRT6能够引起多种肿瘤细胞的凋亡,而对正常细胞及非转化细胞没有影响;这种凋亡效应是由p53和p73介导的,依赖于SIRT6的单ADP-核糖基化转移酶活性,而非去乙酰化酶活性[22]。随着研究的进一步深入,SIRT6被证明在多种肿瘤,如肝癌、肺癌、乳腺癌和结直肠癌等中具有重要的作用,这些作用不仅仅是与癌症的发生有关,也与其随后的发展密切相关。
2.1 SIRT6与肝癌
肝癌 (Liver cancer) 是世界上男性第五大最常见肿瘤,第二大癌症死因,是女性第七大最常见肿瘤,第六大癌症死因[23]。研究显示,SIRT6与肝癌发生密切相关。从临床数据来看,SIRT6缺失更容易形成肿瘤,肝癌组织中SIRT6的表达也普遍降低,且SIRT6与肝细胞癌 (Hepatocellular carcinoma,HCC) 病人的低分化型、较高的AFP水平以及预后和复发情况明显相关[24-25]。动物实验显示,在SIRT6缺失小鼠的肝脏细胞中检测发现HCC相关的表面分子标记如甲胎蛋白 (Alpha-fetoprotein,AFP)、胰岛素样生长因子2 (Insulin-like growth factor 2,IGF2)、磷脂酰肌醇聚糖-3 (Glypican-3,GPC3) 及H19表达显著上调[12];而在肝癌起始特异性的转基因小鼠中发现,增高SIRT6的表达能够降低肝癌的发生[26]。以上这些研究结果表明SIRT6能够抑制肝癌的发生。
除此之外,研究显示SIRT6与肝癌的病理发展也密切相关。在肝细胞癌细胞系HepG2中敲低SIRT6明显促进增殖,而过表达SIRT6则激活细胞外信号调节激酶1/2 (Extracellular signal regulated kinase 1/2,ERK1/2) 通路,促进了细胞凋亡并降低了活性氧及超氧化物阴离子的水平[25]。在HCC细胞上的实验也证明,SIRT6下调对凋亡不敏感,而过表达SIRT6后,HCC细胞对死亡受体CD95刺激及化疗引起的凋亡敏感性增加[12]。而且,SIRT6能够被组蛋白乙酰转移酶MOF (Males absent on the first) 转录激活,降低其调节的下游蛋白Survivin、Afp、IGF2、H19及GPC3的表达[24]。
虽然上述的结果已经明确了SIRT6在肝癌中的抑癌效应,但是也有研究发现SIRT6在某些肝癌中可能是促进癌变进程的。一项研究结果显示,SIRT6在肝癌组织中的表达水平要高于癌旁组织,但是预后却没有明显的相关性[27]。但是有实验确实证实SIRT6能够通过抑制细胞衰老,促进转化生长因子 (Transforming growth factor,TGF-1β)、H2O2及HClO介导的肝癌发生[28]。虽然如此,SIRT6促肝癌的效应目前还不能完全证实,需要进一步充分验证。
以上结果表明,SIRT6与肝癌发生发展密切相关。在大多数情况下,SIRT6是以一个抑癌基因的角色发挥着抑制肝癌发生、控制肝癌进展的作用。但是因为肝癌的异质性比较强,而且SIRT6功能也具有多样性,因此SIRT6在肝癌病理发展中的效应不可一概而论,尚需要更多的研究去证实。
2.2 SIRT6与肺癌
在世界范围内,肺癌 (Lung cancer) 是人类中致死率最高的癌症[23]。研究显示,SIRT6在肺癌中,尤其是非小细胞肺癌 (Non-small cell lung cancer,NSCLC) 中也表现出显著的抑癌效应。在NSCLC组织及细胞系中,SIRT6 mRNA及蛋白水平表达普遍降低[29]。进一步研究发现,SIRT6能够抑制Twist1的表达,从而抑制NSCLC细胞的增殖[29]。而且在NSCLC细胞系A549中过表达SIRT6能够增加对放疗的敏感性,抑制其增殖,引起细胞周期阻滞在G0/G1期,诱发凋亡[30]。
但也有研究显示,SIRT6在肺癌中的作用与其在细胞中的定位有关。在98例NSCLC的临床样本中,相比较其他SIRT6的定位,SIRT6在胞质高表达而细胞核内低表达的病人拥有更恶性的肿瘤、更低的总生存率、更短的无复发生存期[31]。而且SIRT6在肺癌中作用复杂性还远不及此,因为SIRT6下调后,使得肺癌细胞对于化疗和放疗更加敏感。研究显示,在NSCLC中,c-AMP信号能够通过抑制Raf-MEK-ERK通路促进SIRT6的泛素-蛋白酶体降解过程,降低SIRT6的表达,使得细胞对于放疗引起的凋亡或者自噬更加敏感[32];而且SIRT6的降低使核因子-κB (NF-κB) 和自噬标志蛋白Beclin1的表达也降低了,从而增加了肺腺癌细胞系对紫杉醇的敏感性[31]。
综合以上研究结果,SIRT6与肺癌的病理发展密切相关,尤其是在调节NSCLC细胞对放疗及化疗的耐受性方面发挥着重要作用。上调或者下调SIRT6都降低了肺癌细胞的耐药性,这可能是SIRT6功能的复杂性所引起的。但是SIRT6在肺癌中的作用机制尚不够明确,尚需进一步深入研究。
2.3 SIRT6与乳腺癌
在世界范围内,乳腺癌 (Breast cancer,BC) 是女性因恶性肿瘤死亡的首要原因[33]。SIRT6在乳腺癌中的作用主要也是与耐药性相关,研究结果同样也有很大的分歧。有些研究者发现SIRT6能够使得乳腺癌细胞获得耐药性。研究显示,SIRT6的高表达与乳腺癌病人较低的预后生存率相关,SIRT6能够通过乙酰化FOXO1/3/4 (Forkhead box protein O1/3/4) 介导乳腺癌细胞的DNA损伤修复来应答紫杉醇及表柔比星引起的DNA损伤,从而使乳腺癌细胞获得耐药性[34]。
然而,有些研究者却发现SIRT6的功能并非如此,而是行使抑癌基因的功能。SIRT6的下调能够增加糖代谢水平,促进乳腺癌细胞的转移[35]。另一项研究显示,乳腺癌病人的预后生存率与SIRT6的表达水平呈正相关,而与其第338位丝氨酸的磷酸化水平呈负相关[36],这说明SIRT6在乳腺癌中的作用与其自身的转录后修饰也有关系。进一步发现,SIRT6的Ser338位点磷酸化后会导致SIRT6被降解,当敲低SIRT6后,会降低乳腺癌细胞对乳腺癌治疗药物曲妥单抗 (Trastuzumab,Herceptin) 的敏感性;而且增加一个非磷酸化的SIRT6突变体会增加乳腺癌耐药株对曲妥单抗的敏感性[36]。
综合以上结果,SIRT6在乳腺癌中扮演着癌基因或者抑癌基因双重角色,且SIRT6的作用效应受到明显的转录后修饰,但SIRT6作用的具体机制尚未明确。有研究显示在乳腺癌中SIRT6启动子甲基化状态与正常组织比较,并没有明显的特异性,且在侵袭性乳腺癌中SIRT6启动子甲基化状态与其表达水平也没有明显的相关性[37]。这表明,在乳腺癌中SIRT6的表达模式可能并不受甲基化的调控,而是通过其他表观遗传作用调控表达的,具体的机制目前尚需进一步研究。
2.4 SIRT6与生殖系统肿瘤
生殖系统肿瘤 (Genital system tumors) 是发生于男性和女性生殖器官的肿瘤的总称,包括阴道癌 (Vaginal cancer)、阴茎癌 (Penis cancer)、前列腺癌 (Prostate cancer)、外阴癌 (Vulva cancer)、卵巢癌 (Ovary cancer)、子宫内膜癌 (Endometrial cancer) 和输卵管癌 (Carcinoma of fallopian tube) 等,其中尤以前列腺癌、子宫内膜癌及卵巢癌发病率最高,严重威胁着人类生殖健康。在前列腺中,SIRT6可能扮演着癌基因的角色。研究显示,相对于正常及癌旁组织,SIRT6在前列腺癌中高表达,下调SIRT6的表达能够引起细胞周期阻滞在G1期、凋亡、DNA损伤,降低BCL2的表达;除此之外,SIRT6缺失细胞降低了细胞活力,并促进了化疗敏感性[38]。在子宫内膜癌中,SIRT6扮演着双重角色。一方面,SIRT6在子宫内膜癌患者的子宫抽取物中高表达,是子宫内膜癌的潜在的标记之一[39];另一方面,SIRT6的表达水平与子宫内膜癌细胞系AN3CA和KLE的增殖能力呈负相关,且过表达SIRT6能够抑制抗凋亡蛋白survivin的表达,从而促进细胞凋亡[40]。在卵巢癌中,SIRT6则扮演着抑癌基因的角色。SIRT6在卵巢癌中表达水平普遍降低,且在卵巢癌细胞系中过表达SIRT6能够抑制细胞增殖,而下调SIRT6促进了Notch3的表达,从而增加了细胞生长[41]。
综合以上结果,SIRT6在几种生殖系统肿瘤中起着关键作用,但分歧较大,既在前列腺癌中表现出促癌功能,又在卵巢癌和子宫内膜癌中表现出抑癌功能,这显示出SIRT6功能多样性和肿瘤的高异质性。因此在临床应用的时候,需要对不同的肿瘤进行进一步的分型检测,以满足日益热化的个体化治疗要求。
2.5 SIRT6与结直肠癌
作为消化系统最主要的恶性肿瘤之一,结肠癌是世界上女性肿瘤发生率的第2位,男性肿瘤发生率的第3位[42]。在早期的研究中,SIRT6在结肠癌细胞系SW480中被证明与能够抑制肿瘤的GCIP/CCNDBP1相互结合,暗示着SIRT6可能在结肠的发生和演进中起着重要的作用[43]。而且在结肠癌细胞中增加具有促癌作用的脂肪滴会导致PI3K依赖的FOXO3a降低,进一步下调SIRT6[44]。随后有研究证明,USP10能够通过维持SIRT6的稳定性,阻碍细胞周期进程,从而抑制结肠癌细胞的生长和肿瘤形 成[11]。同样地,SIRT6除了上述的抑癌功能外,也可能起着癌基因的功能。研究显示,在结肠癌中食物来源的异硫氰酸酯 (Isothiocyanates,ITCs) 能够下调包括SIRT6在内的几个去乙酰化酶,从而使得如CtIP等一些关键的DNA双链断裂损伤修复蛋白的乙酰化升高,并促进其随后的降解,使得DNA双链断裂,细胞生长阻滞,引发自噬和凋亡[45]。
综上可见,SIRT6在结直肠癌中可能扮演着抑癌基因的角色,但是相关的研究目前还不够深入,且其机制也未十分明确,还需要进一步进行研究。
2.6 SIRT6与头颈部鳞状细胞癌
头颈部鳞状细胞癌 (Squamous cell carcinoma of the head and neck,SCCHN) 是发生于头颈部最常见的癌症之一,近年来其发生率不断升高[46]。相对于非肿瘤组织,包括SIRT6在内的Surtuins家族在SCCHN中的表达显著降低,虽然其他Sirtuins在其发生的晚期表达水平显著低于早期,但SIRT6并没有显著性差异[47]。然而在头颈部鳞状细胞癌病人的外周血中检测发现,SIRT6的表达显著高于正常人,这表明SIRT6可以作为头颈部鳞状细胞癌早期检测的标志之一[48]。虽然这些研究尚处于初步阶段,但是SIRT6在头颈部鳞状细胞癌中的重要作用是明确的,对其具体机制尚值得进一步研究。
2.7 SIRT6与其他肿瘤
除了上述肿瘤外,SIRT6在其他肿瘤中目前的研究还较少,但是也发挥着重要的作用。在有些肿瘤中,如胃癌、膀胱癌和胶质瘤,SIRT6是一个肿瘤抑制因子。在胃癌组织中,SIRT6蛋白和mRNA较癌旁组织均呈现低表达[49];免疫组化显示在T2-T4期的肌肉入侵性尿道上皮癌中SIRT6的表达显著降低,且功能研究发现SIRT6抑制糖酵解及细胞增殖[13]。在胶质瘤中,SIRT6普遍低表达,进一步研究发现SIRT6能够去乙酰化H3K9,降低PCBP2的表达,从而抑制胶质瘤细胞的增殖[50]。
而在其他一些肿瘤中,如胰腺癌、皮肤鳞状细胞癌、慢性淋巴性白血病及喉癌等,SIRT6似乎扮演着癌基因的功能。在胰腺癌中,SIRT6能够促进促炎因子IL-8及TNF-α的表达,并通过激活瞬时受体电位M型2 (Transient receptor potential melastatin 2,TRPM2) 增强Ca2+应激,促进胰腺癌细胞的迁移[51],且SIRT6抑制剂喹唑啉二酮类化合物能够增加胰腺癌细胞对化疗的敏感性[52]。动物实验也显示,SIRT6皮肤特异性敲除小鼠抑制了肿瘤的发生,且SIRT6能够通过抑制腺苷酸活化蛋白激酶 (Adenosine monophosphate activated protein kinase,AMPK) 信号通路促进环氧合酶-2 (Cyclooxygenase-2,COX-2) 的表达,从而促进表皮细胞增殖和存活;UVB照射皮肤角质细胞增加了SIRT6的表达;皮肤鳞状细胞癌的临床分析也发现SIRT6的表达上调[53]。除此之外,相对于对照组,SIRT6在慢性淋巴性白血病病人血液中表达较高,且与肿瘤分级相关[54]。在多药耐药性人喉癌细胞中,SIRT6高表达,并与多药耐药性基因MDR1和MRP的转录和表达相关[55]。
3 总结与展望
近年来,SIRT6在Sirtuins家族中作用十分突出。作为一个具有多种功能的长寿蛋白,SIRT6在多种疾病中发挥重要作用,尤其与多种肿瘤的发生发展密切相关。虽然目前的研究发现SIRT6在不同的肿瘤中发挥着不同的作用,但是总的来说,SIRT6作为大多数肿瘤抑制子的功能被广泛认可。尤其是SIRT6作为抑制糖酵解的重要因子,在逆转肿瘤的沃伯格效应中发挥着重要作用。但是由于SIRT6功能的多样化,且调节机制复杂,在某些特定种类的肿瘤中,也有可能扮演着癌基因的功能。如图1所示,SIRT6作用机制的复杂性决定了其功能的多样性,也使得SIRT6在肿瘤中的作用表现出促癌和抑癌的双重性。
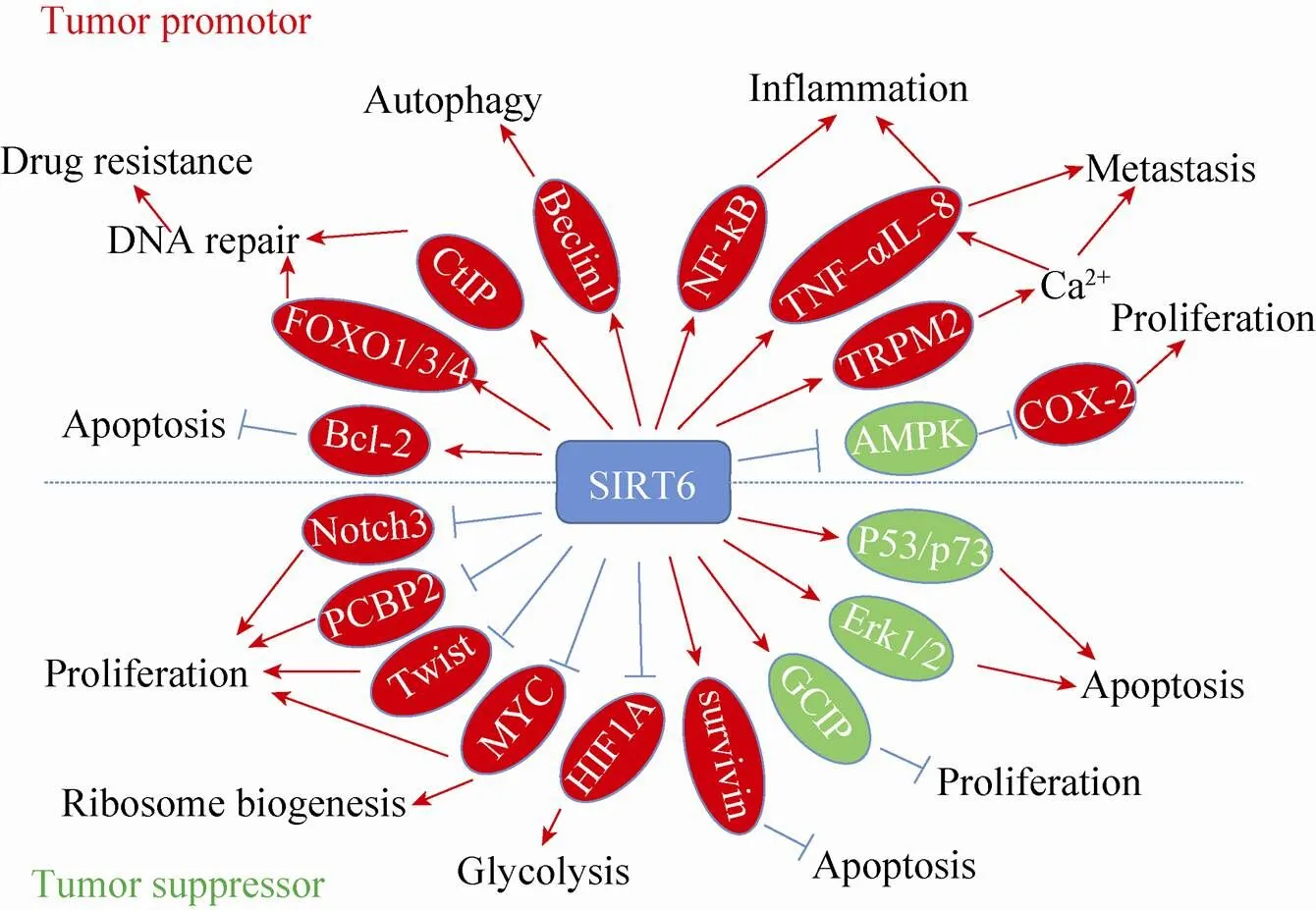
图1 SIRT6在肿瘤发生及发展中的作用机制
当然,SIRT6在肿瘤中的作用机制目前尚缺乏较为深入的研究。首先,SIRT6作用的上下游信号通路调节较为复杂,在何种情况下进行何种信号通路的调节是值得进一步研究的方向。另外,SIRT6自身活性具有多样性,除了去乙酰化转移酶的活性外,还具有脂肪酰化、单ADP糖基化等功能,因此SIRT6自身活性的调节也很重要,这也是SIRT6在肿瘤中作用具有差异性的原因所在。除此之外,SIRT6抑制糖酵解,进而逆转肿瘤细胞沃伯格效应,使得肿瘤细胞代谢重编程,从而降低癌细胞恶性。SIRT6在糖代谢上的重要作用也是近年来的研究热点,但是其机制还尚未十分清晰。最新的研究发现CyclinD1-CDK4复合物能够通过不依赖细胞周期的方式调节糖代谢[56],而具有抑癌作用的CyclinD1结合蛋白 (CyclinD1-binding protein 1,CCNDBP1) 能够与SIRT6相互结合[43]。本实验室在此研究基础上进一步深入,发现SIRT6能够直接与CyclinD1-CDK4复合物结合,调节其活性,从而逆转多种肿瘤细胞中的沃伯格效应 (数据尚未发表)。最后,SIRT6作为药物靶标,目前尚未发现或开发出其特异性的抑制剂和激活剂,虽然也有几项针对SIRT6进行设计新药的相关研究[52,57],但其效应尚有待进一步评估。总之,SIRT6在肿瘤的发生和发展中发挥着重要作用,是肿瘤临床诊断和治疗中的潜在靶点。
REFERENCES
[1] Imai S, Armstrong CM, Kaeberlein M, et al. Transcriptional silencing and longevity protein sir2 is an nad-dependent histone deacetylase. Nature, 2000, 403(6771): 795–800.
[2] Frye RA. Phylogenetic classification of prokaryotic and eukaryotic sir2-like proteins. Biochem Biophys Res Commun, 2000, 273(2): 793–798.
[3] Michishita E, Park JY, Burneskis JM, et al. Evolutionarily conserved and nonconserved cellular localizations and functions of human sirt proteins. Mol Biol Cell, 2005, 16(10): 4623–4635.
[4] Rajendran R, Garva R, Krstic-Demonacos M, et al. Sirtuins: molecular traffic lights in the crossroad of oxidative stress, chromatin remodeling, and transcription. J Biomed Biotechnol, 2011, 2011: 368276.
[5] Kanfi Y, Naiman S, Amir G, et al. The sirtuin sirt6 regulates lifespan in male mice. Nature, 2012, 483(7388): 218–221.
[6] Whitaker R, Faulkner S, Miyokawa R, et al. Increased expression of drosophila sir2 extends life span in a dose-dependent manner. Aging (Albany NY), 2013, 5(9): 682–691.
[7] Mostoslavsky R, Chua KF, Lombard DB, et al. Genomic instability and aging-like phenotype in the absence of mammalian sirt6. Cell, 2006, 124(2): 315–329.
[8] Liszt G, Ford E, Kurtev M, et al. Mouse sir2 homolog sirt6 is a nuclear ADP-ribosyltransferase. J Biol Chem, 2005, 280(22): 21313–21320.
[9] Jiang H, Khan S, Wang Y, et al. SIRT6 regulates TNF-α secretion through hydrolysis of long-chain fatty acyl lysine. Nature, 2013, 496(7443): 110–113.
[10] Sebastián C, Zwaans BM, Silberman DM, et al. The histone deacetylase sirt6 is a tumor suppressor that controls cancer metabolism. Cell, 2012, 151(6): 1185–1199.
[11] Lin ZH, Yang H, Tan C, et al. Usp10 antagonizes c-MYC transcriptional activation through sirt6 stabilization to suppress tumor formation. Cell Rep, 2013, 5(6): 1639–1649.
[12] Marquardt JU, Fischer K, Baus K, et al. Sirtuin-6-dependent genetic and epigenetic alterations are associated with poor clinical outcome in hepatocellular carcinoma patients. Hepatology, 2013, 58(3): 1054–1064.
[13] Wu MH, Dickinson SI, Wang X, et al. Expression and function of sirt6 in muscle invasive urothelial carcinoma of the bladder. Int J Clin Exp Pathol, 2014, 7(10): 6504–6513.
[14] Mahlknecht U, Ho AD, Voelter-Mahlknecht S. Chromosomal organization and fluorescence in situ hybridization of the human sirtuin 6 gene. Int J Oncol, 2006, 28(2): 447–456.
[15] Tennen RI, Berber E, Chua KF. Functional dissection of sirt6: identification of domains that regulate histone deacetylase activity and chromatin localization. Mech Ageing Dev, 2010, 131(3): 185–192.
[16] Chakrabarty SP, Balaram H. Reversible binding of zinc insir2: structure and activity of the apoenzyme. Biochim Biophys Acta (BBA)-Proteins Proteom, 2010, 1804(9): 1743–1750.
[17] Pan PW, Feldman JL, Devries MK, et al. Structure and biochemical functions of sirt6. J Biol Chem, 2011, 286(16): 14575–14587.
[18] Finkel T, Serrano M, Blasco MA. The common biology of cancer and ageing. Nature, 2007, 448(7155): 767–774.
[19] Warburg O. On the origin of cancer cells. Science, 1956, 123(3191): 309–314.
[20] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell, 2011, 144(5): 646–674.
[21] Lyssiotis CA, Cantley LC. Sirt6 puts cancer metabolism in the driver's seat. Cell, 2012, 151(6): 1155–1156.
[22] Van Meter M, Mao ZY, Gorbunova V, et al. SIRT6 overexpression induces massive apoptosis in cancer cells but not in normal cells. Cell Cycle, 2011, 10(18): 3153–3158.
[23] Jemal A, Bray F, Center MM, et al. Global cancer statistics. CA: Cancer J Clin, 2011, 61(2): 69–90.
[24] Zhang J, Liu H, Pan H, et al. The histone acetyltransferase hmof suppresses hepatocellular carcinoma growth. Biochem Biophys Res Commun, 2014, 452(3): 575–580.
[25] Zhang ZG, Qin CY. Sirt6 suppresses hepatocellular carcinoma cell growth via inhibiting the extracellular signalregulated kinase signaling pathway. Mol Med Rep, 2014, 9(3): 882–888.
[26] Min LH, Ji Y, Bakiri L, et al. Liver cancer initiation is controlled by AP-1 through SIRT6-dependent inhibition of survivin. Nat Cell Biol, 2012, 14(11): 1203–1211.
[27] Wang JX, Yi Y, Li YW, et al. Down-regulation of sirtuin 3 is associated with poor prognosis in hepatocellular carcinoma after resection. BMC Cancer, 2014, 14: 297.
[28] Feng XX, Luo J, Liu M, et al. Sirtuin 6 promotes transforming growth factor-β1/H2O2/HOCl-mediated enhancement of hepatocellular carcinoma cell tumorigenicity by suppressing cellular senescence. Cancer Sci, 2015, 106(5): 559–566.
[29] Han ZJ, Liu L, Liu YX, et al. Sirtuin SIRT6 suppresses cell proliferation through inhibition of Twist1 expression in non-small cell lung cancer. Int J Clin Exp Pathol, 2014, 7(8): 4774–4781.
[30] Cai Y, Sheng ZY, Liang SX. Radiosensitization effect of overexpression of adenovirus-mediated SIRT6 on A549 non-small cell lung cancer cells. Asian Pac J Cancer Prev, 2014, 15(17): 7297–7301.
[31] Azuma Y, Yokobori T, Mogi A, et al. SIRT6 expression is associated with poor prognosis and chemosensitivity in patients with non-small cell lung cancer. J Surg Oncol, 2015, 112(2): 231–237.
[32] Kim EJ, Juhnn YS. Cyclic AMP signaling reduces sirtuin 6 expression in non-small cell lung cancer cells by promoting ubiquitin-proteasomal degradation via inhibition of the raf-mek-erk (raf/mitogen-activated extracellular signal- regulated kinase/extracellular signal- regulated kinase) pathway. J Biol Chem, 2015, 290(15): 9604–9613.
[33] Jacobo-Herrera NJ, Pérez-Plasencia C, Camacho-Zavala E, et al. Clinical evidence of the relationship between aspirin and breast cancer risk (review). Oncol Rep, 2014, 32(2): 451.
[34] Khongkow M, Olmos Y, Gong C, et al. SIRT6 modulates paclitaxel and epirubicin resistance and survival in breast cancer. Carcinogenesis, 2013, 34(7): 1476–1486.
[35] Choe M, Brusgard JL, Chumsri S, et al. The RUNX2 transcription factor negatively regulates SIRT6 expression to alter glucose metabolism in breast cancer cells. J Cell Biochem, 2015, 116(10): 2210–2226.
[36] Thirumurthi U, Shen J, Xia WY, et al. MDM2-mediated degradation of SIRT6 phosphorylated by AKT1 promotes tumorigenesis and trastuzumab resistance in breast cancer. Sci Signal, 2014, 7(336): ra71.
[37] Wang D, Li CL, Zhang XM. The promoter methylation status and mrna expression levels of ctcf and sirt6 in sporadic breast cancer. DNA Cell Biol, 2014, 33(9): 581–590.
[38] Liu YW, Xie QR, Wang BS, et al. Inhibition of SIRT6 in prostate cancer reduces cell viability and increases sensitivity to chemotherapeutics. Protein Cell, 2013, 4(9): 702–710.
[39] Colas E, Perez C, Cabrera S, et al. Molecular markers of endometrial carcinoma detected in uterine aspirates. Int J Cancer, 2011, 129(10): 2435–2444.
[40] Fukuda T, Wada-Hiraike O, Oda K, et al. Putative tumor suppression function of sirt6 in endometrial cancer. FEBS Lett, 2015, 589(17): 2274–2281.
[41] Zhang J, Yin XJ, Xu CJ, et al. The histone deacetylase SIRT6 inhibits ovarian cancer cell proliferation via down-regulation of Notch 3 expression. Eur Rev Med Pharmacol Sci, 2015, 19(5): 818–824.
[42] Ferlay J, Soerjomataram I, Dikshit R, et al. Globocan 2012 v1.0, cancer incidence and mortality worldwide: Iarc cancerbase No. 11 [internet]. Lyon, France: International Agency for Research on Cancer, 2013.
[43] Ma WB, Stafford LJ, Li DL, et al. GCIP/CCNDBP1, a helix-loop-helix protein, suppresses tumorigenesis. J Cell Biochem, 2007, 100(6): 1376–1386.
[44] Qi WT, Fitchev PS, Cornwell ML, et al. FOXO3 growth inhibition of colonic cells is dependent on intraepithelial lipid droplet density. J Biol Chem, 2013, 288(23): 16274–16281.
[45] Rajendran P, Kidane AI, Yu TW, et al. HDAC turnover, CtIP acetylation and dysregulated DNA damage signaling in colon cancer cells treated with sulforaphane and related dietary isothiocyanates. Epigenetics, 2013, 8(6): 612–623.
[46] Nuño-Gonzalez A, Vicente-Martin FJ, Pinedo-Moraleda F, et al. High-risk cutaneous squamous cell carcinoma. Actas Dermo-Sifiliogr, 2012, 103(7): 567–578.
[47] Lai CC, Lin PM, Lin SF, et al. Altered expression ofgene family in head and neck squamous cell carcinoma. Tumour Biol, 2013, 34(3): 1847–1854.
[48] Lu CT, Hsu CM, Lin PM, et al. The potential of SIRT6 and SIRT7 as circulating markers for head and neck squamous cell carcinoma. Anticancer Res, 2014, 34(12): 7137–7143.
[49] Yu CS, Ding Y, Zeng D, et al. Expression and clinical significance of SIRT6 in gastric cancer. J Shanxi Med Univ, 2015, 46(3): 216–218 (in Chinese). 余长寿, 丁瑜, 曾锻, 等. 去乙酰化酶6在胃癌中的表达. 山西医科大学学报, 2015, 46(3): 216–218.
[50] Chen X, Hao B, Liu Y, et al. The histone deacetylase SIRT6 suppresses the expression of the rna-binding protein PCBP2 in glioma. Biochem Biophys Res Commun, 2014, 446(1): 364–369.
[51] Bauer I, Grozio A, Lasigliè D, et al. The NAD+-dependent histone deacetylase SIRT6 promotes cytokine production and migration in pancreatic cancer cells by regulating Ca2+responses. J Biol Chem, 2012, 287(49): 40924–40937.
[52] Sociali G, Galeno L, Parenti MD, et al. Quinazolinedione SIRT6 inhibitors sensitize cancer cells to chemotherapeutics. Eur J Med Chem, 2015, 102: 530–539.
[53] Ming M, Han WN, Zhao BZ, et al. SIRT6 promotes COX-2 expression and acts as an oncogene in skin cancer. Cancer Res, 2014, 74(20): 5925–5933.
[54] Wang JC, Kafeel MI, Avezbakiyev B, et al. Histone deacetylase in chronic lymphocytic leukemia. Oncology, 2011, 81(5/6): 325–329.
[55] Li HY. The exprimental research on expression of Sirtuins in laryngeal carcinoma and drug resistant cell lines[D]. Changchun: Jilin University, 2014 (in Chinese). 李涵宇. Sirtuins在喉癌细胞及其耐药株中表达水平的实验研究[D]. 长春: 吉林大学, 2014.
[56] Lee Y, Dominy JE, Choi YJ, et al. Cyclin D1-Cdk4 controls glucose metabolism independently of cell cycle progression. Nature, 2014, 510(7506): 547–551.
[57] He B, Hu J, Zhang XY, et al. Thiomyristoyl peptides as cell-permeable Sirt6 inhibitors. Org Biomol Chem, 2014, 12(38): 7498–7502.
Function of SIRT6 in tumor initiation and progression
Zhen Dong1, Qian Lei1, Lichao Liu2, and Hongjuan Cui1
1 College of Biotechnology, State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400716, China 2 Department of Dermatology, the Third Hospital of Hebei Medical University, Shijiazhuang 050051, Hebei, China
As a member of the sirtuins family, also called Class III histone deacetylases (HDACs), SIRT6 has many catalytic enzyme activities and plays a pivotal role in biological processes including anti-aging, chromatin regulation, transcriptional control, glucose and lipid metabolism, and DNA damage repair. Recently, increasing evidences indicated that SIRT6 was related to initiation and development of tumors, such as hepatic cancer, lung cancer, breast cancer and genital system tumors. However, SIRT6 might play a dual role in tumorigenesis and progression. SIRT6 often acted as a tumor suppressor, but might play an oncogenic role. Based on our current study, we depicted the essential roles of SIRT6 in the initiation and progression of various tumors, and summarized its mode of actions, which might provide clues for cancer therapy.
SIRT6, tumor initiation, tumor development, Warburg effect, histone deacetylases (HDACs)
September 21, 2015; Accepted: November 3, 2015
综 述 |
董振, 雷倩, 刘力超, 等. 长寿蛋白SIRT6在肿瘤发生发展中的作用. 生物工程学报, 2016, 32(7): 870–879.
Dong Z, Lei Q, Liu LC, et al. Function of SIRT6 in tumor initiation and progression. Chin J Biotech, 2016, 32(7): 870–879.
Supported by: National Natural Science Foundation of China (Nos. 31501100, 81502574).
Corresponding author: Hongjuan Cui. Tel: +86-23-68251713; Fax: +86-23-68251128; E-mail: hongjuan.cui@gmail.com, hcui@swu.edu.cn
国家自然科学基金 (Nos. 31501100, 81502574) 资助。
网络出版时间:2016-01-06 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20160106.1106.004.html
(本文责编 陈宏宇)
