日本血吸虫凋亡基因Sjcaspase3的克隆、真核表达 及其功能分析
2016-09-19王涛洪炀韩宏晓吕超贾秉光曹晓丹韩倩陆珂李浩傅志强林矫矫
王涛,洪炀,韩宏晓,吕超,贾秉光,曹晓丹,韩倩,陆珂,李浩,傅志强,林矫矫
日本血吸虫凋亡基因的克隆、真核表达 及其功能分析
王涛,洪炀,韩宏晓,吕超,贾秉光,曹晓丹,韩倩,陆珂,李浩,傅志强,林矫矫
中国农业科学院 上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241
为深入研究日本血吸虫细胞凋亡机制。利用PCR技术扩增得到的全长序列,其ORF含900 bp,编码299个氨基酸,理论分子量为33 509.7 Da,理论等电点为6.39。Real-time PCR分析表明该基因在日本血吸虫生长发育的各个时期均有表达,其中21 d表达量最高,42 d雌虫表达量高于42 d雄虫。成功构建了pXJ40-FLAG-Sjcaspase3重组质粒并转染到Hela细胞内,荧光定量PCR和Western blotting分析表明成功在Hela细胞中表达。酶活分析提示重组Sjcaspase3具有切割特异性底物天冬氨酸-谷氨酸-缬氨酸-天冬氨酸 (DEVD) 的活性。流式细胞术检测了可诱导Hela细胞发生早期细胞凋亡。研究结果为深入探讨的生物学功能及日本血吸虫细胞凋亡机制奠定了基础。
日本血吸虫,caspase3,细胞凋亡,酶活,细胞流式
细胞凋亡 (Apoptosis) 是细胞程序性死亡(Programmed cell death) 的一种重要方式。它在多细胞生物去除不需要和异常细胞中起着重要作用,对多细胞生物体生长发育具有重要的意义。目前,研究比较透彻的凋亡调控通路主要有两条:即外源性的死亡受体通路和内源性的线粒体通路。两种通路虽然起始的调控基因不同,但终点都是半胱天冬酶家族 (Caspase family) 成员的激活并进行一系列切割,最终导致细胞不可逆地发生细胞凋亡。可见Caspase家族在细胞凋亡中起着不可替代的作用。
本实验室前期对日本血吸虫的细胞凋亡现象和机制进行了初步探索。彭金彪等对不同适宜性宿主来源10 d日本血吸虫童虫的细胞凋亡进行了观察和比较,发现非适宜性宿主来源的日本血吸虫存在更明显的细胞凋亡现象[1]。韩宏晓等在miRNA水平上分析了不同适宜性宿主来源日本血吸虫差异表达的miRNA,发现一些与调控凋亡相关的miRNA在不同适宜性宿主来源虫体呈现差异表达[2]。郭小勇等观察并实验证明了大、小鼠来源不同时期的日本血吸虫存在细胞凋亡现象[3]。以上研究说明日本血吸虫和其他多细胞生物一样存在细胞凋亡现象,并且细胞凋亡与日本血吸虫的生长发育具有重要关系。
2009年日本血吸虫全基因组测序工作的完成对深入开展日本血吸虫凋亡机制的研究提供了重要基础[4]。人类等高等哺乳动物的Caspase家族目前已经发现有11个成员,而日本血吸虫仅仅在基因组水平上发现了4个成员[5]。本实验室前期已在转录及蛋白水平上证实日本血吸虫存在Caspase9[6],但其他成员却未见相关报道。
很早以前人们就开始关注细胞凋亡在癌症治疗方面的应用[7-8],在细胞凋亡中Caspase3就是一个关键的分子[9]。近几年人们开始关注细胞凋亡在治疗血吸虫病方面的应用前景[10]。2013年Kumar等利用生物信息学分析了血吸虫的Caspase3/7成员并对比了人类的Caspase成员[11],发现血吸虫的Caspase3/7蛋白在二级结构和三级结构上和它们的哺乳动物宿主具有一定的差异,分析了血吸虫Caspase3/7作为药物靶点的可能性。因此对日本血吸虫基因的研究具有重要意义,不仅有助于对日本血吸虫细胞凋亡机制的理解,也可能有助于日本血吸虫病新药物靶点的鉴定。
本研究对日本血吸虫3进行了克隆、表达,验证了其具有切割特异性底物的活性,并可诱导Hela细胞发生细胞凋亡,为深入研究日本血吸虫细胞凋亡机制奠定了基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂和酶
Trizol、SuperscriptTMⅢ反转录酶购自Invitrogen公司;ExDNA聚合酶、T4 DNA连接酶、pMD19-T载体、限制性内切酶、PrimeScriptTM PT-PCR Kit、SYBR®Premix ExTMⅡ (Perfect Real Time)、EASY Dilution (For Real Time PCR) 均购自TaKaRa生物工程 (大连) 有限公司;DNA纯化回收试剂盒,小型质粒回收试剂盒购自Axygen公司;大型质粒纯化回收试剂盒购自QIAGEN公司。Caspase3/7活性检测试剂盒,FuGene HD转染试剂购自Progema公司;FLAG单抗购自CST公司; HRP标记的山羊抗小鼠二抗购自北京碧云天生物技术研究所;Annexin V-FITC/PI细胞凋亡检测试剂盒购自Invitrogen公司;pXJ40-FLAG质粒由中国农业科学院上海兽医研究所禽病实验室保存;DAPI染料购自上海前尘生物科技有限公司;Anti-Flag亲和凝胶和Poly Flag多肽购自Biotool生物公司。
1.1.2 生物材料
DH5α和BL21 (DE3) 感受态细胞购自北京全式金生物有限公司;Hela细胞由中国农业科学院上海兽医研究所禽病实验室保存;日本血吸虫虫体由中国农业科学院上海兽医研究所血吸虫实验室保存;6周龄雄性BALB/c购自上海斯莱克实验动物有限公司;中国大陆株日本血吸虫阳性钉螺由中国农业科学院上海兽医研究所钉螺实验室提供。
1.2 方法
1.2.1 RNA提取与反转录
取液氮保存的42 d日本血吸虫约150 mg,按照Trizol试剂盒说明书提取虫体总RNA。利用SuperscriptTMⅢ反转录酶将总RNA反转录成cDNA。
1.2.2 Sjcaspase3基因的克隆
根据日本血吸虫基因 (GenBank登录号FN315427.1) 序列设计特异引物F1 (与ORF的1-20位核苷酸重叠) 和R1 (与ORF的878–900位核苷酸反向互补),引物序列见表1,引物由上海桑尼生物科技有限公司合成。PCR反应体系参考Ex酶说明书。PCR反应条件为:95 ℃预变性 5 min;95 ℃变性 30 s,55 ℃退火 30 s,72 ℃延伸 1 min,共32个循环;72 ℃继续延伸 5 min;4 ℃终止反应并保存。
1.2.3 生物信息学分析
利用ORF FINDER (http://www.ncbi.nlm.nih. gov/gorf/gorf.htmL) 在线分析寻找开放阅读框;将序列进行BLASTX (http:// blast.ncbi.nlm.nih. gov/Blast.cgi?) 进行比对寻找同源基因;利用Primer Premier 5软件进行酶切位点分析和理论编码蛋白质序列分析;利用NCBI(http:// www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi) 和SMART (http://smart.embl-heidelberg.de/)在线分析寻找结构域;利用MEGA 6软件进行多序列比对并构建系统发育树;利用ProtParam tool (http://web.expasy.org/protparam/)在线分析氨基酸残基组成、数目,蛋白质理论分子质量和理论等电点等基本理化性质。
1.2.4 荧光定量PCR分析Sjcaspase3在各期别虫体中的表达情况
分别提取日本血吸虫尾蚴、7 d、14 d、21 d、28 d、35 d、42 d、42 d雄虫、42 d雌虫的总RNA,
按照TaKaRa PrimeScriptTMPT-PCR Kit试剂盒说明书反转录日本血吸虫各时期虫体的cDNA。以日本血吸虫基因为内参,各时期日本血吸虫cDNA为模板,并利用SYBR®Premix ExTMⅡ (Perfect Real Time) 酶进行荧光定量PCR实验。实验进行3次独立重复。荧光定量PCR引物 (F2和R2) 序列和日本血吸虫内参引物 (F3和R3) 序列见表1。引物由上海桑尼生物科技有限公司合成。
1.2.5 pXJ40-FLAG-SjCaspase3重组质粒的构建
根据自身酶切位点和pXJ40-FLAG多克隆位点设计携带有酶切位点的引物F4和R4,分别在上、下游引物的5¢端引入H I和I限制性酶切位点。引物序列见表1,引物由上海桑尼生物科技有限公司合成,PCR反应体系和反应条件同上。PCR扩增产物经纯化回收后,亚克隆到pMD19-T载体,挑取单克隆测序验证后进一步克隆到pXJ40-FLAG载体上并再次进行测序验证。将构建成功的pXJ40-FLAG-Sjcaspase3单克隆菌液大量培养,并利用QIAGEN质粒抽提试剂盒提取pXJ40-FLAG-Sjcaspase3重组质粒,保存备用。
表1 PCR和RT-PCR引物
Table 1 Primers used for PCR and RT-PCR

1.2.6 转染Hela细胞
将生长状况良好的Hela细胞用完全培养基稀释成2×105cells/mL浓度,按每孔2 mL的量铺到35 mm直径的细胞培养皿中。待细胞贴壁生长至80%–90%时可进行细胞转染。弃去培养基,利用37 ℃预热的PBS洗3遍后加入 1 mL 37 ℃预热的含2%胎牛血清的完全培养基。利用FuGene HD转染试剂,按照质粒 (µg) 与转染试剂 (µL) 1∶3的比例配制进行转染。每个培养皿转染2 µg质粒。分别设置对照组、空质粒组和Sjcaspase3组。其中对照组只更换培养基,不进行质粒转染;空质粒组转染相应的pXJ40-FLAG质粒;Sjcaspase3组转染pXJ40- FLAG-Sjcaspase3重组质粒。
1.2.7 荧光定量PCR分析Sjcaspase3基因的 表达
转染Hela细胞后6、9、12、15 h,先弃去培养基,利用37 ℃预热的PBS洗3遍,然后加入Trizol反复吹打细胞。按照上述方法提取Hela细胞的总RNA并反转录成cDNA。以的荧光定量PCR引物和人类的基因为内参,以各期别虫体cDNA为模板,按照上述方法进行荧光定量PCR分析,每个实验重复3次。内参基因的引物 (F5和R5) 见表1。
1.2.8 Western blotting分析Sjcaspase3蛋白表达
转染Hela细胞后6、9、12、15 h,先弃去培养基,利用37 ℃预热的PBS洗3遍,然后加入200 µL RIPA (含蛋白酶抑制剂) 细胞裂解液4 ℃裂解30 min。收集细胞裂解液,4 ℃、12 000×离心10 min,取上清进行Western blotting分析Sjcaspase3蛋白在Hela细胞中的表达。
1.2.9 rSjcaspase3重组蛋白的纯化
转染Hela细胞后15 h后先弃去培养基,利用37 ℃预热的PBS清洗3遍,然后加入400 µL RIPA细胞裂解液裂解30 min。收集细胞裂解液,4 ℃、12 000×离心10 min取上清。按照Anti-Flag亲和凝胶纯化说明书进行操作,取 300 µL细胞裂解液并加入100 µL亲和凝胶4 ℃振荡孵育4 h。利用TBS缓冲液清洗3遍后加入200 µg/mL的Poly Flag多肽200 µL。4 ℃振荡孵育4 h后,4 ℃、10 000×离心1 min取上清即为纯化的目的蛋白。取10 µL目的蛋白上清并加入10 µL 2×上样缓冲液煮沸后进行SDS-PAGE蛋白电泳实验。
1.2.10 Caspase酶活检测
转染Hela细胞15 h后先弃去培养基,利用37 ℃预热的PBS清洗3遍,然后加入400 µL RIPA细胞裂解液裂解30 min。收集细胞裂解液,4 ℃、12 000×离心10 min取上清。按照Promega Caspase3/7酶活检测试剂盒说明书操作,每组各取200 µL并加入200 µL含天冬氨酸-谷氨酸-缬氨酸-天冬氨酸 (DEVD) 序列的蛋白底物,混匀后在室温下避光振荡。30 min后利用FB12 光度计读取荧光强度。取剩下的蛋白裂解液进行蛋白浓度测定。每个组别进行3次独立重复实验。
Sjcaspase3体外酶活检测实验方法同上。取100 µL含rSjcaspase3重组蛋白上清并加入 100 µL底物,混匀后在室温下避光振荡。对照组为进行相同处理的阴性细胞裂解液。30 min后利用FB12 光度计读取荧光强度。每个组别进行3次独立重复实验。
1.2.11 流式细胞术检测细胞凋亡
转染Hela细胞15 h后利用流式细胞术分别检测对照组、空质粒组和Sjcaspase3重组质粒组细胞凋亡率,对凋亡细胞进行统计学分析。转染Hela细胞15 h后收集各组细胞,利用PBS洗3遍。按照Invitrogen凋亡检测试剂盒说明书利用Binding buffer (试剂盒内提供) 稀释细胞浓度至1×106cells/mL。避光下100 µL细胞悬液中加入5 µL Annexin V-FITC和1 µL PI染色 15 min后利用流式细胞仪检测细胞凋亡。
2 结果与分析
2.1基因克隆和生物信息学分析
利用日本血吸虫42 d cDNA为模板,利用全长基因引物F1和R1进行PCR扩增。核酸凝胶电泳分析在750 bp和1 000 bp之间得到一条DNA片段 (图1)。
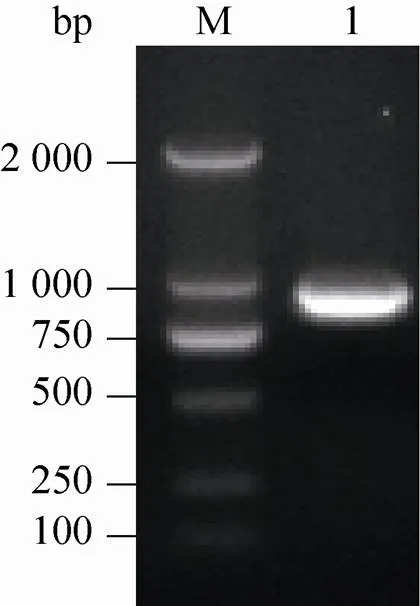
图1 PCR扩增Sjcaspase3基因
生物信息学分析表明的ORF共有900 bp,编码299个氨基酸残基,理论分子量为33 509.7 Da,理论等电点为6.39。利用NCBI的Blastx在线工具分析,发现该基因与曼氏血吸虫SmCaspase3基因的相似性为77%,故将此基因命名为。利用NCBI的Conserved Domains Search Service和SMART进行结构域搜索,结果显示Sjcaspase3属于CASc超家族,具有CASc结构域 (图2)。选择曼氏血吸虫、埃及血吸虫、华支睾吸虫、细粒棘球绦虫和人类的基因与日本血吸虫的基因进行多序列比较,较高相似性依次为77%、73%、53%、50%和43%。利用MEGA 6软件构建系统发育树,结果显示曼氏血吸虫的基因与日本血吸虫的亲缘性最近,与人的基因亲缘性较远 (图3)。
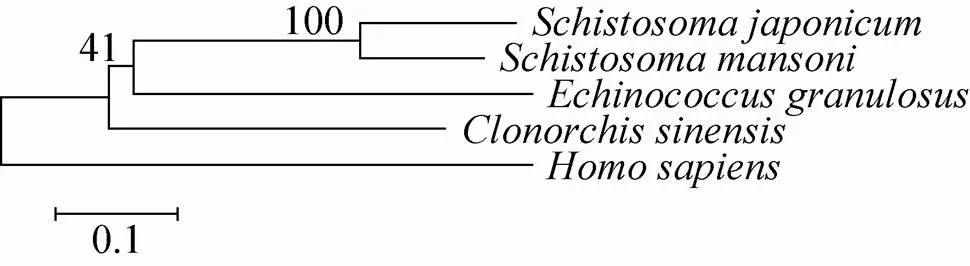
图3 Sjcaspase3系统发育树
2.2在各期别虫体中的表达情况分析
荧光定量PCR结果分析表明,在日本血吸虫尾蚴、7 d、14 d、21 d、28 d、35 d、42 d虫体中均有表达 (图4),其中21 d虫体表达量最高。42 d虫体雌雄虫转录水平相比,雌虫表达量高于雄虫且具有显著性差异 (<0.05)。
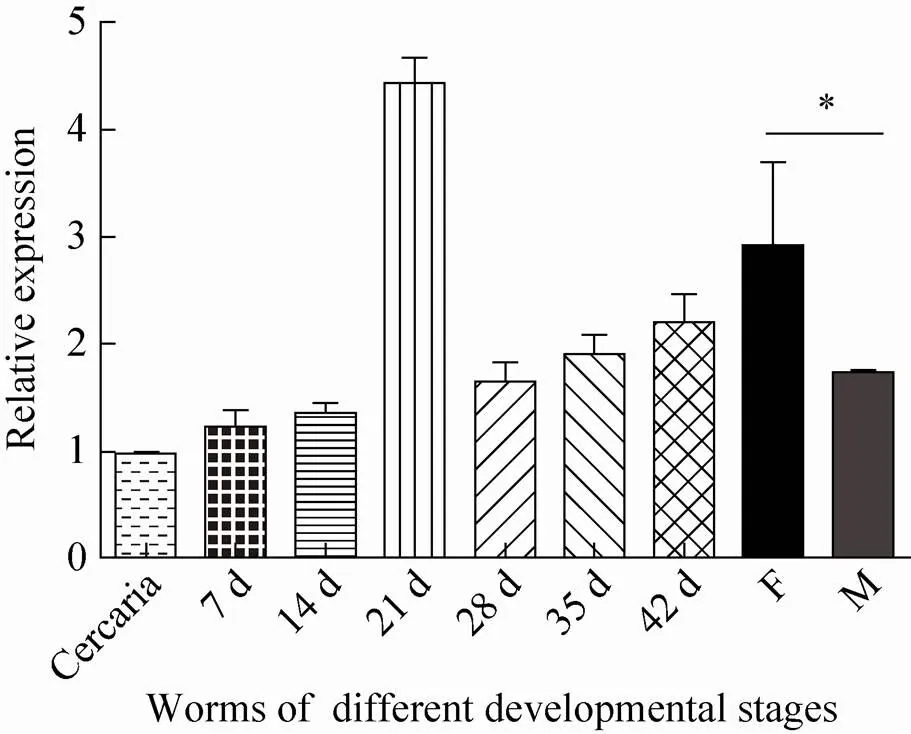
图4 荧光定量PCR分析Sjcaspase3在日本血吸虫体内各期别的转录水平 () *表示差异显著 (P<0.05)
2.3 转染Hela细胞后基因转录 水平
pXJ40-FLAG-Sjcaspase3重组质粒转染Hela细胞后,分别在0、6、9、12、15 h时经荧光定量PCR技术分析基因的表达量 (图5)。结果显示在转染pXJ40-FLAG-Sjcaspase3质粒后6 h可检测到基因的转录,在15 h之内随着时间的延长基因的表达量随着时间的延长逐步上升。
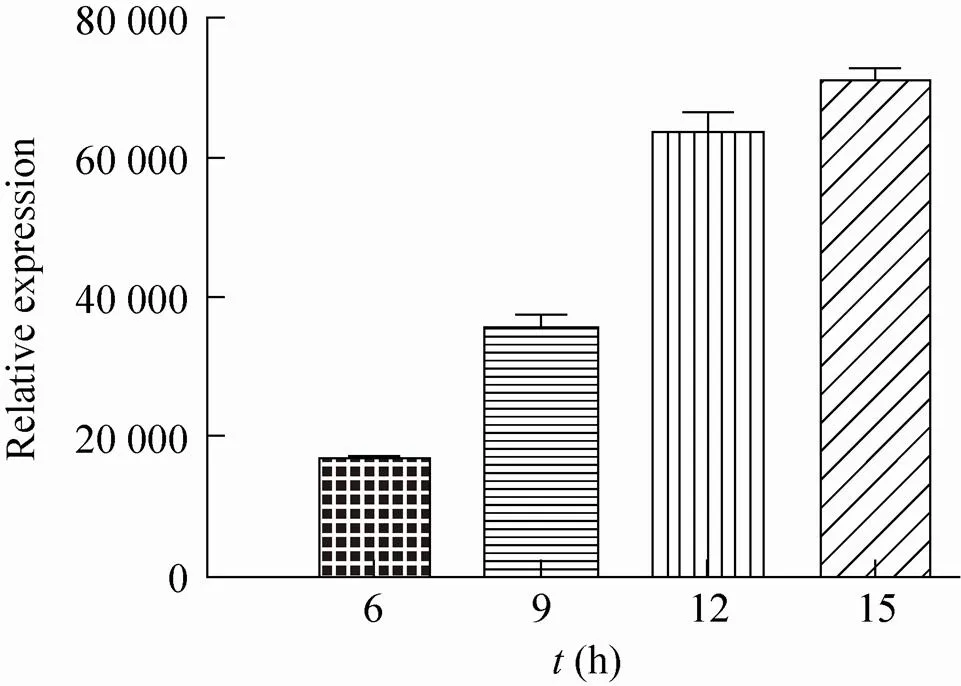
图5 Sjcaspase3在Hela细胞中不同时间的转录水平 (±s)
2.4 转染Hela细胞后Western blotting检测Sjcaspase3蛋白表达情况
如图6所示,转染Hela细胞后分别在6、9、12、15 h时收样进行Western blotting检测,12 h时可见有微量Sjcaspase3蛋白表达,15 h后可见明显的Sjcaspase3蛋白表达。

图6 Sjcaspase3蛋白在Hela细胞中表达检测
2.5 rSjcaspase3重组蛋白的纯化
利用Anti-Flag亲和凝胶对Hela细胞表达的rSjcaspase3重组蛋白进行纯化并进行SDS-PAGE蛋白电泳,结果如图7所示。纯化结果为单一条带,蛋白大小约33 kDa,符合预期。

图7 rSjcaspase3重组蛋白的纯化
2.6 酶活检测
转染Hela细胞15 h后分别提取细胞总蛋白并进行均一化处理。分别测定对照组、空质粒组和Sjcaspase3重组质粒组的Caspase酶活性结果 (图8)。结果显示,与对照组和空质粒组相比,Sjcaspase3重组质粒组具有较高的荧光强度。体外Caspase酶活实验结果如图9所示,结果与对照组相比,纯化的rSjcaspase3重组蛋白组具有较强的荧光强度。
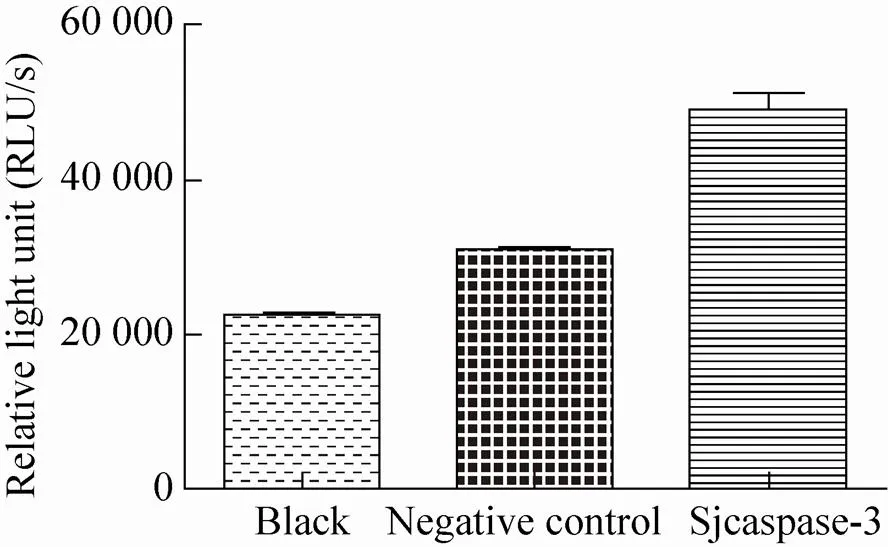
图8 转染Hela细胞15 h后不同组别Caspase酶活检测
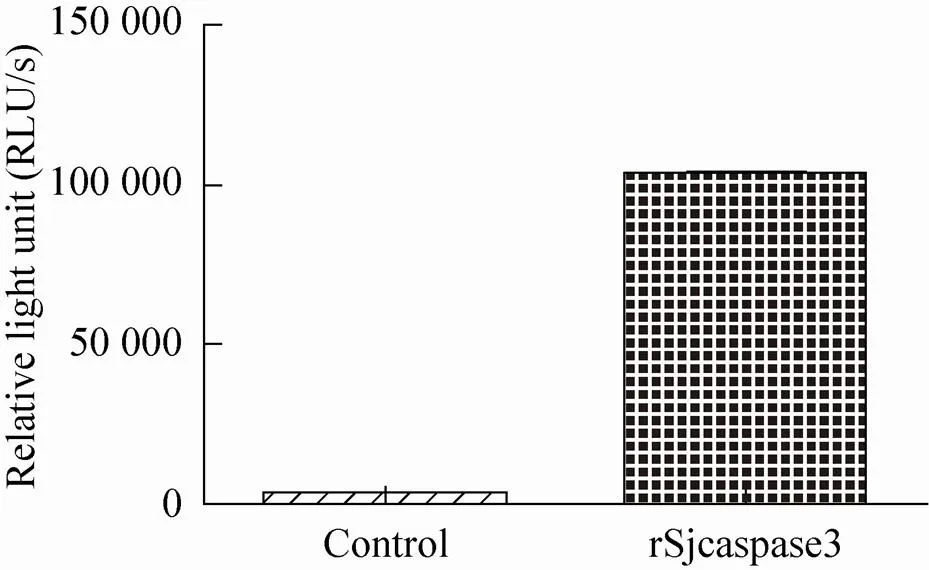
图9 rSjcaspase3重组蛋白体外Caspase酶活检测
2.7 流式细胞术检测细胞凋亡
细胞流式结果如图10所示。对照组中有99.1%的细胞为正常细胞,早期凋亡细胞占0.5%,晚期凋亡细胞占0.4%;空质粒组正常细胞占91.7%,早期凋亡细胞占5.3%,晚期凋亡细胞占0.7%,死亡细胞占2.2%;Caspase3组正常细胞占79.8%,早期凋亡细胞占19.2%,晚期凋亡细胞占0.3%,死亡细胞占0.7%。
3 讨论
日本血吸虫病是一种严重危害公共卫生安全的人畜共患寄生虫病,截至2013年底,全国推算有血吸虫病人184 943例[12]。血吸虫病的防治措施是使用吡喹酮化疗为主,而长期大规模使用吡喹酮治疗引起了人们对耐药性的担心[13]。因此,迫切需要治疗血吸虫病新药物靶点的筛选,而血吸虫细胞凋亡分子就具有作为新药物靶点的潜力。本实验室前期在探讨东方田鼠对日本血吸虫感染的抗性机制时发现,细胞凋亡可能是东方田鼠清除日本血吸虫的机制之一[14]。Dubois等利用凋亡诱导药物Trichostatin A (TSA)在体外对曼氏血吸虫进行处理,发现TSA可以提高曼氏血吸虫Caspase3/7的表达量,可见Caspase3在曼氏血吸虫细胞凋亡过程中发挥作用并具有作为药物靶标的潜力[15]。Hines-Kay等研究表明PZQ对血吸虫的杀伤作用与细胞凋亡有关[16],因此研究血吸虫细胞凋亡分子具有重要意义。
最早H. Robert Horvitz研究团队在1993年研究秀丽隐杆线虫时发现一个基因在凋亡细胞中表达特别丰富,命名为CED3,Horvitz发现此基因编码一种蛋白酶并与细胞凋亡有关[17]。随后,人们研究发现人类也存在与线虫CED3同源的基因CPP32[18],也证明此基因具有导致细胞凋亡的作用。后来人们陆续在人类基因中发现许多与线虫CED3同源的基因[19-21]。由于这些基因编码的蛋白质都具有半胱氨酸依赖性的天冬氨酸酶活性,因此命名为半胱天冬酶 (Caspase)。Caspase家族成员分为两类,一类是起始者 (Initiators),一类是执行者 (Executioners)。其中起始者负责凋亡信号的传递和放大,主要成员有Caspase8/9/10等。而执行者的功能就像细胞的“刽子手”一样,被激活后就会切割特异性底物,导致细胞发生不可逆的凋亡,主要成员有Caspase3/6/7。本研究对日本血吸虫凋亡基因进行了克隆和真核表达,并证明了其具有切割特异性底物 (DEVD) 和诱导Hela细胞发生细胞凋亡的作用。
荧光定量PCR结果表明在日本血吸虫生长发育的各个时期均有表达,其中21 d虫体表达量最高。日本血吸虫雌雄虫一般在入侵后14–16 d开始合抱,19–21 d雌雄虫生殖器官及其相应的管道全部形成,虫体处于配子发生期,睾丸及卵巢开始有精子及卵子产生,是虫体生长发育最快的阶段之一[22]。在21 d呈现高表达可能与虫体的快速生长发育及性器官的发育成熟和产卵有关。42 d雌虫比42 d雄虫表达量高且差异显著,这可能与雌虫大量产卵相关。先前也有报道未成功合抱的曼氏血吸虫雌虫的卵巢会退化并发生细胞凋亡[23],这一结果提示基因可能对雌虫生殖器官发育和产卵具有重要作用。
pXJ40是一种哺乳动物细胞表达载体,经过多克隆位点前添加了一个FLAG标签 (DYKDDDDK) 的修饰后并不影响其连接和表达目的蛋白功能,已有多位学者利用添加标签修饰后的pXJ40载体表达出有功能的目的蛋 白[24-26]。本实验构建了pXJ40-FLAG-Sjcaspase3重组质粒,荧光定量PCR和Western blotting分析表明重组质粒成功转入Hela细胞,并可在该细胞系中表达。
Caspase家族蛋白具有切割特异性底物 (天冬氨酸残基后的肽键)。为了检测日本血吸虫的Sjcaspase3是否具有典型的Caspase家族特征。我们提取了含Sjcaspase3目的蛋白的细胞裂解液,并加入了含天冬氨酸-谷氨酸-缬氨酸-天冬氨酸 (DEVD) 序列的蛋白底物和其他非底物酶。当特异性底物被切割后,其他酶会继续发挥作用,与切割后的底物发生作用并发出荧光,并且荧光强度和Caspase酶活性成正比例相关。经检测,与阴性对照组和空质粒对照组相比,Sjcaspase3组Caspase酶活性明显增强。为进一步证明Sjcaspase3蛋白的Caspase酶活性,我们对Hela细胞中的rSjcaspase3重组蛋白进行了纯化,并利用纯化后的rSjcaspase3重组蛋白进行了体外Caspase酶活检测。结果表明rSjcaspase3重组蛋白在体外也具有较高的Caspase酶活性。可见,日本血吸虫的基因在Hela中成功表达且翻译出具有酶活的蛋白,此蛋白具有Caspase家族其他蛋白切割特意底物的活性。
细胞凋亡具有一系列典型特征,如细胞膜皱缩,内陷、细胞核皱缩,崩解、形成凋亡小体、保持膜完整性等,通过检测这些特征性变化可以判断细胞是否发生了细胞凋亡。当细胞发生早期细胞凋亡时细胞膜上的磷脂酰丝氨酸会外翻,它能与Annexin V特异性结合,因此可以利用FITC标记的Annexin V检测到。当细胞处于细胞凋亡晚期时,细胞膜依然保持完整但通透性会发生改变,这时核染料PI就能进入细胞核并与之结合。细胞坏死后细胞膜破裂,细胞可以被PI染色,但是却不能被Annexin V-FITC标记,以此判断细胞为坏死细胞。本研究通过细胞流式实验检测了诱导Hela细胞凋亡的作用。结果显示,对照组99%以上的细胞为正常细胞。空质粒组可能由于外源核酸的应激作用,诱导了5.3%和0.7%的细胞发生了早期凋亡与晚期凋亡,并且有2.2%的细胞发生坏死。但是空质粒组仍有90%以上的细胞为正常细胞。Sjcaspase3组早期细胞凋亡率为19.2%,明显高于对照组和空质粒组,但是晚期凋亡率却无明显差别。说明日本血吸虫的基因的表达可诱导Hela细胞发生早期细胞凋亡。
综上,本研究对日本血吸虫进行了初步的研究,为深入研究日本血吸虫细胞凋亡机制奠定了基础。
REFERENCES
[1] Peng JB. Analysis of differentially expressed genes among the schistosomula offrom different hosts [D]. Shanghai: Chinese Academy of Agricultural Sciences, 2010 (in Chinese). 彭金彪. 不同宿主来源日本血吸虫童虫差异表达基因的研究 [D]. 上海: 中国农业科学院, 2010.
[2] Han HX. Analysis on miRNA expression of host and schistosomulum among different suitable rodent animals underinfection [D]. Yangzhou: Yangzhou University, 2013 (in Chinese). 韩宏晓. 日本血吸虫感染不同适宜性啮齿类动物后宿主及虫体miRNA表达分析 [D]. 扬州: 扬州大学, 2013.
[3] Guo XY. The preliminary observation of apoptosis in[D]. Shanghai: Chinese Academy of Agriculutural Scinece, 2014 (in Chinese).郭小勇. 日本血吸虫细胞凋亡的初步观察 [D]. 上海: 中国农业科学院, 2014.
[4] Zhou Y, Zheng HJ, Chen XY, et al. Thegenome reveals features of host-parasite interplay. Nature, 2009, 460(7253): 345–351.
[5] Lee EF, Clarke OB, Evangelista M, et al. Discovery and molecular characterization of a Bcl-2-regulated cell death pathway in schistosomes. Proc Natl Acad Sci USA, 2011, 108(17): 6999–7003.
[6] Wang F. Cloning, expression and evaluation ofof[D]. Nanjing: Nanjing Agriculture University, 2011 (in Chinese).王飞. 日本血吸虫基因的克隆、表达及免疫保护效果的初步评估 [D]. 南京: 南京农业大学, 2011.
[7] Dive C, Evans CA, Whetton AD. Induction of apoptosis-new targets for cancer chemotherapy. Semin Cancer Biol, 1992, 3(6): 417–427.
[8] Ke W. Treatment of cancer using cell apoptosis theory. Chin J Biotech, 2004, 23(4): 589 (in Chinese). 柯为. 利用细胞凋亡原理治疗癌症. 生物工程学报, 2004, 23(4): 589.
[9] Galluzzi L, Kepp O, Kroemer G. Caspase-3 and prostaglandins signal for tumor regrowth in cancer therapy. Oncogene, 2012, 31(23): 2805–2808.
[10] Lee EF, Young ND, Lim NTY, et al. Apoptosis in schistosomes: toward novel targets for the treatment of schistosomiasis. Trends Parasitol, 2014, 30(2): 75–84.
[11] Kumar S, Biswal DK, Tandon V. In-silico analysis of Caspase-3 and -7 proteases from blood-parasitic Schistosoma species (Trematoda) and their human host. Bioinformation, 2013, 9(9): 456–463.
[12] Lei ZL, Zheng H, Zhang LJ, et al. Endemics status of schistosomiasis in People’s Republic of China in 2013. Chin J Schisto Control, 2014, 26(6): 591–597 (in Chinese). 雷正龙, 郑浩, 张利娟, 等. 2013年全国血吸虫病疫情通报. 中国血吸虫病防治杂志, 2014, 26(6): 591–597.
[13] Doenhoff MJ, Kusel JR, Coles GC, et al. Resistance ofto praziquantel: is there a problem? Trans R Soc Trop Med Hyg, 2002, 96(5): 465–469.
[14] Peng JB, Gobert GN, Hong Y, et al. Apoptosis governs the elimination offrom the non-permissive host Microtus fortis. PLoS ONE, 2011, 6(6): e21109.
[15] Dubois F, Caby S, Oger F, et al. Histone deacetylase inhibitors induce apoptosis, histone hyperacetylation and up-regulation of gene transcription in. Mol Biochem Parasitol, 2009, 168(1): 7–15.
[16] Hines-Kay J, Cupit PM, Sanchez MC, et al. Transcriptional analysis oftreated with praziquantelMol Biochem Parasitol, 2012, 186(2): 87–94.
[17] Yuan JY, Shaham S, Ledoux S, et al. Thecell death geneencodes a protein similar to mammalian interleukin-1β-converting enzyme. Cell, 1993, 75(4): 641–652.
[18] Fernandes-Alnemri T, Litwack G, Alnemri ES. CPP32, a novel human apoptotic protein with homology tocell death protein Ced-3 and mammalian interleukin-1β-converting enzyme. J Biol Chem, 1994, 269(49): 30761–30764.
[19] Alnemri ES, Fernandes-Alnemri T, Litwack G. Cloning and expression of four novel isoforms of human interleukin-1β converting enzyme with different apoptotic activities. J Biol Chem, 1995, 270(9): 4312–4317.
[20] Wang L, Miura M, Bergeron L, et al. Ich-1, an/-related gene, encodes both positive and negative regulators of programmed cell death. Cell, 1994, 78(5): 739–750.
[21] Faucheu C, Diu A, Chan AW, et al. A novel human protease similar to the interleukin-1β converting enzyme induces apoptosis in transfected cells. EMBO J, 1995, 14(9): 1914–1922.
[22] Hu CR. Morphology, life history and biological characteristics of different stages of. Prac Rural Doctor, 1995, (1): 20–22(in Chinese).胡昌仁. 日本血吸虫的形态、生活史及各期生物学特性. 实用乡村医生杂志, 1995, (1): 20–22.
[23] Galanti SE, Huang SC, Pearce EJ. Cell death and reproductive regression in female. PLoS Negl Trop Dis, 2012, 6(2): e1509.
[24] He HL. The regulation ofon snail incell carcinoma and its role in EMT [D]. Zhengzhou: Zhengzhou University, 2011 (in Chinese).贺红柳. Stat3对Snail的调控及在食管鳞癌上皮间质转化中的作用 [D]. 郑州: 郑州大学, 2011.
[25] Song JJ, Wang T, Xu XJ, et al. Construction and biological function of eukaryotic expression vector for myctagged HER2. Chin J Cell Mol Immunol, 2013, 29(6): 606–612 (in Chinese).宋金洁, 王涛, 徐小洁, 等. 带myc标签的人HER2基因真核表达载体的构建及其生物学功能. 细胞与分子免疫学杂志, 2013, 29(6): 606–612.
[26] Zhang WS, Bian Q, Chi Y, et al. Construction and eukaryotic expression of NS1 protein of influenza a virus subtype H1N1. Mod Prev Med, 2011, 38(16): 3303–3308 (in Chinese). 张文帅, 卞倩, 迟莹, 等. 甲型流感病毒H1N1亚型NS1蛋白真核表达载体的构建与表达. 现代预防医学, 2011, 38(16): 3303–3308.
Cloning, eukaryotic expressing and function analysis ofapoptosis gene
Tao Wang, Yang Hong, Hongxiao Han, Chao Lv, Bingguang Jia, Xiaodan Cao, Qian Han, Ke Lu, Hao Li, Zhiqiang Fu, and Jiaojiao Lin
Key Laboratory of Animal Parasitology, Ministry of Agriculture, Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Science, Shanghai 200241, China
For further research of the apoptosis mechanism of(). The cDNA encodingofwas amplified by polymerase chain reaction (PCR) technique, which contained 900 nucleotides and encoded 299 amino acids. The theory molecular weight and isoelectric point (PI) of the deduced protein is 33.5 kDa and 6.39, respectively. Real-time PCR was used to analyze the transcription profiles ofat different development stages of. The results showed that this gene was expressed in all stages ofwith the highest expression in 21d worms, and the level of gene transcription in 42 d female worms was higher than that of male worms. The recombinant plasmid pXJ40-FLAG-Sjcaspase3 was constructed and transfection into Hela cells successfully. Real-time PCR and Western blotting analysis showedwas successfully expressed in Hela cells. Enzyme activity analysis revealed that recombinant Sjcaspase3 possessed the activity to cut substrate DEVD. Flow cytometry proved thatcould induce early apoptosis of Hela cells. The results provide the basis for proceeding further study on the biological function ofand better understand the apoptosis mechanism of.
, caspase3, apoptosis, enzyme activity, flow cytometry
November 13, 2015; Accepted: April 5, 2016
动物及兽医生物技术
王涛, 洪炀, 韩宏晓, 等. 日本血吸虫凋亡基因的克隆、真核表达及其功能分析. 生物工程学报, 2016, 32(7): 889–900.
Wang T, Hong Y, Han HX, et al. Cloning, eukaryotic expressing and function analysis ofapoptosis gene. Chin J Biotech, 2016, 32(7): 889–900.
Supported by: National Natural Science Foundation of China (Nos. 81271871, 31172315).
Corresponding author: Jiaojiao Lin. Tel: +86-21-34293440; E-mail: jjlin@shvri.ac.cn
国家自然科学基金 (Nos. 81271871, 31172315) 资助。
网络出版时间:2016-04-14 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20160414.1437.002.html
(本文责编 郝丽芳)
