直肠癌同步放化疗所致急性骨髓抑制的临床和物理因素分析*
2016-09-19黄维李英鲁文力李志雄姜庆丰谭本旭
黄维 李英 鲁文力 李志雄 姜庆丰 谭本旭
·临床研究与应用·
直肠癌同步放化疗所致急性骨髓抑制的临床和物理因素分析*
黄维①李英①鲁文力①李志雄②姜庆丰①谭本旭①
目的:分析直肠癌患者同步放化疗所致急性骨髓抑制的临床和物理因素,为临床治疗提供参考依据。方法:回顾性分析2012年1月至2015年8月重庆医科大学附属第一医院肿瘤科接受同步放化疗的直肠癌患者62例,在放疗计划系统中勾画患者的骨盆,将其分成腰骶骨、髂骨及骨盆下部3部分。应用单因素和多因素分析方法研究直肠癌患者临床和物理因素与急性骨髓抑制的关系。临床因素有患者的性别、年龄、临床分期、原始血色素水平、化疗方案、是否手术及放疗方式;物理因素包括腰骶骨、髂骨、骨盆下部及骨盆V5、V10、V15、V20、V25、V30、V35、V40、V45、V50、最大剂量(Dmax)及平均剂量(Dmean)。结果:全组≥2级急性骨髓抑制发生率为61.3%(38/62)。单因素分析显示性别、化疗方案、腰骶骨V45、髂骨V20和髂骨V30与急性骨髓抑制的发生有关。Logistic多元回归分析发现化疗方案和髂骨V30是影响急性骨髓抑制发生的高危因素,使用受试者工作特征曲线(receiver operating characteristic,ROC)确定髂骨V30的界值为44%。结论:急性骨髓抑制是受多因素综合影响的结果,在直肠癌患者治疗中应综合考虑肿瘤局部控制率和急性骨髓抑制的关系,优选化疗方案,且髂骨V30控制在44%以下。
直肠癌急性骨髓抑制临床因素物理因素
Correspondence to:Ying LI;E-mail:peiyuanx@163.com
1Department of Oncology,The First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China;2Department of Oncology,The Fifth People's Hospital of Chongqing,Chongqing 400062,China
This work was supported by the National Clinical Oncology Key Specialty Construction Projects(AXA Medical Office letter[2013]No. 544)
急性骨髓抑制是直肠癌同步放化疗常见并发症之一,严重的骨髓抑制会延迟或中断化疗和放疗的实施,从而有可能降低疗效[1]。目前,局部晚期患者的疗效仍不乐观,可能需要加强治疗强度。如果能降低骨髓抑制程度,为患者接受更强的同期放化疗创造机会,从而进一步提高临床疗效[2]。因此,如何减轻患者骨髓抑制程度成为直肠癌同步放化疗的关注问题。目前关于骨髓抑制影响因素的研究结果较少[3-4]。本研究回顾性分析2012年1月至2015年8月重庆医科大学附属第一医院肿瘤科接受同步放化疗的62例直肠癌患者的病例资料,探讨临床与物理因素对急性骨髓抑制的影响,试图寻找有价值的指标来预测和控制急性骨髓抑制的发生。
1 材料与方法
1.1病例资料
回顾性分析2012年1月至2015年8月重庆医科大学附属第一医院肿瘤科62例无腹主动脉旁和盆腔淋巴结转移直肠癌患者接受同步放化疗。其中男性41例,女性21例。年龄为17~80岁,平均年龄为55岁。所有患者经病理确诊为直肠腺癌,按分期标准进行临床分期,Ⅱ期18例,Ⅲ期39例,Ⅳ期5例。KPS评分均≥70分。62例患者中,35例口服单药化疗,27例接受双药化疗。术前放疗28例,术后放疗34例。患者详细资料见表1。本研究经过被研究对象或其家属知情同意并得到医院伦理委员会批准。
1.2方法
1.2.1化疗方案接受卡培他滨单药化疗患者,放疗当天口服卡培他滨1000mg/m2(2次/d,7d/w×5w)。接受卡培他滨+奥沙利铂双药化疗患者,卡培他滨800 mg/m2(2次/d,第1~14 d)+奥沙利铂100 mg/m2(1次/2 w)。
1.2.2放疗方案所有患者应用LightSpeed RT 4排CT行盆腔扫描(购自美国GE公司),扫描层厚为5 mm。图像经数字化传输,三维重建进入计划系统Eclipse 10.0(购自美国Varian公司)。靶区及危及器官勾画参照ICRU50号和62号报告。所有患者使用VARIAN-21EX-1加速器进行治疗(购自美国Varian公司),能量选择6 MV X射线。其中39例使用IMRT计划,23例使用SIB-IMRT计划。IMRT及SIB-IMRT均采用7野均分等中心照射,照射角度为0°、50°、100°、150°、210°、260°、310°。IMRT的PTV处方剂量45.0~50.4 Gy/25~28次;SIB-IMRT的GTV处方剂量54~60 Gy/25~28次,PTV 50.4 Gy/28次。所有患者PTV覆盖处方剂量均达到95%。
1.2.3骨盆勾画骨盆包括腰骶骨、髂骨、坐骨、耻骨、双侧股骨头及股骨上段。骨盆被分成3个子区域:1)腰骶骨:包含在PTV内的椎骨(通常L5)及整个骶骨;2)髂骨:股骨头上缘延伸到髂嵴;3)骨盆下部由坐骨,髋臼及双侧股骨头及股骨上段组成,范围从股骨头上缘至坐骨结节下缘。
1.2.4评估参数临床因素包括患者性别、年龄、临床分期、原始血色素水平(患者进行放化疗前血色素值)及化疗方案。物理因素指患者腰骶骨、髂骨、骨盆下部及骨盆接收>5、10、15、20、25、30、35、40、45、50剂量照射的体积百分比(V5、V10、V15、V20、V25、V30、V35、V40、V45、V50)、最大剂量(Dmax)及平均剂量(Dmean)。
1.2.5急性骨髓抑制评定所有患者急性期骨髓抑制评定遵循美国肿瘤放射治疗协作组织(RTOG)分级标准进行评估[5]。记录放疗开始后90 d内患者白细胞、血色素及血小板减少最为严重的情况。
1.3统计学分析
采用SPSS 17.0软件进行统计学分析。单因素分析采用χ2检验和t检验,使用剔除变量法对存在多重共线性的物理参数进行修正。应用Logistic回归模型进行多因素分析。剂量体积参数以±s表示。采用受试者工作特征曲线(receiver operating characteristic,ROC)判断骨髓抑制的剂量体积临界值。以P≤0.05为差异具有统计学意义。
2 结果
2.1急性骨髓抑制情况
全组≥2级急性骨髓抑制发生率为61.3%(38/62),其中27例为2级,11例为3级,无≥4级急性骨髓抑制发生。
2.2急性骨髓抑制的单因素分析
2.2.1临床因素对骨髓抑制发生有影响临床因素中患者性别及化疗方案对宫颈癌骨髓抑制发生影响,差异具有统计学意义(χ2=5.175、5.480,P<0.05,表1)。
2.2.2物理因素对骨髓抑制的影响物理因素中腰骶骨V45、髂骨V20和髂骨V30对急性骨髓抑制具有显著性影响(t=-2.001、-2.038、-3.372,P≤0.05,表2)。
2.3急性骨髓抑制多因素分析
对单因素分析中获得的与≥2级骨髓抑制发生相关的因素,采用Logistic多元回归分析。化疗方案与髂骨V30与≥2级骨髓抑制的发生呈显著相关性(OR=3.460、1.127,P<0.05,表3)。
2.4受试者ROC曲线分析
对髂骨V30进行ROC曲线分析,结果显示曲线下面积为0.730,根据判断标准预测正确度为中等,以灵敏度和特异度之和最大为标准寻找到髂骨V30界值为44%(灵敏度为0.658,特异度为0.750)。进一步分析,髂骨V30<44%患者31例,发生2级以上急性骨髓抑制患者13例(41.9%);髂骨V30≥44%患者31例,发生2级以上急性骨髓抑制患者25例(80.6%);提示当髂骨V30≥44%,≥2级急性骨髓抑制的发生率明显增加。
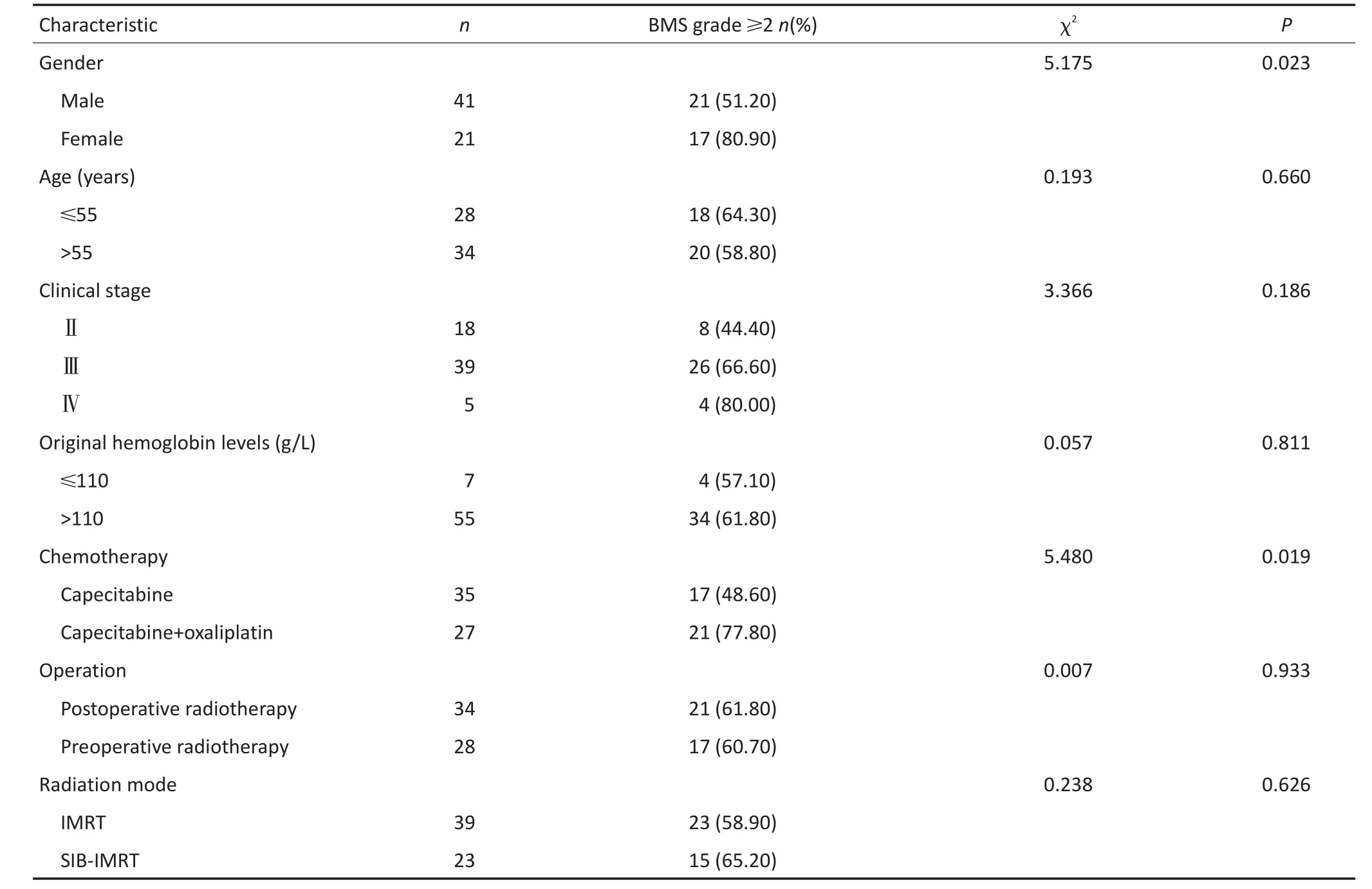
表1 临床因素与≥2级骨髓抑制的单因素分析Table 1 Univariate analysis of clinical factors and incidence of bone marrow suppression(BMS)≥2 grades
表2 物理因素与≥2级骨髓抑制的单因素分析(±s)Table 2 Univariate analysis of physical factors and bone marrow suppression(BMS)≥2 grades±s)
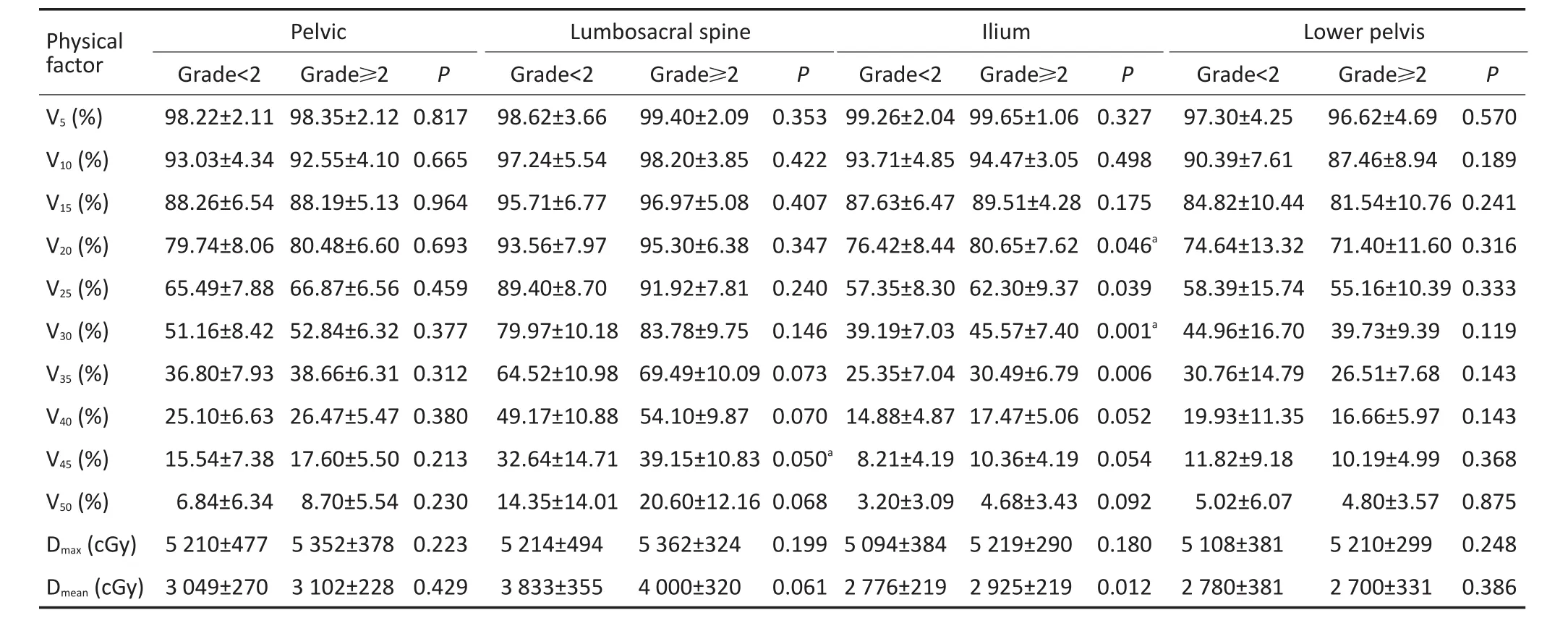
表2 物理因素与≥2级骨髓抑制的单因素分析(±s)Table 2 Univariate analysis of physical factors and bone marrow suppression(BMS)≥2 grades±s)
Note.24 cases of patients with BMS grade<2;38 cases of patients with BMS grade≥2;a.physical factors between≥2 and<2 bone marrow suppression are compared,there is no multicollinearity between factors and P≤0.05
Physical factor V5(%)V10(%)V15(%)V20(%)V25(%)V30(%)V35(%)V40(%)V45(%)V50(%)Dmax(cGy)Dmean(cGy)Pelvic Grade<2 98.22±2.11 93.03±4.34 88.26±6.54 79.74±8.06 65.49±7.88 51.16±8.42 36.80±7.93 25.10±6.63 15.54±7.38 6.84±6.34 5 210±477 3 049±270 Grade≥2 98.35±2.12 92.55±4.10 88.19±5.13 80.48±6.60 66.87±6.56 52.84±6.32 38.66±6.31 26.47±5.47 17.60±5.50 8.70±5.54 5 352±378 3 102±228 P 0.817 0.665 0.964 0.693 0.459 0.377 0.312 0.380 0.213 0.230 0.223 0.429 Lumbosacral spine Grade<2 98.62±3.66 97.24±5.54 95.71±6.77 93.56±7.97 89.40±8.70 79.97±10.18 64.52±10.98 49.17±10.88 32.64±14.71 14.35±14.01 5 214±494 3 833±355 Grade≥2 99.40±2.09 98.20±3.85 96.97±5.08 95.30±6.38 91.92±7.81 83.78±9.75 69.49±10.09 54.10±9.87 39.15±10.83 20.60±12.16 5 362±324 4 000±320 P 0.353 0.422 0.407 0.347 0.240 0.146 0.073 0.070 0.050a0.068 0.199 0.061 Ilium Grade<2 99.26±2.04 93.71±4.85 87.63±6.47 76.42±8.44 57.35±8.30 39.19±7.03 25.35±7.04 14.88±4.87 8.21±4.19 3.20±3.09 5 094±384 2 776±219 Grade≥2 99.65±1.06 94.47±3.05 89.51±4.28 80.65±7.62 62.30±9.37 45.57±7.40 30.49±6.79 17.47±5.06 10.36±4.19 4.68±3.43 5 219±290 2 925±219 P 0.327 0.498 0.175 0.046a0.039 0.001a0.006 0.052 0.054 0.092 0.180 0.012 Lower pelvis Grade<2 97.30±4.25 90.39±7.61 84.82±10.44 74.64±13.32 58.39±15.74 44.96±16.70 30.76±14.79 19.93±11.35 11.82±9.18 5.02±6.07 5 108±381 2 780±381 Grade≥2 96.62±4.69 87.46±8.94 81.54±10.76 71.40±11.60 55.16±10.39 39.73±9.39 26.51±7.68 16.66±5.97 10.19±4.99 4.80±3.57 5 210±299 2 700±331 P 0.570 0.189 0.241 0.316 0.333 0.119 0.143 0.143 0.368 0.875 0.248 0.386

表3 对单因素分析中获得的与≥2级骨髓抑制发生相关的多因素分析Table 3 Multivariate logistic regression analysis for factors related to bone marrow suppression(BMS)≥2 grades
3 讨论
造血干细胞的损伤是造成骨髓抑制的首要因素,成年人的造血干细胞主要分布在扁平骨的红骨髓内,超过50%的骨髓集中于髋、骶骨、近端股骨和腰椎的下端[6]。这些部位均在直肠癌常规外照射范围内,放射线会造成骨髓的病理及影像学改变[7-8],而这种改变与骨髓体积及其受照剂量有关[9-11]。同时化疗会造成患者全身性骨髓的急、慢性损伤,同步放化疗会导致直肠癌患者的骨髓抑制更加严重,甚至会延迟或中断化疗和放疗的实施[1],从而有可能降低疗效,并且对于可能需要加强治疗强度的局部晚期患者,严重的骨髓抑制会阻碍患者接受更强的同期放化疗。因此,在同步放化疗过程中对直肠癌患者制定合理的治疗方案,减少直肠癌患者急性骨髓抑制的发生尤为重要。
近年来,临床和物理因素对直肠癌患者急性骨髓抑制的影响受到越来越多的临床关注。金晶等[12]对直肠癌患者进行同步放化疗急性不良反应研究发现,相比接受卡培他滨单药治疗,接受卡培他滨+奥沙利铂双药化疗的患者,1~3级急性骨髓抑制发生率略高,但差异均无统计学意义。而物理因素方面,Yang等[3]将腰骶骨V45进行限制,可有效减少急性骨髓抑制的发生;而Wan等[4]研究提示腰骶骨V40与急性骨髓抑制的发生密切相关。
本研究对62例直肠癌患者同步放化疗中临床及物理因素对骨髓抑制的影响进行探讨。临床因素中性别和化疗方案(χ2=5.175、5.480,P<0.05),以及物理因素中腰骶骨V45、髂骨V20和髂骨V30对急性骨髓抑制有显著影响(t=-2.001、-2.038、-3.372,P≤0.05)。但经过Logistic回归分析,发现化疗方案(OR=3.460,P=0.043)和髂骨V30(OR=1.127,P<0.05)与急性骨髓抑制的发生呈显著相关性。
本研究发现接受卡培他滨+奥沙利铂双药化疗患者更易发生急性骨髓抑制,这与金晶等[12]的研究有所差异。本研究中化疗药物的用法:单药口服卡培他滨1 000 mg/m2,双药卡培他滨800 mg/m2+奥沙利铂100 mg/m2,其中奥沙利铂1次/2 w;金晶等[12]研究中单药口服卡培他滨800 mg/m2,双药卡培他滨650 mg/m2+奥沙利铂70 mg/m2,其中奥沙利铂1次/1 w。两者化疗药物剂量大小和用药方式的不同,可能是导致化疗方案对骨髓抑制的影响存在差异的原因。另外在物理因素方面,本研究发现髂骨V30是急性骨髓抑制的高危因素,这与Wang等[2]和Yang等[3]所认为的骨髓剂量体积参数有所不同。Wang等[2]研究发现腰骶骨V40、Yang等[3]研究中腰骶骨V45是急性骨髓抑制的高危因素,而本研究中发生急性骨髓抑制患者的腰骶骨V40和V45平均值为54%和39%,均在Wang等[2](腰骶骨V40<60%)和Yang等[3](骶骨V45<51%)研究的界定范围之内。这说明在腰骶骨高剂量区体积较低的情况下,髂骨V30是影响直肠癌患者急性骨髓抑制的重要物理因素。采用ROC曲线确定髂骨V30最优剂量学取值为44%。当髂骨V30≥44%,全组≥2级急性骨髓抑制的发生率明显增加。
在同步放化疗中,化疗方案及髂骨V30是影响直肠癌患者急性骨髓抑制发生的高危因素。因此,在直肠癌患者治疗中应综合考虑肿瘤局部控制率和急性骨髓抑制的关系,优选化疗方案,且髂骨V30控制在44%以下。
[1]Ren H,Jin J,Xiao Q,et al.Comparision of acute toxicities between IMRT and VMAT in preoperative concurrent chemoradiotherapy for rectal cancer[J].Chin J Radi Oncol,2014,23(3):205-209.[任骅,金晶,肖琴,等.直肠癌术前IMRT同期化疗与VMAT同期化疗的急性不良反应比较[J].中华放射肿瘤学杂志,2014,23(3):205-209.
[2] Wang JY,Jin J.Research progress of BM-sparing IMRT technology to reduce the acute hematologic toxicity in concurrent chemoradiotherapy[J].Chin J Radi Oncol,2013,22(4):329-332.[王健仰,金晶.限定骨髓剂量的调强放疗对减轻同期放化疗急性血液毒性的研究进展[J].中华放射肿瘤学杂志,2013,22(4):329-332.
[3] Yang TJ,Oh JH,Apte A,et al.Clinical and dosimetric predictors of acute hematologic toxicity in rectal cancer patients undergoing chemoradiotherapy[J].Radio Oncol,2014,113(1):29-34.
[4] Wan J,Liu K,Li K,et al.Can dosimetric parameters predict acute hematologic toxicity in rectal cancer patients treated with intensitymodulated pelvic radiotherapy[J].Radi Oncol,2015,10:1-7.
[5]Cox JD,Stetz J,Pajak TF.Toxicity criteria of the radiation therapy oncology group(RTOG)and the european organization for research and treatment of cancer(EORTC)[J].Int J Radi Oncol Bio Phy,1995,31(5):1341-1346.
[6] Mell LK,Kochanski JD,Roeske JC,et al.Dosimetric predictors of acute hematologic toxicity in cervical cancer patients treated with concurrent cisplatin and intensity-modulated pelvic radiotherapy [J].Int J Radi Oncol Bio Phy,2006,66(5):1356-1365.
[7]Mauch P,Constine L,Greenberger J,et al.Hematopoietic stem cell compartment:acute and late effects of radiation therapy and chemotherapy[J].Int J Radi Oncol Bio Phy,1995,31(5):1319-1339.
[8]Blomlie,V,Rofstad EK,Skjonsberg A,et al.Female pelvic bone marrow:serial MR imaging before,during,and after radiation therapy [J].Radiology,1995,194(2):537-543.
[9]Rubin P,Landman S,Mayer E,et al.Bone marrow regeneration and extension after extended field irradiation in Hodgkin's disease[J]. Cancer,1973,32(3):699-711.
[10]Sacks EL,Goris ML,Glatstein E,et al.Bone marrow regeneration following large field radiation:influence of volume,age,dose,and time[J].Cancer,1978,42(3):1057-1065.
[11]Scarantino CW,Rubin P,Constine LS.The paradoxes in patterns and mechanism of bone marrow regeneration after irradiation.1.Different volumes and doses[J].Radiother Oncol,1984,2(3):215-225.
[12]Jin J,Li YX,Wang WH,et al.Comparison of acute toxicities between two postoperative concurrent chemoradiotherapy regimens of capecitabine with or without oxaliplatin in patients with stageⅡandⅢrectal cancer[J].Chin J Radi Oncol,2009,18(3):200-204.[金晶,李晔雄,王维虎,等.Ⅱ和Ⅲ期直肠癌术后卡培他滨±奥沙利铂同步放化疗急性副反应比较[J].中华放射肿瘤学杂志,2009,18(3):200-204.]
(2016-06-03收稿)
(2016-07-25修回)
(编辑:杨红欣校对:孙喜佳)

黄维专业方向为盆腔肿瘤放疗不良反应的研究。
E-mail:529475382@qq.com
Analysis of clinical and physical factors for acute bone marrow suppression induced by concurrent chemoradiotherapy in rectal cancer
Wei HUANG1,Ying LI1,Wenli LU1,Zhixiong LI2,Qingfeng JIANG1,Benxu TAN1
Objective:To analyze the clinical and physical tactors associated with acute bone marrow suppression in concurrent chemoradiotherapy for rectal cancer and to provide a reference standard for the best clinical treatment plan.Methods:Retrospective analysis was performed on 62 patients with rectal cancer who received concurrent radiotherapy and chemotherapy in our department.The pelvis was contoured for each patient in the radiotherapy treatment planning system and divided into three subsites:lumbosacral spine,ilium,and lower pelvis.Prognostic clinical and physical factors were analyzed by univariate and multivariate analyses.Evaluated prognostic clinical factors included sex,age,clinical stage,original hemoglobin levels,and chemotherapy,operation,and radiation modes;physical factors included V5,V10,V15,V20,V25,V30,V35,V40,V45,V50,Dmax,and Dmean of lumbosacral spine,ilium,lower pelvis,and pelvis.Results:The percentage of patients who developed acute bone marrow suppression(≥2 grade)was 61.3%(38/ 62).Univariate analysis of related factors revealed statistically significant differences were sex,chemotherapy,lumbosacral spine V45,ilium V20,and ilium V30.Multivariate logistic regression analysis indicated that chemotherapy and ilium V30 are the risk factors for acute bone marrow suppression.The receiver operating curve showed that the threshold of ilium V30 was 44%.Conclusion:Acute bone marrow suppression is influenced by more than one factor;local control rate of the tumor and acute bone marrow suppression are tradeoffs in rectal cancer treatment.An appropriate chemotherapy method should be selected,and ilium V30 must be maintained below 44%to prevent bone marrow suppression in rectal cancer patients.
rectal cancer,acute bone marrow suppression,clinical factors,dosimetric factors
10.3969/j.issn.1000-8179.2016.16.659
①重庆医科大学附属第一医院肿瘤科(重庆市400016);②重庆市第五人民医院肿瘤科
*本文课题受国家临床重点专科建设项目(编号:国卫办医函[2013]544号)资助
李英peiyuanx@163.com
