RASAL2对胃癌细胞侵袭与上皮间质转化的影响*
2016-09-19赵猛赵晓朋李峥任丽
赵猛 赵晓朋 李峥 任丽
·基础研究·
RASAL2对胃癌细胞侵袭与上皮间质转化的影响*
赵猛赵晓朋李峥任丽
目的:探讨RASAL2表达改变对胃癌细胞侵袭与迁移能力的影响,以及对细胞上皮间质转化(epithelial-mesenchymal transition,EMT)的影响。方法:以胃癌细胞系SNU-1、SNU-16与AGS为体外模型,通过RNA干扰技术构建RASAL2敲低细胞系,通过过表达慢病毒载体构建RASAL2过表达细胞系。利用体外侵袭与迁移实验,划痕实验观察RASAL2表达改变对两种胃癌细胞系侵袭与迁移能力的影响。同时利用免疫显微荧光技术与免疫印迹分析RASAL2表达改变对胃癌细胞EMT的影响。利用免疫印记分析RASAL2对Ras-ERK通路的活化影响。结果:两种不同靶位的RASAL2-shRNA均可以有效抑制RASAL2在SNU-16与AGS细胞中的表达。细胞体外侵袭与迁移能力在RASAL2敲低后显著高于对照组。划痕实验也提示同样结果。上皮标志E-cadherin表达在RASAL2敲低后发生下调,同时间质标志Vimentin发生上调。EMT调控转录因子Snail也发生上调。Ras-ERK通路活化在RASAL2敲低后显著上调。RASAL2过表达抑制SNU-1细胞迁移能力。结论:RASAL2在胃癌中具有抑制细胞侵袭与迁移的能力。同时也是胃癌细胞EMT的调控分子。RASAL2发挥生物学功能至少是部分依赖Ras-ERK通路的。
胃癌侵袭迁移RASAL2EMT
Correspondence to:Li REN;E-mail:lirentmu@163.com
Department of Clinical Laboratory,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center for Cancer,Tianjin Key Laboratory of Cancer Prevention and Therapy,Tianjin's Clinical Research Center for Cancer,Tianjin 300060,China
This work was supported by the National Natural Science Foundation of China(No.81402174)
在全球范围内,胃癌一直保持较高的发病率与死亡率。尽管近10余年间胃癌的预防与治疗均有很大改善[1],但其仍是全球第四大流行癌症,第二大癌症死因[2-3]。根据GLOBOCAN 2012的数据,70%胃癌发生在发展中国家,东亚占全球发病率的一半,其中大部分在中国。胃癌具有较差的预后,其5年生存率仅20%左右[1]。越来越多的研究发现上皮间质转化(epithelial-mesenchymal transition,EMT)在肿瘤的发生发展中扮演重要的角色[4]。EMT是指上皮细胞失去细胞间的紧密连接与细胞极性,重塑其骨架结构和细胞信号,进而向具有更多运动能力与侵袭性的间质细胞表型的转换。而间质上皮转化(mesenchy-mal-epithelial transition,MET)是与之相反的过程,其相互转换的难易程度称之为可塑性[5]。肿瘤组织通过利用EMT机制使单个癌细胞离开原发灶进入远端组织。
RASAL2属于RasGAP(Ras GTPase activating protein)蛋白。本课题组之前的研究发现RASAL2在卵巢癌中具有抑癌作用[6]。也有研究显示RASAL2在乳腺癌中抑制癌症转移[7]。然而在三阴性乳腺癌中RASAL2可以通过活化RAC1促进乳腺癌进展[8]。而在肺癌中RASAL2可以促进细胞EMT进而促进转移[9]。因而,在不同组织和遗传背景下,RASAL2发挥不同的生物学功能。本课题组旨在研究RASAL2在胃癌中功能,对胃癌进展的机制提供理论基础,同时加深对RASAL2在不同组织与遗传背景下功能的理解。
1 材料与方法
1.1材料
1.1.1细胞系人胃癌细胞系SNU-16与AGS(购自美国模式培养物保藏所),293T细胞(购自中国科学院上海生命科学研究院细胞资源中心)。
1.1.2主要试剂细胞培养基DMEM high与F-12(购自美国Hyclone公司)。胎牛血清(购自美国Hyclone公司)。Matrigel Matrix与8 μL Transwell微孔板(购自美国康宁公司)。总RNA提取试剂盒(购自北京索莱宝生物科技有限公司)。cDNA逆转试剂盒与SYBR实时定量试剂(购自美国Applied biosystems公司)。Lipofectamine 2000脂质体(购自美国Thermo Fisher公司)。抗人RASAL2单抗(ab121578),抗人E-cadherin抗体(ab15148)及抗人Vimentin单抗(ab92547)(购自英国abcam公司)。抗人β-actin单抗(购自美国Sigma-Aldrich公司)。抗人Snail单抗(C15D3)(购自美国Cell Signaling公司)。RASAL2-shRNA与对照慢病毒(购买自上海吉玛制药技术有限公司)。
1.2方法
1.2.1细胞培养SNU-16细胞系与293T分别培养在含有10%胎牛血清的RPMI 1640培养基和DMEM培养基中,并放置于含有5%CO2的37℃的恒温孵箱中。AGS细胞系培养于10%胎牛血清的F-12培养基,并放置于37℃恒温孵箱空气培养。
1.2.2慢病毒感染shRASAL2-1的靶点序列为5'-CC CTCGTGTTCTTGCTGATAT-3',shRASAL2-2的靶点序列为5'-GCCTTCCACCTCTTCATAGTA-3'。病毒上清加入终浓度为8 μg/mL的polybrene与靶细胞孵育12 h。4 h后用puromycin筛选稳定细胞株。
1.2.3RNA提取RNA提取与qRT-PCR细胞总RNA提取使用总RNA提取试剂盒。cDNA逆转使用2 μg总 RNA。qRT-PCR的反应在ABI公司的7500快速实时定量检测系统进行。数据用2-ΔΔCt表示。GAPDH作为内参。实时定量引物为RASAL2(AGCAGAAAGGTCCCCTCGT AG和AGGGTGAGGTATTTGCAGTGT)GAPDH(GGAG CGAGATCCCTCCAAAAT和GGCTGTTGTCATACTTC TCATGG)。引物合成自苏州金唯智生物科技有限公司。免疫显微荧光细胞预培养于盖玻片上。用4%的多聚甲醛固定15 min。用含有5%胎牛血清的PBS封闭60 min。而后加入一抗4℃孵育过夜。用PBS洗3次后,加入荧光二抗室温孵育1 h。用荧光显微镜拍照分析。
1.2.4体外迁移与侵袭实验SNU-16或AGS细胞消化后加入未包被(迁移实验)或包被Matrigel(侵袭实验)的Transwell小室上层。在小室下层加入含有20%胎牛血清的细胞培养基600 μL。37℃培养24 h后,用4%多聚甲醛固定,并用棉签擦去上层细胞。用0.05%结晶紫染色10 min镜下观察。
1.2.5划痕愈合实验胃癌细胞培养至95%~100%汇合。用加样枪头划痕。在3、6、12、24、48 h分别用显微镜拍照观察愈合速度。
1.2.6Ras活化实验利用Ras Activation ELISA Assay Kit(Millipore)检测Ras活化状态。在4℃用Raf-1-RBD预先孵育孔板1 h。然后将胃癌细胞孔板中室温孵育1 h。然后,分别用一抗与二抗孵育1 h后加入发光底物孵育30 min后。用普洛麦格GloMax 20/ 20化学发光检测仪检测。
1.3统计学分析
2 结果
2.1RASAL2对胃癌细胞系的构建
首先针对RASAL2 CDS区设计两条不同靶点的序列,并构建于慢病毒载体pLKO.1puro中。利用慢病毒分别感染胃癌细胞系SNU-16与AGS,并使用puromycin筛选稳定细胞株。提取总RNA通过RT-qPCR技术进行敲低效率验证。结果显示,在两种胃癌细胞系中,RASAL2-shRNA感染细胞的RASAL2表达低于20%。同时Western blot也得出一致的结论(图1)。
2.2RASAL2对胃癌细胞系的体外侵袭与迁移能力的影响
利用基于Transwell小室的体外侵袭与迁移实验,本研究检测RASAL2敲低对SNU-16与AGS细胞运动能力的影响。迁移实验显示,RASAL2敲低后,SNU-16细胞通过Transwell小室的数量增加70%以上,并且两种敲低序列都得到一致结果,提示无脱靶效应。与SNU-16细胞的结果类似,AGS细胞在敲低RASAL2后通过Transwell小室的属相增加50%以上。Transwell侵袭实验结果显示,RASAL2敲低后SNU-16细胞通过Transwell小室的细胞数显著高于对照组。AGS细胞也得到同样的结果。上述结果提示RASAL2的表达具有抑制胃癌细胞运动能力的作用(图2)。
2.3RASAL2对胃癌细胞划痕愈合能力的影响
为进一步验证上述实验结果,本研究分别检测RASAL2敲低对SNU-16与AGS细胞的划痕愈合能力的影响。结果显示两种shRNA介导的RASAL2低表达均有效的促进SNU-16细胞的愈合速度(图3)。对AGS细胞的实验获得相似的结果。RASAL2敲低促进AGS细胞的愈合能力。
2.4RASAL2对胃癌细胞EMT的影响
利用免疫显微荧光技术检测RASAL2敲低对E-cadherin分布的影响。结果显示RASAL2敲低后SNU-16细胞表面分布的E-cadherin显著减少。相反,作为间质表型标志的Vimentin表达却发生显著上调(图4)。同时,本研究利用Western blot技术检测RASAL2敲低对E-cadherin与Vimentin表达影响。与免疫荧光结果相一致,无论在SUN-16还是AGS细胞,E-cadherin的表达在RASAL2敲低后发生显著下调,而Vimentin的表达却发生上调(图4)。另外,EMT调控的关键转录因子Snail的表达也在RASAL2敲低后发生上调。上述实验结果提示,RASAL2是胃癌细胞EMT的关键调控分子,其表达下调促进EMT的发生。2.5RASAL2对胃癌细胞Ras-ERK通路活化的影响

图1 SNU-16与AGS细胞RASAL2敲低后验证Figure 1 Validation of RASAL2 knockdown in SNU-16 and AGS cells

图2 RASAL2敲低对SNU-16与AGS细胞迁移与侵袭能力的影响Figure 2 Effects of RASAL2 knockdown on migration and invasion of SNU-16 and AGS cells
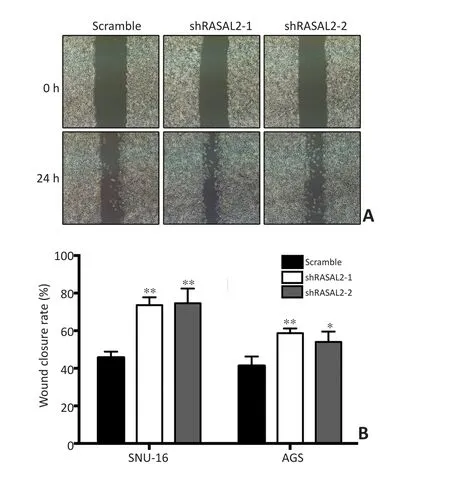
图3 RASAL2敲低对SNU-16与AGS细胞划痕愈合能力的影响Figure 3 Effects of RASAL2 knockdown on wound healing ability of SNU-16 and AGS cells
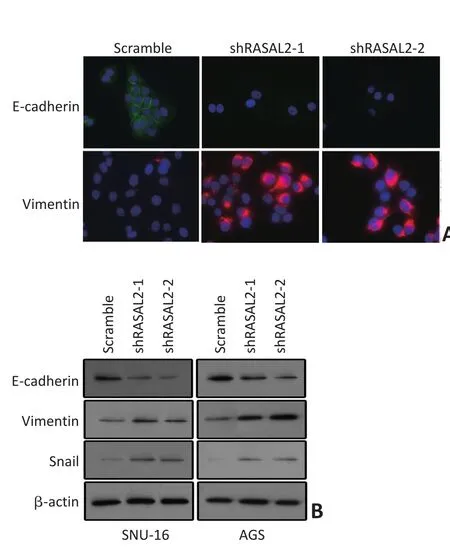
图4 RASAL2敲低对EMT标志分子分布与表达的影响Figure 4 Effects of RASAL2 knockdown on EMT markers
利用Ras活化ELISA检测试剂盒检测RASAL2敲低对Ras活化的影响。结果显示RASAL2敲低可以显著促进SNU-16与AGS细胞中Ras的活化(图5)。同时,本研究也利用Western blot技术检测ERK磷酸化状态。结果显示RASAL2敲低可以促进ERK的活化。
2.6抑制ERK活化对RASAL2敲低介导的迁移增强的影响
利用MEK抑制剂PD98059抑制RASAL2敲低细胞中ERK的磷酸化,然后利用划痕愈合实验检测SNU-16与AGS细胞的迁移能力,结果显示PD98059可以抑制RASAL2敲低介导的SNU-16与AGS细胞迁移能力增强(图6)。
2.7RASAL2过表达对SNU-1细胞迁移能力的影响
首先,检测不同细胞系中RASAL2的表达,发现SNU-1细胞系中RASAL2表达显著低于SNU-16与AGS细胞。利用慢病毒载体过表达RASAL2于SNU-1细胞,并检测细胞迁移能力的改变。划痕愈合实验显示RASAL2过表达后SNU-1细胞的迁移能力被抑制。同时RASAL2过表达可以促进E-cadherin的表达(图7)。
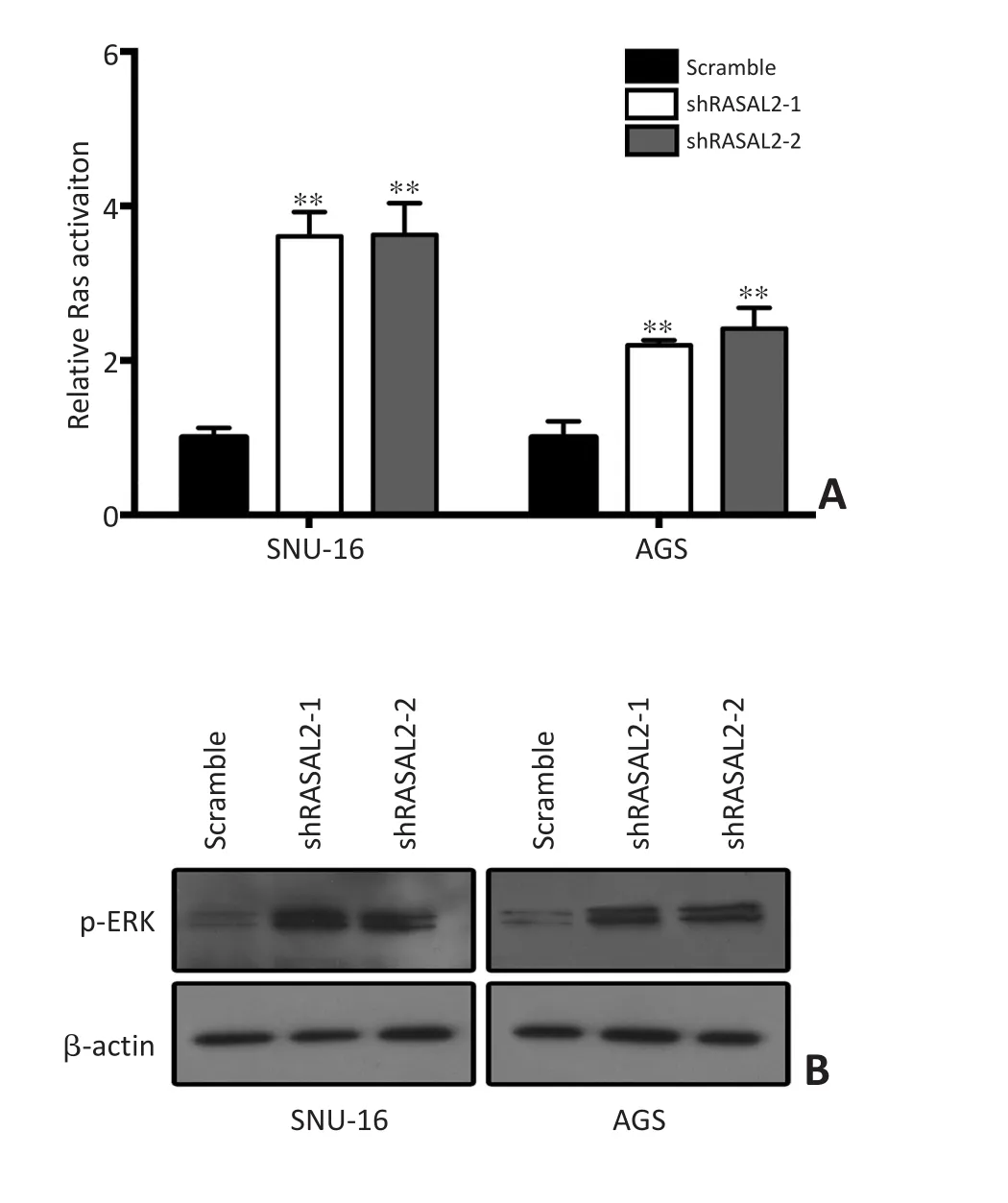
图5 RASAL2敲低对Ras活化以及ERK通路活化的影响Figure 5 Effects of RASAL2 knockdown on activation of Ras-ERK pathway

图6 PD98059对RASAL2敲低介导细胞迁移的影响Figure 6 Effects of PD98059 on RASAL2 knockdown-induced enhancement of cell migration

图7 RASAL2过表达对SNU-1细胞迁移能力的影响Figure 7 Effects of RASAL2 overexpression on SNU-1 cell migration
3 讨论
Ras GTP酶是细胞外信号向细胞内传递的关键环节,其调控细胞周期、细胞增殖、细胞骨架、极性和运动能力多个方面[10]。GEF(GDP/GTP exchange factor)与GAP(GTPase activating protein)是两种Ras调节蛋白,其分别通过促进与抑制Ras活化而达到调控Ras通路开关的作用。Ras突变在包括胃癌各种癌症中普遍存在[11-12]。但是Ras翻译后修饰所介导的Ras通路活化也被广泛关注。RASAL2是RasGAP蛋白,其异常表达在多种癌症中都有报道,但其结果却不完全一致。因此,了解RASAL2在不同癌症环境下的功能显得尤为重要。
本研究利用两种人胃癌细胞系SNU-16与AGS为体外研究模型,探讨RASAL2在胃癌中的生物学功能。在RASAL2敲低后,SNU-16与AGS都表现出显著迁移能力上调,划痕愈合实验也验证出同样的实验结果,这提示RASAL2的表达对胃癌细胞的运动能力具有抑制作用。同时,RASAL2敲低还导致SNU-16 与AGS细胞的侵袭能力增强。侵袭能力是肿瘤细胞穿过基底层并在间质中运动的前提。本研究的实验结果提示RASAL2的低表达可以促进胃癌细胞侵袭能力,使其脱离原发组织进入边界组织中。上述研究结果提示,RASAL2是胃癌细胞运动能力的调控分子,其低表达有助于SNU-16与AGS细胞侵袭与迁移能力的提升。
肿瘤细胞利用遗传性保守的EMT机制,获得运动能力与干细胞性状[13]。在胃癌中,EMT的存在也有较多报道[14-16]。由于RASAL2对胃癌细胞具有抑制侵袭与迁移能力的作用,因此本研究推测RASAL2同时可以调控胃癌细胞EMT。本课题组的研究结果支持这个假设。RASAL2敲低后,SNU-16细胞表面分布的E-cadherin显著下降,同时Vimentin却发生上调。此外,Western blot的结果也显示,RASAL2敲低后SNU-16与AGS细胞中E-cadherin的表达下调,而Vimentin的表达上调。EMT被多种转录因子精细调控,包括Snail、Slug、ZEB1和ZEB2等[17]。本研究发现,RASAL2敲低可以在SNU-16与AGS细胞中显著上调Snail的表达。上述实验结果均提示RASAL2在胃癌中是1个EMT调控分子,其低表达可以促进胃癌细胞发生EMT。RASAL2是一种RasGAP蛋白。RASAL2敲低可以促进Ras-ERK通路的活化,抑制ERK的磷酸化可以逆转RASAL2敲低介导的迁移能力增强。
综上所述,本研究发现RASAL2在胃癌中很可能是一个抑癌因子,其表达下降可以促进胃癌细胞侵袭与迁移能力增强。同时,RASAL2具有调控胃癌细胞EMT的能力。本课题组的研究加深了对RASAL2在胃癌中生物功能的理解,同时为胃癌治疗提供分子理论基础。
[1]Ferro A,Peleteiro B,Malvezzi M,et al.Worldwide trends in gastric cancer mortality(1980-2011),with predictions to 2015,and incidence by subtype[J].Eur J Cancer,2014,50(7):1330-1344.
[2] Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):e359-e386.
[3]Siegel RL,Miller KD,Jemal A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7-30.
[4] Yang J,Weinberg RA.Epithelial-mesenchymal transition:at the crossroads of development and tumor metastasis[J].Dev Cell,2008,14(6):818-829.
[5]Thiery JP,Acloque H,Huang RY,et al.Epithelial-Mesenchymal transitions in development and disease[J].Cell,2009,139(5):871-890.
[6] Huang Y,Zhao M,Xu H,et al.RASAL2 down-regulation in ovarian cancer promotes epithelial-mesenchymal transition and metastasis[J].Oncotarget,2014,5(16):6734-6745.
[7]Mclaughlin SK,Olsen SN,Dake B,et al.The RasGAP gene,RASAL2,is a tumor and metastasis suppressor[J].Cancer Cell,2013,24(3): 365-378.
[8]Feng M,Bao Y,Li Z,et al.RASAL2 activates RAC1 to promote triplenegative breast cancer progression[J].J Clin Invest,2014,124(12): 5291-5304.
[9]Li N,Li S.RASAL2 promotes lung cancer metastasis through epithelial-mesenchymal transition[J].Biochem Biophys Res Commun,2014,455(3/4):358-362.
[10]Vigil D,Cherfils J,Rossman KL,et al.Ras superfamily GEFs and GAPs:validated and tractable targets for cancer therapy[J]?Nat Rev Cancer,2010,10(12):842-857.
[11]Lee SH,Lee JW,Soung YH,et al.BRAF and KRAS mutations in stomach cancer[J].Oncogene,2003,22(44):6942-6945.
[12]Samatar AA,Poulikakos PI.Targeting RAS-ERK signalling in cancer: promises and challenges[J].Nat Rev Drug Discov,2014,13(12):928-942.
[13]Lamouille S,Xu J,Derynck R.Molecular mechanisms of epithelialmesenchymal transition[J].Nat Rev Mol Cell Biol,2014,15(3):178-196.
[14]Huang L,Wu RL,Xu AM.Epithelial-mesenchymal transition in gastric cancer[J].Am J Transl Res,2015,7(11):2141-2158.
[15]Peng Z,Wang CX,Fang EH,et al.Role of epithelial-mesenchymal transition in gastric cancer initiation and progression[J].World J Gastroenterol,2014,20(18):5403-5410.
[16]Katoh M.Epithelial-mesenchymal transition in gastric cancer(Review)[J].Int J Oncol,2005,27(6):1677-1683.
[17]Thiery JP,Sleeman JP.Complex networks orchestrate epithelial-mesenchymal transitions[J].Nat Rev Mol Cell Biol,2006,7(2):131-142.
(2016-06-20收稿)
(2016-07-29修回)

赵猛专业方向为癌症转移及其分子机制的基础研究。
E-mail:zhaomeng@tmu.edu.cn
Effects of RASAL2 on invasion and epithelial-masenchymal transition of gastric cancer
Meng ZHAO,Xiaopeng ZHAO,Zheng LI,Li REN
Objective:To investigates the effects of RASAL2 on invasion and migration of gastric cancer cells and the role of RASAL2 in epithelial-mesenchymal transition(EMT).Methods:SNU-1,SNU-16,and AGS gastric cancer cell lines were used as in vitro experimental models.RNAi technology was used to establish stable RASAL2 knockdown cell lines,and RASAL2-expressing lentivirus was used to establish cells expressing upregulated RASAL2.To determine the impacts of RASAL2 on migration and invasion,we performed Transwell migration and invasion assay,together with wound healing assay.Immunofluorescence and Western blot assays were performed to explore the role of RASAL2 in EMT of gastric cancer cells.Furthermore,Western blot assay was performed to investigate the effects of RASAL2 on activation of Ras-ERK pathway.Results:Both target sites could significantly downregulate RASAL2 expression in SNU-16 and AGS cells.The number of migrating and invading cells decreased in cells expressing upregulated RASAL2 compared with that in scrambled controls.Similar results were obtained in wound healing assay.The epithelial marker E-cadherin was downregulated after RASAL2 knockdown,whereas the mesenchymal marker vimentin was upregulated.Snail,a transcriptional regulator of EMT,was also upregulated in RASAL2 knockdown cells.Ras-ERK pathway was activated after RASAL2 inhibition.Moreover,RASAL2 overexpression in SNU-1 inhibited cell migration.Conclusion:RASAL2 negatively regulates invasion and migration of gastric cancer cells and plays a vital role in EMT of these cells.The biological function of RASAL2 is at least partly dependent on Ras-ERK pathway.
gastric cancer,invasion,migration,RASAL2,EMT
10.3969/j.issn.1000-8179.2016.16.726
天津医科大学肿瘤医院检验科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心(天津市300060)
*本文课题受国家自然科学基金项目(编号:81402174)资助
任丽lirentmu@163.com
