Zn(Ⅱ)在锌电极上的电沉积机理
2016-09-18徐双全刘春侠沈庆峰俞小花昆明理工大学冶金与能源工程学院昆明650093昆明理工大学分析测试中心昆明650093
徐双全 刘春侠 沈庆峰 张 涛 倪 源 俞小花*,(昆明理工大学冶金与能源工程学院,昆明 650093)(昆明理工大学分析测试中心,昆明 650093)
Zn(Ⅱ)在锌电极上的电沉积机理
徐双全1刘春侠2沈庆峰1张涛1倪源1俞小花*,1
(1昆明理工大学冶金与能源工程学院,昆明650093)
(2昆明理工大学分析测试中心,昆明650093)
在Zn(Ⅱ)-NH4Cl准中性体系中,采用循环伏安法(CV)研究了Zn2+在锌电极上的反应方式,通过计时电流法(CA)研究了Zn2+沉积的成核方式,利用交流阻抗谱(EIS)考察了不同过电位时Zn2+沉积的阻抗行为。结果表明:Zn2+的电沉积是一个不可逆电极反应,以两步骤单电子串联的方式进行,第一步为速控步;电极反应的电荷传递系数与锌电极的表面结构有关。在恒电位条件下,体系中锌电极上Zn2+的结晶近似于三维瞬时成核方式。Zn2+的沉积经历了覆盖、吸附成膜、大量晶核形成等过程,该过程随着控制电位的负移由电化学极化过渡到电化学极化-浓差极化混合控制阶段。最后给出了Zn2+在锌电极上电沉积过程的机理。
Zn(Ⅱ)-NH4Cl准中性体系;电沉积;循环伏安;计时电流;交流阻抗谱
0 引 言
传统硫酸法炼锌因其得到的锌片致密平整、工作环境友好已经在工业上应用多年。随着大量的实践也发现该工艺存在诸多不足:例如其电能消耗高、净化除铁工艺复杂、脱硅脱氟、氯困难,不适合处理含高硅、高铁、高氟氯以及低品位氧化矿等复杂含锌物料。随着硫化锌精矿资源的日益匮乏,扩大炼锌原料的来源已显得尤为必要,越来越多的科技工作者投入到如何经济有效的利用低品位氧化锌矿以及热镀锌渣等二次锌资源的研究中来[1-2]。铵盐法能选择性的浸出铜、锌、钴、镍等有价金属[3-5],而它几乎不与铁、硅等常见杂质发生作用,得到的浸出液纯净;由该浸出液电解得到的产品纯度高,电解能耗低,浸出剂可循环使用;因此该方法已经在铜、镍、钴等的低品位矿、二次资源的回收上取得了一定应用,而在锌湿法冶炼中尚处于研究阶段[6]。
丁治英[7]、唐谟堂[8-10]、马春[11]以及邓良勋[12]等就低品位锌氧化矿、锌烟尘、热镀锌渣等复杂含锌物料在NH3·H2O-NH4Cl体系中进行了溶解热力学、阳极反应动力学、电解工艺等方面进行了许多探索。然而Zn2+在氯铵盐近中性配位体系中的阴极电沉积行为的基础研究报道较少;且他们所研究的电解体系是在一个高氨水浓度的溶液中并在较高的温度下进行的,电解过程中氨气的挥发较为严重,这与实际生产条件相差较远。由于电沉积锌时在较短的时间内阴极板上就覆盖一层锌,大部分时间实际上是在锌金属表面上的沉积,研究Zn2+在锌金属面上的沉积行为更为接近实际生产情况;而在锌电极上Zn2+的电沉积行为的研究却未曾见报道。因此本文通过调整溶液中氨浓度及pH值后研究了Zn-NH4Cl准中性体系中锌电极上Zn2+的电沉积行为,以期为氯铵盐中性配位体系电沉积锌在工业上的推广应用提供一定的理论参考。
1 实验部分
1.1测试体系
利用AutlabPGSTAT204电化学工作站(荷兰)在Zn-NH4Cl准中性体系中进行电化学实验。实验采用三电极体系:1 cm×1 cm双面铂片为辅助电极(CE),饱和甘汞电极(SCE)作为参比电极(RE),直径d=3 mm的L型的锌电极作为工作电极。电解池和3种电极由天津艾达恒晟科技发展有限公司提供。
1.2测试方法
每次测定之前,工作电极在4、5号金相砂纸上依次打磨,用0.05 μm Al2O3粉抛光至镜面,然后工作电极和辅助电极经蒸馏水冲洗和超声波清洗,无水乙醇除油后经三次蒸馏水冲洗。准备测试时工作电极先在溶液中浸泡5 min以稳定开路电位。初次启动电化学工作时先让其预热15 min,以使电化学工作站稳定。
CV曲线采用5~300 mV·s-1不等的扫描速率测试,扫描起始和终止电位设定在接近开路电位的-0.9 V,以避免反方向回扫时锌电极可能氧化溶解。CA曲线计时时间为40 s,采样间隔时间0.05 s。EIS曲线扫描频率为0.1~105Hz,振幅为5 mV。
2 结果与讨论
2.1Zn2+在锌电极上的伏安曲线
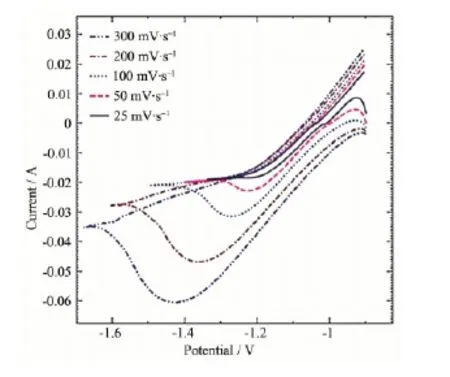
图1 Zn2+在锌电极上的半程循环伏安曲线Fig.1 Half cycle CV curves of the Zn2+on the zinc electrode
图1是在不同扫描速率下测得的Zn2+在锌电极上的半程(以起始电位为界,只扫描某一边)循环伏安曲线。电势从-0.9 V开始向负方向扫描,在扫描初期极短的时间内暂态电流迅速增大后下降,这是双电层充电所致;在约-1.01 V时表观电流达到零点,此后电流逐渐变负,在扫描速率为50 mV·s-1时,在工作电极电势φw约为-1.2 V时出现了1个还原峰,说明发生了Zn2+的放电还原反应;此后还原电流随着电势的负移而减小,在接近扫描换向电位φλ时还原电流逐渐稳定成水平值,φλ以后,扫描换向,形成电流“负向背”;而在扫描速率小于25 mV· s-1时难以形成电流峰,相同电势下的正向扫描电流与负向扫描的电流基本重合,暂态电流逐渐转变成稳态电流。

表1 Zn2+在锌电极上的半程循环伏安曲线参数列表Table 1 Half cycle CV curves parameter list of the Zn2+on the zinc electrode
表1给出了图1中从电流基线开始计算得出的一些伏安行为结果。由表1可知:随着扫描速率的增加,还原峰电流增大,不同扫描速率下的还原电流峰高ip∝v1/2;峰电位φp随扫描速率的增加逐渐负移,半峰宽随扫描速率的增加而增大,在扫描速率为300 mV·s-1时,半峰宽度已接近0.4 V。这说明Zn2+在阴极的还原是一个不可逆的电极反应过程,并且随着扫描速率的增加不可逆程度加大。图1中还原峰对应的电流-时间(i-t)积分电量Q随着扫描速率的增加而逐渐减小,说明Zn2+在阴极的沉积一部分来源于测试前吸附在电极上的Zn2+,一部分来源于溶液当中。
根据不可逆电极反应的峰电位和半峰电位关系式[13]可计算出30℃下其关系式如下:

由表1中φp-φp/2的测定值和式(1)可计算出扫描速率在25~300 mV·s-1下的αna分别为:0.605、0.575、0.506、0.396、0.334,由于在大多数体系中,α值处于0.3~0.7之间,这说明Zn2+在阴极沉积过程中控制步骤的电子转移数na=1,因此不同扫描速率下的电子传递系数α分别为0.605、0.575、0.506、0.396、0.334。α随着扫描电势速率的加快而逐渐减小,这是因为在不同的电势变化速率下Zn2+在锌电极上的沉积状况不同,锌电极表面随着Zn2+电沉积的进行逐渐转变成不同的表面结构所造成的。
由图1可知,Zn2+在锌电极上的还原峰跨度较大,波形较缓,接近于一个“矮胖”型的单峰,而且电流峰合并成一个没有分开的宽峰,另由于na=1,说明Zn2+的还原是一个由第一步为控制步骤的两电子的串联反应,第一步由Zn2+生成Zn+,第二步Zn+再迅速接受1个电子还原成Zn。此外,从ip∝v1/2及αna的变化值可推断出:电极反应过程中总的传质系数DO随电势扫描速率的增加而增大。这是由于DO受电迁移、扩散传质、对流传质三方面综合的作用,在暂态反应过程中,控制到达电极表面Zn2+的这三方面作用均受到不同电场强度和阳极反应生成气体扰动的影响。
2.2锌电沉积的计时电流曲线
由上面对Zn2+在锌电极上的伏安行为的分析可知锌电极上电势的控制方式是影响Zn2+电沉积状态的一个重要因素,在电锌工业中获得平整致密的锌片是评价电沉积锌片是否合格的一个重要指标,因此有必要讨论恒电位下(区别于图1中测试电势时刻变动对电极表面造成的影响)Zn2+在锌电极上的沉积状态。参照图1中扫描速率为50 mV·s-1时的还原峰电位,下面给出了不同的恒电势条件下Zn2+在锌电极上沉积的计时电流曲线,如图2。
从图2可知锌的电结晶成核过程的特征是:当阶跃电位输入后电流迅速上升,锌电极与参比电极间溶液的欧姆极化发生突变,双电层Cd被迁移的离子充电,反应电流(ir)刚刚产生,新相开始生成。电极电流在tm时刻出现极大值im,此后双电层充电电流ic呈指数减小,ir逐渐加大,当总电流i衰减至水平段,双电层充电基本结束,净的反应电流ir成为稳定电流。此时锌的电结晶经历了生长中心的交叠并向外生长伸出溶液,同时伴随生长中心的消失和新的生长中心的再生。随着控制电位阶跃幅度增加,电流峰值im逐渐增大,这表明电位负移提高了Zn的电结晶率;而当阶跃电位减小到一定程度,Zn2+在锌电极上的电结晶电流已变得十分微小。

图2 Zn2+在锌电极上的电流-时间暂态曲线Fig.2 Current-time transient curves of the Zn2+on thezinc electrode
在不同金属表面上电结晶可能是二维也可能是三维的,成核过程既可以是瞬时的也可以是连续的。瞬时成核说明金属在成核的过程中其所有的成核位置一开始就是活跃的;相反,连续成核随着成核的不断进行,成核位置逐渐被激活。在由传质步骤控制的电沉积过程中,不同成核机制的暂态的无量纲方程[14]分别为:
二维成核:

从图3和图4可看出:理论二维的连续成核与瞬时成核曲线呈现一个尖锐的峰,三维瞬时成核曲线却是一个较宽的峰。当计时时间与形成电流峰的时间之比t/tm<1时,无论是在电位阶跃幅度较小时还是在电位阶跃幅度较大时,锌电极上Zn2+的还原沉积都基本符合三维瞬时成核规律,但在电位阶跃幅度较小时更为接近。当t/tm>1时,在电位阶跃幅度较大的阶段,锌电极上Zn2+的沉积近似于三维瞬时成核规律;但实际曲线与三维的瞬时成核曲线产生一定的正偏差,这应该是由于生长中心的交叠引起的。
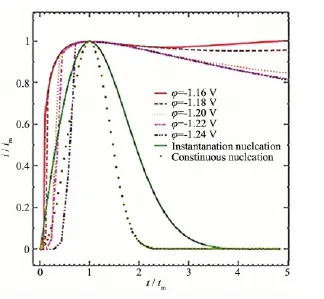
图3 Zn2+在锌电极上二维成核的实际与理论无因次暂态曲线Fig.3 Two-dimensional nucleation of practical and theoretical dimensionless transient curves of the Zn2+on the zinc electrode

图4 Zn2+在锌电极上三维成核的实际与理论无因次暂态曲线Fig.4 Three-dimensional nucleation of practical and theoretical dimensionless transient curves of the Zn2+on the zinc electrode
2.3Zn2+在锌电极上电沉积过程中的电化学阻抗谱
2.3.1很小过电位时Zn2+电沉积的阻抗
由图5a可见,2条阻抗曲线均由2个不同半径的压扁的圆弧和扫描后期长度不等的电感弧连接;随着电位稍微负移,2个圆弧的半径均迅速减小,扫描后期的电感弧减小的更快。图5b是其相应的等效电路,电荷传递电阻Rp在很小过电位时显示较大的数值,但随着过电位的增加迅速减小;此时电路中也无扩散阻抗(该过程与扩散无关,可以说扩散阻抗无限小)。这说明在过电位很小的初始期工作电极的表面难以形成结晶,只有锌氨配离子覆盖在工作电极表面,该过程完全处于电荷传递控制阶段,吸附在工作电极表面离子的覆盖状态变得越发不稳定。而溶液的电阻Rs大约固定在6.8 Ω,这说明在很低的过电位情况下反应无法正常进行,电极表面离子富集,扩散层厚度极小,它不能激发锌氨配离子快速迁移到工作电极表面,溶液相对稳定电阻基本保持不变。CPE指数的大小N接近于1,这说明CPE的性质接近于双电层电容的性质;而数值L则显示由于电极表面状态不稳定造成的电流分布不均匀而产生的电感。
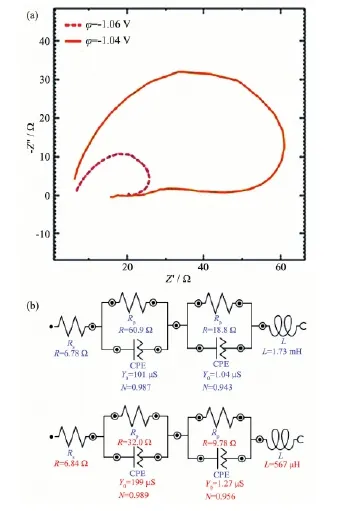
图5 很小过电位时Zn2+电沉积的Nyquist图及等效电路Fig.5 Nyquist curves and Equivalent circuits of the Zn2+electrodeposition at very low overpotential
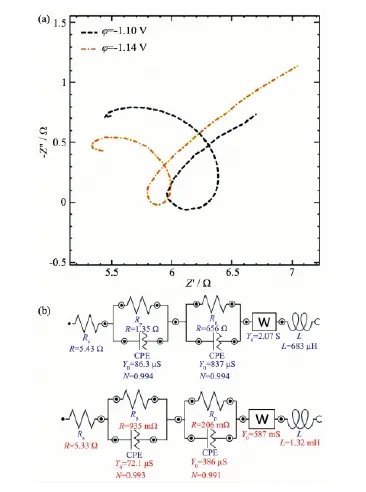
图6 较小过电位时Zn2+电沉积的Nyquist图及等效电路Fig.6 Nyquist curves and Equivalent circuits of the Zn2+electrodeposition at lower overpotential
2.3.2较小过电位时Zn2+电沉积的阻抗
图6a是较小过电位时Zn2+沉积的电化学阻抗谱图,该图由第一象限旋转的圆弧和第四象限的小圆弧以及大约倾斜45°角的直线组成,高频区还存在小段的电感弧。由等效电路图6b可知:随着阴极电势的变负,代表两半圆半径的Rp值均减小,第四象限的半圆半径Rp(串联的第2个)减小的更快;而扩散电阻Warburg阻抗值增加(等效电路中显示的导纳Y的数值减小),溶液电阻Rs却减小,同时较很小过电位的初期减小了1.4 Ω;感抗强度L增加,但双电层电容的变化却不大。这说明此时在阴极表面离子浓度缓慢减小,电沉积反应以很缓慢的速度在进行,电极表面有膜层形成,电结晶缓慢,阴极反应处于以电化学极化为主与浓差极化相结合的混合控制阶段;电极反应分步进行,反应过程存在很不稳定的电活性的吸附态中间产物,膜层的形成激发了电荷传递过程。
2.3.3较大过电位时Zn2+电沉积的阻抗
如图7a可见,2条阻抗曲线整体上由一段因“弥散效应”引起的偏转的容抗弧和Warburg阻抗直线组成,高频区存在极微小的电感弧。如图7b所示,此阶段溶液电阻Rs由5.7 Ω降至5.2 Ω,化学反应电阻Rp从1.6 Ω减小到1.5 Ω,Warburg阻抗的导纳Y减小120 mS。这说明工作电极在较高的过电位下Zn2+电沉积结晶过程已较为明显,电沉积过程仍处于电化学极化和浓差极化双重作用的混合控制阶段;随着过电位增加,两电子反应快速发生,阴极表面离子相对贫乏,电迁移速度的加快和浓度梯度进一步扩大使溶液电阻和电化学反应电阻有所减小。而双电层电容则由于过电位和电极表面改变的双重作用变化不甚明显,粗糙蓬松的电极的表面电感也基本上可以忽略。

图7 较大过电位时Zn2+电沉积的Nyquist图及等效电路Fig.7 Nyquist curves and Equivalent Circuits of the Zn2+electrodeposition at higher overpotential
将Zn2+电沉积前中后的整个过程连在一起,由图5~7可以看出:随着电位的负移,溶液的电阻Rs先是减小然后增加最后减小;电化学反应电阻Rp先是急剧减小然后增大接着减小;扩散电阻则一直增大;双电层电容整体变化不大。溶液电阻Rs的这一变化应该与不断增加的电场强度以及逐渐增快的阳极反应生成的气体溶于电解液中形成气膜双重作用所致,电场能量、电极表面离子浓度和粗糙程度使电化学反应电阻反复变化,扩散电阻一直增大与扩散层的厚度不断增加及溶液本体浓度不断下降有关。双电层电容总体上没有大的变化因该是与测试时提供的正弦交流电方式整体步调一致有关。
由文献[15]可知[Zn(NH3)4]2+、[Zn(NH3)2]2+、[Zn(Cl)4]2-的稳定常数分别为4.5×109、7.6×104、2.0。因此在时,Zn2+在Zn2+-NH4Cl准中性体系中主要以[Zn(NH3)2]2+形式存在。联系工作电极的过电位从很小到较大的过程中,Zn2+的电沉积经历了由覆盖在电极表面到成膜,最后大量结晶析出等一系列过程。因此锌氨配离子在锌电极上电沉积的机理有可能是这样的:
过电位很小时:
[Zn(NH3)2]2+(溶液深处)+M(锌电极)→M·[Zn(NH3)2]2+(覆盖电极)
过电位较小时:
M·[Zn(NH3)2]2++e→M·[Zn(NH3)]++NH3(进入溶液),(速控步)
M·[Zn(NH3)]+(不稳定)+e→M·Zn(吸附成膜,成核缓慢)+NH3
过电位较大时:
M·[Zn(NH3)2]2++e→M·[Zn(NH3)]++NH3(进入溶液),(速控步)
M·[Zn(NH3)]+(不稳定)+e→M·Zn(吸附态,数量多而快)+NH3
M·Zn→M·Zn(形成大量结晶态,布满电极表面)
3 结 论
(1)在Zn2+-NH4Cl准中性体系中,Zn2+在锌电极上的沉积是一个不可逆的电极反应,反应过程分两步骤单电子串联进行;第1步为速控步,第2步瞬时完成。反应所需的Zn2+由早期吸附在电极上的Zn2+及溶液中扩散至电极界面的Zn2+提供。控制电位方式不同,Zn2+在锌电极上的沉积状态有所差别,进而改变电子传递系数α。暂态反应中的总传质系数DO与工作电极上的电场强度及阳极生成气体的扰动有关。
(2)在Zn2+-NH4Cl准中性体系中,采用恒电位控制条件下,锌电极上Zn2+的电沉积主要近似于三维瞬时成核方式,成核的具体行为依据控制电势的大小稍微有所差别。
(3) Zn2+的沉积随着阴极过电位的逐渐增加经历了覆盖、吸附成膜和晶核大量形成的过程,在过电位较小时可观察到吸附态中间产物。溶液电阻随着电位的负移先减小后增加再减小;电化学反应电阻先急剧减小然后增大接着减小;扩散电阻则随着电势不断负移而增加。总的电沉积阻抗由单一的电化学速控步逐渐过渡到电化学极化-浓差极化混合控制阶段。
[1] XIA Zhi-Mei(夏志美), CHEN Yi-Feng(陈艺峰), WANG Yu-Fei(王宇菲), et al. J. Hunan Univ. Technol.(湖南工业大学学报), 2010,24(6):9-13
[2] HE Xiao-Feng(何小凤), LI Yun-Gang(李运刚), CHEN Jin(陈金). China Nonferrous Metall.(中国有色冶金), 2008(2): 55-58
[3] HAN Yue-Xin(韩跃新), MA Song-Bo(马松勃), WANG Yu-Bin(王宇斌), et al. Min. Metall. Eng.(矿冶工程), 2014,34 (6):56-59
[4] WANG Meng(王猛), CAO Hong-Bin(曹宏斌), ZHANG Yi(张懿), et al. Environ. Sci.(环境科学), 2011,32(2):596-602
[5] ZHENG Guo-Qu(郑国渠), ZHENG Li-Feng(郑利峰), ZHANG Zhao(张昭), et al. Nonferrous Metals(有色金属), 2004,13 (3):45-48
[6] WANG Yuan(王渊), XU Jin-Yong(徐进勇), SANG Shi-Hua(桑世华), et al. Sichuan Nonferrous Metals(四川有色金属), 2013(1):59-62
[7] Ding Z Y, Chen Q Y, Yin Z L, et al. Trans. Nonferrous Met. Soc. China, 2013,23(3):832-840
[8] Yang S H, Tang M T, Chen Y F, et al. Trans. Nonferrous Met. Soc. China, 2004,14(3):626-630
[9] WANG Rui-Xiang(王瑞祥), TANG Mo-Tang(唐谟堂), LIU Wei(刘维), et al. Chin. J. Process Eng.(过程工程学报), 2008(S1):219-222
[10]XIA Zhi-Mei(夏志美), YANG Sheng-Hai(杨声海), TANG Mo-Tang(唐谟堂), et al. Chin. Nonferrous Metals(中国有色金属学报), 2013,23(12):3455-3461
[11]MA Chun(马春), YU Zhong-Xing (余仲兴), WANG Wei(王玮). J. Shanghai Univ.: Nat. Sci. Ed.(上海大学学报:自然科学版), 2002,8(5):428-432
[12]DENG Liang-Xun(邓良勋), WU Bao-Qing(吴保庆). Nonferrous Metals(Extr. Metall.)(有色金属(冶炼部分)), 2011(4): 14-15
[13]HU Hui-Li(胡会利), LI Ning(李宁). Electrochemical Measurement(电化学测量). Beijing: National Defense Industry Press, 2011.
[14]Thirsk H R, Harrison J A. A Guide to the Study of Electrode Kinetics. London: Academic Press, 1972.
[15]Scharifker B R, Mostany J. J. Electroanal. Chem. Interfacial Electrochem., 1984,177(1/2):13-23
[16]Scharifker B R, Hills G. Electrochim. Acta, 1983,28(7):879-889
[17]Smith R M, Martell A E. Critical Stability Constants: Inorganic Complexes: Vol.4. New York and London: Springer, 1976.
Electrodeposition Mechanism of Znon Zinc Electrode
XU Shuang-Quan1LIU Chun-Xia2SHEN Qing-Feng1ZHANG Tao1NI Yuan1YU Xiao-Hua*,1
(1Faculty of Metallurgical and Energy Engineering, Kunming University of Science and Technology, Kunming 650093, China)
(2Analysis and Test Center, Kunming University of Science and Technology, Kunming 650093, China)
Reaction method of Zn2+on the zinc electrode was researched by cyclic voltammetry (CV). Nucleation mode with Zn2+was studied by chronoammperometry (CA) and impedance′s behavior of the Zn2+in the different overpotential deposition periods was investigated by electrochemical impedance spectroscopy (EIS) in Zn-NH4Cl quasi neutral system. The results showed that the electrodeposition of Zn2+is an irreversible electrode reactions and conducts by continuous two steps of single electron in which the first step is controlled by speed. The electron transfer coefficient of electrode reaction is related to the surface of zinc electrode structure. Under the condition of constant potential, the crystallization of Zn2+is approximate to three-dimensional instantaneous nucleation on zinc electrode in this system. Depositing of Zn2+has experienced the process of covering, adsorption film and the formation of large number of nucleation. The process was controlled by electrochemical polarization firstly and then the electrochemical polarization-concentration polarization mixed control with the control potential negatively shifted. Finally the mechanism of electrodeposition process with Zn2+on the zinc electrode was given.
Zn(Ⅱ)-NH4Cl quasi neutral system; electrodeposition; cyclic voltammetry; chronoammperometry; electrochemical impedance spectroscopy
O646.5
A
1001-4861(2016)03-0386-07
10.11862/CJIC.2016.061
2015-10-14。收修改稿日期:2016-01-19。
国家自然科学基金(No.51304094)资助项目。
*通信联系人。E-mail:yxhyxh1978@aliyun.com
