CMPO/[Cnmim][NTf2]体系对Eu3+和UO22+的萃取行为
2016-09-18施锦强袁威津韦悦周何林峰唐方东上海交通大学核科学与工程学院上海0040上海市计量测试技术研究院化学与电离辐射计量技术研究所上海003
施锦强 袁威津 董 珍 赵 龙*, 韦悦周 何林峰 唐方东(上海交通大学核科学与工程学院,上海 0040)(上海市计量测试技术研究院,化学与电离辐射计量技术研究所,上海 003)
CMPO/[Cnmim][NTf2]体系对Eu3+和UO22+的萃取行为
施锦强1袁威津1董珍1赵龙*,1韦悦周1何林峰2唐方东2
(1上海交通大学核科学与工程学院,上海200240)
(2上海市计量测试技术研究院,化学与电离辐射计量技术研究所,上海201203)
讨论了辛基(苯基)-N,N-二异丁基胺甲酰基甲基氧化膦(CMPO)/1-烷基-3-甲基咪唑双(三氟甲烷磺酰)亚胺盐([Cnmim][NTf2],n=2,8,12)萃取体系分别对硝酸溶液中的铕离子(Eu3+)和铀酰根离子(UO22+)的萃取行为。主要研究了硝酸浓度、接触时间、温度、CMPO浓度对CMPO/[Cnmim][NTf2]体系萃取性能的影响,并选取CMPO/[C2mim][NTf2]体系对模拟高放废液中的镧锕元素进行了萃取分离。结果表明:随着离子液体侧链长度增长,萃取平衡时间逐渐延长;CMPO/[C2mim][NTf2]体系对Eu3+的萃取是放热反应,萃取率随酸度增加而逐渐降低,对UO22+则是吸热反应,萃取率随酸度增加而逐渐升高;通过机理研究,推测出对Eu3+的萃取反应是离子交换,而对UO22+的萃取反应则是中性配位;CMPO/[C2mim][NTf2]体系能有效的萃取模拟高放废液中的镧系、锕系元素,且在高酸下有一定的镧锕分离效果。
三价铕离子;铀酰根离子;辛基(苯基)-N,N-二异丁基氨甲酰基甲基氧化膦;离子液体;萃取
Purex[1]流程是核燃料后处理中经典的处理工艺,几十年来被广泛用于分离乏燃料中的铀和钚,但是由于有机稀释剂存在易挥发,易燃等缺点,可能会导致一些安全问题。离子液体(Ionic Liquids)[2]由于其具有许多优良的性质,例如:蒸汽压低、溶解能力强、结构功能易调以及电化学窗口宽,克服了有机稀释剂的缺点,其在许多领域都有应用[3],尤其是在放射性核素的回收中[4-5]。采用离子液体作为稀释剂可以实现放射性核素绿色萃取。
由于在高放废液中一些镧系和锕系金属离子不能被Purex流程中的萃取剂磷酸三丁酯(TBP)萃取,Truex[6]流程因此被研发出来,其引入了辛基(苯基)-N,N-二异丁基胺甲酰基甲基氧化膦(CMPO)并将其和TBP一起作为萃取剂则能很好的将这些金属离子从废液中分离。中性萃取剂CMPO在所有用于锕系元素分离的化合物中受到了极大关注,CMPO能够将Am从HNO3或HCl溶液中萃取到稀释剂如二乙苯、CCl4、四氯乙烯(C2Cl4)和石蜡族烃中[7-9];CMPO的十二烷溶液或CMPO和TBP混合物的十二烷溶液能从HNO3或HCl中萃取Eu,同时也能将Np、Pu[10-12]、Pm、U、Am、Zr、Ru、Fe和Pd[13]从HNO3溶液萃取到CMPO和TBP的十二烷溶液中。
对以CMPO作为萃取剂,离子液体作为稀释剂的萃取体系的研究有不少。Visser等[14]最早研究了CMPO/[C4mim][PF6]体系从硝酸溶液中萃取Am3+、Pu4+、UO22+和Th4+,发现随着酸度的增加萃取分配比越大且在相同条件下,其分配比要比使用正十二烷为溶剂高1个数量级。Nakashima等[15]研究了CMPO 在1-丁基-3-甲基咪唑六氟磷酸盐([C4mim][PF6])和1-丁基-3-甲基咪唑双(三氟甲烷磺酰)亚胺盐([C4mim][NTf2])中对三价镧系元素的萃取,提出了阳离子交换的萃取机理,且萃取的金属离子与CMPO的计量比为1∶3,即形成Ln(CMPO)33+的配离子。Rout 等[16]研究了CMPO-TBP/[C4mim][NTf2]针对Eu3+的萃取行为,发现加入适量的TBP可以消除萃取过程中产生的第三相。Sengupta等[17]研究了CMPO在正十二烷和异癸醇的混合溶液中对Am3+、Pu4+、UO22+萃取,并研究了萃取热力学、萃取机理,发现金属离子与CMPO的配位比以及萃取热力学随着金属离子的变化有较大的差异。黄磊等[18]研究了CMPO/离子液体体系对Ce3+的萃取,发现其萃取效率远高于相同条件下以传统有机溶剂作为稀释剂的萃取效率。现有的研究成果中还没有用CMPO/[Cnmim][NTf2]体系对镧系、锕系代表元素作系统的研究,故本文以分离锕系和镧系元素化合物中的典型代表CMPO为萃取剂,研究了其在1-烷基-3-甲基咪唑双(三氟甲烷磺酰)亚胺盐([Cnmim][NTf2],n=2,8,12)中对Eu3+和UO22+的萃取行为,详细考察了萃取时间、硝酸浓度、萃取剂浓度、温度对萃取性能的影响,并探究了离子液体阳离子侧链长度变化对萃取机理的影响以及萃取过程中产生的第三相的影响,最后考察了CMPO/[C2mim][NTf2]体系对模拟高放废液进行的萃取分离,研究了Eu3+和UO22+相对于实际高放废液中一些元素的萃取选择性。
1 实验部分
1.1试剂和仪器
试剂:离子液体1-烷基-3-甲基咪唑双三氟甲磺酰亚胺盐([Cnmim][NTf2],99%),购于兰州化学物理研究所;辛基(苯基)-N,N-二异丁基胺甲酰基甲基氧化膦(CMPO),购于Strem化学试剂公司,纯度为97%,结构式见Scheme 1;正十二烷(n-Dodecane,n-DD)、Eu(NO3)3·6H2O和UO2(NO3)2·6H2O,购于国药化学试剂有限公司。实验用水为去离子水。配制的模拟废液所使用的Fe(NO3)3·9H2O、Ni(NO3)2·6H2O、Sr(NO3)2、Zr(NO3)4·5H2O、Pd(NO3)2·2H2O、KReO4、Y(NO3)3·6H2O、AgNO3均为分析纯。所有试剂使用前均未进行纯化。
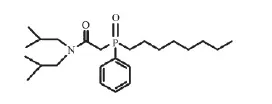
Scheme 1 Molecular structure of CMPO
仪器:ICP-AES7510电感耦合等离子体-原子发射光谱仪,日本SHIMADZU公司;SA-2100E纯水仪,日本EYELA公司;NTS-4000C往复式水浴恒温振荡器,日本EYELA公司;H-1600A离心机,上海利鑫坚离心机有限公司。
1.2实验方法
取20 mmol·L-1CMPO/[Cnmim][NTf2]或者CMPO/n-Dodecane 0.5 mL分别加入到离心管,再加入事先配好的2 mmol·L-1金属离子硝酸溶液0.5 mL,在恒温振荡器中(25±1)℃下震荡,然后离心分离,取上清液0.4 mL用去离子水稀释并定容至10 mL容量瓶,然后使用ICP-7510测量。再利用以下公式计算出萃取分配比(D),萃取率(E)和分离因子(SF):

其中,Ci、Caq分别代表水相中金属离子的初始浓度和萃取结束后剩余的浓度(mol·L-1),Co代表萃取结束后有机相中金属离子的浓度(mol·L-1),Vaq代表水相体积(mL),Vo代表有机相体积(mL),DU代表UO22+的分配比,DEu代表Eu3+的分配比。
在仲裁申请中,成锐要求公司向其支付违法解除劳动关系赔偿金48802元、2011年6月6日至2017年8月1日期间的周六日加班工资差额18210元、十三薪23274元、住房补贴14040元、特种工种津贴7602元。此外,还有2017年67个小时的加班工资2812元。考虑到自己从事的工作接触有毒有害物质,他还要求公司为其出具特种工种证明并为其做特殊工种离职体检。然而,仲裁裁决驳回了他的全部请求。成锐不服裁决,又诉至法院。
2 结果与讨论
2.1酸度对萃取Eu3+和UO22+影响
Eu3+和UO22+浓度分别为2 mmol·L-1和9 mmol· L-1(实验发现,如果UO22+浓度也为2 mmol·L-1,其萃取率始终是100%,在图上是一条直线),CMPO浓度为20 mmol·L-1,在室温下(25±1)℃酸度对各萃取体系萃取性能的影响如图1所示:总体上,CMPO/[Cnmim][NTf2]体系的萃取率在不同酸度下都大于CMPO/n-Dodecane体系,相比于正十二烷,离子液体具有很好的协同萃取能力;在同一酸度下,随着离子液体碳链长度的增长,萃取体系的萃取率越低。对于Eu3+,随着酸度的增加,CMPO/[C2mim][NTf2]和CMPO/[C8mim][NTf2]体系的萃取率逐渐降低,而CMPO/[C12mim][NTf2]和CMPO/n-Dodecane体系的萃取率先增加,当硝酸浓度大于1 mol·L-1时,萃取率逐渐减小。这表明,CMPO/[C2mim][NTf2]和CMPO/[C8mim][NTf2]体系在萃取Eu3+时的萃取机理主要是离子交换,由于H+参与竞争萃取,[C2mim][NTf2]和[C8mim][NTf2]中CMPO的萃取性能随酸度的增强而降低。Nakashima等[15]在用CMPO/[C4mim][PF6]体系萃取Ce3+、Eu3+、Y3+时也发现了同样的现象。CMPO/[C12mim][NTf2]和CMPO/n-Dodecane体系的萃取机理在硝酸浓度小于1 mol·L-1时,以中性配位为主,酸度大于1 mol·L-1时,以离子交换为主。可以看出,随着离子液体碳链长度逐渐变长,各体系不仅萃取性能逐渐下降,萃取机理也发生了变化:[C2mim][NTf2]体系为离子交换,[C8mim][NTf2]体系同为离子交换但程度减弱,[C12mim][NTf2]体系中进一步减弱为离子交换、中性配位共存。Diet等[19]在研究离子液体结构对萃取机理的影响时,也发现并证实了这种机理变化的存在。各体系萃取UO22+时与萃取Eu3+情况大不一样,随着酸度的增加萃取率逐渐上升,直至达到最大。显然,这里的萃取机理以中性配位为主,NO3-的引入有助于配位的进行,这与许多学者的研究结果一致[14,17]。由于受所谓的“分子内缓冲效应”影响[20],CMPO具有很好的耐酸性,在高酸下也能获得很高的萃取率。通过以上分析,CMPO/[Cnmim] [NTf2]体系在萃取Eu3+和UO22+时的机理是不同的,对于CMPO/[C2mim][NTf2]体系,其萃取机理可以分别用以下等式表示:
对于Eu3+,在[C2mim][NTf2]和[C8mim][NTf2]体系中,以离子交换为主:
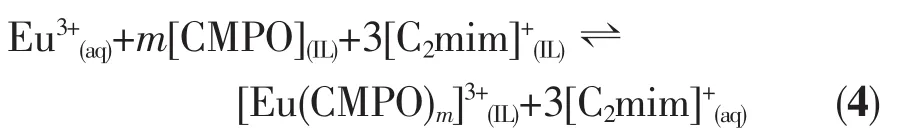

图1 酸度对萃取率E的影响: (A)萃取Eu3+; (B)萃取UO22+Fig.1 Effects of acidity on extracting efficiency: (A) extracting Eu3+; (B) extracting UO22+
在[C12mim][NTf2]和n-Dodecane体系中,中性配位起重要作用:
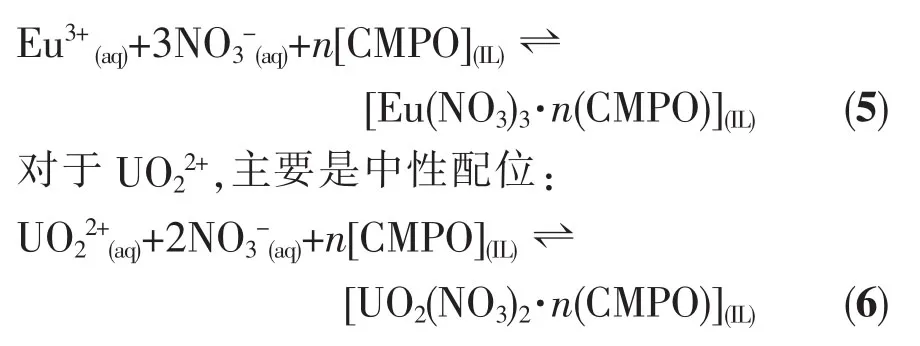
2.2萃取动力学
萃取平衡时间是萃取实验的一个重要的参数,考虑到在低酸度下各体系都有较明显的萃取效果,且都是离子交换的萃取机理,故本实验考察了在硝酸浓度为0.1 mol·L-1时的萃取动力学。其中Eu3+的浓度为2 mmol·L-1,UO22+浓度均为9 mmol·L-1,CMPO浓度为20 mmol·L-1,温度为(25±1)℃。从图2可以看出,离子液体体系的萃取性能要远远优于正十二烷体系。且随着碳链长度的增加,萃取率和萃取速率均下降,萃取平衡时间也由n=2的5 min延长至n=12的120 min。这一方面归因于离子液体的疏水性和粘度会随着碳链长度的增长而变大,从而减弱了体系的萃取性能[21];另一方面由于萃取机理的变化,离子交换的反应速率要大于中性配位,导致平衡时间延长。
萃取结束后,在对Eu3+的萃取中发现在水相和离子液体中间有一层乳白色的第三相产生。第三相产生情况如表1中所示,在CMPO/[C2mim][NTf2]体系中第三相产生的比较明显,随着碳链长度的增长,第三相逐渐变少,在CMPO/[C12mim][NTf2]体系中则几乎观察不到第三相。推测第三相应该是萃取后CMPO和Eu3+形成的配合物,由于其在不同离子液体中的溶解度不同,所以产生了上述差异,其原因是短碳链离子液体极性相对较大,而配合物中含有的CMPO极性相对较弱,因此导致配合物在短碳链离子液体中溶解度下降,出现第三相[22]。而在对UO22+的萃取中却未发现有第三相的产生,且观察到下层离子液体相呈黄色,说明CMPO与UO22+形成的配合物很好地溶进了离子液体中,这可能与UO22+比Eu3+在本实验条件下更容易与CMPO配位有关,CMPO与UO22+形成的配合物时物质的量之比大约为6∶1(将在下文详细说明)。由于CMPO/[C2mim] [NTf2]相对于其它体系不管对Eu3+还是对UO22+都表现出了最佳的萃取性能,所以下文均以CMPO/[C2mim][NTf2]为代表研究其萃取行为。
2.3萃取剂浓度对萃取Eu3+和UO22+的影响

图2 接触时间对不同体系萃取率E的影响(A)萃取Eu3+(B)萃取UO22+Fig.2 Effect of contact time on the extraction performance in different systems (A) extract Eu3+(B) extract UO22+

以上公式中K为反应的平衡常数,K′为修正平衡常数,D为分配比,(O)代表有机相,(aq)代表水相,式中c均表示浓度。
将(9)取对数可得到简化式:

通过(10)式可以看出以lgcCMPO为x轴,以lgD为y轴,拟合出来的直线的斜率就是n值,也就是配合物中CMPO与金属离子的计量比,而修正平衡常数K′可以通过直线在y轴上的截距计算出来,斜率和截距见表2。对于UO22+,图3中直线斜率为5.39,这说明配合物中CMPO与UO22+配位比大约为6。 Siddall等[23]指出在萃取剂浓度很低时lgD-lgcCMPO的斜率代表着分子间反应系数。因此在本实验条件下,CMPO与UO22+的萃取反应方程为:

表1 第三相在各体系的形成情况Table 1 Formation of the third phase in each system

图3 CMPO浓度对萃取分配比D的影响Fig.3 Effects of CMPO concentration on distribution rate

同理,对于Eu3+,如图3所示,lgD对lgcCMPO作图得一条斜率为2.55的直线,即CMPO与Eu3+的配位比大约为3,所以相应的反应方程为:

2.4温度对萃取Eu3+和UO22+的影响

表 2 CMPO和Eu3+、UO22+配合的平衡常数及配位比Table 2 Stoichiometry and extraction constant for complex of the Eu3+or UO22+with CMPO
水相Eu3+和UO22+初始浓度分别为2 mmol·L-1和9 mmol·L-1,酸度为0.1 mol·L-1HNO3,CMPO浓度为20 mmol·L-1,反应温度为25、35、45、55、65℃,得到萃取分配比随温度的变化如图4所示:随着温度的升高,对于Eu3+,萃取分配比降低,对于UO22+,萃取分配比升高,这表明对于Eu3+反应为放热反应,对于UO22+反应为吸热反应。根据Van′t Hoff方程:
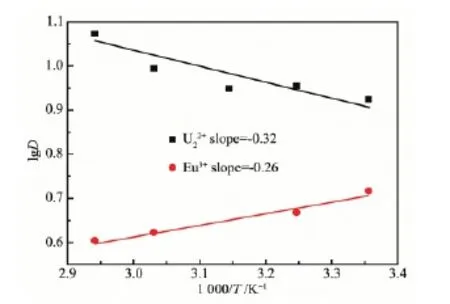
图4 温度对萃取分配比D的影响Fig.4 Effect of temperature on distribution rate

可推导出lgD和1/T的函数关系式:

以lgD对1 000/T作图,可得到2条确定斜率的直线,由上式可以计算出焓变,而吉布斯自由能变和熵变可通过以下等式计算出:

表3总结了在(25±1)℃下,CMPO/[C2mim][NTf2]体系萃取Eu3+和UO22+时的各热力学参数变化。

表3 萃取反应的各热力学参数Table 3 Thermodynamic parameters for the twophase extraction reaction

表4 针对模拟高放废液的萃取结果Table 4 Results of extraction for the simulated high level waste (SHLW)
2.5CMPO/[C2mim][NTf2]体系对模拟高放废液的萃取
本研究最后选择CMPO/[C2mim][NTf2]体系,考察其对于模拟高放废液中各种元素的萃取选择性,并与CMPO/n-Dodecane的实验结果作了比较。所配制的模拟废液含Fe3+、ReO4-、Sr2+、Zr4+、Ag+、Pd2+、Ni2+、UO22+、Eu3+和Y3+10种金属离子,浓度均为1 mmol· L-1,分别在硝酸浓度为0.01 mol·L-1和3 mol·L-1时对模拟废液进行了萃取分离,CMPO浓度为20 mmol·L-1,在(25±1)℃下萃取2 h,萃取结果如表4所示:铀和铕分别作为锕系和镧系元素的代表,不管在低酸还是高酸下都能很好的被CMPO/[C2mim] [NTf2]体系萃取,且萃取率明显高于CMPO/n-Dodecane体系。在n-Dodecane体系中,Ag+的分配比很高,这对Eu3+和UO22+的萃取产生了很大的干扰,而且萃取Eu3+的效果也不理想,但在[C2mim][NTf2]体系下,不仅Ag+的干扰被很好的减弱了,Eu3+也能很好的被萃取出来。此外在高酸下CMPO/[C2mim] [NTf2]体系对Eu3+和UO22+两者之间的分离显示了一定的效果,分离因子约为914。由前面讨论可以推断,如果提高萃取温度,分离因子还可以进一步提高。
3 结 论
与传统稀释剂正十二烷体系相比,CMPO在离子液体[Cnmim][NTf2](n=2,8,12)中,不管在低酸还是高酸下,针对硝酸溶液中的Eu3+和UO22+,表现出了很好的萃取性能。随着碳链长度的增加,各体系对Eu3+的萃取机理由离子交换逐渐向中性配位变化,对UO22+则是中性配位;萃取平衡时间也随碳链增长而变长,其先后顺序为:[C2mim][NTf2]>[C8mim] [NTf2]>[C12mim][NTf2]>n-Dodecane。并且,在低酸下,CMPO/[Cnmim][NTf2]体系在针对Eu3+的萃取时产生的第三相会随着碳链长度增长而逐渐消失。在高酸下,用CMPO/[C2mim][NTf2]体系萃取时不仅没有第三相的产生,对Eu3+和UO22+还有一定的分离效果。对于Eu3+,反应机理有离子交换:Eu3+(aq)+3[CMPO](IL)+ 3[C2mim]+(IL)⇌[Eu(CMPO)3]3+(IL)+3[C2mim]+(aq),中性配位: Eu3+(aq)+3NO3-(aq)+n[CMPO](IL)⇌[Eu(NO3)3·n(CMPO)](IL),反应为放热反应;对于UO22+,反应机理为中性配位:UO22+(aq)+2NO3-(aq)+6[CMPO](IL)⇌[UO2(NO3)2·6(CMPO)](IL),反应为吸热反应。CMPO/[C2mim][NTf2]体系相对于正十二烷体系能有效的将镧系和锕系元素从模拟废液中分离出来,且调整反应温度有利于Eu3+和UO22+的分离。综上所述,离子液体体系相较于传统有机溶剂体系,具有诸多优势,有望在核燃料循环过程中发挥一定的作用。
[1] Swanson J L. Sci. Technol. Tributyl Phosphate, 1984,3:55
[2] Huddleston J, Rogers R. Chem. Commun., 1998(16):1765-1766
[3] SHI Jia-Hua(石家华), SUN Xun(孙逊), YANG Chun-He(杨春和), et al. Chemistry(化学通报), 2002,65(4):243-250
[4] Binnemans K. Chem. Rev., 2007,107(6):2592-2614
[5] Cocalia V A, Gutowski K E, Rogers R D. Coord. Chem. Rev., 2006,250(7):755-764
[6] Horwitz E P, Kalina D C, Diamond H, et al. Solvent Extr. Ion Exch., 1985,3(1/2):75-109
[7] Horwitz E P, Kalina D G. Solvent Extr. Ion Exch., 1984,2(2): 179-200
[8] Kalina D, Horwitz E P, Kaplan L, et al. Sep. Sci. Technol., 1981,16(9):1127-1145
[9] Horwltz E P, Martin K A, Diamond H, et al. Solvent Extr. Ion Exch., 1986,4(3):449-494
[10]Kolarik Z J, Horwitz E P. Solvent Extr. Ion Exch., 1988,6(2): 247-263
[11]Mincher B. Solvent Extr. Ion Exch., 1989,7(4):645-654
[12]Nagasaki S, Kinoshita K, Wisnubroto D S, et al. J. Nucl. Sci. Technol., 1992,29(7):671-676
[13]Mathur J, Murali M, Natarajan P, et al. Talanta, 1992,39(5): 493-496
[14]Visser A E, Rogers R D. J. Solid State Chem., 2003,171(1): 109-113
[15]Nakashima K, Kubota F, Maruyama T, et al. Ind. Eng. Chem. Res., 2005,44(12):4368-4372
[16]Rout A, Venkatesan K A, Srinivasan T G, et al. Sep. Sci. Technol., 2011,76(3):238-243
[17]Sengupta A, Murali M S, Thulasidas S K, et al. Hydrometallurgy, 2014,147-148:228-233
[18]HUANG Lei(黄磊), HUANG Wei(黄卫), FU Hai-Ying(付海英), et al. Chinese J. Inorg. Chem.(无机化学学报), 2012,4: 669-673
[19]Dietz M L, Dzielawa J A, Laszak I, et al. Green Chem., 2003, 5(6):682-685
[20]Schulz W, Horwitz E P. Sep. Sci. Technol., 1988,23(12/13): 1191-1210
[21]Huddleston J G, Visser A E, Reichert W M, et al. Green Chem., 2001,3(4):156-164
[22]LIU Hai-Wang(刘海望), SHEN Xing-Hai(沈兴海), CHEN Qing-De(陈庆德). Acta Phys.-Chim. Sin.(物理化学学报), 2015(5):843-851
[23]Siddall T H. J. Inorg. Nucl. Chem., 1964,26(11):1991-2003
Extraction Behavior of Eu3+and UO22+Using CMPO/[Cnmim][NTf2] Systems
SHI Jin-Qiang1YUAN Wei-Jin1DONG Zhen1ZHAO Long*,1
WEI Yue-Zhou1HE Lin-Feng2TANG Fang-Dong2
(1School of Nuclear Science and Engineering, Shanghai Jiao Tong University, Shanghai 200240, China)
(2Division of Chemistry and Ionizing Radiation Measurement Technology, Shanghai Institute of
Measurement and Testing Technology, Shanghai 201203, China)
The extraction behavior of Eu3+and UO22+from nitric acid solution with n-Octyl (phenyl)-N,N diisobutylcarbamoylmethylphosphine oxide(CMPO) dissolved in hydrophobic ionic liquid [Cnmim][NTf2] (n=2, 8, 12) was studied. The extraction efficiency (E) of Eu3+and UO22+in CMPO/[Cnmim][NTf2] was measured as a function of various parameters such as contact time, the concentrations of nitric acid, CMPO and temperature. CMPO/[C2mim] [NTf2] system was selected for lanthanide and actinide partitioning from simulated high level waste (SHLW). The results showed that the extraction equilibrium time extended gradually with the increasing of the chain length of the ionic liquid. The E values for Eu3+decreased while that for UO22+increased with the increasing of acidity. The extraction process was endothermic for UO22+while the same was for Eu3+it was exothermic. The extraction mechanism was suggested that the extraction proceed via ion exchange mechanism for Eu3+while that for UO22+via neutral complex. Actinides (An) and lanthanides (Ln) could be extracted effectively from SHLW. And to some extent, An/Ln separation effectiveness was observed under high acidity using CMPO/[C2mim][NTf2] system.
Eu3+; UO22+; octyl(phenyl)-N,N-diisobutylcarbamoylmethylphosphine oxide; ionic liquid; extraction
O614.33+8;O614.62
A
1001-4861(2016)03-0414-07
10.11862/CJIC.2016.048
2015-08-30。收修改稿日期:2015-12-22。
国家自然科学基金资助项目(No.11475112),教育部博士点基金项目(No.20130073120051)资助。*通信联系人。E-mail:ryuuchou@sjtu.edu.cn,ryuuchou@hotmail.com
