低活性β-葡糖苷酶酵母菌株的筛选及其在黑莓果酒发酵中的应用
2016-09-18周剑忠胡彦新梁红云夏秀东黄自苏
王 英,周剑忠,胡彦新,梁红云,夏秀东,黄自苏
低活性β-葡糖苷酶酵母菌株的筛选及其在黑莓果酒发酵中的应用
王英,周剑忠,胡彦新,梁红云,夏秀东,黄自苏
(江苏省农业科学研究院 农产品加工研究所,江苏 南京 210014)
从本实验室保存的23株来源于自然发酵果酒的酵母中筛选到1株β-葡糖苷酶活性较低、生长快且不产膜的酵母FY4,经18S rDNA序列分析,该菌株鉴定为酿酒酵母(Saccharomyces cerevisiae)。利用该菌株发酵黑莓果酒,通过单因素和正交试验考察了发酵温度、果胶酶用量、加糖量和接种量对黑莓果酒中花色苷含量的影响。结果表明,当酵母FY4接种量为2%,发酵温度为32℃,加糖量为14%,果胶酶添加量为0.22%时,发酵后黑莓果酒中的花色苷含量达到(406.31±5.64)mg/L,是相同条件下利用商业酿酒酵母PHYTHM.nsac发酵的黑莓果酒中花色苷含量的1.53倍。
β-葡糖苷酶;酿酒酵母;鉴定;花色苷;黑莓果酒
花色苷(anthocyanins)是植物体内的一种色素类物质,能够赋予植物不同的颜色。由于花色苷对人体具有多方面的保健功能,如抗癌、抗炎、保护心血管、改善肝功能和视力[1-5]。随着生活水平的提高和保健意识的增强,对花色苷提取、花色苷结构的分析、花色苷稳定性、功能食品的开发成为目前的研究热点[6-9]。
由于花色苷的结构特征和苷元的高活性,导致花色苷的稳定性较差[10]。研究结果表明,果酒、果汁中的花色苷含量随着储存时间的延长,花色苷含量会有不同程度的下降[11]。导致花色苷降解的因素很多,温度、pH、体系的氧化状态等都能影响花色苷的降解速度[12]。据有关研究报道,能够使花色苷降解的酶广泛存在于高等植物及微生物体内[13],主要包括β-葡糖苷酶(β-glucosidase)、多酚氧化物酶(polyphenol oxidase)和过氧化物酶(peroxidase)等酶类,因此减少和钝化不利于花色苷保存的酶活性是提高果酒中花色苷含量的手段之一[14]。
大量的研究结果表明真菌和高等植物中存在β-葡糖苷酶[15-16]。β-葡糖苷酶(β-glucosidase)催化花色苷β-糖苷键断裂,生成糖和花色素,花色素很不稳定,可自发转换成无色衍生物。因此,黑莓、蓝莓、树莓等果酒、果汁等花色苷含量高的体系中的β-葡糖苷酶对果酒、果汁的色泽稳定性具有重要的作用,同时β-葡糖苷酶对保持果酒、果汁中的花色苷含量也具有重要作用。目前,文献报道[17]主要是β-葡糖苷酶对果酒的挥发性风味物质的影响,β-葡糖苷酶对果酒的色泽稳定性、花色苷含量的影响还少有相关的报道。
本研究从本实验室保存的自然发酵果酒中分离获得的23株酵母中筛选β-葡糖苷酶活性低的酵母,利用筛选酵母发酵黑莓果酒,研究发酵条件(发酵温度、果胶酶用量、接种量和蔗糖添加量)对发酵黑莓果酒中花色苷含量的影响,旨在为高含量花色苷黑莓果酒发酵提供优良的酵母资源。
1 材料与方法
1.1材料与试剂
1.1.1菌株来源及实验材料
酵母菌株23株:由江苏省农科院农产品加工研究所生物工程研究室保存。其中,菌株F1~F6,来源于自然发酵的葡萄果酒;菌株F7~F15,来源于自然发酵的蓝莓果酒;菌株FY1~FY8,来源于自然发酵的黑莓果酒。商业酿酒酵母PHYTHM.nsac:丹麦Chr.hansen公司;黑莓(Rubus fruticosus):江苏省南京市溧水县黑莓种植基地。
1.1.2主要试剂
3,5-二硝基水杨酸(dinitrosalicylicacid,DNS)(分析纯)、七叶苷(分析纯)、偏重亚硫酸钾(食品级):国药集团化学试剂有限公司;水杨苷(分析纯):上海扶生实业有限公司;果胶酶(300000U/g):诺维信生物技术有限公司;聚合酶链反应(polymerase chain reaction,PCR)试剂及DNA Marker:宝生物工程有限公司;PCR引物:上海生工生物工程技术服务有限公司;对硝基苯酚:天津市凯信化学工业有限公司;酵母膏、蛋白胨、葡萄糖、琼脂、柠檬酸、磷酸二氢钠、碳酸钠等均为国产分析纯。
1.1.3培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:酵母浸膏10 g/L、蛋白胨20 g/L、葡萄糖20 g/L、琼脂20 g/L,121℃灭菌20 min。
YEPD液体培养基:酵母浸膏10 g/L、蛋白胨20 g/L、葡萄糖20 g/L,121℃灭菌20 min。
发酵培养基:酵母浸膏10 g/L、蛋白胨20 g/L、葡萄糖20 g/L,121℃灭菌20 min。
1.2仪器与设备
分光光度计UV-1600PC:上海美普达仪器有限公司;LC-210.2精密电子天平:德国赛多利斯股份有限公司;THZ-C-1全温振荡器:太仓市实验设备厂;SevenEasy plus pH仪:上海梅特勒-托利多仪器有限公司;SIGMA3K-15台式冷冻离心机:德国西格玛公司;GLS3500全自动凝胶成像分析系统仪:上海天龙科技有限公司;S1000ThermalCycler PCR仪:美国BIO-RAD公司。
1.3实验方法
1.3.1菌种活化与培养
将甘油管保藏菌种在YEPD固体培养基上划线,25℃条件下培养36 h。提取单菌落,接种至YEPD液体培养基,25℃、150 r/min条件下,培养24 h,待用。
1.3.2菌株生长特性的测定
按照2%的接种量把24株分别接种至YEPD液体培养基中,25℃、150 r/min条件下,培养10 h,测定光密度值OD600nm。
按照2%的接种量把24株分别接种至YEPD液体培养基中,25℃条件下,静止培养24 h,观察其表面产膜现象。
1.3.3粗酶液制备
将活化后的酵母分别按2%的接种量接入到装液量为50mL/250mL的发酵培养基中,25℃条件下,摇床150r/min,培养72 h,发酵液于4℃、10 000 r/min条件下离心20 min,收集菌体,将菌体悬浮pH为5.0的磷酸盐缓冲液(phosphate buffer solution,PBS)中,利用超声波破碎法破碎细胞(400 W,超声5s,间歇5s,处理8min),离心(12000r、10min,4℃)收集上清液,即为待测粗酶液,测定粗酶液中β-葡糖苷酶的活性。
1.3.4β-葡糖苷酶活性的测定[18]
葡萄糖标准曲线的制作:分别吸取1mg/mL葡萄糖标准液0、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL、1.2mL、1.4mL于试管中,用蒸馏水将每支试管加水到2.0 mL,再加1.5 mL DNS试剂,充分混合后在沸水中煮沸5 min,冷却后用蒸馏水稀释至25 mL,用分光光度计在波长540 nm处测定吸光度值A540nm,以0号试管为对照。以葡萄糖含量(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线,得到标准曲线回归方程:y=0.005 3x-0.002 5,相关系数R2=0.999 1。
取1.0 mL的粗酶液,加入1.0 mL 0.5%的水杨苷(溶于0.1mol/LpH5.0醋酸缓冲液中),60℃保温1h后,加入1.5mL DNS试剂,充分混合在沸水中煮沸5 min,冷却后用蒸馏水稀释至25 mL,用分光光度计于波长540 nm处测吸光度值A540nm,以加热灭活的酶液按照同样方法处理作为空白。β-葡糖苷酶酶活定义:上述反应条件下,每小时由底物产生1 μmol还原糖(以葡萄糖计)所需酶量为一个酶活单位(U/mL)。
1.3.5低产β-葡糖苷酶菌的分子生物学鉴定
利用天根生物科技有限公司的酵母基因组提取试剂盒提取酵母总脱氧核糖核酸(deoxyribonucleic acid,DNA)。具体提取步骤参照说明书。
采用18S rDNA通用引物,正向引物18:5'-GTAGTCA TATGCTTGTCTC-3';反向引物:5'-TCCGCAGGTTCACC TACGGA-3'。50μLPCR反应体系为:10×Taqbuffer 5.0μL、2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)5.0 μL、上游引物(10 pmol/L)2.0 μL、下游引物(10 pmol/L)2.0 μL、2 U/LTaq酶0.5 μL、DNA模板1.0 μL、双蒸水34.6 μL[19]。
PCR扩增反应循环参数:95℃预变性5 min,95℃变性40 s,45℃退火40 s,72℃延伸40 s,体系运行34个循环,最后72℃延伸10 min。利用0.8%琼脂糖凝胶电泳检测PCR产物。产物经纯化后送上海生物工程有限公司测序。
测序结果在GenBank数据库中用局部序列比对基本检索工具(basic local alignment search tool,BLAST)程序进行同源序列分析。利用MEGA5.1软件构建系统发育树,分析该菌株的亲缘关系和系统发育。
1.3.6分析检测
(1)总糖测定
果酒总糖含量的测定采用蒽酮法,具体操作步骤参照文献[20]。
(2)酒精度测定
取2支100 mL的容量瓶,分别准确量取100 mL黑莓果酒和蒸馏水,将黑莓果酒导入500 mL的蒸馏瓶中,再用100 mL蒸馏水分3次冲洗量取黑莓果酒的容量瓶,并将100 mL蒸馏水全部加入蒸馏瓶中,加入适量玻璃珠。将其中一个100mL的容量瓶作为接收瓶,打开冷凝水和电热套,进行加热蒸馏。当接收瓶达到100 mL刻度线时,关闭电热套,蒸馏结束。在规定的温度条件下用酒精计测定酒精度。
(3)花色苷的测定
花色苷含量:黑莓果酒中花色苷含量的测定参考WROLSTAD T等[21]方法,直接取稀释后的黑莓果酒进行测定。取两个l0 mL的容量瓶各加入1.0 mL稀释后的黑莓果酒,分别用pH1.0的缓冲液(0.2 mol/L KCl∶0.2 mol/L HCl= 25∶67(V/V))和pH 4.5的缓冲液(1 mol/L NaAc∶l mol/L HCl∶H2O=100∶60∶90(V/V)进行定容,在冰箱中避光静置2 h后,分别在波长520 nm和700 nm条件下测定吸光度值A。花色苷含量按下式计算,结果以矢车菊-3-O-葡萄糖苷计。
花色苷含量(mg/L)=(A×MW×DF×1000)/(ε×1)
A=(A520nm-A700nm)pH1.0-(A520nm-A700nm)pH4.5;
式中:MW为矢车菊-3-O-葡萄糖苷的相对分子质量449.2;DF为稀释倍数10;ε为矢车菊-3-O-葡萄糖苷的摩尔消光系数26 900;1为比色皿的光程长度,cm。
1.3.7酿酒酵母FY4发酵黑莓果酒加工工艺流程及操作要点

操作要点:
黑莓果清洗:剔除坏果和烂果,利用流动的清水将黑莓果清洗干净,并沥干水分。
打浆:将沥干的黑莓果打浆,尽量打碎。
配料:根据黑莓果质量,依次添加75 mg/L的偏重亚硫酸钾、果胶酶、蔗糖,并充分搅拌均匀。
接种:添加不同含量菌种,并混匀。
发酵:将接种后的体系放置在不同温度条件下静止发酵。
过滤:当残糖量<4 g/L时,终止发酵,利用硅藻土进行过滤。
澄清:向酒液中加入0.40~0.50 g/L的壳聚糖溶液,充分混匀,进行澄清处理。
1.3.8黑莓果酒发酵工艺优化单因素试验
发酵温度的影响:按照3%的接种量接入酿酒酵母FY4,蔗糖添加量为14%,果胶酶添加量为0.1%,分别于15℃、20℃、25℃、30℃、35℃进行恒温发酵,当残糖量<4 g/L时结束发酵,测定发酵果酒的花色苷含量。
果胶酶的影响:按照3%的接种量接入酿酒酵母FY4,蔗糖添加量为14%,发酵温度为30℃,果胶酶的添加量分别为0.05%、0.10%、0.15%、0.20%、0.25%、0.30%,当残糖量<4 g/L时结束发酵,测定发酵果酒的花色苷含量。
接种量的影响:蔗糖添加量为14%,发酵温度为30℃,果胶酶添加量为0.2%,分别接入2%、4%、6%、8%、10%(V/V)的活化后酿酒酵母FY4菌液,当残糖量<4 g/L时结束发酵,测定发酵果酒的花色苷含量。
加糖量的影响:按照2%的接种量接入酿酒酵母FY4,发酵温度为30℃,果胶酶的添加量0.2%,蔗糖添加量12%、14%、16%、18%、20%的白砂糖,当残糖量<4 g/L时结束发酵,测定发酵果酒的花色苷含量。
1.3.9黑莓果酒发酵工艺的正交优化
根据以上单因素试验,确定发酵温度、加糖量、果胶酶用量作为正交试验中的3个因素,采用L9(34)正交设计表进行试验,以确定酿酒酵母FY4发酵黑莓果酒的最优化条件,正交试验因素与水平见表1。

表1 发酵条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for fermentation conditions optimization
1.3.10数据处理
试验均重复3次,结果以“平均值±标准差”表示,用SPSS 20.0进行显著性分析。
2 结果与分析
2.1低产β-葡糖苷酶菌株的筛选
本研究利用比色法测定了从自然发酵的黑莓、蓝莓和葡萄酒中筛选到的24株酵母的β-葡糖苷酶的酶活性,同时考察了菌株的生长能力和发酵液体表面的成膜情况,具体结果见表2。由表2可知,24株酵母的β-葡糖苷酶的酶活性差异很大,最大值为0.79 U/mL,最小值仅为0.08 U/mL,最大酶活性是最小酶活性的9.625倍。不同菌株的生长能力也有很大差异。相同的生长时间内,最大OD600nm值为2.61,最小OD600nm值仅为1.75。不同的酵母在生长的过程中会在液体表面成膜,利用这种酵母发酵果酒会影响果酒的品质并给果酒的后期处理带来不便,因此,综合考虑酵母的β-葡糖苷酶活性、菌株的生长能力和表面成膜现象,选择酵母菌株FY4进行黑莓果酒的发酵。

表2 菌株培养液中β-葡糖苷酶的活力及酵母FY4生长特性Table 2 β-glucosidase activity and growth characteristics of yeast FY4 in cultured liquid
2.2酵母菌株FY4的系统发育分析
经过测序获得酵母菌株FY4的18S rDNA的序列,BLAST结果显示,菌株FY4与Saccharomyces cerevisiae的同源性最高,同源性为100%。利用CLUATRAW和MEGA 5.1构图软件将菌株FY4与GeneBank数据库中已知的酵母菌株进行的序列并构建系统发育树,结果见图1。由图1可知,酵母菌株FY4与S.cerevisiae(Z75578)、S.cerevisiae(AB278124)在系统发育树上聚为一支,表明该菌株与酿酒酵母最为相近,从而确定酵母菌株FY4属于酿酒酵母(Saccharomycescerevisiae)。

图1 酵母FY4的18S rDNA的系统发育进化树Fig.1 Phylogenetic tree of 18S rDNA of yeast FY4
2.3发酵工艺优化单因素试验
2.3.1发酵温度对黑莓果酒中花色苷含量的影响
花色苷提取的研究结果显示,在低温的条件下随着提取温度的升高,花色苷含量会增加,但随着温度的升高,花色苷含量会有降低的趋势[8,22-23]。发酵温度对黑莓果酒中花色苷含量的影响,结果见图2。由图2可知,发酵温度在15~30℃时,黑莓果酒花色苷含量随发酵温度的升高而增加;当温度为30℃时,花色苷含量达到最大值298.48 mg/L;发酵温度>30℃之后,花色苷含量增加不显著。因此,选择发酵温度为30℃为黑莓果酒发酵的合适温度。
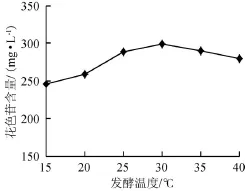
图2 发酵温度对黑莓果酒花色苷含量的影响Fig.2 Effect of fermentation temperature on the anthocyanin content in blackberry wine
2.3.2果胶酶添加量对黑莓果酒中花色苷含量的影响

图3 果胶酶添加量对黑莓果酒花色苷含量的影响Fig.3 Effect of pectinase addition on the anthocyanin content in blackberry wine
在利用酶法或者超声波辅助酶法提取花色苷的研究中,常会用到果胶酶和纤维素酶,研究结果显示,随着果胶酶的添加能够增加花色苷的提取量,但是果胶酶量增加到一定的程度,对花色苷提取量的影响就不再明显[24]。本研究固定果酒的发酵温度和加糖量,考察不同果胶酶的添加量对果酒中花色苷的影响,结果见图3。由图3可知,果胶酶添加量为0~0.20%时,黑莓果酒花色苷含量随着果胶酶的添加量的增加而增加;在果胶酶添加量为0.20%时,黑莓果酒花色苷含量最高,为328.84 mg/L;但是当果胶酶添加量>0.20%时,果酒中的花色苷含量趋于稳定。因此,在果酒的发酵过程中,果胶酶的适宜的添加量选择0.20%。
2.3.3加糖量对黑莓果酒中花色苷含量的影响
体系中糖分含量及种类对花色苷的稳定性有很大的影响,前人的研究结果显示,体系中的糖能够增加花色苷的稳定性,且在低浓度的时候,随着糖含量的增加,增加花色苷稳定性的效果在增强,不同种类的糖对花色苷稳定性的影响是不同的[9]。在固定发酵温度和接种量的条件下,加糖量对黑莓果酒中花色苷含量的影响,结果见图4。由图4可知,加糖量在黑莓果酒花色苷含量随加糖量的升高而增加,当加糖量为16%时,花色苷含量达到351.48 mg/L,继续提高加糖量,花色苷含量逐渐减少。可见在果酒的发酵过程中,加糖量为16%时黑莓果酒花色苷含量最高。
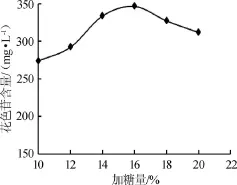
图4 加糖量对黑莓果酒花色苷含量的影响Fig.4 Effect of sugar addition on the anthocyanin content in blackberry wine
2.3.4接种量对黑莓果酒中花色苷含量的影响
在果酒发酵过程中,接种量的大小对果酒的发酵周期和果酒的风味有关,随着接种的增大,将明显缩短发酵时间,活化菌体接入发酵罐中,在发酵罐内成为优势菌体,能够减少和抑制杂菌的生长,明显减少发酵罐染菌的机会;若接种量过大,也会对黑莓果酒的发酵产生不利影响,果酒的口感较差[25]。接种量的大小对果酒中的花色苷含量的影响鲜见报道。本研究对接种量对黑莓果酒的花色苷的影响进行了分析,结果见图5。由图5可知,黑莓果酒中花色苷含量随接种量的增加有降低的趋势,在试验研究的接种量范围内,当接种量为2%时,花色苷含量最高为335.37 mg/L;随着接种量的增大,发酵的过程中酵母菌株FY4菌体密度增大,其果酒体系中β-葡糖苷酶活性提高,进而导致色苷含量下降趋势。当接种量<2%时,花色苷含量差异不明显,考虑到发酵时间长会导致在实际生产中发酵周期延长,加大成本。因此,选择接种量为2%。

图5 接种量对黑莓果酒中花色苷含量的影响Fig.5 Effect of yeast inoculum on the anthocyanin content in blackberry wine
2.4黑莓果酒发酵工艺的正交优化
在单因素试验基础上,对花色苷含量增加效果较明显的3种因素(发酵温度、果胶酶添加量、加糖量)进行L9(34)正交试验,以优化黑莓果酒的最佳发酵条件,正交试验结果与分析及方差分析结果分别见表3和表4。

表3 发酵条件优化正交试验结果与分析Table 3 Results and analysis of orthogonal experiments for fermentation conditions optimization
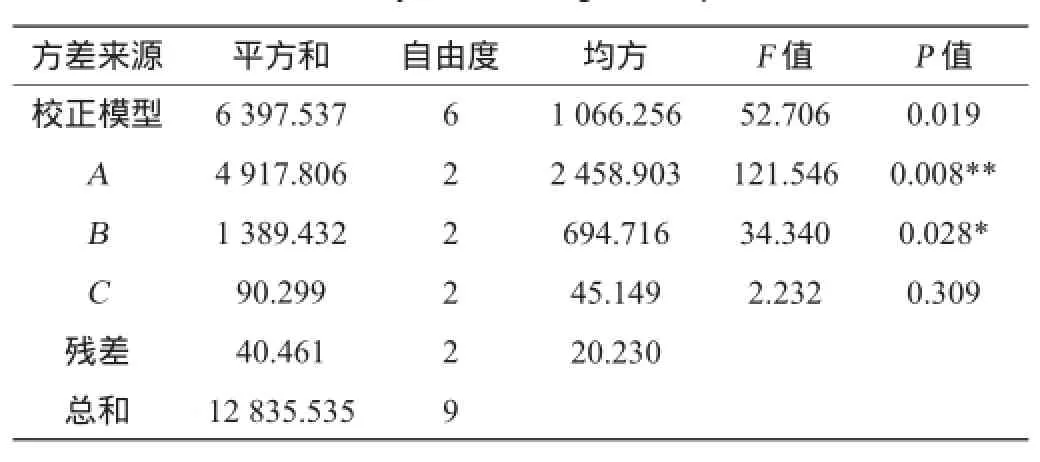
表4 正交试验结果方差分析Table 4 Variance analysis of orthogonal experiments results
由表3可知,三个因素对黑莓果酒中的花色苷含量的影响大小依次为发酵温度>果胶酶添加量>加糖量,最佳组合为A3B3C1,即发酵温度为32℃,果胶酶添加量为0.22%,加糖量为14%。按照所得最优试验条件进行3次验证试验,发酵后黑莓果酒中的花色苷含量为(406.31±5.64)mg/L。同时利用商业酿酒酵母(Saccharomycescerevisiae)PHYTHM. nsac在相同的发酵条件下发酵黑莓果酒,果酒中的花色苷含量为(264.56±4.11)mg/L,可见利用酵母菌株FY4发酵黑莓果酒,可以明显的提高果酒中的花色苷含量。
由表4可知,发酵温度对黑莓果酒的花色苷含量的影响极显著(P<0.01),果胶酶的用量对结果的影响显著(P<0.05),加糖量对结果的影响不显著(P>0.05)。
3 结论
从来源于自然发酵的黑莓、蓝莓、葡萄果酒中的23株酵母中筛选到1株β-葡糖苷酶活性较低的酵母FY4,经系统发育分析该菌株鉴定为酿酒酵母。
通过单因素和正交试验确定了酵母FY4发酵黑莓果酒的最佳工艺条件为接种量2%,发酵温度32℃,加糖量14%,果胶酶添加量0.22%。在此最佳发酵条件下,黑莓果酒中的花色苷含量为(406.31±5.64)mg/L,是相同条件下利用商业酿酒酵母PHYTHM.nsac发酵的黑莓果酒中花色苷含量的1.53倍。
[1]FOLMER F,BASAVARAJU U,JASPARS M,et al.Anticancer effects of bioactive berry compounds[J].Phytochem Rev,2014,13(1):295-322.
[2]JOSEPH S V,EDIRISINGHE I,BURTON-FREEMAN B M.Berries:Antiinflamatoryeffects in humans[J].J Agr Food Chem,2014,62:3886-3903.
[3]KRUGER M J,DAVIES N,MYBURGH K H,et al.Proanthocyanidins,anthocyanins and cardiovascular diseases[J].Food Res Int,2014,59:41-52.
[4]DAI J,GUPTE A,GAGES L,et al.A comprehensive study of anthocyanin-containing extracts from selected blackberry cultivars:extraction methods,stability,anticancerpropertiesand mechanism[J].Food Chemical Toxicol,2009,47(4):837-847.
[5]易龙,陈春燥,金鑫,等.花色苷类植物化学物抑制血管内皮细胞氧化应激损伤作用的结构-效应关系研究[J].第三军医大学学报,2009,31(21):2046-2049.
[6]DIAS A L S,ROZET E,CHATAIGNÉ G,et al.A rapid validated UHPLC-PDA method for anthocyanins quantification fromEuterpe oleracea fruits[J].J Chromatogr B,2012,907:108-116.
[7]卢锋波,刘桂玲,王烁,等.响应面法优化果胶酶酶解提取黑莓花色苷的工艺参数[J].食品科学2010,31(16):11-15.
[8]姚蓓,赵慧芳,吴文龙,等.蓝莓果实花色苷色素提取工艺研究[J].江西农业学报,2015,27(9):109-113.
[9]任二芳,李昌宝,孙健,等.金属离子和食品添加剂对桑果花色苷稳定性的影响[J].南方农业学报,2014,45(1):98-103.
[10]赵昶灵,李云,陈中坚,等.花色苷的酶降解[J].热带亚热带植物学报,2011,19(6):576-584.
[11]赵玉红,贾琳娜,赵铁楠,等.黑加仑果汁中花色苷的贮存稳定性[J].食品科学,2014,35(20):301-306.
[12]SHARMA R J,GUPTA R C,SINGH S,et al.Stability of anthocyanins-and anthocyanidins-enriched extracts,and formulations of fruit pulp ofEugenia jambolana('jamun')[J].Food Chem,2016,190(1):808-817.
[13]张丽霞.黑莓花色苷降解与辅色及抗氧化活性研究[D].南京:南京农业大学,2012.
[14]REIN M J,HEINONEN M.Stability and enhancement of berry juice color[J].J Arg Food Chem,2004,52(10):3106-3114.
[15]侯晓瑞,王婧,杨学山,等.甘肃河西走廊葡萄酒产区高产β-葡萄糖苷酶酵母菌株筛选[J].食品科学,2014,35(23):139-143.
[16]王云,曾沃坦.黑曲霉Aspergillus nigerS菌株所产β-葡糖苷酶的纯化和酶学性质[J].中国科学院研究生院学报,2009,26(2):274-279.[17]郭慧女.β-葡萄糖苷酶生产菌的选育及其对葡萄酒中结合态香气的影响[D].无锡:江南大学,2010.
[18]SHOEMAKER S P,BROWN R D.Characterization of endo-1,4-beta-D-glucanases purified fromTrichoderma viride[J].Biochim Biophys Acta,1978,523(1):147-161.
[19]MARIA R C,MARCOS E C,ANTONIL L G,et al.Evaluation of a rapid DNA extraction method to detect yeast cells by PCR in orange juice[J]. Food Control,2007,18(1):33-39.
[20]王宪泽.生物化学实验技术原理和方法[M].北京:中国农业出版社,2002:77-80.
[21]BFNTSIS T,ROBINSON R K.A study of adjunct cultures on the aroma compounds of feta-type cheese[J].Food Chem,2004,88(3):435-441.
[22]程佑声,王鸿飞,许凤,等.蓝莓皮渣花色苷提取及抗氧化活性的研究[J].果树学报,2015,32(4):696-704.
[23]孟宪军,王冠群,宋德群,等.向应面法优化蓝莓花色苷提取工艺的研究[J].食品工业科技,2010,31(7):226-229.
[24]赵玉红,苗雨,张立钢.双酶法提取蓝靛果果渣中花色苷酶解条件的研究[J].中国食品学报,2008,8(4):75-79.
[25]杨艳彬,童军茂,张宏刚,等.香梨发酵饮料[J].冷饮与速冻食品工业,2000,7(3):24-26.
Screening of yeast with low β-glucosidase activity and its application in the blackberry wine fermentation
WANG Ying,ZHOU Jianzhong,HU Yanxin,LIANG Hongyun,XIA Xiudong,HUANG Zisu
(Institute Agro-Product Processing,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,China)
A yeast FY4 with low β-glucosidase activity,fast growth and no-membrane-producing was screened from 23 yeast strains preserved in the laboratory and derived from the natural fermented fruit wine.The yeast FY4 was identified asSaccharomyces cerevisiaeby 18S rDNA sequencing analysis.The blackberry wine was fermented byS.cerevisiae.The effects of fermentation temperature,pectinase addition,sugar addition and yeast inoculum on the anthocyanin content in blackberry wine were researched by single factor and orthogonal experiments.In the conditions of yeast FY4 inoculum 2%,fermentation temperature 32℃,sugar 14%,pectinase 0.22%,the anthocyanin content in blackberry wine after fermentation was up to(406.31±5.64)mg/L,which was 1.53 times of blackberry wine fermented by commercialS.cerevisiaePHYTHM.nsac at the same conditions.
β-glucosidase;Saccharomyces cerevisiae;identification;anthocyanin;blackberry wine
Q939.97
0254-5071(2016)07-0102-06
10.11882/j.issn.0254-5071.2016.07.022
2016-03-25
江苏省科技支撑计划(BE2014302)
王英(1978-)女,助理研究员,硕士,研究方向为食品生物技术。
