坎皮纳斯类芽孢杆菌木聚糖酶的纯化以及酶学性质
2016-09-18赵祥颖刘建军
陈 磊,赵祥颖,刘建军,
坎皮纳斯类芽孢杆菌木聚糖酶的纯化以及酶学性质
陈磊1,赵祥颖2,刘建军1,2*
(1.齐鲁工业大学 生物工程学院,山东 济南 250013;2.山东省食品发酵工程重点实验室,山东 济南 250013)
采用硫酸铵盐析、Sephadex G-50凝胶过滤、DEAE Sepharose Fast Flow离子交换层析对坎皮纳斯类芽孢杆菌(Paenibacillus campinasensis)xy-7发酵液进行分离纯化,获得纯化的木聚糖酶,纯化倍数为26.36,酶活回收率为5.13%。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)结果为单一条带,分子质量为24.5 ku。酶学性质研究结果表明,该酶的最适反应温度为60℃,最适pH值为8.0。K+、Fe2+对酶有激活作用,Zn2+、Cu2+对酶有强烈的抑制作用。以榉木木聚糖为底物时,米氏常数Km=4.733 mg/mL,最大酶反应速率Vm=315.85 μmol/(min·mg)。
坎皮纳斯类芽孢杆菌;木聚糖酶;分离纯化;酶学性质
木聚糖(xylan)是由β-1,4木糖苷键连接起来的多聚糖,分子中含有许多葡萄糖醛酸、乙酰基、阿拉伯糖、阿魏酸、香豆酸等侧链基团[1]。它是半纤维素中最主要的成分,在农业上被当作废料而大量浪费[2]。木聚糖酶是降解半纤维素木聚糖的一组酶的总称[3],包括切β-1,4-内切木聚糖酶、β-D-木糖苷酶、α-L-呋喃阿拉伯糖苷酶、α-D-葡萄糖醛酸苷酶、乙酰木聚糖酯酶和酚酸酯酶等[4]。在木聚糖降解酶系中,β-1,4-内切木聚糖酶是使木聚糖完全水解最关键的酶,主要来源于细菌、真菌、放线菌等微生物[5]。目前,木聚糖酶在食品行业中引人注目的应用是作为面包品质改良剂[6]。在造纸行业中,碱性木聚糖酶可以提高纸浆的漂白率,并因此减少化学漂白剂的用量[7]。大多数木聚糖酶的分离纯化采用多步非特异性方法,如粗沉淀之后,采用离子交换、凝胶层析、疏水层析等[8]。目前,国内外对木聚糖酶的研究已有较多的报道,但对坎皮纳斯类芽孢杆菌产木聚糖酶的分离纯化以及酶学性质等方面的研究较少。本研究以一株坎皮纳斯类芽孢杆菌为发酵菌株,利用盐析、凝胶色谱分离技术和离子柱层析技术对该菌发酵产生的木聚糖酶进行分离纯化及酶学性质研究,以期为工业生产提供理论指导。
1 材料与方法
1.1材料与试剂
1.1.1菌株
坎皮纳斯类芽孢杆菌(Paenibacillus campinasensis)xy-7:山东省食品发酵工程重点实验室保存。
1.1.2培养基
种子培养基:木聚糖1%,酵母浸粉0.5%,蛋白胨1%,NaCl 0.5%,pH 8.0;121℃灭菌20 min。
发酵培养基:木聚糖1%,蛋白胨0.5%,K2HPO40.05%,KCl 0.08%,MgSO40.08%,pH 8.0;121℃灭菌20 min。
1.1.3主要试剂
木聚糖(分析纯):美国Sigma公司;牛血清白蛋白(生化试剂):南京奥多福尼生物科技有限公司;蛋白质分子质量标准品(生化试剂):宝生物工程(大连)有限公司。
1.2仪器与设备
SephadexG-50层析柱(2.5cm×20cm)、DEAESepharose Fast Flow层析柱(2.5 cm×20 cm):北京瑞达恒辉科技发展有限公司;ZN17-HD自动液相色谱分离层析仪:上海沪西分析仪器厂有限公司。
1.3实验方法
1.3.1木聚糖酶活力测定
取0.1 mL适当稀释的酶液,加入到1.9 mL用Tris-HCl缓冲液(pH8.0)配制的1%木聚糖溶液中,60℃反应10 min,3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法测定还原糖(以木糖计)[9]。木聚糖酶活定义:在上述条件下,每分钟水解木聚糖产生1 μmol还原糖(以木糖计)所需酶量定义为一个酶活力单位(IU/mL)。
木聚糖酶活、比酶活、酶回收率、纯化倍数等计算公式,参照TSENG M J等[10]的方法。
1.3.2分析检测[11-12]
蛋白质含量测定采用考马斯亮蓝法;木聚糖酶的纯度测定采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)法。
1.3.3木聚糖酶的分离
(1)粗酶液的制备
坎皮纳斯类芽孢杆菌xy-7菌株在37℃、180 r/min、装液量30 mL/250 mL条件下,培养24 h。所得发酵液离心(9 000 r/min、15 min)收集上清液,即为木糖酶粗酶液。
(2)硫酸铵分级沉淀[13]
取6支离心管,每支加入离心后粗酶液10 mL,分别加干燥研磨后的(NH4)2SO4至饱和度为0、20%、40%、60%、80%、100%。充分溶解后置于4℃环境中过夜,离心,测定沉淀中木聚糖酶活力及沉淀中蛋白质含量,确定最佳盐析区间。将蛋白沉淀用磷酸盐缓冲液(pH 6.5)复溶,离心(4℃、10 000 r/min、10 min)除去不溶沉淀。所得上清液用蒸馏水透析(截留分子质量为8 000~14 000 u),浓缩。
1.3.4木聚糖酶的纯化
(1)Sephadex G-50层析柱凝胶过滤
将浓缩后的木聚糖酶液取5 mL上样于经Tris-HCl缓冲液(pH8.0)平衡的SephadexG-50层析柱(3.0cm×20cm),并用同一种缓冲液以3.0 mL/min的流速洗脱。根据波长280 nm处吸光度值的变化开始收集样品,每管6 mL,按照1.3.1方法检测木聚糖酶活性。将有酶活的峰收集,并浓缩。
(2)DEAE Sepharose Fast Flow离子层析
将浓缩后的酶液取5 mL上样于经Tris-HCl缓冲液(pH 8.0)平衡的DEAE Sepharose Fast Flow离子层析柱(2.5 cm×20 cm),并以2.5 mL/min流速,0~1 mol/L NaCl梯度洗脱。根据波长280 nm处吸光度值的变化开始收集样品,每管6 mL,按照1.3.1方法检测木聚糖酶活力。将有酶活的峰收集,浓缩。
所得的浓缩液取5 mL上样于经Tris-HCl缓冲液(pH 9.0)平衡的DEAE Sepharose Fast Flow柱(2.5 cm×20 cm),并以2.5 mL/min流速,0~1 mol/L NaCl梯度洗脱。根据波长280 nm条件下吸光度值的变化开始收集样品,每管6 mL,按照1.3.1方法检测木聚糖酶活力。将有酶活的峰收集,浓缩。
1.3.5木聚糖酶的分子质量测定
采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)法。迁移率计算公式、标准蛋白质分子质量的对数和迁移率的标准曲线、木聚糖酶分子质量计算,参照张蕾等[11]的方法。
1.3.6木聚糖酶的酶学性质
(1)木聚糖酶最适反应温度
分别在50℃、55℃、60℃、65℃、70℃水浴条件下进行酶解反应并测定酶活力,以酶活力最高者为100%计算相对酶活力,重复3次,取平均值。
(2)木聚糖酶的最适pH
采用pH值为6.0、6.5、7.0的磷酸盐缓冲液(phosphate buffer solution,PBS)配制底物,pH 7.5、8.0、8.5、9.0、9.5、10.0的Tris-HCl缓冲液配制底物和稀释酶液,在60℃条件下分别用不同pH值的木聚糖底物进行酶解,并按上述方法测定酶活力。以酶活力最高者为100%计算相对酶活力,重复3次,取平均值。
(3)金属离子对酶活的影响
将金属离子(Zn2+、Mg2+、Fe2+、Cu2+、Ca2+、Mn2+、K+)分别加入到木聚糖酶的反应体系中,使金属离子终浓度为5 mmol/L,在60℃条件下按正常酶活体系测定酶活力。为了排除阴离子的影响,除了Ca2+、K+的阴离子为Cl-,其余为SO42-。以未处理酶液的酶活力为100%计算相对酶活力,重复3次,取平均值。
(4)木聚糖酶的米氏常数Km和最大反应速率Vm
根据Lineweaver-Burk双倒数法,测定底物浓度不同时酶的活力,然后计算出在不同浓度时的反应速率,取双倒数得到回归方程,求出木聚糖酶米氏常数Km和最大反应速率Vm。
(5)木聚糖酶的专一性
将1%的木聚糖、羧甲基纤维素、淀粉、蔗糖作为底物,在60℃条件下按正常酶活体系测定酶活力,以木聚糖底物的酶活力为100%计算相对酶活。
2 结果与分析
2.1木聚糖酶分离
在不同(NH4)2SO4饱和度条件下,硫酸铵分级盐析结果见图1。
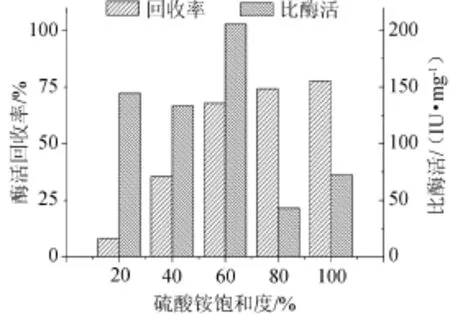
图1 木聚糖酶分段盐析纯度和回收率Fig.1 Purity and recovery rate of xylanase by fractional salting out
由图1可知,当(NH4)2SO4饱和度>80%时,沉淀中酶的比酶活和回收率很低,说明主要为杂蛋白。所以综合比酶活和酶活回收率两个因素考虑,本实验选择(NH4)2SO4饱和度60%为最适盐析条件。
2.2木聚糖酶纯化
SephadexG-50层析凝胶过滤、pH=8.0DEAESepharose Fast Flow离子交换层析、pH=9.0 DEAE Sepharose Fast Flow离子交换层析,洗脱曲线分别见图2~图4。
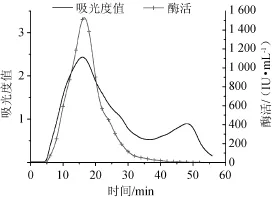
图2 Sephadex G-50凝胶层析柱纯化木聚糖酶洗脱曲线Fig.2 Elution curve of xylanase purified by Sephadex G-50 gel chromatography column
由图2可知,经过SephadexG-50凝胶层析过滤分离出两个蛋白峰,有酶活力的是第一个峰。Sephadex G-50凝胶过滤分离范围为1.5~30ku,适用于小分子蛋白分离、脱盐。由图3可知,经过pH=8.0 DEAE Sepharose Fast Flow离子交换层析分离出3个峰,其中有两个峰有酶活,第一个峰有较高酶活,第二个峰酶活较低不具备研究价值。由图4可知,经过pH=9.0 DEAE Sepharose Fast Flow离子交换层析分离出3个峰,第二个峰有酶活。
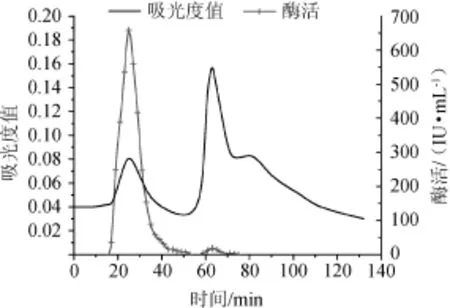
图3 DEAE Sepharose Fast Flow离子交换层析柱纯化木聚糖酶洗脱曲线(pH=8.0)Fig.3 Elution curve of xylanase purified by DEAE Sepharose Fast Flow ion-exchanged chromatography column(pH=8.0)
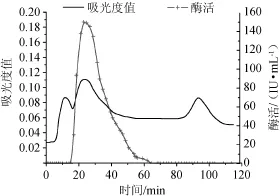
图4 DEAE Sepharose Fast Flow离子交换层析柱纯化木聚糖酶洗脱曲线Fig.4 Elution curve of xylanase purified by DEAE Sepharose Fast Flow ion-exchanged chromatography column(pH=9.0)
木聚糖酶纯化倍数和比酶活见表1。根据邹永龙等[14]的研究表明,具有木聚糖降解酶活性的各个组分如内切木聚糖酶、木聚糖苷酶等参与木聚糖降解为木糖单体同时存在时,它们之间的协同作用可能使实验过程中测得的酶活力值高于实际值,致使酶活力的回收率偏低,这在酶分离纯化的初期表现得很明显。
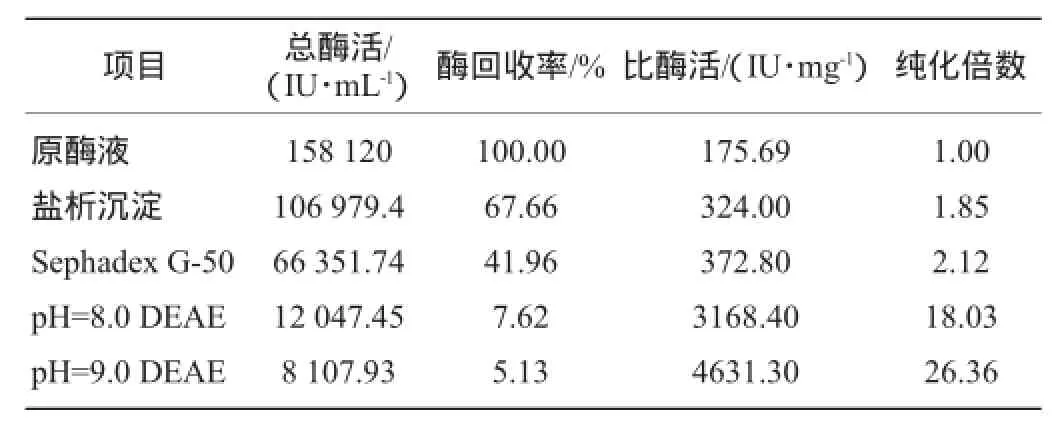
表1 木聚糖酶纯化结果Table 1 Purification results of xylanase
由表1可知,经过盐析、G-50凝胶过滤、两次离子交换层析后,纯化倍数是26.36,酶活回收率为5.13%,比酶活提高至4 631.3 IU/mg。虽然在实验中也检测到其他具有木聚糖水解活性的组分,但由于酶活较低,不具备研究意义,所以只是鉴定了其中的一个具有较高活性的组分,致使酶活力的回收率比较低。
木聚糖酶SDS-PAGE电泳结果见图5。由图5可知,1号泳道说明盐析后的酶液中含有大量杂蛋白;2号泳道说明Sephadex G-50凝胶层析过滤后的酶液也含有大量杂蛋白;3号泳道说明经过pH 8.0离子层析后只含有3条蛋白带,4号泳道说明经过pH 9.0离子层析后只含有1条蛋白带。结果表明,纯化后只有一条木聚糖酶电泳条带,说明该酶为单肽链结构蛋白。按照1.3.5节方法计算出胞外木聚糖酶相对分子质量为24.5 ku。
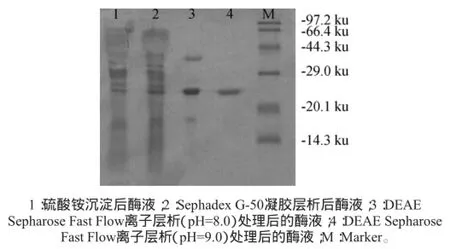
图5 木聚糖酶粗酶和纯化后的电泳图Fig.5 Electrophoretogram of crude and purified xylanase
2.2木聚糖酶的酶学性质
2.2.1木聚糖酶最适反应温度
在不同温度下测定木聚糖酶的酶活力,结果见图6。从图6可以看出,随着温度的增加,酶活呈上升趋势,在温度为60℃时达到最高峰,随后开始下降,因此,最适温度为60℃。在温度为45~65℃时可保持80%以上的相对酶活,说明该酶具有很好的耐热性,具有工业化潜力。例如,在面包制作方面,使用中温木聚糖酶能使面包体积最大增加量为30%,而耐热木聚糖酶可使面包增大40%~60%[16]。
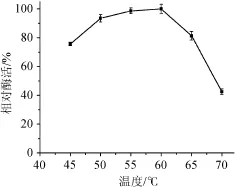
图6 木聚糖酶最适反应温度Fig.6 Optimal reaction temperature of xylanase
2.2.2木聚糖酶的最适pH
在不同pH值下测定木聚糖酶的酶活力,结果见图7。从图7可以看出,随着pH的增加,酶活呈上升趋势,在pH值为8.0时达到最高峰,随后开始下降;在pH值为6.5~8.5可保持85%以上的相对酶活;当pH<6.5或>8.5时相对酶活急剧下降。pH值为10.0时,相对酶活为22.5%。因此,木聚糖酶的最适pH值为8.0。根据孙振涛等[15]的研究,粗酶液的最适pH值在7.0左右,这是由于粗酶液含有多种降解木聚糖的酶,如内切木聚糖酶、木聚糖苷酶等,这些酶影响最适pH的测定。
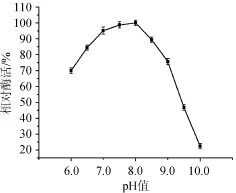
图7 木聚糖酶最适pH值Fig.7 Optimal pH of xylanase
2.2.3金属离子对酶活的影响
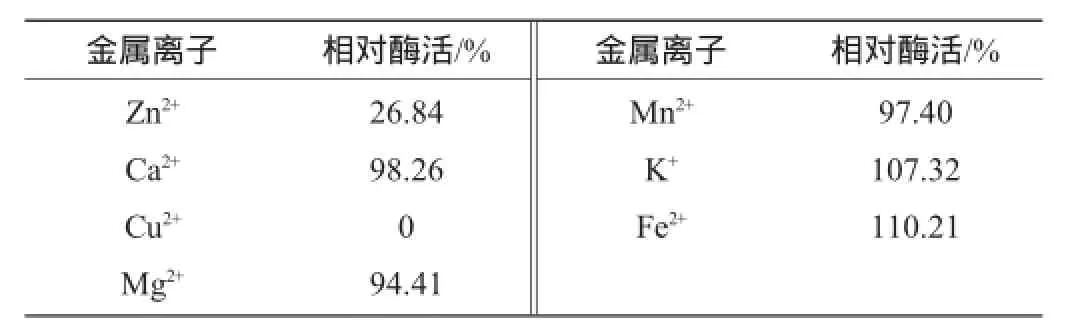
表2 不同金属离子对木聚糖酶活性的影响Table 2 Effects of different metal ions on xylanase activity
由表2可知,K+、Fe2+对木聚糖酶有明显激活作用。Zn2+、Cu2+对木聚糖酶有强烈的抑制作用,Ca2+、Mg2+、Mn2+使木聚糖酶活性有不同程度下降。
2.2.4木聚糖酶的米氏常数Km和最大反应速率Vm
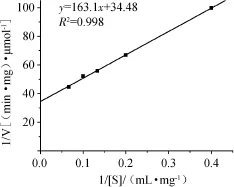
图8 木聚糖酶的米氏常数双倒数曲线Fig.8 Lineweaver-Burk plot of Kmof xylanase
据Lineweaver-Burk双倒数作图法得出1/V(y)与1/[S](x)呈线性关系,结果见图8。直线方程为y=163.1x+34.46(相关系数R2=0.998),从而得出米氏常数Km=4.733 mg/mL,最大酶反应速率Vm=315.85 μmol/(min·mg)。
2.2.5底物专一性
由表3可知,该木聚糖酶对羧甲基纤维素、淀粉、蔗糖均没有酶活力,具有良好的专一性,在生物漂白方面有很大潜力[17]。

表3 木聚糖酶的底物专一性Table 3 Substrate specificity of xylanase
3 结论
本实验采用硫酸铵沉淀法、Sephadex G-50凝胶层析柱过滤、DEAE Sepharose Fast Flow离子交换层析纯化出较高纯度的木聚糖酶,纯化倍数为26.36,酶活回收率为5.13%,分子质量为24.5 ku。酶学性质研究结果表明,该酶的最适反应温度为60℃,最适pH值为8.0。该酶具有很好的耐碱性和耐热性,以及底物专一性。
[1]刘瑞田,曲音波.木聚糖酶生物学特性及其诱导产生的研究进展[J].工业微生物,1998,28(3):38-42.
[2]DA S L,CARMONA E C.Production and characterization of cellulase-free xylanase fromTrichoderma inhamatum[J].Appl Biochem Biotechnol,2008,150(2):117-125.
[3]蔡少丽,杨章萍,黄建忠.里氏木霉制备木聚糖酶的产酶历程[J].食品与发酵工业,2013,39(8):113-118.
[4]冯波,尹翌,易旭东,等.康氏木霉固体发酵木聚糖酶条件的研究[J].中国酿造,2015,34(10):73-77.
[5]徐君飞,张居作.微生物β-l,4-内切木聚糖酶研究进展[J].中国酿造,2014,33(5):15-17.
[6]孙超,陈卫平.微生物木聚糖酶及其应用研究进展[J].中国酿造,2013,32(4):24-29.
[7]李宗任,陈小泉.纸浆生物漂白技术[J].黑龙江造纸,2008,36(3):30-32.
[8]孙雷,朱孝霖,李环,等.木聚糖酶分离纯化技术[J].生物技术通报,2005,14(5):51-54.
[9]MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Anal Chem,1959,31(3):426-428.
[10]TSENG M J,YAP M N,RATANAKHANOKCHAI K,et al.Purification and characterization of two cellulase free xylanases from an alkaliphilicBacillus firmus[J].Enzyme Microb Technol,2002,30(5):590-595.
[11]张蕾,刘昱,蒋达和,等.生物化学实验指导[M].武汉:武汉大学出版社,2011:99-106.
[12]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000:77-100.
[13]付燕秋,王欣宏,管斌,等.利用(NH4)2SO4分步盐析法从麦芽中初步分离极限糊精酶[J].食品与发酵工业,2013,39(1):119-202.
[14]邹永龙,桑月蝉,彭建新,等.β-内切木聚糖酶的分离纯化及其性质[J].植物学报,1999,41(11):1212-1216.
[15]孙振涛,刘建军,赵祥颖,等.一株产木聚糖酶菌株的分离、鉴定及其酶学特性研究[J].生物技术,2007,17(4):74-77.
[16]江正强.微生物木聚糖酶的生产及其在食品工业中应用的研究进展[J].中国食品学报,2005,5(1):1-9.
[17]毛连山,余世袁.木聚糖酶在纸浆漂白中应用的研究现状[J].中国造纸学报,2006,21(3):93-98.
Purification and enzymatic properties of xylanase fromPaenibacillus campinasensis
CHEN Lei1,ZHAO Xiangying2,LIU Jianjun1,2*
(1.College of Bioengineering,Qilu University of Technology,Jinan 250013,China;2.Food&Fermentation Engineering Key Lab of Shandong Province,Jinan 250013,China)
The fermentation liquid ofPaenibacillus campinasensisxy-7 was separated and purified by ammonium sulfate salting-out,Sephadex G-50 gel filtration and DEAE Sepharose Fast Flow ion-exchange column chromatography.The purified xylanase was obtained,the purification multiple was 26.36 and recovery rate of the enzyme was 5.13%.The electrophoresis result of SDS-PAGE was single band and mass of molecule was 24.5 ku.The results of enzymatic property showed that the optimal reaction temperature of xylanase was 60℃and the optimal pH was 8.0.The enzyme could be activated by Fe2+and K+,but inhibited by Zn2+and Cu2+.With beech xylan as substrate,the Kmwas 4.733 mg/ml and the Vmwas 315.85 μmol/(min·mg).
Paenibacillus campinasensis;xylanase;separation and purification;enzymatic properties
Q814.1
0254-5071(2016)07-0064-05
10.11882/j.issn.0254-5071.2016.07.014
2016-02-23
山东省自主创新专项(201422cx02602)
陈磊(1990-),男,硕士研究生,研究方向为生化反应工程。
刘建军(1962-),男,研究员,博士,研究方向为微生物资源开发利用。
