苹果醋优势醋酸菌株的诱变选育
2016-09-18胡生海李明泽张霁红
宋 娟,胡生海,李明泽,张霁红
苹果醋优势醋酸菌株的诱变选育
宋娟,胡生海,李明泽,张霁红
(甘肃省农业科学院 农产品贮藏加工研究所,甘肃 兰州 730070)
以酒精含量为7%vol的苹果酒发酵醪液为驯化介质,对引进的醋酸杆菌20056进行驯化与诱变选育。采用紫外诱变的方法,确定最佳诱变条件为诱变时间40 s、诱变距离40 cm、菌液稀释度10-5,此时细胞致死率为82.15%。15株诱变菌株通过诱变效应、产酸实验、定性实验等验证,结果表明经过初步筛选的UV-3、UV-6、UV-11三株正突变菌株,产酸总量分别和诱变前的原菌株相比分别提高了20.45%、23.73%、24.61%,乙醇脱氢酶活性的峰值分别是原菌株的2.7、3.5、3.7倍。紫外诱变有效的提高了苹果酒发酵醪液中的酒精转化力,为优势醋酸菌的选育提供了简便、有效的育种手段。
苹果醋;醋酸菌;驯化;诱变选育
近年来,随着人们生活水平的提高,果醋及果醋饮料越来越受到消费者的青睐。苹果醋是一种成本较低、营养价值高、风味优良的酸性调味品和饮料保健品[1],特别具有抗真菌特性,改善口腔炎症[2],预防高血脂症[3]、抑制双糖酶活动、延缓胃排空[4]、增加饱腹感[5]、减轻糖尿病、控制体质量[6]等功效。目前果醋主要的生产方法是液态深层发酵法,此法对醋酸菌活力要求较高,目前生产上使用较多的有食醋醋曲、恶臭醋杆菌(Acetobacter rancens)、巴氏醋酸菌(Acetobacter pasteurianus)、巴氏亚种(沪酿1.01)[7]等,但这些菌株普遍存在易退化、活性低、产酸率低及产品风味不佳等问题[8-9]。优良醋酸菌株具有产酸率高、发酵能力强、稳定性好等特点,通过检测乙醇脱氢酶(alcohol dehydrogenase,ADH)活性指标,不但可以感知菌株的发酵能力和产酸速率,而且能够实时监控产品的品质和风味。通常采用传统的驯化、诱变育种、杂交育种和现代的原生质体融合技术,以及基因工程育种等选育手段,而驯化、诱变育种是最普遍、最经济实用的育种手段[10]。虽然人们对利用遗传学方法获得优良菌株有极大的兴趣,但生产中获得的工业菌株并不多。本实验在引进菌株驯化研究基础上进一步开展诱变研究,采用紫外诱变方法从诱变时间、诱变距离、菌液稀释浓度等影响因素的选择到诱变菌株的初筛、复筛及产酸性能、乙醇脱氢酶活性等实验,为优势醋酸菌的选育提供了简便、有效的育种途径。
1 材料与方法
1.1材料与试剂
1.1.1菌株
醋酸菌CICC20056:中国微生物菌种保藏中心。
1.1.2培养基
基础培养基:葡萄糖1%,酵母膏1%,无水乙醇3%,pH 4.5。
分离培养基:基础培养基加入琼脂2%,碳酸钙2%,无水乙醇3%。
斜面保藏培养基:基础培养基加入琼脂2%,碳酸钙1%,无水乙醇3%。
产酸培养基:基础培养基经灭菌冷却后加入7%无水乙醇,装液量50 mL/250 mL。
各培养基121℃高压灭菌30 min,待温度降至60~70℃时加入碳酸钙(便于测量菌落透明圈),备用。
1.1.3试剂
氢氧化钠(分析纯):天津大茂化学试剂厂;葡萄糖:上海广诺化学科技有限公司;酵母膏:北京奥博星生物技术有限责任公司;琼脂:上海致化化学科技有限公司;无水乙醇、碳酸钙、酚酞、磷酸氢二钾、磷酸二氢钾、铁氰化钾、Trition X-100、FeCl3:天津光复精细化工有限公司。
1.2仪器与设备
BSA224S-CW电子天平:赛多利斯科学仪器(北京)有限公司;YXQ-LS立式压力蒸汽灭菌锅:上海博讯实业有限公司;ZHJH-C1112B超净工作台、ZWY-2102恒温培养振荡器:上海智城分析仪器制造有限公司;LRH-250生化培养箱:上海一恒科学仪器有限公司;TGL-16MC冷冻离心机:长沙维尔康湘鹰离心机有限公司;HH-S4电热恒温水浴锅:北京科伟永兴仪器有限公司;KQ-200VDB超声波清洗器:上海昆山超声仪器有限公司;S25-2恒温磁力搅拌器:上海司乐仪器有限公司;UV2400紫外可见分光光度计:上海舜宇恒平科学仪器有限公司。
1.3实验方法
1.3.1菌株诱变和筛选流程
菌源制备→扩大培养→紫外线诱变→产醋酸定性实验→菌株初筛→菌株复筛→产酸测定、乙醇脱氢酶活测定
1.3.2紫外线诱变方法[11]
(1)制备菌悬液:取培养48 h的5支斜面保藏醋酸菌20056,用无菌生理盐水将菌苔冲洗完全,3 000 r/min振荡培养30 min,以便将菌块打碎。菌液离心15 min,制成菌悬液待用(细胞浓度调整为108个/mL)。
(2)紫外线处理
现代育种理论认为,被诱变的微生物致死率在80%左右时,产量性状的正突变率较高[12]。
①不同照射时间紫外线处理:打开紫外线灯开关,预热约20 min,取无菌平皿(直径6 cm)6套,分别加入已制备的菌悬液3mL,并在平皿中放入无菌搅拌棒。设置紫外照射距离为40 cm,分别搅拌照射10 s、20 s、30 s、40 s,50 s、60 s,同时做空白对照(菌悬液3 mL,不需要紫外照射,下同)。
②不同照射距离紫外线处理:操作同上,紫外线照射时间为40s,分别设置照射距离为30cm、35cm、40cm、45cm、50 cm,同时做空白对照。
③不同菌液浓度紫外线处理:操作同上,紫外线照射时间为40 s,距离为40 cm,菌液浓度(108个/mL)分别稀释10-4、10-5、10-6、10-7四个梯度,同时做空白对照。
(3)稀释、涂板、计数:采用10倍稀释法,分别取10-4、10-5、10-6、10-7四个稀释度进行涂平板,每组3个重复。用黑布避光培养,72 h取出平板进行细菌计数,根据对照平板上菌落数,计算出每毫升菌液中的活菌数,计算细胞致死率。

(4)观察诱变效应:分别测量透明圈直径与菌落直径并计算其比值(HC值),并选取HC比值大的菌落进行培养和实验。
1.3.3产酸定性实验
将上述斜面保藏菌种分别接种于体积分数3%乙醇的基础培养基,于30℃条件下培养72 h,取5 mL除去菌体的培养液,以2.5 mol/L的NaOH溶液中和至pH值为7.0,加入5%FeCl3溶液5~6滴,形成红褐色沉淀者为产醋酸细菌。
1.3.4醋酸产量的测定
制备含7%vol乙醇的产酸培养基于装液量50 mL/250 mL的三角瓶中,在温度30℃条件下,110 r/min摇床培养72 h,采用酸碱滴定法测定总酸(以醋酸计)。取2 mL发酵液,加入50 mL蒸馏水,3~5滴0.5%酚酞溶液,用标定的0.1 mol/L NaOH溶液滴定至浅粉色,由消耗的NaOH溶液的体积来计算样品中的醋酸量。产酸量计算公式如下:
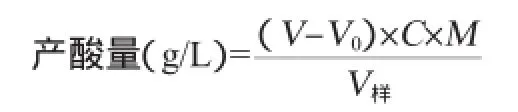
式中:V为发酵液样品滴定耗用的NaOH体积,mL;V0为以空白培养基为对照滴定耗用的NaOH体积,mL;C为NaOH标准溶液浓度,mol/L;M为醋酸的摩尔质量,60 g/mol;V样为样品体积,L。
1.3.5乙醇脱氢酶(ADH)活性测定
(1)酶液制备
取相应时间段的酶液8 mL,4℃、3 000 r/min离心20 min;用50 mmol/L磷酸钾缓冲液(kalium phosphate buffer,KPB)洗涤2~3次,重新悬浮于该溶液中(0.1 g湿菌体/3 mL KPB);悬浮液在冰浴下进行超声破碎,240 W,20 min,即可获得粗酶液。
(2)ADH测定参照WOOD W A的方法[13]
取Mcllvans缓冲液(pH 4.0)0.5 mL,1.0 mol/L乙醇溶液0.1 mL,粗酶液0.1 mL,6%Triton X-100溶液0.1 mL,于10 mL比色管中,25℃保温5 min;加入0.1 mol/L铁氰化钾溶液0.2 mL,25℃保温5 min;再次,加入硫酸铁-Dupanol溶液0.5 mL,25℃放置20 min,终止反应;加入3.5 mL蒸馏水混合后,用722型分光光度计测定波长660 nm处的光密度值。
酶活力单位定义:在上述条件下,每分钟氧化1 μmol乙醇所消耗的酶量为一个活力单位(U/mL)。
2 结果与分析
2.1紫外线诱变结果及致死率测定
2.1.1最适紫外诱变时间的确定
采用18 W紫外灯照射对培养72 h的原始菌株进行诱变,照射距离为40 cm,采用10倍稀释法,统计诱变处理后菌液稀释度为10-5的数据,观察不同紫外线诱变时间对细胞致死率的影响,结果如图1所示。由图1可以看出,随着时间的延长,菌株的细胞致死率逐渐升高,结果表明原始菌株对紫外照射敏感,并且紫外线诱变时间越长对细胞的杀伤力越大,实验确定最佳紫外诱变时间为40 s,细胞致死率为79.72%。

图1 不同紫外诱变时间对致死率的影响Fig.1 Effect of different UV mutation time on lethality
2.1.2最适紫外诱变距离的确定
采用18 W紫外灯对培养72 h的原始菌株进行诱变,照射时间为40 s,采用10倍稀释法,统计诱变处理后菌液稀释度为10-5对细胞致死率的影响,结果如图2所示。从图2可以看出,随着紫外线垂直距离的增加,菌株的细胞致死率逐渐降低,由此说明紫外线诱变距离越小对细胞的杀伤力越大,实验确定最佳紫外诱变距离为40 cm,细胞致死率为81.92%。

图2 不同诱变距离对致死率的影响Fig.2 Effect of different mutation distance on lethality
2.1.3最适菌液稀释度的确定
采用18 W紫外灯进行诱变,照射时间为40 s,照射距离为40 cm,统计紫外线诱变不同菌体浓度对细胞致死率的影响,结果如图3所示。由图3可以看出,随着菌体浓度稀释倍数的增加,细胞致死率逐渐增加,甚至全部杀死,说明紫外线诱变对菌体浓度越小,细胞的杀伤力越大,实验确定最佳紫外诱变的菌体浓度稀释到10-5,细胞致死率为80.00%。

图3 不同菌液稀释度对致死率的影响Fig.3 Effect of different cell concentrations on lethality
2.1.4紫外诱变最佳条件组合确定
采用18 W紫外灯进行诱变,设置照射时间为40 s,照射距离为40 cm,菌液稀释度10-5,三组重复,统计紫外线诱变组合的细胞致死率,基本稳定在82.15%左右,说明此诱变组合条件具有较高的稳定性,可以作为紫外线诱变的最优条件组合。
2.1.5紫外诱变最佳条件组合的诱变效应
采用18 W紫外灯进行诱变,设置照射时间为40 s,照射距离为40 cm,菌浓稀释度10-5,培养后的平板菌落周围会出现透明圈,计算HC比值,挑选HC比值大的15株紫外诱变菌株(如表1所示),将其移接到试管斜面上培养用于复筛。从表1可以看出,和对照相比,UV-3、UV-6、UV-11三种突变菌株的HC比值较大,可初步确定为紫外诱变的较优菌株。

表1 紫外诱变对HC比值的影响Table 1 Effect of UV mutation on HC ratio
2.1.6产酸定性实验
将上述斜面保藏菌种分别进行产酸定性实验,操作步骤见1.3.3。通过实验发现,和对照相比,15株紫外诱变菌株均产生红褐色沉淀。定性实验结果表明,15株紫外诱变菌株均为产醋酸细菌。
综上所述,通过紫外诱变效应和产酸定性实验综合比较,初步挑选UV-3、UV-6、UV-11三种正突变菌株进行醋酸菌的定量实验。
2.2定量检测分析
2.2.1产酸量的测定
配制UV-3、UV-6、UV-11三种紫外诱变正突变菌株生长的产酸培养基,于装液量50 mL/250 mL的三角瓶,30℃条件下、110 r/min,每隔24 h测定醋酸总量,结果如图4所示。由图4可以看出,随着紫外诱变后菌体培养时间的延长,和对照相比,醋酸菌产生的醋酸总量逐渐增加,UV-3、UV-6、UV-11三种诱变菌株的增加幅度有所不同,UV-3、UV-6、UV-11三株正突变菌株的产酸总量和对照相比分别提高了20.45%、23.73%、24.61%。结果表明,紫外诱变可以有效提高醋酸菌的产酸量,对微生物生产有一定的实践意义。

图4 三株正突变菌株产酸量变化Fig.4 Acid production changes of three positive mutant strains
2.2.2乙醇脱氢酶活性测定
ADH是醋酸菌培养过程中的重要代谢酶。配制UV-3、UV-6、UV-11三种诱变菌株生长的扩大培养基,在装液量50 mL/250 mL的三角瓶,30℃、110 r/min条件下,每隔24 h取样,测定乙醇脱氢酶活性,结果如图5所示。

图5 三株正突变菌株ADH酶活变化Fig.5 ADH enzyme activity changes of three positive mutant strains
由图5可知,通过紫外线诱变处理,ADH酶活性随着菌液培养时间的延长均高于对照,且变化相似,均表现为先升高后降低再趋于平稳,当UV-3、UV-6、UV-11三种醋酸菌菌株培养48 h时ADH酶活均达到峰值,分别是原菌株的2.7、3.5、3.7倍,随后酶活性均下降。实验结果表明,紫外线照射处理能有效激活醋酸菌培养48 h前的ADH酶活性。
2.2.3乙醇脱氢酶活性和产酸量之间的关系
配制UV-3、UV-6、UV-11三种诱变菌株生长的扩大培养基,同时检测苹果醋发酵过程中乙醇脱氢酶活力和产酸量的相互关系,结果如图6所示。

图6 三株正突变菌株在醋酸发酵过程中ADH酶活、产酸量变化曲线Fig.6 Variation curve of ADH enzyme activity and acetic acid production during acetic fermentation of three positive mutant strains
由图6可以看出,当菌液培养时间<48 h时,ADH活力和产酸总量均随着培养时间的延长而逐渐上升,表明ADH和产酸总量呈正相关;但是,当菌液培养48 h后,ADH随着培养时间的延长却逐渐下降,而产酸总量随着培养时间的延长而逐渐上升,表明ADH和产酸总量呈负相关。推测可能由于前期发酵过程中乙酸的不断累积,导致ADH酶活受到酶作用产物的明显抑制,而且随着时间的推移,菌体生长也开始进入衰亡期,因此从48 h开始ADH酶活逐渐降低;因为产酸是一个累积的过程,48 h后发酵过程中产酸速率不断增大,醋酸含量也随之逐渐增加,综上表明ADH和产酸总量的变化规律呈负相关。这与陈伟等[14-15]研究的变化趋势基本一致。当然,其两者相互作用的复杂生理生化过程,还有待进一步深入研究。
3 结论
本实验以醋酸菌20056为研究对象,采用紫外线诱变手段,确定最佳诱变条件为紫外诱变时间40 s、诱变距离40 cm、菌液稀释度10-5,此时细胞致死率稳定在82.15%左右。因此,初步筛选获得了UV-3、UV-6、UV-11三种适合苹果汁醋酸发酵的较优菌株,提高了醋酸菌的产酸总量;可用检测菌株ADH酶活和产酸总量变化的方法,作为筛选工业菌株和鉴别菌株性能优劣的重要参考指标,为优势醋酸菌的选育提供了简便、有效的育种途径。
[1]杜双奎,于修烛,李志西,等.表面发酵法酿制苹果醋及其醋酸饮料的研制[J].中国酿造,2003,22(5):17-19.
[2]MOTA A C,DE CASTRO R D,DE ARAUJO O,et al.Antifungal activity of apple cider vinegar on candida species involved in denture stomatitis[J].J Prosthodont,2015,24(4):296-302.
[3]BUDAK N H,KUMBUL D D,SAVAS C M,et al.Effects of apple cider vinegars produced with different techniques on blood lipids in highcholesterol-fed rats[J].J Agric Food Chem,2011,59(12):6638-6644.
[4]HLEBOWICZ J,DARWICHE G,BJÖRGELL O,et al.Effect of apple cider vinegar on delayed gastric emptying in patients with type 1 diabetes mellitus:a pilot study[J].BMC Gastroenterol,2007,20(7):46.
[5]SALBE A D,JOHNSTON C S,BUYUKBESE M A,et al.Vinegar lacks antiglycemic action on enteral carbohydrate absorption in human subjects[J].Nutr Res,2009,29(12):846-849.
[6]GAMBON D L,BRAND H S,VEERMAN E C.Unhealthy weight loss. Erosion by apple cider vinegar[J].Ned Tijdschr Tandheelkd,2012,119(12):589-591.
[7]谭才邓,廖延智,司徒满泉,等.高产醋酸的醋酸菌筛选及菌种鉴定[J].食品科技,2014,39(7):36-40.
[8]魏长庆,王海庆,张凌,等.葡萄果醋发酵用醋酸菌的分离及鉴定[J].中国酿造,2010,29(4):42-45.
[9]陈洋,汪超,高冰,等.高耐受性醋酸菌的筛选及发酵特性研究[J].中国酿造,2015,34(12):34-39.
[10]蒋红军.醋酸高产菌株的选育及代谢控制发酵的研究[J].中国酿造,2005,24(1):25-27.
[11]王芳,徐秉良,曹奎荣.深绿木霉紫外光诱导耐低温突变菌株的研究[J].甘肃农业大学学报,2005,40(1):507-511.
[12]周德庆.微生物学教程[M].北京:高等教育出版社,1993:249.
[13]WOOD W A.Methods in enzymology[M].Amsterdam:Elsevier,1982,89:450-451.
[14]陈伟.优质醋酸菌的选育、苹果醋酸发酵规律及酶活影响的研究[D].泰安:山东农业大学,2001.
[15]周秉辰.食醋生产中醋酸菌乙醇脱氢酶的活性与产酸速率关系的研究[J].中国酿造,2009,28(11):58-59.
Mutation breeding of predominantAcetobacter pasteurianusin apple vinegar production
SONG Juan,HU Shenghai,LI Mingze,ZHANG Jihong
(Agricultural Product Storage and Processing Research Institute,Gansu Academy of Agricultural Sciences,Lanzhou 730070,China)
Using cider wine fermentation mash containing 7%vol alcohol as domestication medium,the introduced strainAcetobacter pasteurianus 20056 was domesticated and the mutant strain was screened.By UV mutagenesis,results showed that the optimal mutagenesis condition was mutation time 40 s,mutation distance 40 cm and cell dulition 10-5.Under the conditions,the cell lethality reached 82.15%.Fifteen mutant strains were preliminarily screened,through UV mutation effect,acid production experiment,and qualitative experiment,three positive mutant strains UV-3,UV-6 and UV-11 were screened.Compared with the original strain,the acid production of the mutant strain improved 20.45%,23.73%,24.61%,respectively.The peak ADH enzyme activity was 2.7,3.5,3.7 times of the original strain.Results showed that UV mutation improved alcohol conversion ability of the cider wine fermentation mash effectively,and it provided a simple and efficient breeding method.
apple vinegar;acetic acid bacteria;domestication;mutation breeding
TS264.2
0254-5071(2016)07-0040-05
10.11882/j.issn.0254-5071.2016.07.009
2016-01-29
国家自然科学基金地区基金项目(31460449);甘肃省农牧厅生物技术专项(GNSW-2013-31)
宋娟(1988-),女,研究实习员,硕士,研究方向为食品发酵。
