酶法制备沙漠果蛋白ACE抑制肽工艺的研究
2016-09-16贾叶叶田洪磊邢慧慧石河子大学食品学院新疆石河子832000
贾叶叶,田洪磊,詹 萍,邢慧慧,陈 蕊(石河子大学食品学院,新疆石河子832000)
酶法制备沙漠果蛋白ACE抑制肽工艺的研究
贾叶叶,田洪磊*,詹 萍,邢慧慧,陈 蕊
(石河子大学食品学院,新疆石河子832000)
在单酶筛选和单因素实验的基础上,采用响应面分析法优化沙漠果蛋白血管紧张素转换酶抑制肽(ACEIP)酶解制备的技术条件,主要研究了酶解时间、酶解温度、初始pH及底物浓度四个因素对酶解工艺条件的影响。以ACE抑制率为响应值,确定碱性蛋白酶的最佳酶解条件为:酶解时间114 min,酶解温度57℃,初始pH10,底物浓度3.24%,酶添加量2000 U/g,此时ACEIP抑制率为69.83%。本研究可为沙漠果蛋白的高效利用奠定基础。
沙漠果蛋白,ACEIP,酶解,响应面分析法
沙漠果又名巴西坚果(Brazil nut),也称鲍鱼果等,主要产于亚马逊盆地,目前在我国主要分布于新疆的沙漠地带。沙漠果果实富含油酸、亚油酸、亚麻酸等多种不饱和脂肪酸[1],脂肪酸高达66.7%以上[2],是健脑、益脑特色功能脂质体,脂质体制备后的仁粕中蛋白含量在13.9%左右[2],为特色蛋白生物活性肽开发提供了优质资源。目前国外相关学者在沙漠果天然产物的生物学功能领域开展了相关工作,如Martins等[3]对沙漠果中硒和黄曲霉毒素毒理与安全性进行了评价;Jenny等[4-5]研究了沙漠果中酚类物质的抗氧化活性等,针对沙漠果蛋白生物活性肽制备等方面的研究鲜见报道。
目前,临床用于治疗高血压的多为合成药物,如依那普利、卡托普利等,虽能有效抑制血管紧张素转换酶抑制肽ACE活性,降低血压,但具明显副作用[6]。天然、无毒副作用的食源蛋白(ACEIP)已成为目前研究开发的热点。如Jang等[7]在酶解牛臀部肌浆蛋白提取物获得ACEIP基础上,确定Val-Leu-Ala-Gln-Tyr-Lys可作为牛肉ACEIP肽段主要活性序列;Byun等[8-10]从阿拉斯加鳕鱼皮肤中分离得到Gly-Pro-Leu和Gly-Pro-Met两个ACEIP序列,并测得IC50值(IC50,即ACE抑制肽抑制活性达到50%时肽的浓度)分别为2.6 μmol/L和17.13 μmol/L。植源蛋白来源广泛,成本较低廉,成为制备ACEIP的较好选择,具有广阔应用前景[11]。作为新疆特色林果资源的沙漠果不但是营养油脂资源,而且是优质的蛋白副产物。本实验采用单因素及响应面分析法对酶法制备沙漠果蛋白ACEIP工艺条件进行了优化,为产品开发及生物活性机理的揭示奠定前期研究基础,提高以沙漠果为主的新疆特色坚果资源的精深加工利用程度。
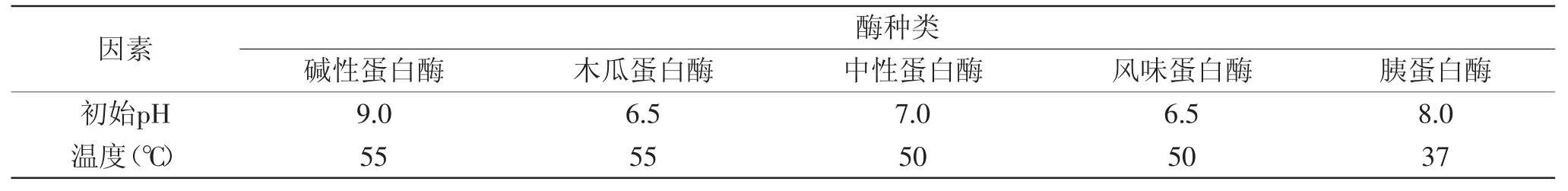
表1 不同蛋白酶最适酶解条件Table1 The optimal conditions on enzymatic hydrolysis of different proteases
1 材料与方法
1.1 材料与仪器
沙漠果 购买于石河子农贸市场,于4℃冰箱保存;碱性蛋白酶(200000 U/g)、木瓜蛋白酶(110000 U/g)、中性蛋白酶(60000 U/g)、风味蛋白酶(12000 U/g)、胰蛋白酶(106000 U/g) 诺维信(中国)生物技术有限公司;血管紧张素转化酶(ACE)、N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(FAPGG)美国Sigma公司;HEPES 上海源叶生物科技有限公司;石油醚(沸程30~60℃)、中性甲醛溶液(37%~40%)、氯化钠、氢氧化钠、磷酸氢二钠、磷酸二氢钠钠等 均为国产分析纯。
粉碎机 温岭市林大机械有限公司;DK-8D数显恒温水浴锅 金坛市医疗仪器厂;Neofuge 15R台式高速冷冻离心机 力康发展有限公司;PHS-25CW雷磁pH计 上海精科公司;85-2数显恒温磁力搅拌器 上海梅香仪器有限公司;ENK-PRO型酶标仪 美国Bioteck公司。
1.2 实验方法
1.2.1 沙漠果蛋白粉制备 在室温条件下,将沙漠果去壳、粉碎,以料液比1∶3(g/mL),用石油醚浸泡1 h(期间不时搅动)后,待其沉淀,弃上清液。反复脱脂2~3次,尽可能脱脂彻底,使得上层液澄清,收集滤渣,于通风处挥发溶剂后,置于恒温干燥箱烘干,收集沙漠果蛋白粉,4℃保存备用。
1.2.2 沙漠果蛋白酶解液制备 称取3 g沙漠果蛋白粉(蛋白含量为41.37%),加入100 mL蒸馏水,混匀,90℃加热10 min后,冷却至室温,再用NaOH调节蛋白液pH至蛋白酶最适pH范围,将溶液置于水浴锅中,预热5 min,加入蛋白酶(酶底比为2000 U/g)酶解240 min。取出酶解液,置于沸水中灭酶10 min,待冷却至室温,8000 r/min离心10 min,收集上清液。
1.2.3 蛋白酶的筛选 分别用碱性蛋白酶、木瓜蛋白酶、中性蛋白酶、风味蛋白酶、胰蛋白酶,于各自适宜条件下以酶底比2000 U/g对沙漠果蛋白进行酶解,酶解条件见表1。
1.2.4 单因素实验
1.2.4.1 底物浓度的影响 设置蛋白酶解体系的酶解温度为55℃,加酶量为2000 U/g,初始pH为9.0,分别在底物浓度为2%、3%、4%、5%、6%、7%的条件下,对沙漠果蛋白酶解240 min,研究底物浓度对ACE抑制率和水解度的影响。
1.2.4.2 酶解时间的影响 设置蛋白酶解体系的底物浓度为3%,酶解温度为55℃,加酶量为2000 U/g,初始pH为9.0,分别在酶解时间为30、90、150、210、270、330 min条件下,对沙漠果蛋白进行酶解,研究酶解时间对ACE抑制率和水解度的影响。
1.2.4.3 酶解初始pH的影响 设置蛋白酶解体系的底物浓度为3%,酶解温度为55℃,加酶量为2000 U/g,分别在初始pH为8.0、8.5、9.0、9.5、10.0、10.5条件下,对沙漠果蛋白酶解240 min,研究初始pH对ACE抑制率和水解度的影响。
1.2.4.4 酶解温度的影响 设置蛋白酶解体系的底物浓度为3%,加酶量为2000 U/g,初始pH为9.0,分别在酶解温度为40、45、50、55、60、65℃条件下,对沙漠果蛋白酶解240 min,研究酶解温度对ACE抑制率和水解度的影响。
1.2.4.5 酶添加量的影响 设置蛋白酶解体系的底物浓度为3%,酶解温度为55℃,初始pH为9.0,分别在酶添加量为500、1000、1500、2000、2500 U/g,对沙漠果蛋白酶解240 min,研究酶添加量对ACE抑制率和水解度的影响。
1.2.5 响应面实验 根据单因素实验结果,选取对ACE抑制率影响较大的四个因素:酶解时间、酶解温度、底物浓度、初始pH,以ACE抑制率为响应值,运用Box-Benhnken的中心组合实验设计原理,设计四因素三水平的酶解工艺优化实验,因素水平设计见表2。
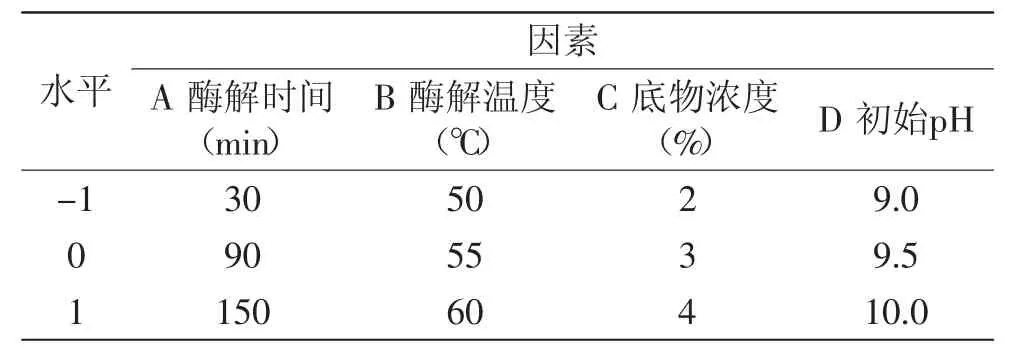
表2 响应面因素水平设计Table2 Factors and levels design of response surface
1.2.6 测定指标及检测方法
1.2.6.1 ACEIP活性的测定[12]以FAPGG作为ACE的底物,测定样品的ACEIP活性,在酶标定量仪中进行测定。按照表3添加反应物,在可见光340 nm处测定吸光值,设空白为a1,样品为b1,于37℃下,反应30 min,再次测定OD340 nm,反应后空白组、样品组吸光值分别记为a2、b2,每组实验均进行平行实验。ACEIP抑制率计算式如下:A=a1-a2,B=b1-b2,抑制率(%)= (A-B)/A×100。
1.2.6.2 蛋白水解度(DH)测定 采用甲醛滴定法[13-15]对沙漠果蛋白各酶解体系中蛋白水解度进行测定。
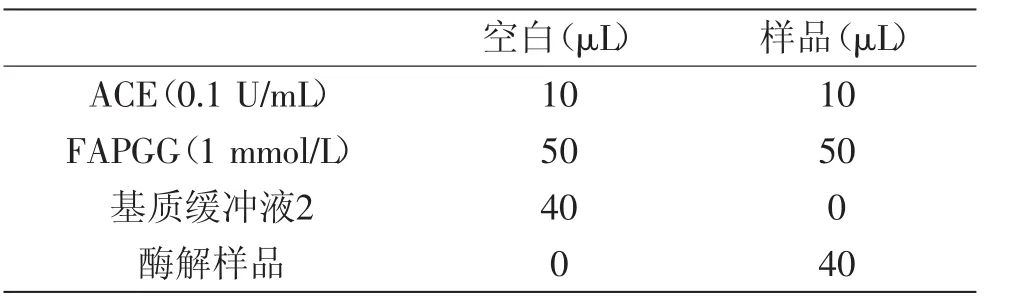
表3 ACE抑制活性的测定Table3 The determination of ACE inhibitory activity
游离氨基态氮的测定:将100 mL酶解液4℃、10000 r/min离心10 min,取上清液60 mL,定容至100 mL。吸取20 mL稀释后的酶解液于250 mL锥形瓶中,加水60 mL,用0.05 mol/L的NaOH滴定至pH8.2。加入10 mL 20%中性甲醛溶液,混匀1 min。再用0.05 mol/L的NaOH滴定至pH9.2(记录加入甲醛溶液后消耗的NaOH体积为V1)。空白组:取80 mL蒸馏水于250 mL锥形瓶中,按照上述方法同样进行滴定,并记录消耗的NaOH体积为V2。
游离氨基态氮(%)=[(V1-V2)×c×0.014]/(m×20/ 100)×100
DH(%)=水解液中游离氨基态氮/样品中总氮×100。
式中:V1—样品稀释液在加入甲醛溶液后滴定至pH9.2,所消耗NaOH体积,mL;V2—蒸馏水(空白)在加入甲醛溶液后滴定至pH9.2,所消耗NaOH体积,mL;c—NaOH标准溶液的浓度,mol/L;m—测定用的样品溶液,相当于样品质量,g或mL;0.014—氮的毫摩尔质量,mg/mol。
1.3 数据统计
实验数据为三个实验样本的平均值,实验数据采用Design Expert 8.0.6.1、Origin 8.5和DPS 7.55数据处理软件进行分析。
2 结果与分析
2.1 蛋白酶筛选
为了探究不同蛋白酶对酶解获得沙漠果蛋白酶ACEIP的影响,本实验采用了五种蛋白酶:碱性蛋白酶、木瓜蛋白酶、中性蛋白酶、风味蛋白酶酶、胰蛋白酶对沙漠果蛋白进行酶解,并以酶解液ACE抑制率和水解度为指标进行测定,每组实验均进行平行实验,结果见图1。
由图1可见,不同蛋白酶酶解液的ACE抑制率存在差异(p<0.05),酶解液的水解度存在差异(p<0.05),造成的原因可能是由于不同蛋白酶的作用位点不同,因此水解得到的肽段结构、数量及大小,均存在差异。风味蛋白酶水解度最大为4.11%,胰蛋白酶、碱性蛋白酶、中性蛋白酶和木瓜蛋白酶次之,分别为3.67%、3.27%、3%、1.83%。碱性蛋白酶的抑制率最高为52.53%,风味蛋白酶酶、中性蛋白酶和木瓜蛋白酶次之,分别为43.41%、42.21%、39.76%,胰蛋白酶最小为32.43%。本实验综合考虑ACE抑制率和水解度两个指标,确定碱性蛋白酶为水解沙漠果蛋白最佳用酶。
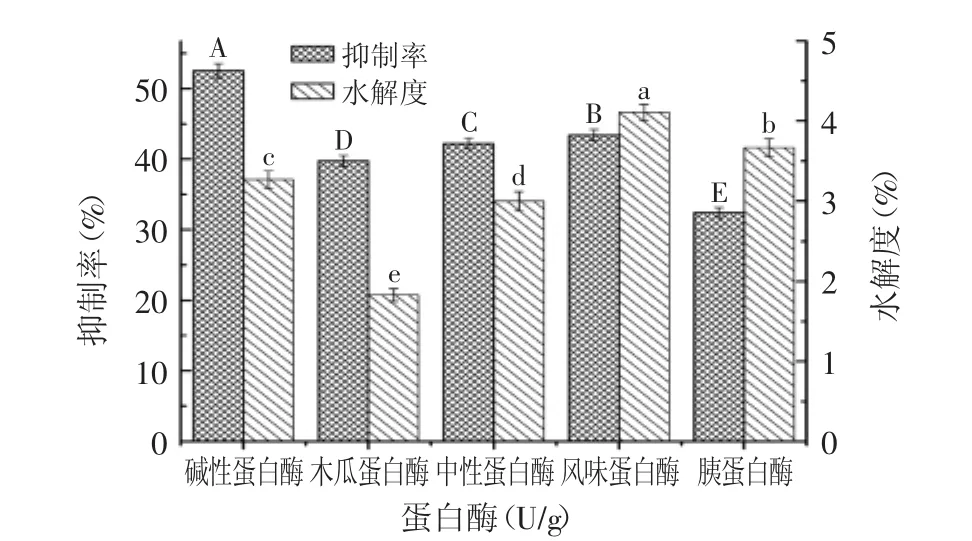
图1 不同蛋白酶对ACE抑制率和水解度的影响Fig.1 Effect of different proteases on ACE inhibition rate and the degree of hydrolysis
2.2 单因素实验
2.2.1 底物浓度对ACE抑制率和水解度的影响 底物浓度对ACE抑制率和水解度的影响,结果见图2。底物浓度是影响酶促反应的主要因素之一,随底物浓度的增加,水解度逐渐降低,可能是因为当底物浓度逐渐增大时,温度升高,溶液粘度增大,有效水分活度降低,酶分子与蛋白分子间的有效碰撞减少造成。而抑制率呈先上升后下降趋势,于底物浓度3%时,抑制率最大达58.29%。造成该趋势可能是因为底物浓度低时,酶解液中的ACEIP较少,因而抑制率较低,此时增加底物浓度,有利于得到更多的ACEIP,抑制率随之增大;但底物浓度增大到一定水平时,酶解液中ACEIP含量较高,造成溶液浓度过高,不利于与底物的结合,抑制率随之降低。底物浓度为6%和7%时,ACE抑制率差异显著(p<0.05)。在此底物浓度下,抑制率上升,可能是因为底物浓度较高,反应正向递进,导致溶液中ACEIP积累量升高,因而抑制率增大[16]。但考虑到成本问题,本实验选取底物浓度为3%。
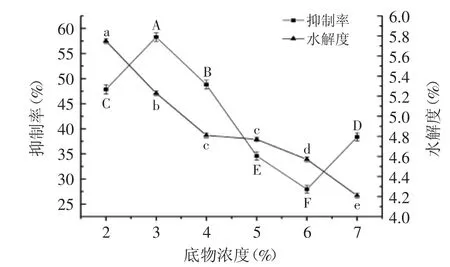
图2 底物浓度对ACE抑制率和水解度的影响Fig.2 Effect of substrate concentration on ACE inhibition rate and the degree of hydrolysis
2.2.2 酶解时间对ACE抑制率和水解度的影响 由图3可知,随时间增加水解度先上升后趋于稳定,变化不大,可能是因为,时间较短时,酶解反应不完全,蛋白未能充分酶解为肽段,因而此时增加酶解时间,将有利于酶解的进行,增大水解度;当时间增至270 min时,即使增加酶解时间,水解度变化不明显(图3),可能是由于蛋白已充分水解所致。
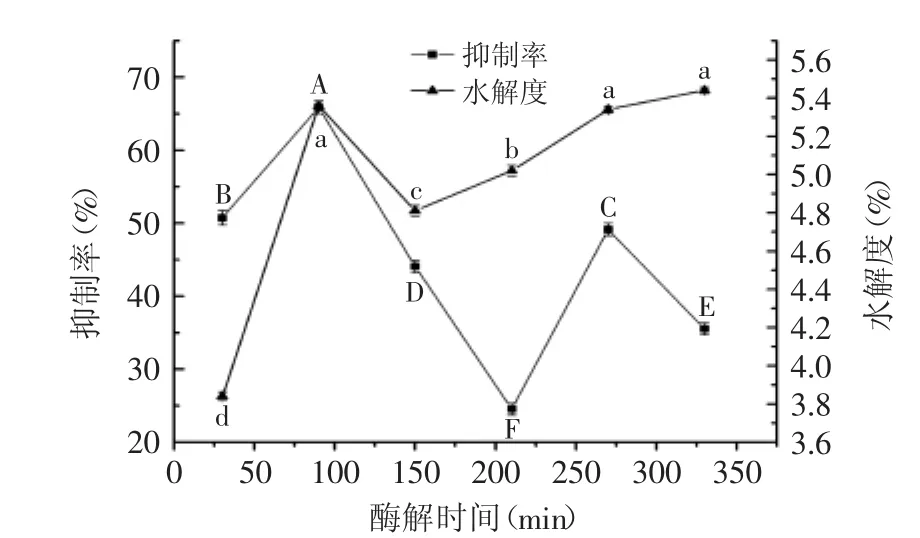
图3 酶解时间对ACE抑制率和水解度的影响Fig.3 Effect of time on ACE inhibition rate and the degree of hydrolysis
抑制率则呈先上升后下降趋势,于90 min时,抑制率和水解度均达最大值,分别为65.88%和5.36%,可能是因为酶解初期,随酶解时间的增加,具有ACE抑制活性的肽段逐渐增加,抑制率增大;但随时间增大到一定程度时,肽类物质过度水解,具有ACE抑制活性的肽段的某些活性基团遭到破坏[17-18],抑制率降低。因此,本实验选取酶解时间为90 min。
2.2.3 初始pH对ACE抑制率和水解度的影响 利用Tukey法多重比较不同初始pH条件下ACE抑制率和水解度,结果见图4。pH是影响酶促反应的重要因素,只有在最适pH范围内,酶的活力较高;偏离最适pH范围时,酶分子活性部位的解离状态可能发生变化[19],酶活降低;甚至过酸或过碱时,可能造成酶分子空间结构不可逆性改变,酶变性失活。由图4可见,当初始pH为9.5时,抑制率最大达64.93%,水解度为4.98%;当pH为10.0时,抑制率为50.71%,水解度为5.26%。综合考虑,选取最佳pH为9.5。
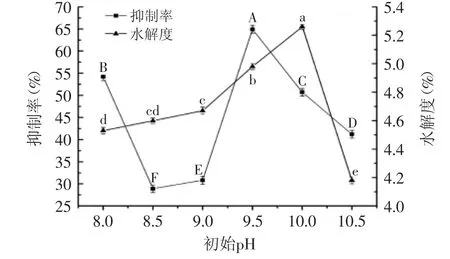
图4 初始pH对ACE抑制率和水解度的影响Fig.4 Effect of initial pH on ACE inhibition rate and the degree of hydrolysis
2.2.4 酶解温度对ACE抑制率和水解度的影响 酶解温度对ACE抑制率和水解度的影响差异显著,结果见图5。由图5可知,随温度的增高,抑制率和水解度均呈现先上升后下降的趋势。酶解温度小于最适温度时,随温度升高,酶分子与底物分子内量增加,单位时间内两者碰撞次数增多,酶促反应速率增大;酶解温度大于最适温度时,随温度升高,酶分子空间结构遭到破坏,导致变性,酶活性降低,甚至失活。由图可知,当温度达到55℃时,抑制率达最大值76.3%,水解度为4.6%;温度达到60℃时,水解度最大,达4.72%,抑制率为66.82%。综合考虑,选取酶解温度为55℃。
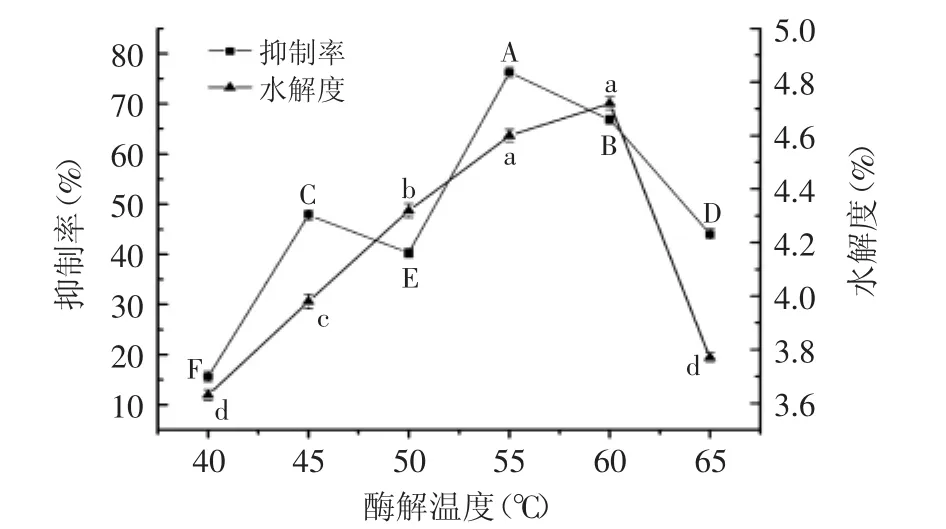
图5 酶解温度对ACE抑制率和水解度的影响Fig.5 Effect of temperature on ACE inhibition rate and the degree of hydrolysis
2.2.5 酶添加量对ACE抑制率和水解度的影响 利用Tukey法多重比较不同加酶量时ACE抑制率和水解度的影响,结果见图6。酶添加量也是影响酶促反应的重要因素之一。由图6可见,随酶添加量的增大,抑制率和水解度均呈先上升后逐渐趋于平缓趋势,当加酶量增加到2000 U/g时,抑制率达到37.55%,水解度达到4.65%。加酶量为2000 U/g和2500 U/g时,水解液的水解度差异不显著(p>0.05),说明底物浓度达2000 U/g后,再增大加酶量,酶解液水解度数值变化不大。随酶添加量逐渐增大,酶与底物结合增多,水解度和抑制率增大;但当酶添加量增大至一定程度时,酶与底物比例失调,底物已充分结合,因而酶解效果变化不大。综合考虑,本实验选取最适酶添加量为2000 U/g。
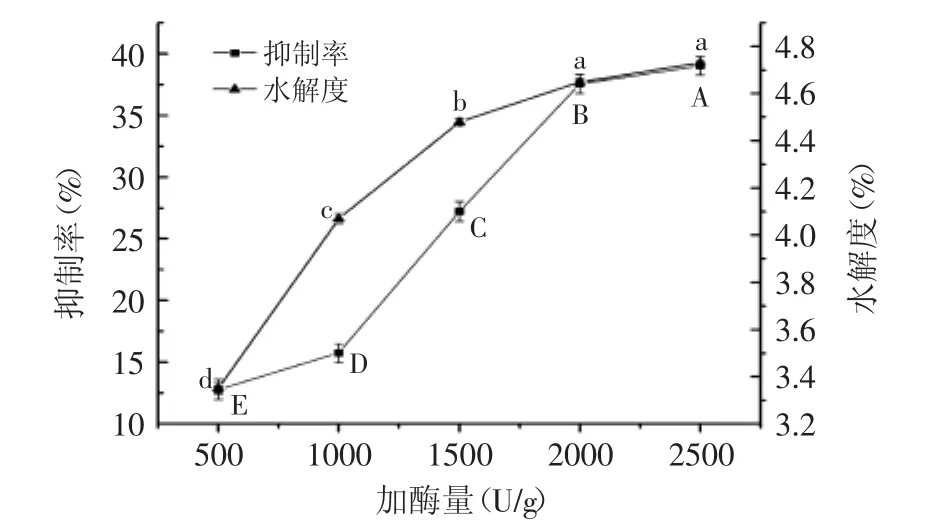
图6 加酶量对ACE抑制率和水解度的影响Fig.6 Effect of dosage of enzyme on ACE inhibition rate and the degree of hydrolysis
2.3 响应面实验
2.3.1 回归方程的建立与方差分析 在单因素实验基础上,运用Design Expert 8.0.5软件中的Box-Behnken模型设计四因素三水平共29组实验,实验设计及结果见表4。
该模型p<0.0001,模型极显著;失拟项p=0.1725>0.05,说明未知因素对实验结果影响不显著;回归决定系数R2=0.9732,说明97.32%的响应值变化来源于所选因素;修正回归决定系数R2Adj=0.9465,说明该模型能解释94.65%的响应值的变化,预测值与实验值具高度相关性,该回归方程对实验拟合度较好。因此,可以用回归模型对实验结果进行分析和预测。
对回归模型进行方差分析,结果见表5。经方差分析可知,一次项中,B、C、D对ACE抑制率有极显著影响,A对ACE抑制率有显著影响;交互项中,AB、BD、CD对ACE抑制率有极显著影响,AD、BC对ACE抑制率有显著影响,而AC对ACE抑制率影响不显著;二次项中,B2、C2、D2对ACE抑制率有极显著影响,而A2对ACE抑制率有显著影响。剔除不显著项,得到优化后的碱性蛋白酶水解沙漠果蛋白多元二次回归方程:Y=-981.02854+88.49900A-0.73031B+26.09327C-53.31767D+0.079333AB+4.11000AD+5.63333E-003BC+0.045083BD+0.64050AD-6.40100A2-2.30597E-003B2-0.27976C2-4.47025D2。
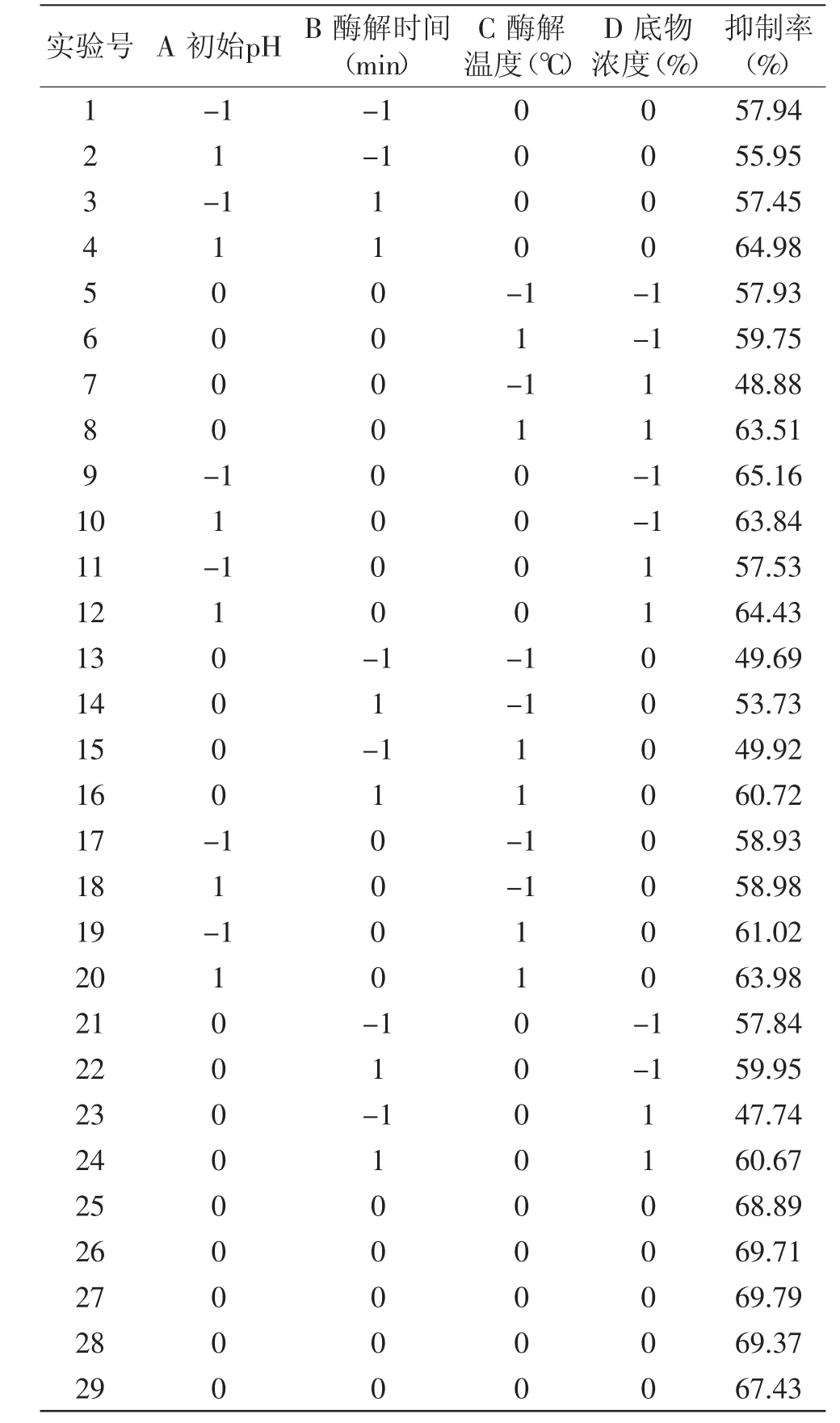
表4 响应面实验设计与结果Table4 The design and results of response surface experiment
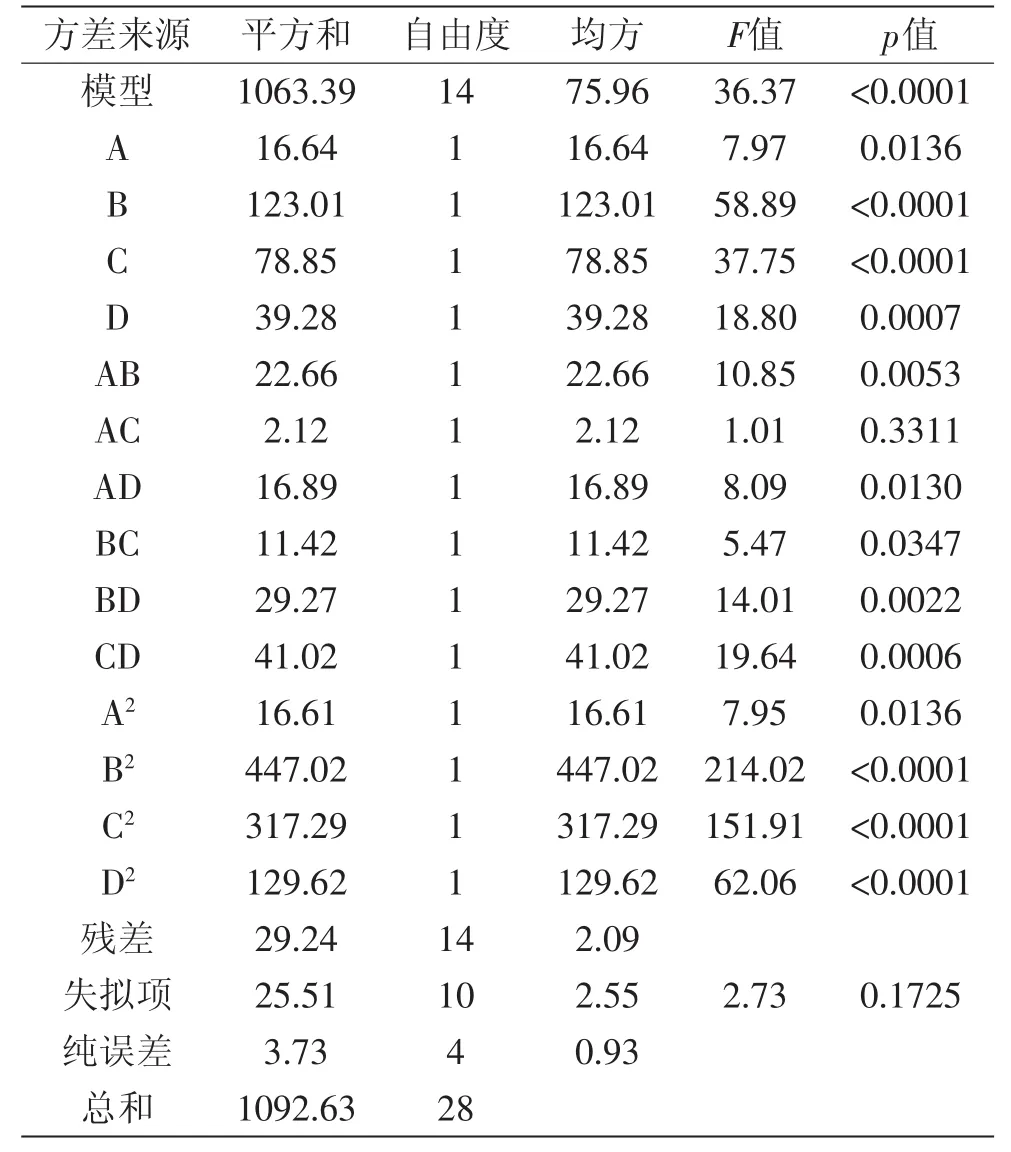
表5 回归模型的建立及方差分析Table5 The establishment of regression model and analysis of variance
2.3.2 响应面分析 对回归模型进行响应面分析,得到6个交互图,其中交互显著项AB、AD、BC、BD、CD的响应面三维立体图,见图7(a~e)。
等高线的形状可以反映因素间交互作用的强弱,呈椭圆形,则表示交互作用明显;等高线越趋向圆形,则表示交互作用越不明显。由图7可看出,CD、BD、AB的交互最为显著;AD、BC次之。
2.3.3 最佳酶解条件的确定和验证实验 通过所得回归模型对实验结果进行分析和预测,确定碱性蛋白酶水解沙漠果蛋白的最佳条件:初始pH9.94,酶解时间113.60 min,酶解温度56.66℃,底物浓度3.24%,酶添加量为2000 U/g,于最佳酶解条件下ACE抑制率的理论值为70.40%。考虑到实际操作的简便性,对酶解条件进行适当调整:初始pH10.0,酶解时间114 min,酶解温度57℃,底物浓度3.24%,酶添加量为2000 U/g。采用优化后的酶解条件,进行验证实验,此条件下ACE抑制率为69.83%,与理论值间误差较小,说明利用响应面优化得到的酶解条件具可行性,该模型成立。
3 结论
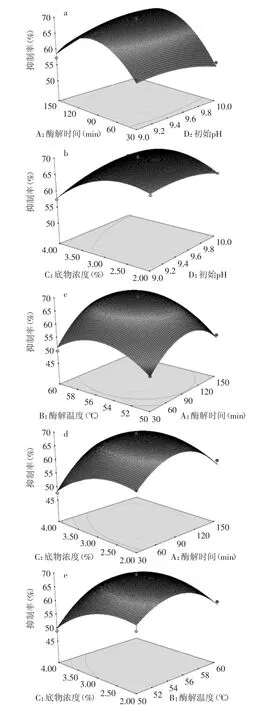
图7 抑制率的响应曲面图Fig.7 The inhibition rate of response surface methodology
采用响应面分析法对酶解制备沙漠果蛋白ACE抑制肽条件进行优化,以ACE抑制率和水解度为指标,从碱性蛋白酶、木瓜蛋白酶、中性蛋白酶、风味蛋白酶、胰蛋白酶中,筛选出碱性蛋白酶为制备沙漠果蛋白ACE抑制肽的最佳用酶。在单因素实验基础上,采用响应面分析法确定了最佳酶解条件,考虑到实际生产中各参数调节的可行性及适宜性,对参数进行调整:初始pH10.0,酶解时间114 min,酶解温度57℃,底物浓度3.24%,酶添加量为2000 U/g。在此条件下,制备的ACE抑制肽抑制率达69.83%,与理论值70.40%相差较小,实际验证值与理论预测值拟合度良好,该工艺条件合理。
[1]Santos O V,Correa N C F,Soares F,et al.Chemical evaluation and thermal behavior of Brazil nut oil obtained by different extraction processes[J].Food Research International,2012,47 (2):253-258.
[2]Sharma G M,Mundoma C,Seavy M,et al.Purification and biochemical characterization of Brazil nut(Bertholletia excelsa L.)seed storage proteins[J].JournalofAgriculturaland Food Chemistry,2010,58(9):5714-5723.
[3]Martins M,Pacheco A M,Lucas A C S,et al.Brazil nuts:determination of natural elements and aflatoxin[J].Acta Amazonica,2012,42(1):157-164.
[4]John J A,Shahidi F.Phenolic compounds and antioxidant activity ofBrazilnut(Bertholletia excelsa)[J].Journalof Functional Foods,2010,2(3):196-209.
[5]Chunhieng T,Hafidi A,Pioch D,et al.Detailed study of Brazil nut(Bertholletia excelsa)oil micro-compounds:phospholipids,tocopherols and sterols[J].Journal of the Brazilian Chemical Society,2008,19(7):1374-1380.
[6]Segura-Campos M R,Chel-Guerrero L A,Betancur-Ancona D A.Purification of angiotensin I-converting enzyme inhibitory peptides from a cowpea(Vigna unguiculata)enzymatic hydrolysate [J].Process Biochemistry,2011,46(4):864-872.
[7]Jang A,Lee M.Purification and identification of angiotensin converting enzyme inhibitory peptides from beef hydrolysates[J].Meat Science,2005,69(4):653-661.
[8]Byun H G,Kim S K.Purification and characterization of angiotensin I converting enzyme(ACE)inhibitory peptides from Alaska pollack(Theragra chalcogramma) skin[J].Process Biochemistry,2001,36(12):1155-1162.
[9]Nakamura Y,Yamamoto N,Sakai K,et al.Purification and characterization of angiotensin I-converting enzyme inhibitors from sour milk[J].Journal of Dairy Science,1995,78(4):777-783.
[10]Wu J,Ding X.Hypotensive and physiological effect of angiotensin converting enzyme inhibitory peptides derived from soy protein on spontaneously hypertensive rats[J].Journal of Agricultural and Food Chemistry,2001,49(1):501-506.
[11]顾欣,李迪,侯雅坤,等.核桃蛋白源血管紧张素转化酶抑制剂的分离纯化[J].食品科学,2013,34(9):52-55.
[12]Holmquist B,Bunning P,Riordan J F.A continuous spectrophotometric assay for angiotensin converting enzyme[J].Analytical Biochemistry,1979,95(2):540-548.
[13]Eremeev N L,Nikolaev I V,Keruchen'ko I D,et al.Enzymatic hydrolysis of keratin-containing stock for obtaining proteinhydrolysates[J].Applied Biochemistry and Microbiology,2009,45 (6):648-655.
[14]赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994(11):65-67.
[15]徐英操,刘春红.蛋白质水解度测定方法综述[J].食品研究与开发,2007,28(7):173-176.
[16]王镜岩主编.生物化学(第三版)[M].北京:高等教育出版社,2002:355-356.
[17]Mullally M M,Meisel H,Fitzgerald R J.Angiotensin-I-converting enzyme inhibitory activities of gastric andpancreatic proteinase digests of whey proteins[J].International Dairy Journal,1997,7(2):299-303.
[18]Liu J Z,Weng L P,Zhang Q L.Optimization of glucoseoxidase Production by Aspergi llusniger in a benchtopbioreactor using response surface methodology[J].Mierobiol Bioteehnol,2003,19 (3):317-323.
[19]王慧溪.从米澄蛋白中制备血管紧张素转换酶抑制肽的研究[D].武汉:武汉工业学院,2009:13-14.
Preparation of ACE inhibitory peptides from Brazil nut protein by enzymatic hydrolysis
JIA Ye-ye,TIAN Hong-lei*,ZHAN Ping,XING Hui-hui,CHEN Rui
(Food College,Shihezi University,Shihezi 832000,China)
Based on single-enzyme screening and single-factor tests analysis,the preparation conditions of ACE inhibitory peptides from Brazil nut protein were studied with response surface analysis methodology.The effects of four factors,including the time of enzymatic hydrolysis,the temperature,initial pH and substrate concentration,were mainly discussed on the enzymatic hydrolysis.Using the ACE inhibitory rate as responses,the optimum conditions of alcalase enzymatic hydrolysis were determined as enzymatic hydrolysis time 114 min,enzymatic hydrolysis temperature 57℃,initial pH10,3.24%concentration of the substrate,dosage of enzyme 2000 U/g,and then the inhibition ratio of ACEIP was 69.83%.The results of the research were the basis for the efficient utilization of the Brazil nut protein.
Brazil nut protein;ACEIP(angiotensin converting enzyme inhibitory peptide);enzymatic hydrolysis;response surface analysis methodology
TS255.6
B
1002-0306(2016)06-0264-07
10.13386/j.issn1002-0306.2016.06.046
2015-07-21
贾叶叶(1992-),女,硕士研究生,研究方向:食品营养学,E-mail:1471282989@qq.com。
田洪磊(1979-),男,博士,副教授,研究方向:食品营养与风味化学,E-mail:272416560@qq.com。
国家自然基金(31260374)。
