接枝4,4'-二羟基查耳酮壳聚糖/硅胶吸附款冬花黄酮类化合物
2016-09-16韩聪聪张晓凤重庆大学化学化工学院重庆400044重庆理工大学化工学院重庆400054
韩聪聪,徐 溢,*,张晓凤,2,曹 坤,张 庆,邹 胜(.重庆大学化学化工学院,重庆400044;2.重庆理工大学化工学院,重庆400054)
接枝4,4'-二羟基查耳酮壳聚糖/硅胶吸附款冬花黄酮类化合物
韩聪聪1,徐 溢1,*,张晓凤1,2,曹 坤1,张 庆1,邹 胜1
(1.重庆大学化学化工学院,重庆400044;2.重庆理工大学化工学院,重庆400054)
本研究制备了一种以硅胶为基材,表面接枝4,4'-二羟基查耳酮的新型交联壳聚糖材料(D-Chitosan@Si),用于选择性分离和富集天然植物中黄酮类化合物,并以槲皮素为吸附对象,考察了影响D-Chitosan@Si吸附性能的因素,分析其吸附机制。研究显示,D-Chitosan@Si对槲皮素的吸附为吸热过程,符合Langmuir吸附模型;槲皮素在DChitosan@Si上的吸附可能受多个步骤共同控制,并且准二级吸附动力学方程能更好地描述槲皮素在D-Chitosan@Si上的吸附行为。进一步将D-Chitsoan@Si用于传统中药款冬花中黄酮类化合物的分离纯化,总黄酮的吸附量可达52.31 mg/g,处理后的款冬花总黄酮的纯度由18.9%提高到85.6%,D-Chitosan@Si表现出较好的选择性吸附效果。
壳聚糖改性,4,4'-二羟基查耳酮,吸附分离,槲皮素,款冬花黄酮类化合物
天然产物分离纯化中,吸附分离技术被最广泛地使用,分离介质以硅胶和大孔树脂为主,但相关新型吸附介质的拓展开发是人们近来的研究热点。壳聚糖作为天然高分子吸附剂,具有原料丰富、低廉,生物相容性好,环境友好,易被修饰改性等优点[1-2],将壳聚糖与其他材料如硅胶复合包裹改性,用于蛋白选择性吸附和特定金属离子处理已有大量报道[3-4],而基于壳聚糖的改性介质应用于天然产物方面的研究和应用却少有报道。
壳聚糖表面含有氨基和羟基,能够与吸附分离组分形成氢键作用。在天然产物吸附分离中,仅依靠氢键作用进行吸附分离,通常选择性较低[5-6]。而引入具有疏水作用的基团可以提高吸附材料的吸附选择性[7],如在丙烯酸大孔树脂表面接枝n-乙烯基吡咯烷酮可选择地吸附茶多酚[8],在二乙烯基苯引入氨基制备所得大孔树脂可高选择性地制备银杏黄酮醇[9]。根据目标组分结构特点,选取相似结构的基团进行功能化接枝,可形成疏水作用[10-11],与氢键作用协同实现选择性吸附分离。
本文选取具有清除活性氧自由基、抗HIV、抗肿瘤等生物活性的款冬花中黄酮类化合物[12-13]为分离纯化目标物,利用戊二醛将壳聚糖包裹在硅胶上(Chitosan@Si),并在壳聚糖表面接枝4,4'-二羟基查耳酮,制得新型吸附材料4,4'-二羟基查耳酮接枝壳聚糖/硅胶(D-Chitosan@Si)。以款冬花植物中的黄酮类代表组分槲皮素为吸附样本,对该材料的吸附性能进行研究,并应用于款冬花黄酮类化合物的选择性吸附分离。
1 材料与方法
1.1 材料与仪器
壳聚糖(DD%=90%) 购自浙江金壳生物化学有限公司;硅胶(150~200目) 试剂级;醋酸、戊二醛、环氧氯丙烷、4,4'-二羟基查耳酮、二甲亚砜、丙三醇、氢氧化钠、甲醇、乙醇 均为分析纯;槲皮素、芦丁(HPLC>98%) 中国食品药品检定研究院;款冬花 购自重庆同仁堂中药房。
76-1型恒温水浴搅拌锅 常州国华电器有限公司;UV-2450型紫外分光光度仪 日本岛津公司;HY-5型回旋式振荡器 江苏金坛市晋城实验仪器厂;RE-2000A型旋转蒸发仪 上海嘉鹏科技有限公司;PB-10酸度计 北京赛多利斯仪器系统有限公司;DZF-6020A型真空干燥箱 北京中兴伟业仪器有限公司;ASAP 2020比表面积测定仪 美国麦克仪器公司。
1.2 实验方法
1.2.1 款冬花黄酮水溶液的制备 将款冬花粉碎,过40目筛,1∶20料液比、95%乙醇回流提取3次(3 h/次),石油醚萃取至无色,旋干,即得款冬花黄酮粗提物;去离子水配制成5 mg/mL款冬花黄酮水溶液,备用。采用紫外-Al3+显色法[14]测得其总黄酮含量达18.9%。
1.2.2 D-Chitosan@Si的制备及表征 实验首先利用戊二醛交联制备Chitosan@Si[15]。然后取1 g 4,4'-二羟基查耳酮于10 mL二甲亚砜和10 mL丙三醇中溶解,加入0.50 mL环氧氯丙烷和100 mL 0.2 mol/L NaOH,搅拌反应4 h;加入5 g Chitosan@Si 40℃下继续反应5 h,过滤、洗涤干净,60℃下干燥6 h,得到D-Chitosan@Si。并测定材料的比表面积、孔径和孔容[16]。
1.2.3 静态吸附实验 取0.2 g D-Chitosan@Si置于50 mL锥形瓶中,加入20 mL槲皮素乙醇标准溶液,0.01 mol/L HCl和NaOH调节溶液pH,恒温振荡吸附一定时间,紫外-可见分光光度法测定剩余槲皮素浓度,按式(1)计算D-Chitosan@Si对槲皮素的吸附量。

式中,τ为吸附量;C0、Ct为溶液原始浓度和测定浓度,mg/mL;V为溶液体积,mL;m为D-Chitosan@Si质量,g。
1.2.4 D-Chitosan@Si吸附性能测试 实验分别选用D-Chitosan@Si、Chitosan@Si和硅胶在槲皮素浓度为40、80、120、160、200、240、260 μg/mL,温度为30℃,吸附6 h,确保吸附饱和,测定材料吸附槲皮素的量,具体操作见1.2.3。
1.2.5 不同吸附条件考察
1.2.5.1 吸附时间对槲皮素吸附量的影响 在槲皮素浓度为240 μg/mL,pH为7,温度为30℃,改变吸附时间为10、20、30、40、50、60、70 min,研究吸附时间对吸附量的影响,具体操作见1.2.3。
1.2.5.2 溶液的pH对槲皮素吸附量的影响 在槲皮素浓度为240 μg/mL,吸附时间60 min,温度为30℃,改变溶液pH为5、6、7、8、9,研究溶液pH对吸附量的影响,具体操作见1.2.3。
1.2.5.3 吸附温度对槲皮素吸附量的影响 在槲皮素浓度为240 μg/mL,pH为7,吸附时间60 min,改变吸附温度为25、30、35℃,研究吸附温度对吸附量的影响,具体操作见1.2.3。
1.2.6 动态吸附-解吸实验 取10 g D-Chitosan@Si装于层析柱中,泵入5 mg/mL的款冬花黄酮水溶液进行动态吸附,收集流出液,采用紫外-Al3+显色法[14]测定流出液中总黄酮的浓度,按式(2)计算总黄酮的吸附量;吸附达饱和后,少量去离子水洗涤,泵入70%乙醇溶液进行洗脱,收集洗脱液测定其浓度,按式(3)计算解吸率。收集洗脱液旋干称重,按式(4)计算所得总黄酮的纯度。
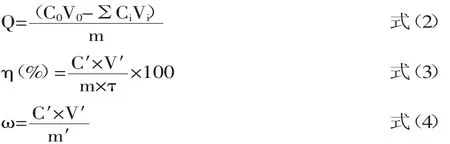
式中,Q为饱和吸附量,mg/g;C0为上柱液初始浓度,g/mL;V0为上柱液体积,mL;Ci为第i管收集液的浓度,μg/mL;Vi为第i管收集液的体积,mL;m为吸附材料质量,g;C′为洗脱液浓度,g/mL;V′为洗脱液体积,mL;m′为洗脱所得固体质量,g。
1.2.7 数据处理 采用Origin 8.5软件对实验数据进行处理。
2 结果与分析
2.1 D-Chitosan@Si的设计制备及表征
氢键和疏水作用力相互协同可增强材料的吸附选择性[9-11]。针对黄酮类化合物具有苯环大π键,且多数具有酚羟基的结构特点,在戊二醛交联制得Chitosan@Si基础上,选取可与黄酮类化合物形成氢键和π-π疏水作用力的4,4'-二羟基查耳酮作为修饰基团,醚化反应制得D-Chitosan@Si(图1),用于选择性吸附分离和纯化黄酮类化合物。
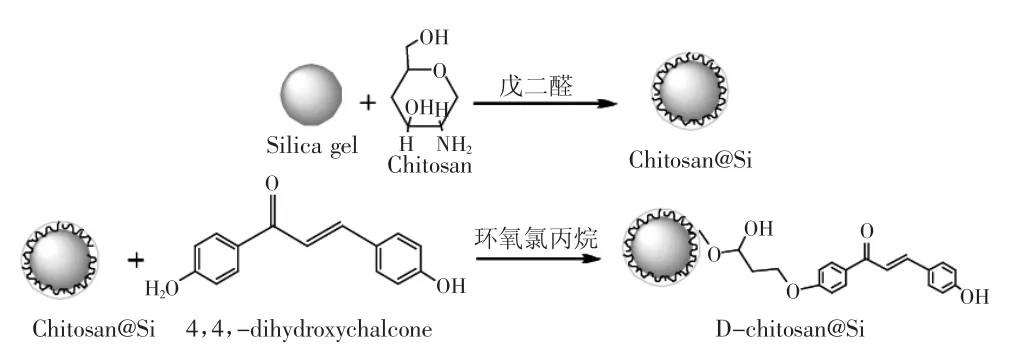
图1 D-Chitosan@Si制备反应原理Fig.1 Preparation principle of D-Chitosan@Si
D-Chitosan@Si的吸附性能受其理化特性的影响,D-Chitosan@si等三种吸附材料理化参数测定结果见表1,接枝过后D-Chitosan@Si比表面积、孔径和孔容较接枝前基本保持不变。由此推断,接枝4,4'-二羟基查耳酮后,D-Chitosan@Si吸附性能的改变是由引入的改性基团引起的。

表1 三种吸附材料的理化参数Table1 The physicochemical parameter of three adsorbents
对系列浓度(40~260 μg/mL)的槲皮素分别进行静态吸附,测得D-Chitosan@Si、Chitosan@Si和纯硅胶对槲皮素的吸附量(图2)。随槲皮素浓度增加,槲皮素吸附量均有增大,硅胶和Chitosan@Si对槲皮素的吸附能力较弱,最大吸附量仅为1.59 mg/g和4.66 mg/g;而接枝4,4'-二羟基查耳酮的D-Chitosan@Si对槲皮素的吸附量可高达17.49 mg/g,是Chitosan@Si和纯硅胶对槲皮素吸附量的4.56倍和11.2倍。可见,经化学改性接枝4,4'-二羟基查耳酮所得D-Chitosan@Si材料吸附能力显著提高。
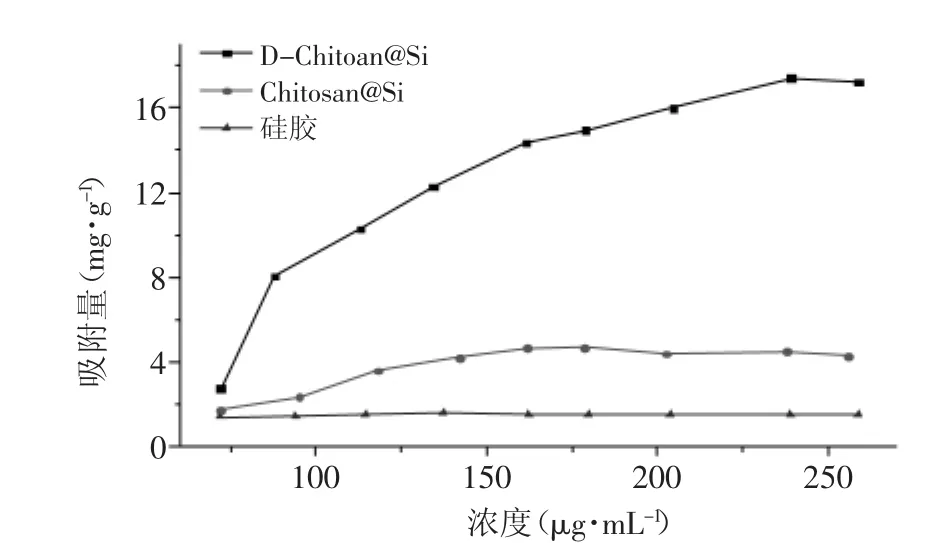
图2 槲皮素浓度对三种吸附材料吸附性能的影响Fig.2 Effect of quercetin concentration on the adsorption capacity on D-Chitosan@Si,Chitosan@Si and Silica gel
2.2 槲皮素在D-Chitosan@Si上吸附影响因素考察
2.2.1 吸附时间对槲皮素吸附量的影响 吸附时间是影响D-Chitosan@Si吸附槲皮素量的一个重要因素,图3为吸附时间对槲皮素吸附量的影响。由图3可知:0~20 min时,随吸附时间增加,槲皮素的吸附量快速增加;50 min后,槲皮素的吸附量增加缓慢;60 min时,槲皮素的吸附量基本保持不变,可认为吸附达到平衡状态,后续研究的吸附时间选择为60 min。
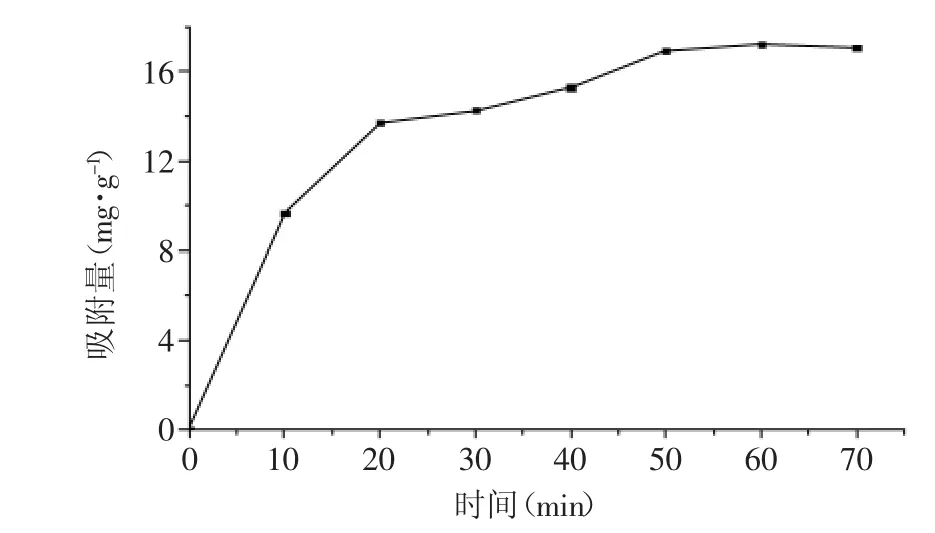
图3 吸附时间对槲皮素吸附量的影响Fig.3 Effect of time on the adsorption capacity of quercetin
2.2.2 pH对槲皮素吸附量的影响 溶液pH是影响槲皮素吸附量的另一个重要因素,图4为溶液pH对槲皮素吸附量的影响。由图4可知,pH<6时,D-Chitosan@Si对槲皮素的吸附量随pH增加而增大;pH=6时,DChitosan@Si对槲皮素具有最大的吸附量,pH>6时,槲皮素的吸附量减小。

图4 pH对槲皮素吸附量的影响Fig.4 Effect of pH value on the adsorption capacity of quercetin
槲皮素结构中γ-吡喃酮环上的1-位氧原子有未共用电子对,表现出微弱的碱性可与强酸生成佯盐而带正电荷[6];接枝基团4,4'-二羟基查耳酮上羰基(C=O)上氧原子电负性较大,酸性条件下可转变为羟基。图4为槲皮素和4,4'-二羟基查耳酮的解离平衡式,pH<6时,溶液中富含大量质子H+,4,4,-二羟基查耳酮和槲皮素均获得质子带正电荷,同性电荷相互排斥,槲皮素的吸附量减少;随pH增大4,4'-二羟基查耳酮和槲皮素获得质子能力减弱,正电荷间排斥作用减弱,pH=6时,槲皮素吸附量达到最大;但pH继续增加,溶液显碱性,4,4'-二羟基查耳酮和槲皮素失去质子带负电荷,负电荷间相互排斥,槲皮素吸附量降低,故,当pH=6时,槲皮素的吸附量最大是合理的。文献报道,D101在溶液pH=2.4时对黄酮类化合物吸附量最大[17],说明D-Chitosan@Si可在相对中性条件下分离黄酮类化合物。
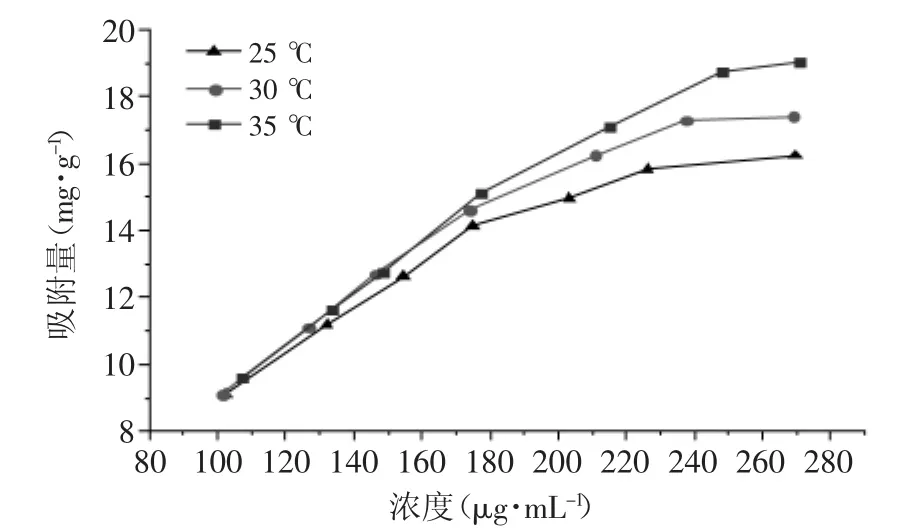
图5 D-Chitosan@Si吸附槲皮素等温吸附线Fig.5 The adsorption isotherm of quercetin sorption on D-Chitosan@Si

表2 D-Chitosan@Si对槲皮素吸附的动力学参数Table2 Kinetic parameters of adsorption on quercetin of D-Chitosan@Si
2.2.3 温度对槲皮素吸附量的影响 吸附温度是DChitosan@Si吸附槲皮素量的重要因素,图5是DChitosan@Si吸附槲皮素的吸附线,由图5可知:相同槲皮素浓度下,D-Chitosan@Si对槲皮素的吸附量均随吸附温度升高而有所增大,说明D-Chitosan@Si对槲皮素的吸附过程为吸热过程。在低浓度时吸附量变化不太大,故,D-Chitosan@Si的吸附实验条件选择30℃。
2.3 D-Chitosan@Si对槲皮素的吸附动力学分析
吸附动力学是研究达到吸附平衡的速率问题,常用公式为Langergren准一级吸附动力学式(5)和准二级吸附动力学式(6)[18-19],即:

式中,qe和qt分别为吸附平衡和t时刻的DChitosan@Si对槲皮素的吸附量,mg/g;k1为一级吸附动力学常数,min-1;k2为二级吸附动力学常数,g/(min·mg)。
将D-Chitosan@Si对槲皮素的吸附动力学用准一级和准二级吸附动力学模型拟合。如表2所示,DChitosan@Si吸附槲皮素的准一级吸附动力学拟合相关系数为0.929,而准二级吸附动力学拟合的相关系数达到了0.995,说明准二级吸附动力学更好地描述了D-Chitosan@Si对槲皮素的吸附行为。
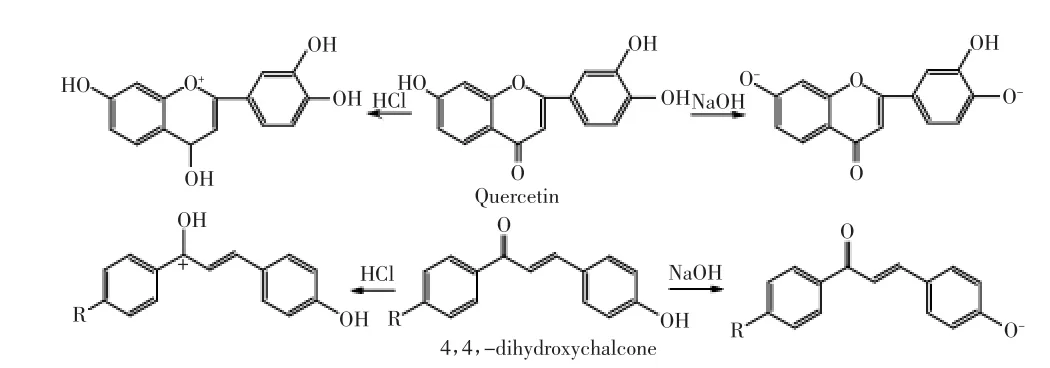
图6 槲皮素和4,4,-二羟基查耳酮离解方程Fig.6 Dissociation equation of quercetin and 4,4,-dihydroxychalcone
Weber-morris粒子内部扩散模型[17]可用来描述粒子在多孔材料内部扩散的机制,其表达式为:

式中,qt为t时刻的D-Chitosan@Si对槲皮素的吸附量;Kid为粒子内部扩散速率常数;C为常数。
如果C≠0,则粒子内部扩散不是唯一的吸附速率控制步骤;如果C=0,则粒子内部扩散是唯一的速率控制步骤[20]。见表2,C≠0,说明槲皮素在D-Chitosan@Si中的扩散不是唯一的吸附速率控制步骤,整个吸附过程可能受多个步骤共同控制。
2.4 D-Chitosan@Si对槲皮素的吸附等温线测试
常用描述吸附等温线的公式为Langmuir方程(8)和Feundilich方程(9)[21],即:
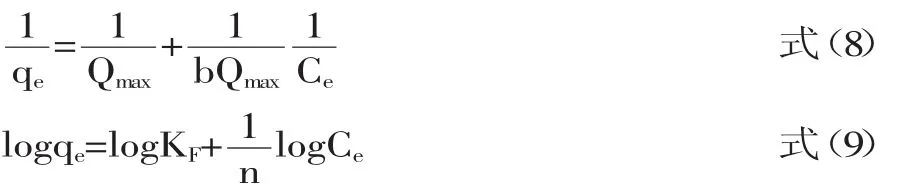
式中,qe为平衡吸附量,mg/g;Qmax为饱和吸附量;ce为槲皮素的平衡质量浓度,mg/mL,b、KF、n为常数。
槲皮素在D-Chitosan@Si上吸附的Langmuir和Freundlich方程拟合的结果见表3。由表3可见,DChitosan@Si吸附槲皮素的Freundlich方程拟合的相关系数最高达到0.940,而Langmuir方程拟合的相关系数均达到了0.98以上,由此可知:Langmuir方程可较好地描述D-Chitosan@Si吸附槲皮素的行为,Langmuir方程被用以描述吸附剂的单层吸附行为,据此推测D-Chitosan@Si对槲皮素的吸附为单层吸附。
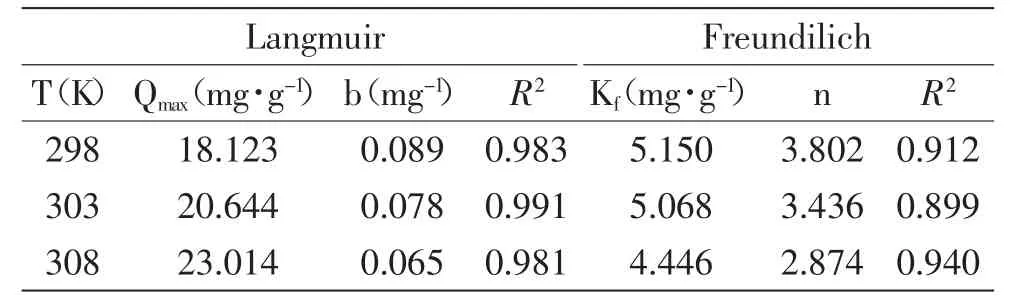
表3 D-Chitosan@Si吸附槲皮素的吸附等温参数Table3 Langmuir and Freundlich isotherm parameters of quercetin sorption on D-Chitosan@Si
2.5 D-Chitosan@Si对款冬花黄酮类化合物的分离和纯化实验
吸附选择性是衡量吸附材料的一个重要方面,可依据吸附-洗脱前后吸附质的纯度变化来评价[22]。吸附容量是衡量吸附材料的另一重要方面,包括吸附量和洗脱量。在前期实验所确定得优化条件:款冬花黄酮水溶液浓度5.0 mg/mL、pH为6,吸附流速1 BV/h;70%乙醇洗脱液,洗脱流速1.5 BV/h下进行动态吸附-洗脱实验,比较D-Chitosan@Si、Chitosan@Si和硅胶的吸附-洗脱效果见表4。从结果上看,DChitosan@Si对款冬花黄酮类化合物具有更强的吸附能力,为Chitosan@Si的1.99倍,硅胶的19.74倍;经D-Chitosan@Si吸附纯化后,款冬花黄酮类化合物纯度由18.9%提高到85.6%,纯化倍数达4.52倍,而Chitosan@Si纯化倍数为3.84,硅胶纯化倍数仅为2.24,由此可知:D-Chitosan@Si对黄酮类化合物具有良好的吸附选择性。
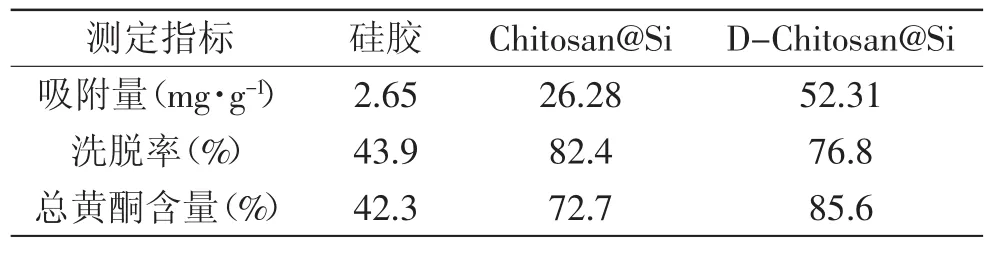
表4 三种吸附材料对款冬花黄酮类化合物的吸附-洗脱效果Table4 Adsorption-elution of tussilago farfara by three adsorptions
3 结论
将壳聚糖包裹在硅胶上,并在壳聚糖表面接枝4,4,-二羟基查耳酮,成功制得了D-Chitosan@Si新型吸附材料。在槲皮素浓度为240 μg/mL,吸附温度30℃,吸附60 min下,该材料对黄酮类代表组分槲皮素的吸附量高达17.49 mg/g,是Chitosan@Si和硅胶的4.56倍和11.2倍,显示出良好的吸附性能。研究发现D-Chitosan@Si对槲皮素的吸附为吸热过程,符合Langmuir吸附模型,相关系数达到0.98,这意味着其吸附过程为单层吸附;其吸附行为符合准二级吸附动力学模型,相关系数达到0.995。槲皮素在D-Chitosan@Si孔径内的扩散不是唯一的吸附速率控制步骤,整个吸附过程可能受多个步骤共同控制。进一步将所制备D-Chitosan@Si用于分离纯化款冬花中黄酮类化合物,黄酮类化合物的纯度由18.9%提高至85.6%,通过改性接枝与黄酮相似结构的4,4'-二羟基查尔酮基团的D-Chitosan@Si对款冬花中黄酮类化合物具有更好的吸附选择性。
[1]J Zhao,Y J Zhu,J Wu,et al.Chitosan-coated mesoporous microspheres of calcium silicate hydrate:environmentally friendly synthesis and application as a highly efficient adsorbent for heavy metal ions[J].J Colloid Interface Sci,2014,418:208-15.
[2]Xiaohua Zhou,Yu Su,Shuo Zhao.Preparation of Chitosan-Quercetin Resin Microspheres and its Adsorption Properties for Flavonoids[J].Separation Science and Technology,2013,48(6):941-946.
[3]Haixia Lu,Hongtao An,Xiaoming Wang,et al.Preparation of carboxymethyl chitosan-graft-beta-cyclodextrin modified silica gel and preconcentration of cadmium[J].International Journal of Biological Macromolecules,2013,61:359-362.
[4]Natrayasamy Viswanathan,Kalimuthu Pandi,Sankaran Meenakshi.Synthesis of metal ion entrapped silica gel/chitosan biocomposite for defluoridation studies[J].International Journal of Biological Macromolecules,2014,70:347-353.
[5]John C Crittenden,John L Bulloch,David W Hand,et al.Correlation of Aqueous-Phase Adsorption Isotherms[J].Environmental Science&Technology 1999,33(17):2926-2933.
[6]Jie Zhang,Xiaohua Zhou,Dan Wang,et al.High Selective Separation of Flavonoids based on Crosslinked Chitosan Resin Grafted by Quercetin[J].Separation Science and Technology,2013,48(18):2825-2833.
[7]C Renner,J Piehler,T Schrader.Arginine-and lysinespecific polymers for protein recognition and immobilization[J].Journal of the American Chemical Society,2006,128(2):620-628.
[8]Ruiying Zhao,Yu Yan,Mingxian Li,et al.Selective adsorption of tea polyphenols from aqueous solution of the mixture with caffeine on macroporous crosslinked poly(N-vinyl-2-pyrrolidi none)[J].Reactive&Functional Polymers,2008,68(3):768-774.
[9]Ping Ren,Xiaolin Zhao,Jing Zhang,et al.Synthesis of high selectivity polymeric adsorbent and itsapplication on the separation of ginkgo flavonol glycosides and terpene lactones[J].Reactive&Functional Polymers,2008,68(4):899-909.
[10]Na Wang,Xiaojing Liang,Qian Li,et al.Nitro-substituted 3,3'-bis(indolyl)methane-modified silica gel as a sorbent for solid-phase extraction of flavonoids[J].Rsc Advances,2015,5 (20):15500-15506.
[11]范育波,陶凤岗,徐伟,等.层叠苯环π-π相互作用的理论研究[J].化学学报,1999(1):1-4.
[12]Yong Lin,Ranxin Shi,Xia Wang,et al.Luteolin,a Flavonoid with Potential for Cancer Prevention and Therapy[J].Current Cancer Drug Targets,2008,8(7):634-646.
[13]Giovanni Agati,Giovanni Stefano,Stefano Biricolti,et al.Mesophyll distribution of‘antioxidant'flavonoid glycosides in Ligustrum vulgare leaves under contrasting sunlight irradiance[J].Annals of Botany,2009,104(5):853-861.
[14]Hongbin Zhu,Yuzhi Wang,Yuxuan Liu,et al.Analysis of Flavonoids in Portulaca oleracea L.by UV-Vis Spectrophotometry with Comparative Study on Different Extraction Technologies[J].Food Analytical Methods,2009,3(2):90-97.
[15]Jin-Can He,Fang-Qin Zhou,Yan-Fen Mao,et al.Preconcentration of trace Cadmium(II)and Copper(II)in environmental water using a column packed with modified silica Gel-Chitosan Prior to Flame Atomic Absorption Spectrometry Determination[J].Analytical Letters,2013,46(9):1430-1441.
[16]郑广,高芒来,罗忠新,等.季铵盐改性蒙脱土的微观结构与表面分形特征[J].石油化工高等学校学报,2011,01:6-11.
[17]Ying Zhang,Shufen Li,Xiwen Wu,et al.Macroporous resin adsorption for purification of flavonoids in Houttuynia cordata Thunb[J].Chinese Journal of Chemical Engineering,2007,15 (6):872-876.
[18]黄洪,颜环环,雷鸣.中性红在柚子皮上的吸附机制研究[J].环境污染与防治,2010(10):41-45.
[19]蒋茹,朱华跃,曾光明.石英砂负载壳聚糖吸附剂对Cu~(2+)吸附性能的研究[J].安全与环境学报,2008(5):32-35.
[20]M Dogan,H Abak,M Alkan.Adsorption of methylene blue onto hazelnut shell:Kinetics,mechanism and activation parameters [J].J Hazard Mater,2009,164(1):172-81.
[21]J Huang,K Huang,S Liu,et al.Adsorption properties of tea polyphenols onto three polymeric adsorbents with amide group[J].J Colloid Interface Sci,2007,315(2):407-414.
[22]Z B Chen,Y F Liu,X Y Huang,et al.The Separation of Steviosides in the leaves of Stevia rebaudiana Bertoni by Macroporous Resin[J].Journal of Polymer Materials,2011,28 (1):75-92.
Adsorption of flavonoids from tussilago farfara by chitosan-graft-4,4'-dihydroxychalcone modified silica gel
HAN Cong-cong1,XU Yi1,*,ZHANG Xiao-feng1,2,CAO Kun1,ZHANG Qing1,ZOU Sheng1
(1.Chemistry and Chemical Engineering,Chongqing University,Chongqing 400044,China;2.Chemistry and Chemical Engineering,Chongqing University of Technology,Chongqing 400054,China)
A silica based cross linking chitosan grafted with 4,4'-dihydroxychalcone(D-Chitosan@Si)was designed and prepared for selective separation and enrichment of flavonoids.The factors which affect the adsorption capacity of D-Chitosan@Si and the absorption mechanism were discussed in detail.The experimental results showed that the adsorption of Quercetin on D-Chitosan@Si was described by the Langmuir model,and the adsorption followed the pseudo second order kinetics equation,was controlled by multiple.D-Chitosan@Si was also successfully used to separate the flavonoids of tussilago farfara,the absorptive capacitythe of flavonoids was 52.31 mg/g and the purity was increased from 18.9%to 85.6%.It indicated that D-Chitosan@Si had high selectivity on enrichment flavonoids.
modified chitosan;4,4'-dihydroxychalcone;adsorption;quercetin;tussilago farfara
TS201.1
B
1002-0306(2016)06-0250-05
10.13386/j.issn1002-0306.2016.06.043
2015-09-10
韩聪聪(1988-),男,硕士研究生,研究方向:中药分离纯化技术,E-mail:hansmart@126.com。
徐溢(1966-),女,博士,教授,研究方法:中药分离纯化技术,E-mail:xuyibbd@cqu.edu.cn。
国家科技部“创新药物孵化基地”项目[2010ZX09401-306-1-5]。
