添加DHA的食用油对SD大鼠肝抗氧化活性的研究
2016-09-16林源锋何东平武汉轻工大学食品科学与工程学院湖北武汉43003中国科学院武汉病毒研究所湖北武汉43007
付 杰,林源锋,柳 梦,田 华,陈 涛,何东平,*(.武汉轻工大学食品科学与工程学院,湖北武汉43003;.中国科学院武汉病毒研究所,湖北武汉43007)
添加DHA的食用油对SD大鼠肝抗氧化活性的研究
付 杰1,林源锋1,柳 梦1,田 华1,陈 涛2,何东平1,*
(1.武汉轻工大学食品科学与工程学院,湖北武汉430023;2.中国科学院武汉病毒研究所,湖北武汉430071)
为了研究添加DHA的食用油对肝抗氧化活性的影响,本文选取96只初断乳SD雄性大鼠(80±10)g,按照随机数字表法分为8组,阴性对照组(大豆油和花生油等比例混合)、阳性对照组(DHA藻油),以250、500、750 mg DHA分别调配入60 g大豆油、花生油中,作为DHA低、中、高剂量调配油的处理组。对各处理组按1 mL混合油/100 g体重·d喂养分别达到4周和8周时,对SD大鼠肝组织中超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量和乙酰胆碱酯酶(AChE)活性进行检测。结果表明:DHA中剂量组大鼠肝组织SOD活性极显著高于阴性对照组(p<0.01),MDA含量极显著低于阴性对照组(p<0.01),AChE活性无显著性差异(p>0.05);DHA高剂量组肝组织SOD活性显著低于阳性对照组(p<0.05),MDA含量显著高于阳性对照组(p<0.05),AChE无显著性差异(p>0.05);其余各组AChE、SOD活性及MDA含量均无显著性差异(p>0.05)。适量补充DHA,有增强大鼠机体抗氧化的能力,然而一旦DHA摄入过量,反而会对机体抗氧化能力产生消极作用。
DHA藻油食用油,肝抗氧化活性,超氧化物歧化酶,丙二醛,乙酰胆碱酯酶
目前在许多国家,传统的鱼油DHA添加剂已经不再流行,逐渐被来源于微藻油的DHA藻油所取代。DHA藻油成为了唯一得到美国食品与药物管理局(FDA)认可的儿童DHA补充剂来源,在国际食品、药品及保健品市场上的应用前景广泛,已成供不应求之势[1-3]。面对我国居民DHA摄入长期不足的统一健康需求,急需一种方便、有效的新途径,来提高我国居民的每日DHA摄入量,这对我国居民的身体健康是至关重要的。DHA藻油在食品中显示出了良好的开发应用前景,其粉剂已被广泛应用于保健品和食品行业,一些添加DHA的乳制品、饮料等已在市场上出现,特别是孕妇、婴幼儿配方奶粉等类似食品受到极大关注[4]。食用油在我国居民日常生活中占有重要地位,在膳食烹调过程中必不可少,将DHA藻油添加入拥有大众化特点的食用油中,方便、快捷,更可以有效解决消费者的每日膳食DHA摄入不足的问题[5-6]。
传统的植物油脂对肌体肝抗氧化性有着非常重要的作用,陈雪君等[7]研究添加植物油对湖羊肝脏的影响,结果表明添加植物油的样品对湖羊血清和肝脏的抗氧化系统有促进作用。DHA多不饱和脂肪酸,有着众多的药理作用,尤丽菊等[8]在DHA的药理作用中提到,DHA含量增加,AA含量降低,丙二醛生成减少,超氧化物歧化酶(SOD)的活性增加。提示DHA对过氧化-抗氧化平衡具有重要影响。本文将DHA添加到植物油中,探讨其对SD大鼠肝组织中超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量和乙酰胆碱酯酶(AChE)的影响,以研究添加DHA食用油的抗氧化能力,以期为添加DHA食用油产品的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
DHA藻油 DHA含量≥45%,由嘉必优生物工程(武汉)有限公司提供;大豆油、花生油 由益海嘉里金龙鱼提供;清洁级初断乳SD雄性大鼠 体重约为(80±10)g,由湖北省实验动物研究中心提供,在武汉大学动物实验中心进行;乙酰胆碱酯酶(AChE)、超氧化物歧化酶(SOD)、丙二醛(MDA)测定试剂盒 购自南京建成生物工程研究所;其他试剂 均为分析纯。
EnSpire多标记微孔板检测仪(酶标仪) 铂金埃尔默仪器(上海)有限公司;S10手提式高速分散器、LEICA ULTRACUT R超薄切片机 上海京工实业有限公司;SK-1漩涡混匀器、台式高速离心机TGL-16郑州南北仪器设备有限公司;HH-6数显恒温水浴锅 常州市万丰仪器制造有限公司;Agilent 7890A气相色谱仪 安捷伦科技(中国)有限公司。
1.2 实验方法
1.2.1 实验动物分组及处理 取96只初断乳SD雄性大鼠(80±10)g,按照随机数字表法分为8组,每组12只。阴性对照组(大豆油和花生油等比例混合)、阳性对照组(DHA藻油)、以250、500、750 mg DHA分别调配入60 g大豆油、花生油中,作为DHA低、中、高剂量调配油的处理组。每天上午对所有实验组大鼠进行灌胃给药,灌胃剂量均为1 mL混合油/100 g体重·d,其他时间自由饮水。
在灌胃至4周和8周时,利用随机数字表法从每组中随机选择8只SD大鼠,对SD大鼠脑组织中超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量和乙酰胆碱酯酶(AChE)活性进行检测。
1.2.2 DHA藻油的脂肪酸成分分析 色谱柱:Agilent SP-2560(100 m×25 μm,0.2 μm);升温程序:100℃保持4 min,以3℃/min升温至230℃,保持20 min,载气(N2)流速25 mL/min,压力2.4 kPa,进样量1 μL;分流比15∶1。
1.2.3 动物肝组织采集及处理 将大鼠置于冰盘上迅速解剖肝脏,取大鼠肝脏将其放入2.5%戊二醛固定液中做预固定处理,再用锇酸做后固定,用乙醇进行逐级脱水处理,接着用丙酮进行置换处理,最后用环氧树脂与丙酮做置换处理[9-10]。将置换处理完成的样品在恒温56℃干燥箱内放置72 h,进行聚合处理。
1.2.4 AChE、SOD、MDA的测定 用预冷的生理盐水冲洗处理过的肝组织后,按质量比1∶9加入生理盐水,制成10%的肝组织匀浆,3500 r/min离心10 min,取上清,按照试剂盒方法进行操作,测定肝组织AChE活性、SOD活性、MDA含量[11-12]。
1.2.5 统计学方法 采用SPSS 11.0软件进行分析,所有数据用均值±标准差(x±s)表示,采用单因素方差t检验进行组间比较,以p<0.05为差异具有统计学意义。
2 结果与分析
2.1 DHA藻油的脂肪酸成分分析
DHA藻油的脂肪酸成分分析结果见表1。
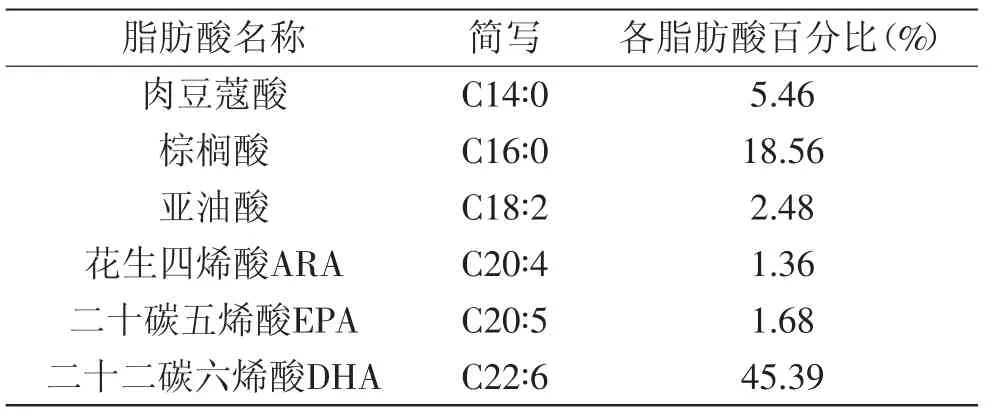
表1 DHA藻油脂肪酸组成Table1 Composition and content of DHA algae oil fatty acid
由表1可知DHA藻油的DHA(二十二碳六烯酸)成分占45.39%,将其按1∶60配比调配到大豆油、花生油中,因为大豆油和花生油两种植物油脂肪酸组成含量有着不同差异,因而分别添加起到组间对照作用,将它们充分混合均匀,采取分级添加、混合调配的方法所得新产品的稳定性、安全性与功能性都较好。
2.2 生化指标的检测
2.2.1 大鼠喂养4周时肝组织SOD活性、MDA值、Ache活性的变化 喂养4周的SD大鼠的肝组织匀浆经离心取上清液,按照SOD、MDA、AChe试剂盒的方法说明操作,测出肝组织中SOD活性、MDA值、Ache活性相比于对照组的变化情况如表2所示。
由表2可知,当大鼠喂养4周时,大鼠肝组织SOD活性、MDA值、AChe活性相比于两个对照组并没有显著的差异(p>0.05),可能与给药时间较短有关,给药时间较短,大鼠肝组织还没有消化吸收DHA,并形成生理常态,可能会缩短了大鼠的逃避潜伏期,但随着给药时间的延长,DHA的作用随时间延长而增强。
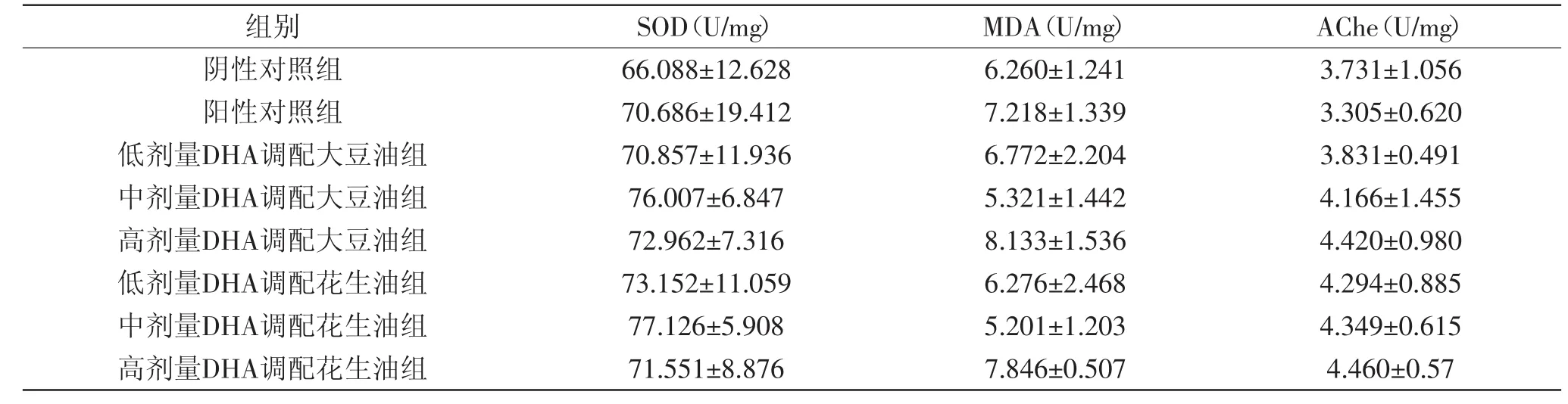
表2 不同调配油组培养4周肝组织中SOD活性、MDA值、Ache活性的变化Table2 The SOD activity,MDA content and AChE of the liver tissues in different groups feeding for 4 weeks
2.2.2 大鼠喂养8周后肝组织的SOD活性变化 对大鼠肝组织SOD活性的测定,因为机体内氧自由基过多会对其运动能力造成不良影响[13],SOD对于清除生物体内的自由基具有重要作用,因此对SOD活性进行测定。肝组织中SOD活性变化情况如表3所示。
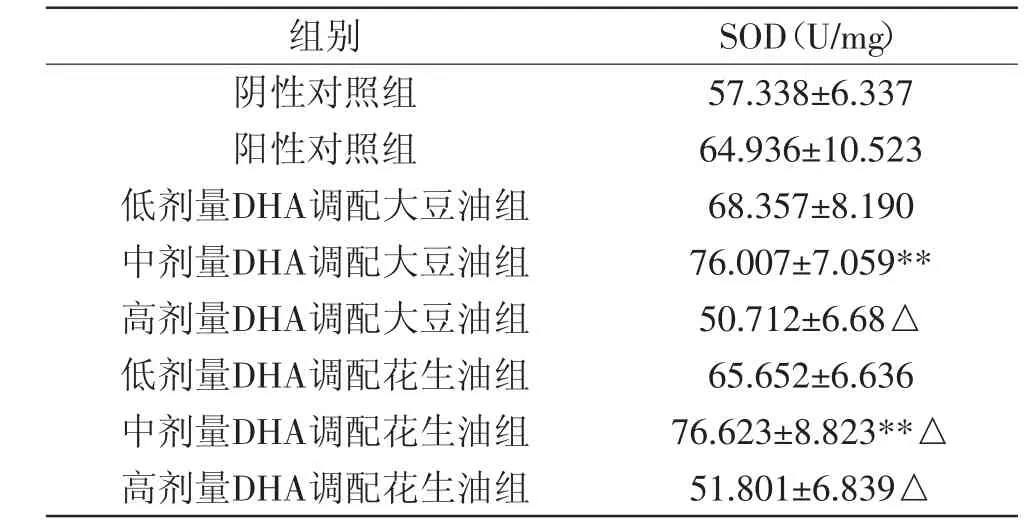
表3 不同调配油组培养8周肝组织中SOD活性的变化Table3 The SOD activity of the liver tissues in different groups feeding for 8 weeks
由表3可知,当低剂量喂养8周时,大鼠肝组织SOD活性相比于阴性对照组、阳性对照组并没有显著的差异,可能与剂量较低有关,还没有达到药效作用。中剂量DHA调配大豆油组SOD活性极显著高于阴性对照组(p<0.01),中剂量DHA调配花生油组极显著高于阴性对照组(p<0.01),显著高于阳性对照组(p<0.05)。这表明DHA中剂量调配植物油能够提高大鼠肝组织SOD活性,适量补充DHA有增强大鼠机体抗氧化的能力。然而,高剂量DHA调配大豆油组和花生油组大鼠SOD活性明显低于阴性对照组,显著低于阳性对照组(p<0.05)。这表明DHA摄入过量,对机体抗氧化能力及代谢会有一定程度的消极作用。因为DHA属于多碳不饱和脂肪酸,其性状不太稳定,容易在调制及灌胃中被氧化,如果剂量过高在人体内不能充分吸收,氧化后的脂肪酸在机体会阻止机体正常运行,因此可能影响到抗氧化能力及免疫调控力。
2.2.3 大鼠喂养8周后肝组织MDA含量的变化 MDA的含量常常能反映机体内脂质过氧化的程度,测定肝组织中MDA含量的变化情况如表4所示。
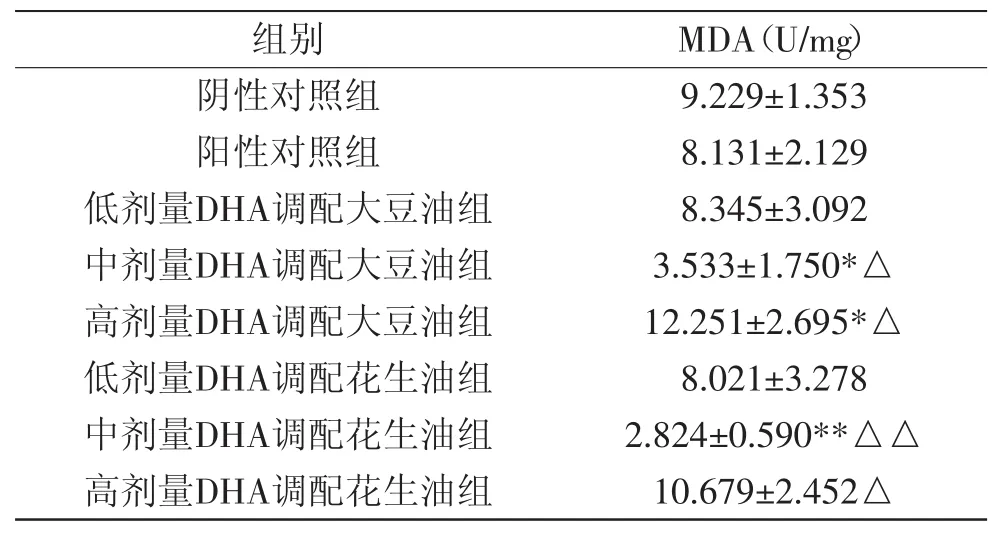
表4 不同调配油组培养8周肝组织中MDA活性的变化Table4 The MDA activity of the liver tissues in different groups feeding for 8 weeks
由表4可知,低剂量喂养8周时,大鼠肝组织MDA含量相比于阴性对照组、阳性对照组并没有显著的差异。中剂量DHA调配大豆油组显著(p<0.05)低于阴性对照组、阳性对照组,中剂量DHA配花生油组极显著(p<0.01)低于阴性对照组、阳性对照组。这表明添加中剂量的DHA有助于防止机体过氧化程度。然而高剂量DHA调配大豆油组显著(p<0.05)高于阴性对照组、阳性对照组,高剂量DHA调配花生油组显著(p<0.05)高于阳性对照组,这表明高剂量的DHA会加快机体过氧化程度。这是因为生物体内氧化反应产生的重要代谢产物之一就是MDA,其含量与生物体内过氧化的程度呈正相关,细胞受到损害的程度可由MDA含量间接表现出来,因此可将其作为定量指标,用来反映机体细胞受到氧自由基攻击的强度。DHA添加剂量较高时,容易在调制及灌胃中被氧化,机体对多碳不饱和脂肪酸的利用是有一定限度的,DHA过多在机体积累,没有利用的部分容易在机体内被酶解氧化,因而促进机体过氧化及降低免疫调控力。总的来说,就是机体清除氧自由基的能力由SOD的活性体现,机体细胞受自由基攻击的严重程度由MDA的含量体现。
2.2.4 大鼠喂养8周时肝组织AChE活性的变化 大鼠肝组织AChE活性的变化情况如表5所示。
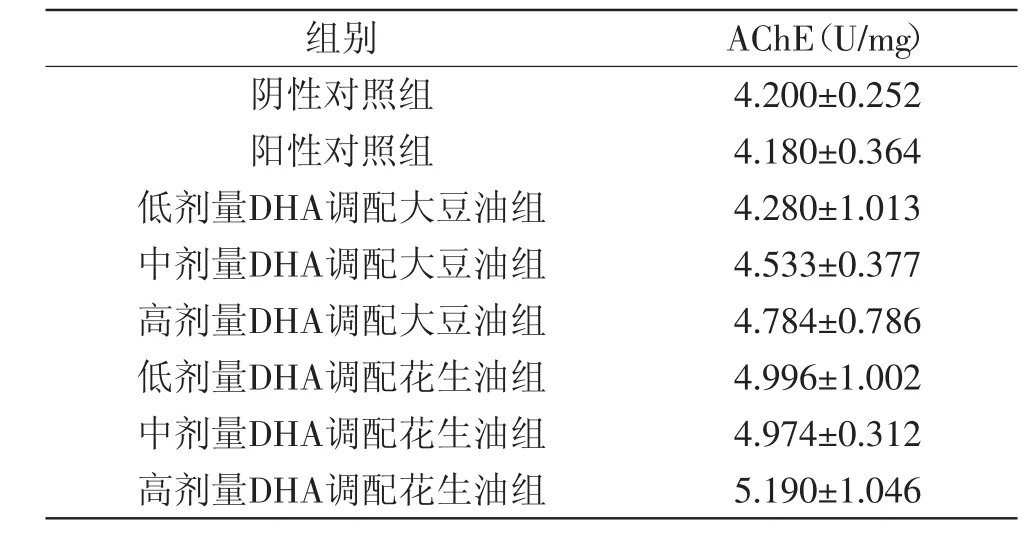
表5 不同调配油组培养8周肝组织中AChE活性的变化Table5 The AChE activity of the liver tissues in different groups feeding for 8 weeks
乙酰胆碱酯酶是在肝脏中生成,然后分泌到血液中的酶,这种酶可将胆碱酯水解成胆碱和有机酸,由于肝脏是合成这种酶的唯一器官,肝脏受损时,肝细胞合成功能下降,血清胆碱酯酶降低。肝细胞炎症程度越重,胆碱酯酶活力下降越明显,肝脏功能恢复后,胆碱酯酶就会恢复正常[14]。由表5可知,添加DHA的食用油对大鼠肝组织AChE含量都没有明显的影响,表明添加DHA对正常大鼠的肝组织产生乙酰胆碱酯酶没有太大促进作用,只是与机体抗氧化能力相关。
3 结论与讨论
反映过氧化程度的最常用的一对指标是超氧化歧化酶(SOD)与丙二醛(MDA),常常被用来配合使用[15]。通常认为当给予动物日粮氧化应激,如饲喂含PUFA较高的日粮时,会导致机体抗氧化性能的改变,“补偿性”地诱导动物内源抗氧化酶活性增加[16-17]。本实验结果表明添加DHA的食用油对大鼠肝组织抗氧化性有明显的提高,对机体过氧化也有一定的抑制作用。当喂养8周时,DHA中剂量调配植物油能显著提高大鼠肝组织SOD活性,显著降低MDA含量,说明能够提高大鼠肝组织抗氧化活性并抑制过氧化。然而添加高剂量DHA时,对改善大鼠肝组织抗氧化活性及抑制过氧化的能力变弱。
所以,在食用油中添加适当的DHA,有利于增强大鼠肝抗氧化的能力以及抑制肝组织的过氧化程度。但DHA摄入过量,在机体氧化沉积,反而会对机体抗氧化能力产生消极作用。对于DHA调配食用油产品的稳定性,和如何解决DHA极易氧化的问题,还需要下阶段深入的研究。
[1]阮征,吴谋成,胡筱波,等.多不饱和脂肪酸的研究进展[J].中国油脂,2003,28(2):55-59.
[2]Ruiz-Lopez N,Haslam R P,Napier J A,et al.Successful high-level accumulation of fish oil omega-3 long-chain polyunsaturated fatty acids in a transgenic oilseed crop[J].The Plant Journal,2014,77(2):198-208.
[3]Kahveci D,Xu X.Bioimprinted immobilization of Candida antarctica lipase a for concentration of omega-3 polyunsaturated fatty acids[J].Journal of the American Oil Chemists'Society,2012,89(10):1839-1845.
[4]古绍彬,虞龙,向砥,等.利用海洋微藻生产DHA和EPA的研究现状及前景[J].中国水产科学,2001,8(3):90-93.
[5]张坚,孟丽苹,姜元荣,等.中国成人膳食脂肪酸摄入和食物来源状况分析[J].营养学报,2009,31(5):424-427.
[6]Arterburn LM,Oken HA,Hoffman JP,et al.Bioequivalence of docosahexaenoic acid from different algal oils in capsules and in a DHA-fortified food[J].Lipids,2007,42(11):1011-1024.
[7]陈雪君,茅慧玲,马小梅,等.日粮添加植物油和VE对湖羊肝脏和血清抗氧化指标的影响[J].浙江大学学报:农业与生命科学版,2010,36(3):311-315.
[8]尤丽菊.DHA的药理作用[J].河南职工医学院学报,2008,20(6):619-621.
[9]司华静,黄巍峰,李建平,等.DHA藻油在花生油中的应用研究[J].现代食品科技,2011,27(9):1134-1136.
[10]郭艳芬,王丽梅,肖娜,等.发育期补充DHA对大鼠空间学习记忆能力的影响[J].中国油脂,2011,36(9):43-47.
[11]Hong-sheng Yu,Ai-Qin Song,Yan-Da Lu,et al.Effects of low-dose radiation on tumor growth,erythrocyte immune function and SOD activity in tumor-bearing mice[J].Chinese Medical Journal,2004(7):1036-1039.
[12]王军,霍军,程会昌,等.不同浓度菊酯类农药对黄河鲤鱼肝胰脏SOD活性和MDA含量的影响[J].江苏农业科学,2013,41(2):263-264.
[13]刘晓迪.DHA影响小鼠运动能力的实验研究[D].新疆:新疆师范大学,2011.
[14]赵飞,李涛,张常春,等.灭多威对红细胞膜及不同脑区乙酰胆碱酯酶的作用[J].中华劳动卫生职业病杂志,2015,33 (6):417-421.
[15]梁治学,胡燕,周语平,等.复肝宁对实验性肝纤维化大鼠血清HA、LN、CⅣ和肝组织SOD、MDA的影响[J].中医药学报,2009,37(4):36-38.
[16]Renerre M,Poncet K,Mercier Y,et al.Influence of dietary fat and vitamin E on antioxidant status of muscles of turkey[J].Journal of Agricultural and Food Chemistry,1999,47:237-244.
[17]Venkatraman J T,Pinnavaia L.Effects of saturated n-6 and n-3 lipids on activities of enzymes involved in antioxidant defense in normal rats[J].Nutrition Research,1998,18:34l-350.
Research of the edible oil contained DHA affecting the antioxidant activity of SD rats livers
FU Jie1,LIN Yuan-feng1,LIU Meng1,TIAN Hua1,CHEN Tao1,HE Dong-ping1,*
(1.College of Food Science and Engineering,Wuhan Polytechnic University,Wuhan 430023,China;2.Wuhan Institute of Virus,Chinese Academy of Sciences,Wuhan 430071,China)
To study the effect of edible oil contained DHA on the antioxidant activity of liver,this paper selected 96 early weaning SD male rats(80±10)g,which were divided into 8 groups based on the random number.Table the negative control group(mixing ratio of soybean and peanut oil),positive control group(DHA algae oil),250,500,750 mg DHA were seperately added to 60 g soybean oil,peanut oil,with low,medium,high dose DHA were treatment group.According to the dosage of 1 mL oil per 100 g weight a day and after feeding for 4 weeks and 8 weeks respectively,the SOD activity,MDA content and AChE in the liver tissues of SD rats were detected.The results showed that the SOD activity of liver tissue in middle dosage of DHA group was significantly higher than that in negative control group,the MDA content was significantly lower than that in positive control group and the AChE had no significant difference.The SOD activity in high dose of DHA group was significantly lower and the MDA content was significantly higher than that in negative control group,positive control group,and the AChE also had no significant difference.While the other groups had no significant difference in AChE,SOD activity and MDA content.Appropriate supplement of DHA could enhance the rat body's antioxidant capacity,but the excessive DHA will bring a negative effect.
DHA algae oil;the antioxidant activity of livers;SOD;MDA;AChE
TS201.1
A
1002-0306(2016)06-0356-04
10.13386/j.issn1002-0306.2016.06.063
2015-10-22
付杰(1991-),男,硕士研究生,研究方向:微生物油脂,E-mail:2683802254@qq.com。
何东平(1957-),男,博士,教授,研究方向:粮食、油脂及植物蛋白,E-mail:hedp123456@163.com。
国家粮食局粮食公益性行业科研专项(201313012-03)。
