我国国家标准和行业标准中黄曲霉毒素测定方法综述
2016-09-16马海华孙楫舟夏善红传感技术国家重点实验室中国科学院电子学研究所北京0090中国科学院大学研究生院北京00080河南工业大学信息科学与工程学院河南郑州45000粮食信息处理与控制教育部重点实验室河南郑州45000
马海华,孙楫舟,甄 彤,张 元,4,*,夏善红(.传感技术国家重点实验室,中国科学院电子学研究所,北京0090;2.中国科学院大学研究生院,北京00080;.河南工业大学信息科学与工程学院,河南郑州45000;4.粮食信息处理与控制教育部重点实验室,河南郑州45000)
我国国家标准和行业标准中黄曲霉毒素测定方法综述
马海华1,2,3,4,孙楫舟1,甄 彤3,张 元1,4,*,夏善红1
(1.传感技术国家重点实验室,中国科学院电子学研究所,北京100190;2.中国科学院大学研究生院,北京100080;3.河南工业大学信息科学与工程学院,河南郑州450001;4.粮食信息处理与控制教育部重点实验室,河南郑州450001)
黄曲霉毒素广泛存在于自然界中,能够污染多种农作物和食品,对人类的健康造成极其严重的危害。目前,尚无绝对有效的措施避免黄曲霉毒素的污染,因此,制定相应的标准并进一步规范和加强对黄曲霉毒素的检测和监控显得尤为重要。截至到2015年1月,我国现行的针对黄曲霉毒素的国家标准和行业标准共有21个,其中有11个标准在2010~2015年发布实施。本文全面综述了21个标准中采纳的7种测定方法及其特点,其中高效液相色谱法是目前广泛使用的最权威的确证定量测定方法,而免疫层析法则是最简便的快速筛查定性检测方法。在此基础上,本文进一步讨论了标准的制修订现状,并展望了黄曲霉毒素检测技术的发展趋势。
黄曲霉毒素,标准,测定,方法
黄曲霉毒素广泛存在于自然界中,主要是黄曲霉和寄生曲霉的次级代谢产物[1]。在已经能够分离并识别的黄曲霉毒素中,黄曲霉毒素B1(AFB1)、B2(AFB2)、G1(AFG1)和G2(AFG2)是最主要的四种[2]。另外,当奶牛摄入受AFB1污染的饲料后,AFB1在体内转变成黄曲霉毒素M1(AFM1),存在于奶牛的乳汁中[3]。在激发光波长为365 nm的紫外光照射下,AFB1和AFB2发射450 nm蓝色荧光,AFG1和AFG2发射425 nm绿色荧光。
黄曲霉毒素是一种剧毒物质,具有严重的致癌性、致畸性和致突变性[4],其中,AFB1的毒性最强。黄曲霉毒素能够污染谷物、玉米、大米、花生、坚果、牛奶等多种农作物和食品。人或动物摄入了受黄曲霉毒素污染的食物或饲料,会造成急性中毒死亡或慢性积累致癌等极其严重的危害。
黄曲霉毒素对人类健康和生命的严重危害引起了世界的广泛关注,许多国家及标准机构和组织纷纷制定相应的标准,规范和加强对黄曲霉毒素的检测和监控。近十年,我国在针对黄曲霉毒素的标准制定和修订方面发展迅速,目前,现行的标准共21个(不含1个地方标准),其中国家标准10个,行业标准11个。关于国内外真菌毒素检测标准的制修订现状的综述[5-6]已有发表,但是尚无针对我国现行国家标准和行业标准中黄曲霉毒素检测方法的详细论述,而且由于新的标准不断发布实施,已有综述中所涵盖的标准已无法全面阐述当前的标准现状,例如,杜英秋等[6]给出我国针对黄曲霉毒素检测方法的标准有16个(含1个地方标准,不含1个限量标准),而2014年新增5个标准,目前共计21个。
1 黄曲霉毒素限量标准
我国卫生部2011年发布实施的食品安全国家标准GB 2761-2011[7]规定了谷物及其制品、豆类及其制品、坚果及籽类、油脂及其制品、调味品以及特殊膳食用食品中AFB1的最高限量,以及乳及乳制品和婴幼儿配方食品中AFM1的最高限量,但是并未对AFB1、AFB2、AFG1和AFG2的总量做出限量要求。具体限量指标见表1[7]和表2[7]所示。

表1 食品中黄曲霉毒素B1限量指标Table1 Maximum levels of AFB1in foodstuffs
2 黄曲霉毒素测定方法
在制定食品中黄曲霉毒素限量标准的同时,进一步完善黄曲霉毒素测定方法的标准也是至关重要的。随着检测技术的发展,我国不断对已有标准做出修订并制定相应的新标准。目前,我国国家标准和行业标准中采纳的黄曲霉毒素测定方法主要有7种,分别是薄层色谱法(thin layer chromatography,TLC)、高效液相色谱法(high performance liquid chromatography,HPLC)、液相色谱-串联质谱法(liquid chromatographytandem mass spectrometry,LC-MS)、荧光光度法(fluorometry)、微柱筛选法(microcolumn screening)、酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)和免疫层析法(immunochromatography)。这些方法的适用范围及检测指标见表3。
2.1 薄层色谱法
TLC是早期应用最广泛的真菌毒素分析技术,被列为国际分析化学师协会(AOAC)标准方法[28]。目前,我国共有4个国家标准采纳TLC,分别是:GB/T 5009.22-2003[9]、GB/T 5009.23-2006[12]、GB 8381-2008[15]和GB 5009.24-2010[19]。
TLC基于黄曲霉毒素在紫外光下能够产生荧光的物理特性,具有制备分离、定性和半定量的分析功能。首先,试样中的黄曲霉毒素经三氯甲烷等提取、过滤,用溶剂分配净化[9,12,19]或硅胶柱纯化[15]、浓缩,滴加在硅胶G制备的薄层板上,采用单向展开或双向展开法,用展开剂将试液层析展开、分离,在紫外灯下用目测法或薄层扫描仪荧光法检测荧光强度。如果与黄曲霉毒素标准点对应的位置上无荧光点,则表示试样中黄曲霉毒素的含量在检出限(例如AFB1为5 μg/kg[9,12])以下;如果有荧光点,则需要进行确证实验;如果样液中荧光强度比检出限所显示的强,则需进行稀释定量,直至样液点的荧光强度与检出限点的荧光强度一致为止。
TLC设备简单,易于普及,在早期使用较为广泛。但是,传统TLC的样品前处理繁琐,实验过程较复杂,耗时长,且受样品提取、纯化、展开、分离等多种因素的影响[29],精确性较差,逐渐被HPLC所取代[30]。
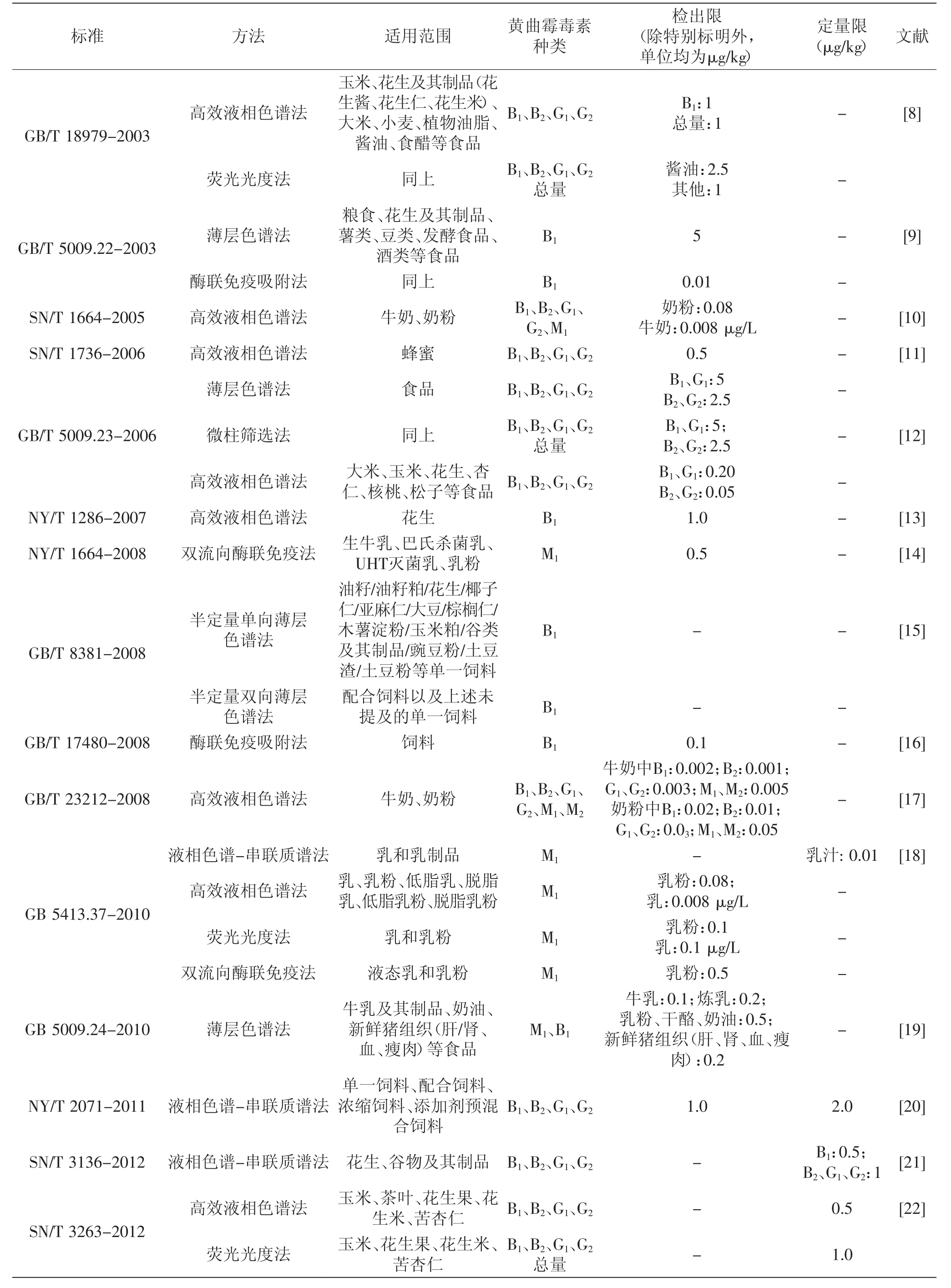
表3 标准中采纳的黄曲霉毒素测定方法的比较Table3 Comparison of aflatoxins determination methods applied in standards

续表
2.2 高效液相色谱法
HPLC是当前国内外检测黄曲霉毒素最权威的方法,也是AOAC的官方方法之一。其中,与荧光检测器联用的高效液相色谱法(HPLC-FLD)是目前使用最为广泛的一种方法[31]。我国共有5个国家标准和4个行业标准采纳HPLC,分别是:国家标准GB/T 18979-2003[8]、GB/T 5009.23-2006[12]、GB/T 23212-2008[17]、GB/T 5413.37-2010[18]和GB/T 30955-2014[27],行业标准SN/T 1664-2005[10]、SN/T 1736-2006[11]、NY/T 1286-2007[13]和SN/T 3263-2012[22]。
HPLC是色谱法的一个重要分支,以液体为流动相,将溶剂、缓冲液等流动相泵入装有固定相的色谱柱,在柱内各成分被分离后,进入检测器进行检测。HPLC用于黄曲霉毒素检测时,首先,提取溶剂(甲醇、乙腈、三氯甲烷等)提取试样中的黄曲霉毒素,提取后的溶液经过滤、净化后,注入反相C18色谱柱,用带荧光检测器的高效液相色谱仪测定试样的响应值(峰高或峰面积),外标法定量[12-13]。
为进一步提高样品的净化、提纯程度,减小杂质干扰,7个标准[8,10-11,17-18,22,27]将HPLC与免疫亲和层析技术相结合,从而提高检测的特异性和灵敏度。免疫亲和柱将黄曲霉毒素特异性抗体交联在柱内固体支持物上,当提取液通过免疫亲和柱时,黄曲霉毒素与抗体结合。用水清洗免疫亲和柱,去除柱内的杂质,然后用洗脱剂(甲醇等)洗脱吸附在柱上的黄曲霉毒素。
为进一步提高检测的灵敏度,特别是提高AFB1和AFG1的荧光强度,发展了一系列柱前衍生或柱后衍生技术,例如柱前三氟乙酸衍生[10,12-13]、柱后碘衍生[8,11]、柱后溴衍生[17,22]、柱后光化学衍生[22,27]和柱后电化学衍生[22],其中柱前三氟乙酸衍生方法已经被采纳为AOAC标准方法。柱前三氟乙酸衍生方法利用AFB1和AFG1的双呋喃环的双键结构在酸性溶液中容易水解,转化为富含羟基的荧光强度更高的衍生物AFB2a和AFG,从而提高荧光检测的灵敏度。
HPLC-FLD具有准确性、灵敏度和分辨率高的优点[29],能够同时检测多种黄曲霉毒素,实现定性、定量分析。但是,该方法操作步骤复杂繁琐,在分离黄曲霉毒素类似物时耗时长,由于AFB1和AFG1的荧光检测灵敏度较低,需要增加衍生处理[33]。另外,该方法需要专业技术人员操作,所需仪器设备昂贵,主要应用在专业实验室。
2.3 液相色谱-串联质谱法
LC-MS结合了色谱对复杂样品分离能力强以及质谱的选择性好的优点,是目前黄曲霉毒素确证性检测技术发展的方向[31]。我国在2010年发布的国家标准GB/T 5413.37-2010[18]以及在2011、2012年分别发布的行业标准NY/T 2071-2011[20]和SN/T 3136-2012[21]中将LC-MS作为黄曲霉毒素的一种测定方法。
LC-MS的液相色谱系统用于分离,质谱系统用于检测。首先,试样中的黄曲霉毒素经提取液提取后稀释、过滤,再经免疫亲和柱[18,21]或霉菌毒素多功能净化柱[20]净化,然后经液相色谱分离,电喷雾离子源离子化,采用多反应离子监测方式检测,根据色谱保留时间和质谱碎片及其离子丰度比定性,外标法定量。
实际上,农作物等实际样品通常受到多种霉菌毒素的污染,因此,多种霉菌毒素的同步测定具有非常重要的现实意义。LC-MS在具备高效分离的同时可实现多组分定性与定量检测,能够提供相对分子量和结构信息,具有高灵敏度和高选择性,适合于微量样品中的痕量组分分析,且无需柱前衍生和柱后衍生步骤,逐渐成为同步精确测定黄曲霉毒素及多种霉菌毒素的一种重要方法[33-34]。已有文献报道使用HPLC-MS同时检测AFB1和OTA等多种霉菌毒素[31,35]。但是,该方法对仪器设备、环境条件及操作人员的专业水平要求高,主要应用在部分专业实验室[29,34]。
2.4 荧光光度法
荧光光度法是利用了物质的分子/原子辐射跃迁的原理,其发出荧光的强度与物质的浓度相关,可实现定性、定量检测。我国共有2个国家标准和2个行业标准采纳荧光光度法,分别是:国家标准GB/T 18979-2003[8]和GB/T 5413.37-2010[18],行业标准SN/T 3263-2012[22]和NY/T 2549-2014[23]。
荧光光度法通常采用无分离直接检测模式,为了减小干扰,提高灵敏度,标准均采用荧光光度计与免疫亲和层析净化技术相结合的方式。样品经提取、脱脂[18]过滤后,经过免疫亲和柱进行层析净化,洗脱液中加入溴溶液衍生[8,18,22]或加入氯化汞荧光增强剂[23],以提高测定灵敏度,用荧光光度计测定荧光强度值,计算得到黄曲霉毒素含量。
免疫层析净化荧光光度法具有选择性强、定量精准等优点,比TLC的灵敏度有所提高。因为采用无分离方式,所以与HPLC和LC-MS相比,操作较为简化、仪器设备简单,但同时正是由于该方法没有分离功能[29],只有检测功能,所以只适用于黄曲霉毒素总量的测定。鉴于以上这些特点,荧光光度法通常作为一种筛选方法,对于阳性样品采用HPLC或LC-MS进一步分离和解析。
2.5 微柱筛选法
现行标准中只有国家标准GB/T 5009.23-2006[12]采纳微柱筛选法作为一种快速定性筛查方法。样品提取液通过由硅镁吸附剂和氧化铝组成的微柱层析管后,黄曲霉毒素被硅镁吸附剂吸附,杂质被氧化铝吸附。在紫外灯下观察结果,将层析后的样品管依次与0、5和10 ng的AFB1标准管比较。如果样品管内硅镁吸附剂层与0 ng标准管一致,则为阴性(5 μg/kg以下),如果呈现蓝紫色荧光,则为阳性。
微柱筛选法设备简单、操作简便,但是,微柱不能分离AFB1、AFB2、AFG1和AFG2,所以,该方法只能检测黄曲霉毒素的总量,是一种适用于样品快速筛查的定性检测方法。
2.6 酶联免疫吸附法
ELISA是二十世纪七十年代发展起来的基于免疫学和酶促反应的检测技术,利用抗原-抗体反应的高特异性和酶促反应的高敏感性实现对抗原或抗体的检测,已成为AOAC官方方法之一。我国采纳ELISA的有3个国家标准和1个行业标准,分别是:GB/T 5009.22-2003[9]、GB/T 17480-2008[16]、GB/T 5413.37-2010[18]和NY/T 1664-2008[14]。
ELISA有直接竞争和间接竞争两种模式。GB/T 17480-2008[16]采用直接竞争模式,用AFB1特异性抗体包被酶标微孔板,样品中的AFB1经过提取和稀释处理后,与辣根过氧化物酶(HRP)标记的AFB1竞争结合酶标板中的AFB1抗体,牛血清蛋白(BSA)封闭剩余的活性位点,加入酶底物后显色,样品中AFB1的含量与颜色成反比。对于结果的判定,可采用目测法比较样品液孔与标准溶液孔的颜色,也可使用酶标仪测定吸光度值。GB/T 5009.22-2003[9]采用间接竞争模式,不同之处在于,使用AFB1-BSA人工抗原包被酶标微孔板,样品中的AFB1与定量的AFB1单克隆抗体混合,发生抗原-抗体特异性结合,然后加入到酶标微孔板,多余的游离抗体与酶标板内的AFB1-BSA结合。
黄曲霉毒素ELISA试剂盒的出现,在一定程度上缩短了检测时间。GB/T 5413.37-2010[18]和NY/T 1664-2008[14]即采用AFM1双流向酶联免疫试剂盒,目测或使用酶联免疫检测读数仪判读结果,实现定性检测。
ELISA利用抗原-抗体的亲和性反应,特异性强,样品的前处理过程较简单,回收率较高,操作较为简便,可以进行定性或定量测定[3,29]。但是,作为标记物的酶,其活性易受反应条件的影响,例如pH的高低或金属离子的存在会破坏酶的活性,容易导致假阳性结果。
2.7 免疫层析法
免疫层析是一种快速筛查的定性或半定量检测技术,近年来在黄曲霉毒素检测应用中得到了广泛关注。它利用毛细管作用,液体流经多孔薄膜时将未结合的反应物与结合的反应物在液体-固体界面分离开[36],利用标记物质在试纸质控线和/或检测线区域的显色确定样品的阴性或阳性结果。我国共有3个行业标准采纳免疫层析法,分别是:LS/T 6108-2014[26]、NY/T 2550-2014[24]和NY/T 2548-2014[25]。
LST 6108-2014[26]规定了两种免疫层析法:酶标记免疫层析法和胶体金免疫层析法。酶标记免疫层析法使用商用AFB1酶联免疫检测卡,试样经甲醇溶液提取、过滤或离心、稀释后,加入检测卡中。试样中AFB1与固相载体上的抗体结合后再与固定在检测线的酶标二抗结合,使检测线显色。通过检测线是否显色及显色时间长短来判定试样中AFB1的含量。
LS/T 6108-2014[26]和NY/T 2550-2014[24]都采纳了胶体金免疫层析法。试样经提取、过滤或净化柱净化[24]、稀释后,加入商用检测卡中。试样中的AFB1先与固定在检测卡金标区的胶体金标记AFB1抗体结合,受毛细管作用向检测线和质控线扩散。可用目测法[24,26]、光谱成像检测仪或胶体金免疫层析检测仪[24]判定结果。若质控线和检测线均显色,则为阴性结果;若质控线显色,检测线不显色,则为阳性结果;若质控线和检测线均不显色,则为无效结果。
NY/T 2548-2014[25]采用时间分辨荧光免疫层析法。该方法以三价稀土离子铕作为荧光标记物,试样经提取、过滤、净化柱净化后与铕标记的AFB1抗体混合,抗原-抗体的结合抑制了层析过程中抗体与固定在检测线上的AFB1-BSA的免疫反应,使检测线时间分辨荧光强度降低,用时间分辨荧光检测仪通过检测时间分辨荧光强度变化进行定量测定。
在免疫层析法中,标记物是影响检测性能的一个重要因素。文献报道了使用磁珠[37-38]作为抗体标记物富集和分离牛奶样品中的AFM1或使用平均直径为75 nm左右的金纳米花[39]标记抗体作为信号放大探针,可进一步降低检测下限,提高灵敏度。
免疫层析法操作简单、成本低,检测过程中一般不需要使用其他试剂,能够实现一步现场快速检测[40],例如,检测时间为5 min[26]或10 min[24]。随着商用检测卡的推出,该方法作为一种快速定性筛查方法得到了更广泛的应用。但是,免疫层析法的灵敏度不高、裸眼读取结果误差大、实现准确定量检测较困难。
3 黄曲霉毒素标准制修订现状分析与展望
在标准的制修订时间和数量方面,我国现行的针对黄曲霉毒素的21个标准(不含1个地方标准)中的11个标准是在2010~2014年间制修订的,可见近几年标准的制修订工作发展迅速。黄曲霉毒素测定方法标准一般采纳一种或多种检测方法,其中共计9个标准采纳HPLC荧光检测法,4个标准分别采纳TLC、荧光光度法和ELISA,3个标准分别采纳LC-MS和免疫层析法,仅1个标准采纳微柱筛选法。HPLC涉及的检测样品种类最多,包括谷物、花生、干果、乳、乳粉、植物油脂、酱油、食醋、蜂蜜和茶叶等,说明该方法适用范围广,是一种权威的能够同时检测多种黄曲霉毒素的确证定量分析方法。LC-MS自2010年被引入标准中,而同时期,AOAC、国际标准化组织(ISO)、欧洲标准化委员会(CEN)制定的标准中尚未引入该法。LC-MS因其能够同时精确定量并识别多种霉菌毒素,必将在今后得到更广泛的应用。另外,2014年制定的5个标准中,有3个是针对免疫层析法,该方法是实现黄曲霉毒素快速筛查定性检测的一个重要发展方向。
在关键技术方面,TLC、HPLC、荧光光度法和微柱筛选法都是利用了黄曲霉毒素在紫外光下能够发出荧光的物理特性,通过荧光的强弱判读和计算结果。而ELISA和免疫层析法则是基于免疫亲和反应原理并结合酶或胶体金的显色反应。另外,LC-MS利用了色谱的分离技术和质谱的检测技术,根据色谱保留时间和质谱碎片及其离子丰度比定性和定量。同时,在样品前处理中,HPLC、LC-MS和荧光光度法都引入免疫亲和柱用于净化提纯。因此,目前现行标准中采用的检测方法主要是基于色谱技术、质谱技术、荧光检测技术和免疫亲和技术。基于大型仪器的色谱技术和质谱技术作为多靶标物质同时检测的主要技术,是黄曲霉毒素确证定量检测的一个重要发展方向。基于三价稀土离子的上转换荧光技术,因作为荧光标记物的三价稀土离子具有较长的亚稳能级寿命,是提高检测稳定性的一个重要研究方向。基于抗原抗体结合的免疫亲和技术,其选择性主要依赖于抗体的选择性,由于不同种黄曲霉毒素间分子结构的差别非常小,所以如何制备高选择性的抗体是免疫亲和技术的一个重要研究方向。
[1]Lima G P P,Vianello F.Food Quality,Safety and Technology [M].Wier:Springer-Verlag,2013:102.
[2]da Rocha M E B,Freire F C O,Maia F E F,et al.Mycotoxins and their effects on human and animal health[J].Food Control,2014,36(1):159-165.
[3]Vidal J C,Bonel L,Ezquerra A,et al.Electrochemical affinity biosensors for detection of mycotoxins:A review[J].Biosensors and Bioelectronics,2013,49(1):146-158.
[4]Some traditional herbal medicines,some mycotoxins,naphtha and styrene[M].//IARC Monographson theevaluation of carcinogenic risks to humans.Lyon,France,2002(82):26-27,172-182.
[5]王松雪,鲁沙沙,张艳,等.国内外真菌毒素检测标准制修订现状与进展[J].食品工业科技,2011,32(3):408-412.
[6]杜英秋,张瑞英,杨焕春,等.国内外真菌毒素检测标准现状及分析[J].粮食与油脂,2014,27(7):60-66.
[7]中华人民共和国卫生部.GB 2761-2011食品安全国家标准食品中真菌毒素限量[S].北京:中国标准出版社,2011.
[8]中华人民共和国国家质量监督检验检疫总局.GB/T 18979-2003食品中黄曲霉毒素的测定免疫亲和层析净化高效液相色谱法和荧光光度法[S].北京:中国标准出版社,2003.
[9]中华人民共和国卫生部中国国家标准化管理委员会.GB/T 5009.22-2003食品中黄曲霉毒素B1的测定[S].北京:中国标准出版社,2003.
[10]中华人民共和国国家质量监督检验检疫总局.SN/T 1664-2005牛奶和奶粉中黄曲霉毒素M1、B1、B2、G1、G2含量的测定[S].北京:中国标准出版社,2005.
[11]中华人民共和国国家质量监督检验检疫总局.SN/T1736-2006进出口蜂蜜中黄曲霉毒素的检验方法高效液相色谱法[S].北京:中国标准出版社,2006.
[12]中华人民共和国卫生部中国国家标准化管理委员会.GB/T 5009.23-2006食品中黄曲霉毒素B1、B2、G1、G2的测定[S].北京:中国标准出版社,2006.
[13]中华人民共和国农业部.NY/T 1286-2007花生黄曲霉毒素B1的测定高效液相色谱法[S].北京:中国标准出版社,2007.
[14]中华人民共和国农业部.NY/T 1664-2008牛乳中黄曲霉毒素M1的快速检测双流向酶联免疫法[S].北京:中国标准出版社,2008.
[15]中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会.GB 8381-2008饲料中黄曲霉毒素B1的测定半定量薄层色谱法[S].北京:中国标准出版社,2008.
[16]中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会.GB/T 17480-2008饲料中黄曲霉毒素B1的测定酶联免疫吸附法[S].北京:中国标准出版社,2008.
[17]中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会.GB/T 23212-2008牛奶和奶粉中黄曲霉毒素B1、B2、G1、G2、M1、M2的测定液相色谱-荧光检测法[S].北京:中国标准出版社,2008.
[18]中华人民共和国卫生部.GB 5413.37-2010食品安全国家标准乳和乳制品中黄曲霉毒素M1的测定[S].北京:中国标准出版社,2010.
[19]中华人民共和国卫生部.GB 5009.24-2010食品安全国家标准食品中黄曲霉毒素M1和B1的测定[S].北京:中国标准出版社,2010.
[20]中华人民共和国农业部.NY/T 2071-2011饲料中黄曲霉毒素、玉米赤霉烯酮和T-2毒素的测定液相色谱-串联质谱法[S].北京:中国标准出版社,2011.
[21]中华人民共和国国家质量监督检验检疫总局.SN/T 3136-2012出口花生、谷类及其制品中黄曲霉毒素、赭曲霉毒素、伏马毒素B1、脱氧雪腐镰刀菌烯醇、T-2毒素、HT-2毒素的测定[S].北京:中国标准出版社,2012.
[22]中华人民共和国国家质量监督检验检疫总局.SN/T 3263-2012出口食品中黄曲霉毒素残留量的测定[S].北京:中国标准出版社,2012.
[23]中华人民共和国农业部.NY/T 2549-2014饲料中黄曲霉毒素B1的测定免疫亲和荧光光度法[S].北京:中国标准出版社,2014.
[24]中华人民共和国农业部.NY/T 2550-2014饲料中黄曲霉毒素B1的测定胶体金法[S].北京:中国标准出版社,2014.
[25]中华人民共和国农业部.NY/T 2548-2014饲料中黄曲霉毒素B1的测定时间分辨荧光免疫层析法[S].北京:中国标准出版社,2014.
[26]国家粮食局.LS/T 6108-2014粮油检验谷物中黄曲霉毒素B1的快速测定免疫层析法[S].北京:中国标准出版社,2014.
[27]中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会.GB/T 30955-2014饲料中黄曲霉毒素B1、B2、G1、G2的测定免疫亲和柱净化-高效液相色谱法[S].北京:中国标准出版社,2014.
[28]Horwitz W,Latimer G W.Official methods of analysis of AOAC international17th edn[J].Gaithersbury,MD:AOAC International,2000,1:87-92.
[29]Fang L Q,Chen H,Ying X T,et al.Micro-plate chemiluminescence enzyme immunoassay for aflatoxin B1in agricultural products[J].Talanta,2011,84(1):216-222.
[30]Shephard G S.Aflatoxin analysis at the beginning of the twenty-first century[J].Analytical and Bioanalytical Chemistry,2009,395(5):1215-1224.
[31]Wei R W,Qiu F,Kong W,et al.Co-occurrence of aflatoxin B1,B2,G1,G2and ochrotoxin A in Glycyrrhiza uralensis analyzed by HPLC-MS/MS[J].Food Control,2013,32(1):216-221.
[32]Takahashi D M.Reversed-phase high-performance liquid chromatographic analytical system for aflatoxins in wines with fluorescence detection[J].Journal of Chromatography A,1977,131:147-156.
[33]Liu S Y,Qiu F,Kong W J,et al.Development and validation of an accurate and rapid LC-ESI-MS/MS method for the simultaneous quantification of aflatoxin B1,B2,G1and G2in lotus seeds[J].Food Control,2013,29(1):156-161.
[34]Pereira V L,Fernandes J O,Cunha S C.Mycotoxins in cereals and related foodstuffs:a review on occurrence and recent methods of analysis[J].Trends in Food Science&Technology,2014,36(2):96-136.
[35]García-Moraleja A,Font G,Mañes J,et al.Development of a new method for the simultaneous determination of 21 mycotoxins in coffee beverages by liquid chromatography tandem-mass spectrometry[J].Food Research International,2015,72:247-255.
[36]Sun X L,Zhao X L,Tang J,et al.Development of an immunochromatographic assay for detectionof aflatoxin B1in foods[J].Food Control,2006,17(4):256-262.
[37]Huang Y M,Liu D F,Lai W H,et al.Rapid Detection of Aflatoxin M1by Immunochromatography Combined with Enrichment Based on Immunomagnetic Nanobead[J].Chinese Journal of Analytical Chemistry,2014,42(5),654-659.
[38]Liu D F,Huang Y M,Wang S Y,et al.A modified lateral flow immunoassay for the detection of trace aflatoxin M1based on immunomagnetic nanobeads with different antibody concentrations [J].Food Control,2015,51:218-224.
[39]Ji Y W,Ren M L,Li Y P,et al.Detection of aflatoxin B1with immunochromatographic test strips:Enhanced signal sensitivity using gold nanoflowers[J].Talanta,2015,142:206-212.
[40]Anfossi L,Baggiani C,Giovannoli C,et al.Lateral-flow immunoassays for mycotoxins and phycotoxins:a review[J].Analytical and Bioanalytical Chemistry,2013,405(2-3):467-480.
A review on aflatoxins determination methods in China's national and industry standards
MA Hai-hua1,2,3,4,SUN Ji-zhou1,ZHEN Tong3,ZHANG Yuan1,4,*,XIA Shan-hong1
(1.State Key Laboratory of Transducer Technology,Institute of Electronics,Chinese Academy of Sciences,Beijing 100190,China;2.Graduate University of Chinese Academy of Sciences,Beijing 100080,China;3.College of Information Science and Engineering,Henan University of Technology,Zhengzhou 450001,China;4.Key Laboratory of Grain Information Processing and Control of Ministry of Education,Zhengzhou 450001,China)
Aflatoxins were widely found in nature,wich could contaminate many kinds of agriculture products and food,causing serious harm to the health of humans.Now,absolutely effective strategies do not have been developed for avoiding aflatoxins contamination.Therefore,establishing regulations and standards designed to standardize aflatoxins detection and strengthen supervision were considered to be very important.Till Jan.2015,there were totally twenty-one national and industry standards for aflatoxins existing in our country,consisting eleven standards that were issued and entered into force between 2010 and 2015.This review dealt with seven determination methods applied in standards.High performance liquid chromatography was now widely used as an authoritative quantitative confirmatory method,and High Performance Liquid Chromatography was a simple qualitative method for fast screening detection.Based on these,the current status in development and revision of the standards were further discussed.Meanwhile,the trends of technologies for aflatoxins determination were proposed.
aflatoxins;standards;determination;methods
TS207.2
A
1002-0306(2016)06-0360-07
10.13386/j.issn1002-0306.2016.06.064
2015-06-12
马海华(1979-),女,博士研究生,讲师,研究方向:生化微传感器与霉菌毒素检测,E-mail:mahaihua@huat.edu.cn。
张元(1961-),男,教授,研究方向:储粮生物危害物检测及智能信号处理与微系统技术,E-mail:zhangyuan@haut.edu.cn。
国家高技术研究发展计划(863计划)(2012AA101608);国家自然科学基金青年科学基金(61401433,61201389)。
