体外模拟消化过程中大豆蛋白的荧光光谱分析及热处理的影响
2016-09-16王中江隋晓楠齐宝坤韩飞飞江连洲东北农业大学食品学院黑龙江哈尔滨50030国家大豆工程技术研究中心黑龙江哈尔滨50030
王 瑞,李 杨,王中江,隋晓楠,齐宝坤,韩飞飞,毕 爽,江连洲,2,*(.东北农业大学食品学院,黑龙江哈尔滨50030;2.国家大豆工程技术研究中心,黑龙江哈尔滨50030)
体外模拟消化过程中大豆蛋白的荧光光谱分析及热处理的影响
王 瑞1,李 杨1,王中江1,隋晓楠1,齐宝坤1,韩飞飞1,毕 爽1,江连洲1,2,*
(1.东北农业大学食品学院,黑龙江哈尔滨150030;2.国家大豆工程技术研究中心,黑龙江哈尔滨150030)
分析了不同温度热处理及不同时间热处理的大豆分离蛋白体外模拟消化过程产物的荧光光谱。结果表明:不同时间热处理及不同温度的热处理均对大豆蛋白的消化有一定促进作用,大豆蛋白的最佳热处理条件为85℃、20 min,蛋白质的消化程度最大。大豆分离蛋白经不同温度热处理后,消化1 h,消化产物的最大吸光波长(λmax)即随着加热温度的上升而红移,在加热90℃时达到最大值后下降,而荧光强度呈现出先上升后下降的变化趋势。经过不同时间热处理后消化1 h,大豆分离蛋白消化产物的λmax先上升后下降。且荧光强度随着加热时间的延长呈现出不同的变化趋势,在0~20 min不断升高时,20 min时达到最大值,而继续加热至60 min,荧光强度逐渐下降。
大豆分离蛋白,荧光光谱,热处理,体外模拟消化
荧光光谱用于检测蛋白质的内源性荧光,主要是通过三种芳香族氨基酸的激发光谱、荧光发射光谱,以及荧光光谱的峰位、强度的变化[1],对这些参数进行定量及定性测定分析,进而了解蛋白质的几种重要的氨基酸残基所处的微环境[2]。一般来说,天然蛋白质中能够产生荧光的氨基酸残基多分布于蛋白质分子的内部,因此这种氨基酸残基的极性小于其外部环境的极性,同一种荧光基团所处环境的极性发生改变时,其最大吸收波长也会发生变化[3]。由此推断蛋白质分子在各种环境中或者与各种分子作用之后的构象变化,从而了解大分子的结构与功能的关系[4]。
蛋白质对人体十分重要,各种食品中蛋白质含量是否丰富固然重要,但能否被人体利用或利用多少,是决定其营养价值的一个先决条件。大豆蛋白(soy proteins)作为一种重要的食物蛋白质,具有突出的营养价值和加工功能特性,广泛地应用于食品工业。热处理对大豆蛋白功能特性的影响一直是大豆蛋白研究领域的热点之一。目前已有很多研究以大豆分离蛋白、大豆7S球蛋白和11S球蛋白为对象,探讨热处理过程中蛋白的结构变化及聚集行为[5-7]。在对大豆分离蛋白进行热处理时,可以通过调整热处理条件控制蛋白质的聚集程度,从而控制蛋白质的功能性质[8]。研究发现,大豆蛋白分子的内部结构较复杂,多肽链紧密折叠,疏水性的氨基酸在其内部形成疏水区域,外部亲水外壳所包裹,且亚基彼此间结合又形成复杂的蛋白质的四级结构[9]。通过分子的高度压缩等变性作用使蛋白酶的酶解作用具有很强的抗性[10]。因此,通过各种预处理手段改性蛋白质,使大豆蛋白高度压缩、紧密的结构松散开,暴露出分子内部的酶作用位点,以利于蛋白酶的结合[11-12]。本研究采用发射荧光光谱(内部荧光光谱)技术研究加热处理对体外模拟消化过程的大豆蛋白消化情况的影响,从色氨酸残基微环境极性的变化角度,探讨三级结构水平上蛋白质空间构象变化情况,并为食品加工领域生产易消化、高吸收、高利用的优质蛋白产品提供进一步理论指导和应用参考。
1 材料与方法
1.1 材料与仪器
大豆 由东北农业大学大豆研究所提供;胃蛋白酶(活力3000 U/g) Novo公司;三硝基苯磺酸(TNBS)、氢氧化钠、磷酸二氢钠、磷酸氢二钠、正己烷、盐酸等试剂 国产分析纯试剂。。
PHSJ-4A型实验室pH计 中国上海雷磁公司;锤片式粉碎机 中国天津泰斯特仪器有限公司;THZ-80水浴恒温振荡器 江苏金坛亿通电子有限公司;CR22G高速冷冻离心机 日本日立公司;F-4500荧光分光光度计 日本HITACHI公司。
1.2 实验方法
1.2.1 大豆分离蛋白制备 参考Petruccelli and Añón[13]的方法。原料大豆经去皮、粉碎过60目筛,然后,在40℃条件下采用正己烷萃取制备脱脂豆粕。将脱脂豆粕按1∶10的质量比与水混合,用2 mol/L NaOH调节pH至8.0,搅拌l.5 h后,将其悬浮液在4℃条件下10000×g离心30 min,取上清液用2 mol/L HCl调pH至4.5。静置后在4℃条件下6000×g离心30 min,取蛋白沉淀水洗2次,最后取沉淀分散于水中并用2 mol/L NaOH调pH至7.0。在4℃条件下10000×g离心30 min,除去少量的不溶物,将其蛋白溶液冷冻干燥后粉碎即得粉末状大豆分离蛋白。所有步骤均在室温条件下进行。
1.2.2 大豆蛋白体外模拟消化工艺 将适量大豆分离蛋白分散于蒸馏水中配制成5%的大豆蛋白溶液,并取调配后样品溶液100 mL,分别密封于加热套管中在控温水浴锅中,首先进行70、80、85、90、100℃不同加热温度的热处理,加热15 min,然后,另取调配好的样品溶液100 mL,样品溶液置于85℃水浴条件,分别加热10、20、30、60 min。样品经热处理完成后,迅速放入冰水浴降温。
将上述经过不同加热时间,不同加热温度热处理的蛋白以及未处理的蛋白样品溶液分别于37℃水浴保温5 min,取胃蛋白酶(酶活力为3000 U/g,酶与底物的比为1∶100)加入人工模拟胃液缓冲液(35 mmol/L NaCl,84 mmol/L HCl,pH1.2)[14],37℃水浴持续搅拌5 min,加入到大豆蛋白溶液中进行消化反应,反应过程中保持pH恒定。消化1 h后,调节消化液pH至7.0终止反应,冷冻干燥后在4℃条件下保存用于测定水解度(DH)及荧光光谱分析。
1.2.3 水解度的测定 水解度(DH)的测定采用三硝基苯磺酸法,参照Adler-Nissen[15]的方法,TNBS能与游离的氨基酸反应生成能在340 nm处有吸收峰的物质。反应是在弱碱性环境中,在酸性中终止。
水解度的计算:
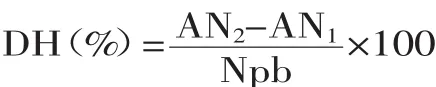
式中:AN1指蛋白水解前氨基氮的含量,mg/g蛋白;AN2指蛋白水解后氨基氮的含量,mg/g蛋白;Npb指蛋白底物中肽键的氮含量,Npb对于大豆球蛋白来讲为109.2 mg/g。
1.2.4 荧光光谱分析 采用荧光分光光度计测定大豆分离蛋白的内源性荧光光谱(色氨酸荧光光谱)。将大豆分离蛋白样品用0.01 mol/L磷酸缓冲液(pH为7.0)配制成浓度为0.15 mg/mL的溶液。荧光发散光谱分析:以蛋白质分子内部的色氨酸荧光基团为探针,荧光光谱激发波长为290 nm,发散光谱扫描范围为300~400 nm,激发狭缝和发射狭缝宽均为5 nm。
1.2.5 数据统计方法 用SAS 8.12进行相关分析和方差分析,如果方差分析效应显著,使用Duncan multiple range test进行多重比较(p<0.05)。
2 结果与分析
2.1 热处理大豆分离蛋白体外模拟消化DH曲线
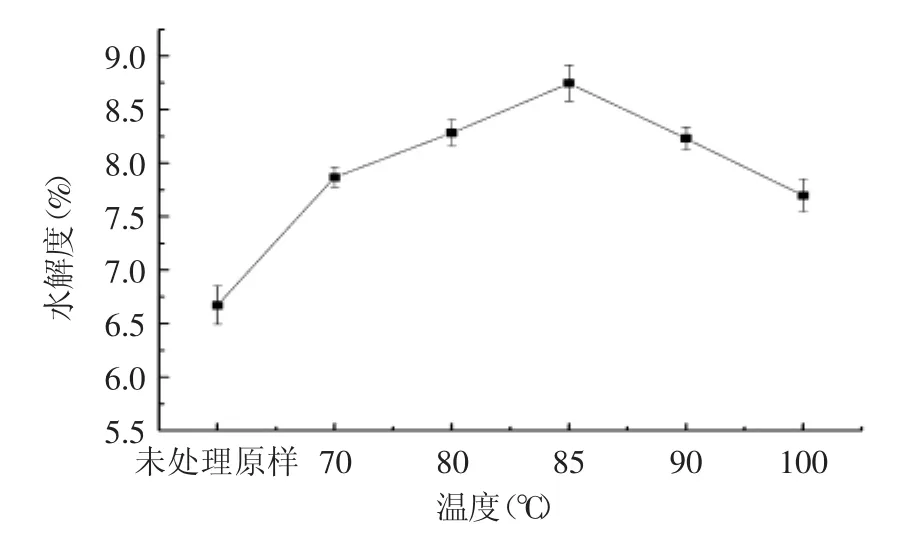
图1 不同热处理温度下大豆分离蛋白体外模拟消化的DH曲线Fig.1 DH curve of soy protein isolate in vitro digestion at different heat treatment temperature
从图1可以看出,不同温度15 min热处理对大豆蛋白的消化有一定促进作用,从DH曲线来看,随着热处理温度的不断增高,DH曲线呈现先上升后下降的变化趋势,在85℃时达到最大值。
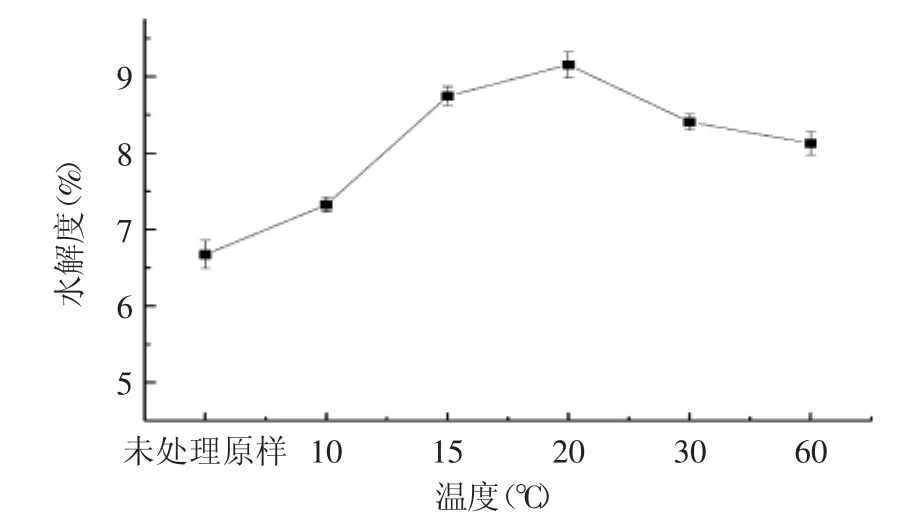
图2 不同热处理时间大豆分离蛋白体外模拟消化的DH曲线Fig.2 DH curve of soy protein isolate in vitro digestion at different heat treatment time
而从图2可知,85℃不同热处理时间的DH曲线在热处理20 min后,DH开始呈现下降的趋势。这是由于热处理可以使蛋白质变性,使整个蛋白的结构展开,一些深埋在蛋白质内部的侧链可以暴露出来,提高表面疏水性和酶作用敏感性。但过度的加热也会引起蛋白的聚集[16],暴露出分子内部的酶作用位点被部分包埋,不利于蛋白酶的结合,DH出现下降的现象。上述研究结果可以得知经过热处理后的大豆蛋白继续体外模拟消化,蛋白质的DH即水解程度较未处理的原样均有所提高,而在85℃、20 min热处理的条件下,再进行体外模拟消化,大豆蛋白的DH最高,消化程度及效果最好。
2.2 不同加热温度的预处理对大豆蛋白体外模拟消化的特点及特性的影响
在295 nm激发的大豆分离蛋白样品荧光发射光谱主要是由色氨酸(Trp)所发射的,和其他含色氨酸和酪氨酸(Tyr)残基的球蛋白一样,由于其分子中从酪氨酸残基到色氨酸残基之间发生了能量转移,从而导致了酪氨酸残基的荧光熄灭和色氨酸残基的荧光增加[17]。分析其荧光强度的变化可能与大豆分离蛋白中Trp残基的量子产率及Tyr→Trp能量传递有关[18]。当大豆分离蛋白的λmax分布在331.2~338.4 nm范围内,有研究表明λmax与Trp残基所处的微环境有关,λmax小于330 nm表示Trp残基位于蛋白质分子内部的非极性环境中,λmax大于330 nm表明Trp残基位于蛋白质分子外部的极性环境中[19]。
图3所示为使用内源荧光扫描测定大豆蛋白经不同温度15 min加热预处理后,消化1 h所得产物的荧光光谱及最大吸收波长图谱。由图3可知,大豆分离蛋白在经过不同温度的加热预处理后消化1 h,λmax分布在345.17~348.67 nm范围内,大豆分离蛋白消化产物的λmax即随着加热温度的上升,不断增长红移,在加热90℃时达到最大值后开始下降,而荧光强度随着加热时间的延长而呈现出先上升后下降的变化趋势。
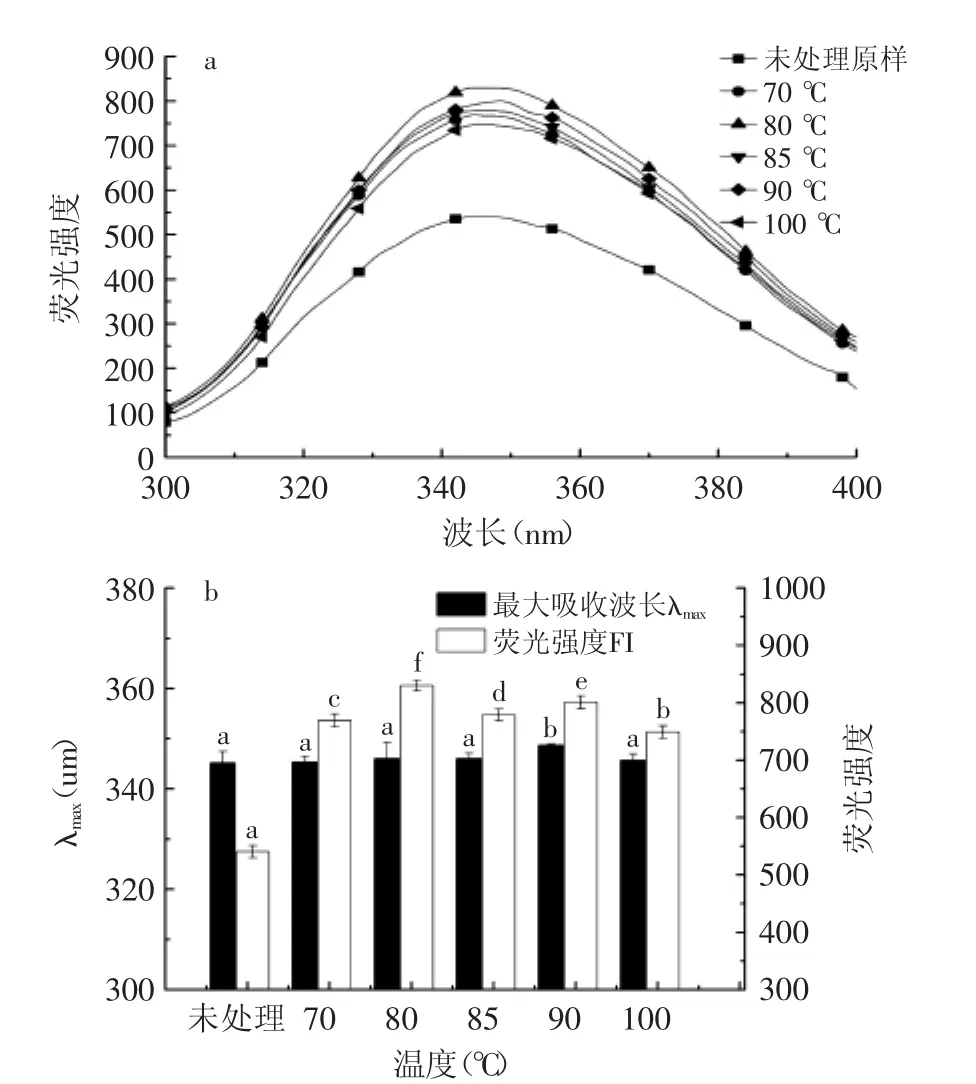
图3 热处理温度对体外模拟消化过程中大豆分离蛋白荧光光谱的影响Fig.3 Effect of heat treatment temperature on Fluorescence spectrum of soy protein isolate in vitro digestion
当蛋白分子内部的发色基团暴露时,λmax会发生红移而增大;当蛋白分子发生聚集,结构趋向紧密时,发色基团被包埋在分子内部,λmax发生蓝移而变小[20]。通过实验结果得知,大豆分离蛋白在经过不同温度的加热预处理后,消化1 h,大豆分离蛋白的荧光光谱形状几乎无变化(如图3所示),而其λmax及荧光强度有改变。这可能是因为随着加热温度的不断增加,7S球蛋白及11S球蛋白变性。100℃热处理后,11S球蛋白完全变性,在反应开始时,胃蛋白酶作用于球蛋白(11S)时,而胃蛋白酶对β-伴大豆球蛋白(7S)的作用较弱。在经过80℃加热处理,β-伴大豆球蛋白(7S)已完全变性,酶作用位点又暴露出,有利于蛋白酶的结合,发色基团的暴露程度增大,λmax增长红移,而在90~100℃持续加热时,有研究指出当大豆11S球蛋白在100℃下热处理时,大部分球蛋白分子快速形成可溶性聚集体[21],导致部分蛋白质底物不易于与酶结合,蛋白质的消化程度降低,发色集团的暴露程度降低,导致λmax下降。而荧光强度的变化受λmax红移的影响,分析原因与蛋白质疏水性集团的暴露有关。低温加热预处理对大豆蛋白的消化有一定的促进作用,疏水性集团的暴露程度增加,而在温度85~100℃加热处理后,蛋白质的变性程度加剧,暴露出来的分子内部的酶作用位点有部分又被包埋,消化程度有所降低,疏水性集团的暴露程度降低,且色氨酸残基趋近于“包埋态”,荧光强度有所降低,并逐渐呈下降趋势[22]。Yang等[23]研究指出,蛋白质的荧光猝灭与分子内芳香族氨基酸残基附近的环境变化密切相关。色氨酸残基荧光强度的变化暗示着由于空间结构变化,分子间疏水作用和由二硫键连接的聚集体增加,蛋白分子相互作用导致荧光猝灭[24],致使荧光强度下降。
2.3 不同加热时间的预处理对大豆蛋白体外模拟消化的特点及特性的影响
荧光光谱可以有效地用于测试蛋白质微环境体系的变化,在大豆蛋白中,两种芳香族氨基酸会表现出荧光性,即酪氨酸和色氨酸[25]。因此大豆分离蛋白的荧光峰实际上是色氨酸残基的荧光峰,其峰位在325~350 nm波长之间。

图4 热处理时间对体外模拟消化过程中大豆分离蛋白荧光光谱的影响Fig.4 Effect of heat treatment time on fluorescence spectrum of soy protein isolate in vitro digestion
图4所示为使用内源荧光扫描测定大豆蛋白经在不同的时间85℃加热预处理后,消化1 h所得产物的荧光光谱及最大吸收波长图谱。从图4可以看出,大豆分离蛋白在经过60 min的加热预处理后消化1 h,λmax分布在345.16~346.67 nm范围内,大豆分离蛋白消化产物的λmax经历了先上升后下降的过程,即随着加热时间的延长,λmax不断增长红移,而在加热处理20 min时,λmax出现了最小值,短暂的缩短蓝移后继续增长红移。而荧光强度随着加热时间的延长,呈现出不同的变化趋势,先升高,在20 min时达到最大值,继续加热,荧光强度呈下降趋势。
这可能是由于反应开始时,蛋白质的热变性导致酶作用位点暴露出,蛋白质的消化程度程度增大,蛋白分子内部的色氨酸、酪氨酸等发色基团暴露时,最大吸收波长λmax会发生红移而增大[22]。当蛋白分子发生聚集,结构趋向紧密导致蛋白质消化程度降低,发色基团部分被包埋在分子内部,最大吸收波长λmax会发生蓝移而变小。而在20 min左右蛋白质的消化产物的λmax及荧光强度出现了极端变化点,继续加热,发色集团在暴露的同时也伴随着聚集的包埋,在这个动态变化过程中,加热预处理60 min的大豆分离蛋白样品的λmax有所缩短,但相对未处理原样要高些,且呈下降趋势。长时间加热使得蛋白质发生过度热变性,结构的遭到破坏,加热产生的大量聚集体,导致暴露出分子内部的酶作用位点有部分又被包埋,消化程度有所减低,疏水性集团的暴露程度降低但相对未处理原样要高些,色氨酸残基趋近于“暴露态”的数量减少[22],荧光强度有所降低,并逐渐呈下降趋势,色氨酸残基荧光强度的变化暗示着由于空间结构变化。
3 结论
不同时间热处理及不同温度的热处理均对大豆蛋白的消化有一定促进作用,从消化效果即DH曲线来看,可以得出大豆蛋白的最佳热处理温度是85℃,在此温度保温20 min后再进行体外模拟消化,大豆蛋白的DH最高,消化程度及效果最好。
大豆分离蛋白在经过不同的加热温度预处理后,消化1 h,大豆分离蛋白的荧光光谱形状几乎无变化,而其λmax及荧光强度有改变。大豆分离蛋白在经过不同温度的加热预处理后消化1 h,λmax分布在345.17~348.67 nm范围内;大豆分离蛋白消化产物的λmax即随着加热温度的上升,不断增长红移;在加热90℃时达到最大值后开始下降。而荧光强度随着加热时间的延长而呈现出先上升后下降的变化趋势。
大豆分离蛋白在经过不同时间的加热预处理后,消化1 h,大豆分离蛋白消化产物的λmax呈现先上升后下降的趋势,即随着加热时间的延长,λmax不断增长红移,而在加热处理20 min时,λmax出现了最小值,短暂的缩短蓝移后继续增长红移。而荧光强度随着加热时间的延长而呈现出不同的变化趋势,0~20 min内不断增加,在20 min时达到最大值,继续加热至60 min,荧光强度呈下降趋势。
[1]程极济.光生物物理学[M].北京:高等教育出版社,1987:10-20.
[2]陈国珍.荧光分析法[M].北京:科学出版社,1990:36-40.
[3]尹燕霞,向本琼,佟丽.荧光光谱法在蛋白质研究中的应用[J].实验技术与管理,2010,27(2):33-36.
[4]钟葵,胡小松,吴继红,等.高压脉冲电场对脂肪氧化酶二级和三级构象的影响效果[J].光谱学与光谱分析,2009,29 (3):765-768.
[5]Petruccelli S,Anon M C.Thermal aggregation of soy protein isolates[J].Journal of Agricultural and Food Chemistry,1995,43 (12):3035-3041.
[6]Mills E N,Marigheto N A,Wellner N,et al.Thermally induced structural changes in glycinin,the 11S globulin of soya bean (Glycine max)-an in situ spectroscopic study[J].Biochim Biophys Acta,2003,1648(1-2):105-114.
[7]Damodaran S,Kinsella J E.Effect of conglycinin on the thermal aggregation of glycinin[J].Journal of Agricultural and FoodChemistry,1982,30(5):812-817.
[8]Sorgentini D A,Wagner J R,Anon M C.Effects of thermal treatment of soy protein isolate on the characteristics and structure-function relationship of soluble and insoluble fractions [J].Journal of Agricultural and Food Chemistry,1995,43(9):2471-2479.
[9]吴加根.谷物与大豆食品工艺学[M].北京:中国轻工业出版社,1996:420-422.
[10]李里特,王海.功能性大豆食品[M].北京:中国轻工业出版社,2002:36-38.
[11]Lee J-Y,Lee HD,Lee C-H.Characterization of hydrolysates produced by mild-acid treatment and enzymatic hydrolysis of defatted soybean flour[J].Food research international,2001,34 (2):217-222.
[12]崔继科,刘景顺.大豆分离蛋白酶解的研究(一)[J].郑州粮食学院学报,1998,19(3):12-22.
[13]Petruccelli S,Añón M.Relationship between the method of obtention and the structural and functional properties of soy proteins isolates.1.Structural and hydration properties[J].Journal of Agricultural and Food Chemistry,1994,42(10):2161-2169.
[14]Jim Nez-Escrig A,Alaiz M,Vioque J,et al.Health-promoting activities of ultra-filtered okara protein hydrolysates released by in vitro gastrointestinal digestion:identification of active peptide from soybean lipoxygenase[J].European Food Research and Technology,2010,230:655-663.
[15]Adler-Nissen J.Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid[J].Journal of Agricultural and Food Chemistry,1979,27(6):1256-1262.
[16]源博恩.亚基解离与重聚集对大豆蛋白结构和功能特性的影响[D].广州:华南理工大学,2012.
[17]Kalapathy U,Hettiarachchy N S,Rhee K C.Effect of drying methods on molecular properties and functionalities of disulfide bond-cleaved soy proteins[J].J Am Oil Chem Soc,1997,74(3):195-199.
[18]刘清亮,吴双顶,余华明,等.皖南尖吻蝮蛇毒糖甙水解酶(NADase)的荧光光谱研究[J].无机化学学报,1998,14(1):53-57.
[19]Vivian J T,Callis P R.Mechanisms of tryptophan fluorescence shifts in proteins[J].Biophysical journal,2001,80(5):2093-2109.
[20]Pallarès I,Vendrell J,Avilés FX,et al.Amyloid fibril formation by a partially structured intermediate state of α-chymotrypsin[J].Journal of molecular biology,2004,342(1):321-31.
[21]Tezuka M,Yagasaki K,Ono T.Changes in characters of soybean glycinin groups I,IIa,and IIb caused by heating[J].Journal of agricultural and food chemistry,2004,52(6):1693-1699.
[22]Ferrer EG,Gómez AV,Añón MC,et al.Structural changes in gluten protein structure after addition of emulsifier.A Raman spectroscopy study[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2011,79(1):278-81.
[23]Yang J H,Yang E S,Park J W.Inactivation of NADP+-dependent isocitrate dehydrogenase by lipid peroxidation products [J].Free Radical Research,2004,38(3):241-249.
[24]Lord R C,Yu N T.Laser-excited Raman spectroscopy of biomolecules I native lysozyme and its constituent amino acids [J].Int J Biochem Cell B,1998,50(2):509-524.
[25]Kalapathy U,Hettiarachchy N,Rhee K.Effect of drying methods on molecular properties and functionalities of disulfide bond-cleaved soy proteins[J].Journal of the American Oil Chemists'Society,1997,74(3):195-199.
Fluorescence spectra analysis of soybean protein in vitro under heat treatment
WANG Rui1,LI Yang1,WANG Zhong-jiang1,SUI Xiao-nan1,QI Bao-kun1,HAN Fei-fei1,BI Shuang1,JIANG Lian-zhou1,2,*
(1.Food College,Northeast Agricultural University,Harbin 150030,China;2.National Soybean Engineering Technology Research Center,Harbin 150030,China)
The characters of fluorescence spectra of soy protein isolate(SPI)solution in vitro of different heat treatment temperature and different heat treatment time.The results showed that heat treatment had a certain effect on the digestion of soybean protein at different heat treatment temperature and different heat treatment time.The best heat treatment condition of soybean protein was 85℃,20 min,which was the best degree and effectiveness of the vitro digestion.The soy protein isolate was heat-treated at different temperatures,digested 1 h.With the rise of heating temperature,digested products of λmaxincreasing redshift,then it started to decrease when the maximum value was reached at 90℃.And the fluorescence intensity increased with the heating time,and showed a trend of decline after the first rise.The in vitro simulated digestion of soybean protein isolate 1 h at different heating time,the isolated soy protein digested products of λmaxexperienced a process,which was first increased,then decreased.And the fluorescence intensity with the increase of heating time and showed different trends.Growing within 0~20 min,reaching maximum at 20 min,continuing to heat up to 60 min,the fluorescence intensity decreased.
soybean protein isolated;fluorescence spectrum;heat treatment;in vitro digestion
TS214.2
A
1002-0306(2016)06-0128-05
10.13386/j.issn1002-0306.2016.06.017
2015-07-06
王瑞(1990-),女,硕士研究生,研究方向:粮食、油脂及植物蛋白工程,E-mail:wrname@163.com。
江连洲(1960-),男,博士,教授,研究方向:粮食、油脂及植物蛋白工程,E-mail:jlzname@yeah.net。
黑龙江省自然科学基金项目重点项目(ZD201302);黑龙江博士后科研启动金(LBH-Q13018);黑龙江省青年科学基金(QC2013C014);黑龙江省教育厅科学技术研究项目面上项目(12531049)。
