硫酸头孢喹肟乳房注入剂中有关物质的检测方法
2016-09-16刘茂林刘义明张道康黄慧丽李秀波
刘茂林,刘义明,徐 飞,张道康,黄慧丽,李 浛,李秀波
(1中国农业科学院饲料研究所/国家饲料药物基准实验室,北京 100081;2北京市兽医药品监察所,北京 100107)
硫酸头孢喹肟乳房注入剂中有关物质的检测方法
刘茂林1,刘义明1,徐 飞1,张道康1,黄慧丽1,李 浛2,李秀波1
(1中国农业科学院饲料研究所/国家饲料药物基准实验室,北京 100081;2北京市兽医药品监察所,北京 100107)
【目的】参考硫酸头孢喹肟注射液兽药质量标准,建立了硫酸头孢喹肟乳房注入剂有关物质的检测方法,建立专属性强、灵敏度高、快速简便的方法,可有效的分析硫酸头孢喹肟乳房注入剂的有关物质,为制剂的质量控制和工艺优化提供依据。【方法】仪器方法按照硫酸头孢喹肟注射液兽药质量标准要求,色谱条件:流动相为高氯酸钠缓冲溶液(精密称取NaClO4·H2O 3.45g于1 000 mL水溶解,加入磷酸12 mL,乙腈115 mL,三乙胺调pH3.6),流速为1 mL·min-1,检测波长为270 nm,进样量为20 µL。采用高效液相色谱法(HPLC)峰面积归一化法计算硫酸头孢喹肟乳房注入剂(干乳期)中有关物质的检测限及其浓度;考察该检查方法精密度及仪器精密度;考察样品主成分及有关物质的稳定性及线性相关性;对样品以适当条件的破坏后对该方法进行专属性考察,例如使用0.2 mol·L-1HCl溶液、0.2 mol·L-1NaOH溶液对硫酸头孢喹肟乳房注入剂进行4 h的破坏;使用10% H2O2溶液对硫酸头孢喹肟乳房注入剂进行30 min的破坏;以及90℃高温对硫酸头孢喹肟乳房注入剂进行1 h的破坏。对比样品破坏前后主成分峰面积的降解程度,有关物质含量的变化程度,主成分峰与杂峰之间及有关物质峰与杂质峰之间的分离度,以及杂质峰个数的变化等主要参数。并对硫酸头孢喹肟乳房注入剂(干乳期)三批样品中的有关物质含量进行测定。【结果】硫酸头孢喹肟乳房注入剂经过一系列的梯度稀释后,当样品主成分浓度为7.5 µg·mL-1时,有关物质的信噪比≥3,按HPLC峰面积归一化法计算,有关物质浓度为0.05 µg·mL-1;100 µg·mL-1浓度样品进样精密度RSD达到0.8%,方法精密度RSD达到0.6%;主成分在7.5—300 µg·mL-1浓度范围内,按HPLC峰面积归一化法计算,有关物质浓度范围为0.05—2 µg·mL-1,有关物质浓度对峰面积线性回归分析方程为y = 45935x-130.03,相关系数r=1。硫酸头孢喹肟乳房注入剂在一定时间内在强酸、强碱、氧化、高温破坏条件下均有降解,以破坏前样品主成分含量为100%计,使用10% H2O2溶液对制剂进行30 min的氧化破坏后主成分含量降解达30%左右,在90℃高温下对制剂进行1 h的高温破坏后主成分含量降解达20%左右,使用0.2 mol·L-1HCl溶液和0.2 mol·L-1NaOH溶液对制剂进行4 h的酸、碱破坏后主成分含量降解均在10%左右。破坏前后主成分峰与有关物质峰的保留时间均未发生变化,主峰与杂峰以及杂峰与杂峰之间分离度均大于 1.5,杂质峰含量发生变化,杂质数量破坏后均有增加。对硫酸头孢喹肟乳房注入剂(干乳期)三批制剂有关物质含量进行检测后,按HPLC面积归一化法计算显示有关物质峰面积均未超过主峰峰面积的 2%,符合兽药质量标准的规定。【结论】硫酸头孢喹肟乳房注入剂有关物质检测方法简便易行,专属性强,灵敏度好,精密度高,可应用于硫酸头孢喹肟乳房注入剂有关物质的考察。
硫酸头孢喹肟乳房注入剂;有关物质;HPLC法
0 引言
【研究意义】国家饲料药物基准实验室自主研发了硫酸头孢喹肟乳房注入剂(干乳期),主要应用于干乳期奶牛乳房炎的预防和治疗,并已获得国家新兽药证书(2015新兽药证字-62号)。在硫酸头孢喹肟注射液兽药质量标准基础上,建立了硫酸头孢喹肟乳房注入剂有关物质的检查方法,该方法灵敏度高,专属性强,可用于硫酸头孢喹肟乳房注入剂中有关物质的检测。【前人研究进展】 头孢喹肟(cefquinome),是20世纪80年代由德国赫斯特公司(Hoechst AG)研发的第一个动物专用第四代头孢菌素类抗生素,商品名为克百特(Cobactan)[1],具有广谱抗菌、生物效价高、适于非肠道给药、低毒低残留、对β-内酰胺酶高度稳定等优势[2-3],目前已经被欧盟兽用药品委员会(CVMP)批准用于预防和治疗由敏感菌引起的家畜呼吸道感染、奶牛乳腺炎和子宫内膜炎[4]。头孢喹肟分子式为C23H24N6O5S2,化学名为(6R-7R)-7-[ (2-氨基-4一噻唑基)-2-(甲氧亚氨基)乙酰氨基]-3-[(5,6,7,8-四氢喹啉甲基)甲氧]-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-甲酸,分子量为528.60。头孢喹肟的合成路线主要有 3种[5-9],均由5,6,7,8-四氢喹啉,又名2,3-环己基吡啶(2, 3 - cyclohexyl pyridine)合成而来。5,6,7,8-四氢喹啉既是头孢喹肟的合成前体,也可以在特殊作用力下由头孢喹肟裂解而来。药物中的杂质是指存在于药物中,但化学结构与药物不一样的任何一种成分,其中与药物结构类似或具渊源的杂质又称为有关物质[10-11]。杂质的活性药物成分可能对药物产品的质量和靶动物的安全性产生较大的影响[12-13]。因此进行药物或制剂中有关物质的测定,对于提高化学的合成过程和优化药物制剂工艺,减少甚至消除此类杂质是至关重要的[14]。硫酸头孢喹肟注射液质量标准中规定,5,6,7,8-四氢喹啉为硫酸头孢喹肟的单个有关物质。四氢喹啉衍生物如1,2,3,4-四氢喹啉或者其他衍生物均匀良好的抗癌、抗抑郁活性[15-16],而单体5,6,7,8-四氢喹啉的化学性质和药理学性质却没有相关研究报道。近年来,随着色谱、光谱技术的迅速发展,越来越多的联用技术被运用于药物质量控制,通常药品中有关物质含量相对较低[17],高效液相色谱法(HPLC)具备检测限较低、灵敏度较高的优势,在有关物质结构已知的情况下被广泛用于开发高效分离,简便可靠的杂质测定方法[18]。MUSTAKHUSEN等[19]在确证 U-高尿酸血症治疗药的有关物质结构时,使用了LC-MS/MS、NMR以及IR技术,推测了其有关物质的生成路径。SATYANARAYANA等[20]在鉴别度他雄胺原料中杂质的结构时,也采用了HPLC、IR、NMR、MS技术。ALIREZA 等[21]利用X-粉末衍射(PXRD)、差示扫描热法(DSC)考察了阿莫西林原料药的纯度,并使用HPLC法对原料药的有关物质进行验证。【本研究切入点】目前硫酸头孢喹肟上市的产品主要有国外的英特威国际有限公司的硫酸头孢喹肟注射液((2011)外兽药证字20号),国内批准产品剂型也以注射剂或粉剂为主,而且目前国内外对硫酸头孢喹肟乳房注入剂有关物质的研究尚不深入。【拟解决的关键问题】研究有关物质检查方法的专属性,即通过给予研究对象极端或剧烈的条件,观察新生成的杂质来考察其降解产物,这也是目前有关物质研究工作的重点[22-24]。本试验着重开展了硫酸头孢喹肟乳房注入剂有关物质检查方法的专属性研究,既在一定破坏条件下,使药物主成分降解控制在 10%—30%以内[10,25],同时考察有关物质的含量、分离度、杂质数量变化等重要参数。
1 材料与方法
试验于2014年11月1日在中国农业科学院饲料研究所国家饲料药物基准实验室开展。
1.1仪器
高效液相色谱仪,Waters e2695 (UV2998);分析天平,Sartorius CPA225D;离心机,Thermo Fisher;超声仪,KQ-300DE;酸度计,Sartorius PB-21。
1.2试剂
头孢喹肟标准品(中国兽医药品监察所,批号:K0312406,含量82.6%);硫酸头孢喹肟乳房注入剂(干乳期)(中国农业科学院饲料研究所,批号:20141104,20141105,20141106);高氯酸钠、磷酸均为分析纯;乙腈为色谱纯,水为超纯水。
1.3色谱条件及样品处理方法
色谱条件参考硫酸头孢喹肟注射液质量标准[26],流动相为高氯酸钠缓冲液(精密称取 3.45 g溶于1 000 mL水中,加乙腈115 mL和磷酸12 mL,三乙胺调pH=3.6);流速为1 mL·min-1;检测波长为270 nm;柱温为30℃;进样量为20 μL。本试验采用的色谱柱为Waters Sunfire C18150 mm×4.6 mm 5 μm。
硫酸头孢喹肟乳房注入剂处理方法:精密称取硫酸头孢喹肟乳房注入剂(干乳期)适量(约相当于头孢喹肟12.5 mg)置50 mL离心管中,加流动相25 mL溶解,涡旋2 min,水浴超声20 min,4 000 r/min离心5 min,取下层溶液20 μL,过0.45 μm滤膜,注入液相色谱仪,记录色谱图至主成分保留时间的2倍。
1.4检测限考察
称取一定量的硫酸头孢喹肟标准品,甲醇溶解,流动相稀释成一系列浓度的标准工作溶液,按1.3项下的色谱条件采用HPLC峰面积归一化法计算硫酸头孢喹肟乳房注入剂有关物质的检测限及其浓度,以s/n ≥3的最小样品浓度为最低检测限。
1.5精密度考察
1.5.1进样精密度 精密称取批号为20141104的硫酸头孢喹肟乳房注入剂(干乳期)适量,用流动相溶解成浓度为100 µg·mL-1的溶液,按1.3项下色谱条件和样品处理后重复进样5针,以头孢喹肟峰面积计算RSD。
1.5.2方法精密度 精密称取5份批号为20141104的硫酸头孢喹肟乳房注入剂(干乳期)适量,用流动相溶解成浓度为100 µg·mL-1的溶液,按1.3项下色谱条件和样品处理后测定,并以头孢喹肟峰面积计算RSD。
1.6稳定性考察
精密称取批号为 20141104的硫酸头孢喹肟乳房注入剂(干乳期)适量,用流动相溶解成浓度为 100 µg·mL-1的溶液,按1.3项下色谱条件和样品处理后分别在室温下于0、0.5、1、2、3 h时进样,测定主成分及杂质峰面积。
1.7线性考察
精密称取头孢喹肟标准品适量,流动相溶解并稀释成300、200、100、30、7.5 µg·mL-1系列浓度的溶液,取20 µL进样,测定有关物质峰及头孢喹肟峰面积,以头孢喹肟及有关物质浓度对各自峰面积分别进行线性回归分析。
1.8专属性考察
1.8.1样品前处理 精密称取2 g样品置于50 mL离心管中,加入50 mL流动相后涡旋2 min,水浴超声20 min,4 000 r/min离心5 min。
1.8.2破坏前样品处理 精密量取下清液1 mL,加流动相1 mL,涡旋2 min后过0.2 μm滤膜,取20 µL进样,记录色谱图(图1-a)。
1.8.3酸破坏样品处理 精密量取下清液5 mL,于10 mL离心管中,加入0.2 mol·L-1HCl 2 mL,振荡摇匀,置50℃水浴振荡4 h后,自然冷却,加入0.2 mol·L-1NaOH 2 mL中和,再加入1 mL流动相后涡旋1 min,过0.2 μm滤膜,取20 µL进样,记录色谱图(图1-b)。
1.8.4碱破坏样品处理 精密量取下清液5 mL,于10 mL离心管中,加入0.2 mol·L-1NaOH 2 mL,振荡摇匀,室温下振荡4 h后,加入0.2 mol·L-1HCl 2 mL中和,再加入1 mL流动相后涡旋1 min,过0.2 μm滤膜,取20 µL进样,记录色谱图(图1-c)。
1.8.5高温破坏样品处理 精密量取下清液5 mL,于10 mL离心管中,置90℃烘箱内1 h后取出,自然冷却,加入流动相5 mL后涡旋1 min,过0.2 μm滤膜,取20 µL进样,记录色谱图(图1-d)。
1.8.6氧化破坏样品处理 精密量取下清液5 mL,于10 mL离心管中,加入10% H2O22 mL,振荡摇匀,置50℃水浴振荡30 min后,自然冷却,加入流动相3 mL后涡旋1 min,过0.2 μm滤膜,取20 µL进样,记录色谱图(图1-e)。
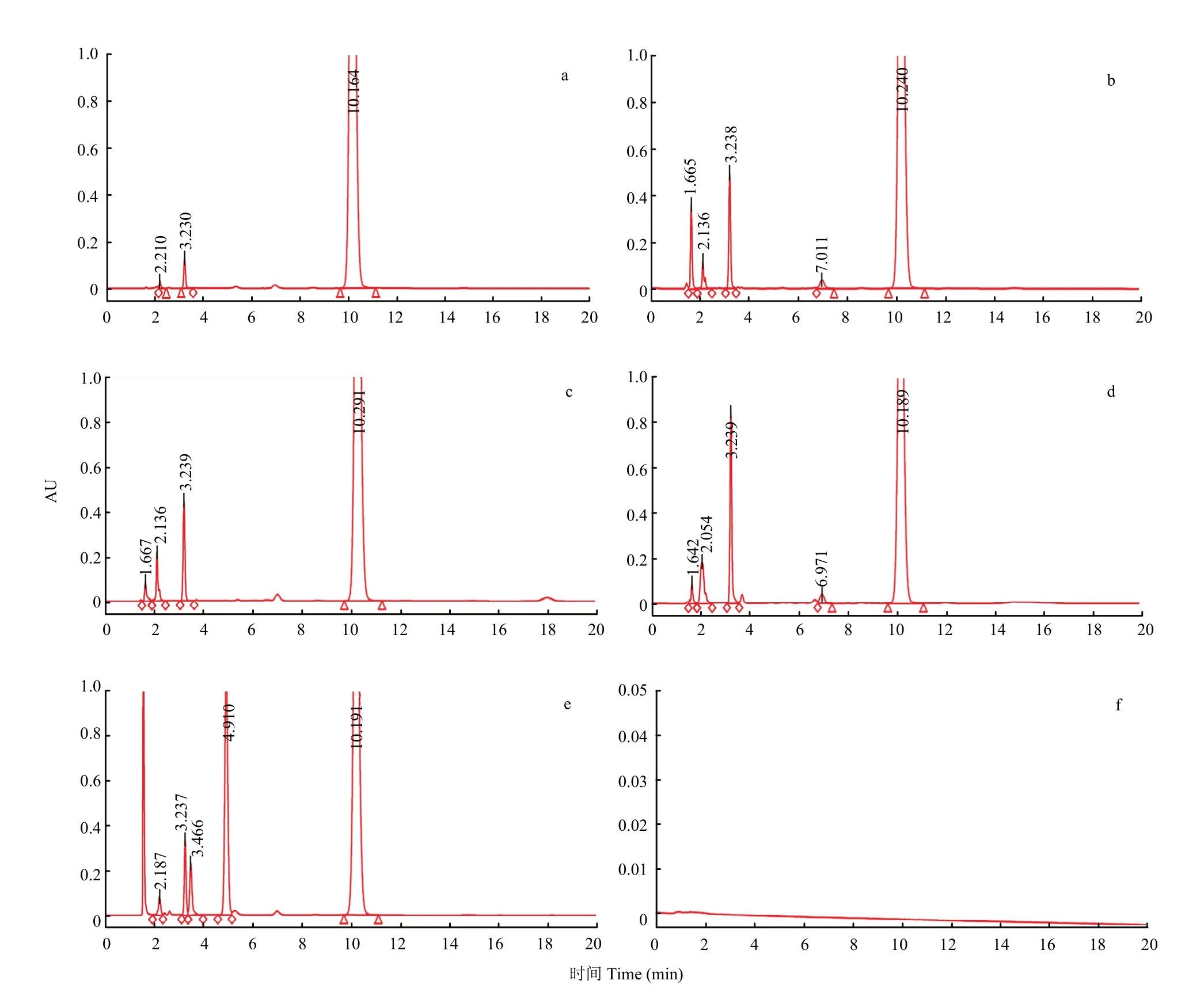
图1 样品破坏前后色谱图Fig. 1 The HPLC chromatograms of samples before and after destruction
2 结果
2.1检测限确定
由数据表1可知,样品经一系列稀释后,当主成分浓度为7.5 µg·mL-1时,有关物质的信噪比为3,经过面积归一化法计算,有关物质的浓度为 0.05 µg·mL-1,因此本方法中硫酸头孢喹肟乳房注入剂有关物质的检测限约为0.05 µg·mL-1,色谱图如图2。
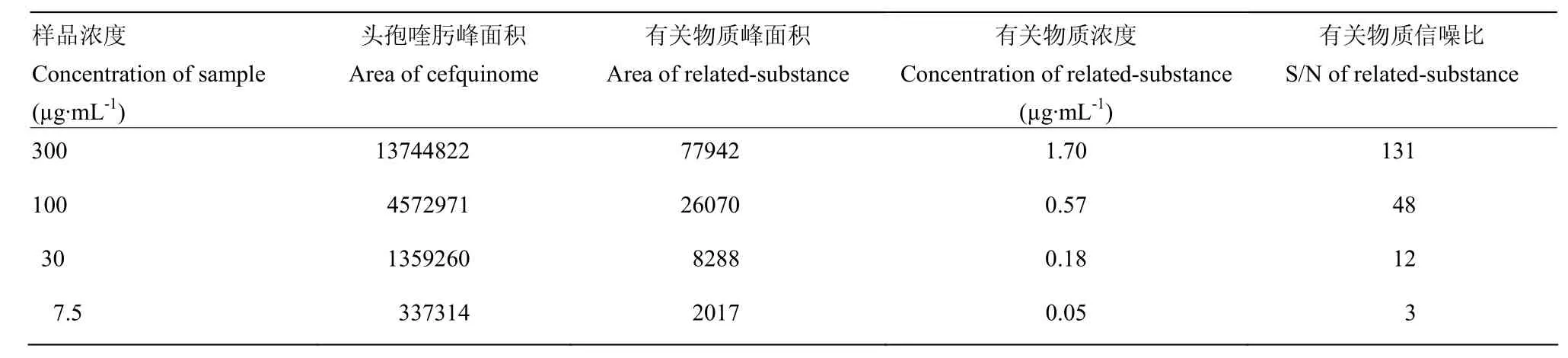
表1 检测限试验Table 1 Results of LOD tests
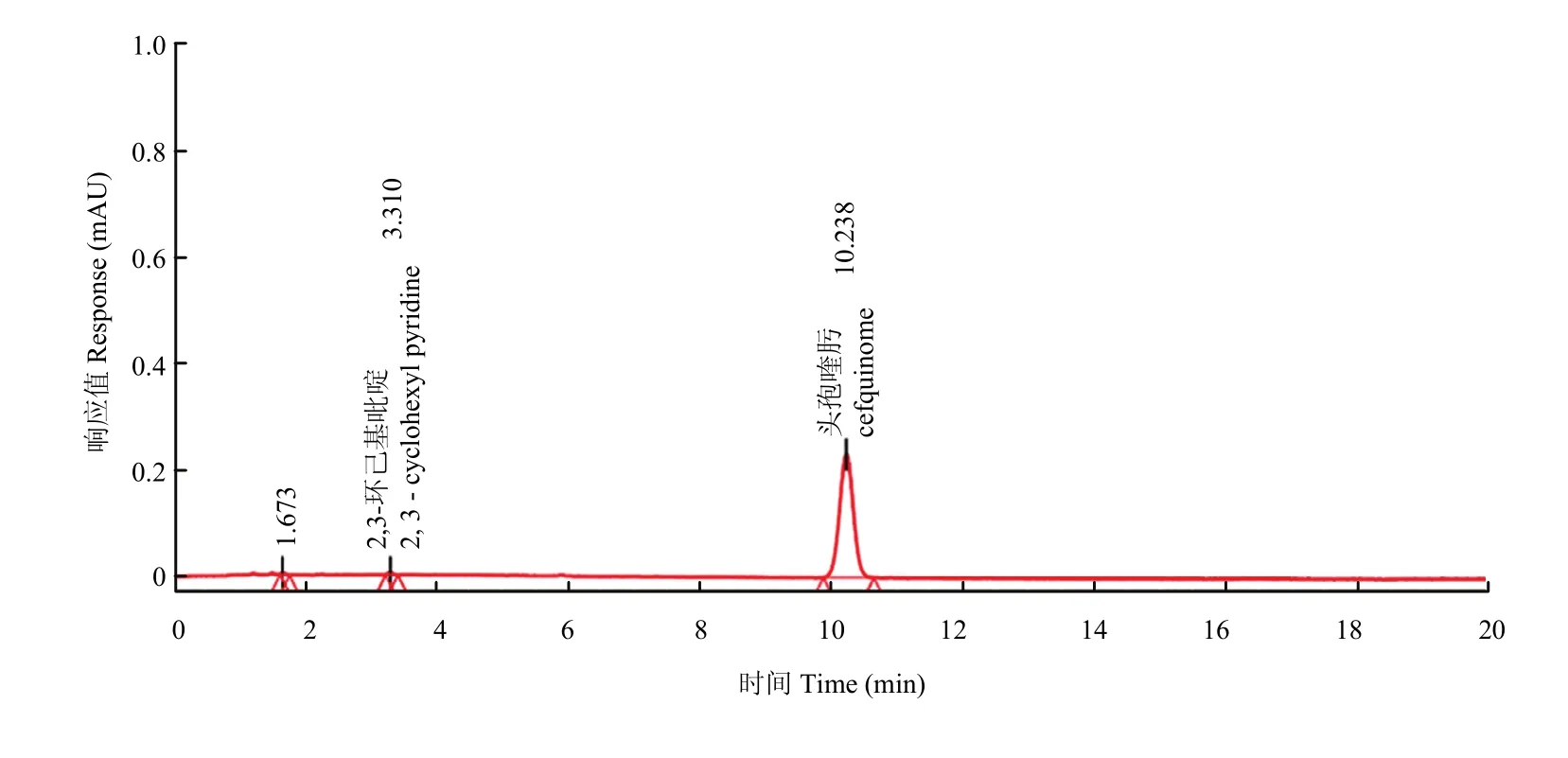
图2 检测限色谱图Fig. 2 The HPLC chromatograms of LOD
2.2精密度试验
按1.5项下样品处理方法处理的样品按1.3项下色谱条件分析,同一样品重复进样5次,以主峰峰面积计算,RSD=0.8%;同一批样品平行处理 5个样品,以主峰峰面积计算,RSD=0.6%。
2.3稳定性试验
由数据表2可知,随着放置时间的加长,杂质含量明显增加,放置2 h的样品测定其有关物质已经超过兽药质量标准规范规定的最高含量(2.0%)[26],因此样品配制后应该立即检测。
2.4线性考察
2.4.1头孢喹肟浓度对峰面积进行线性回归分析,回归方程为y = 45852x - 11520,相关系数r=1。表明头孢喹肟在7.5—300 µg·mL-1浓度范围内,线性相关性良好(图3)。
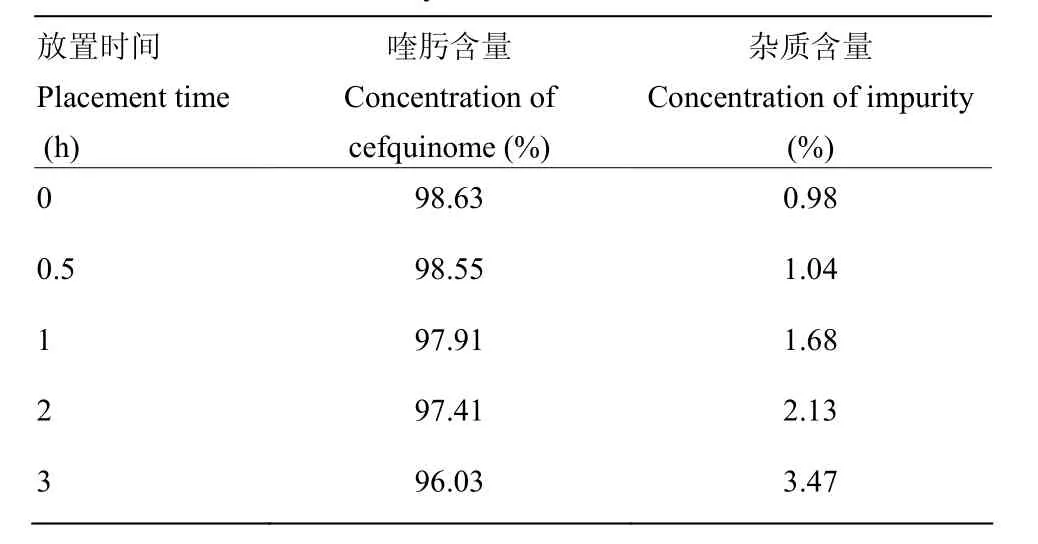
表2 稳定性试验Tab 2 Results of stability tests
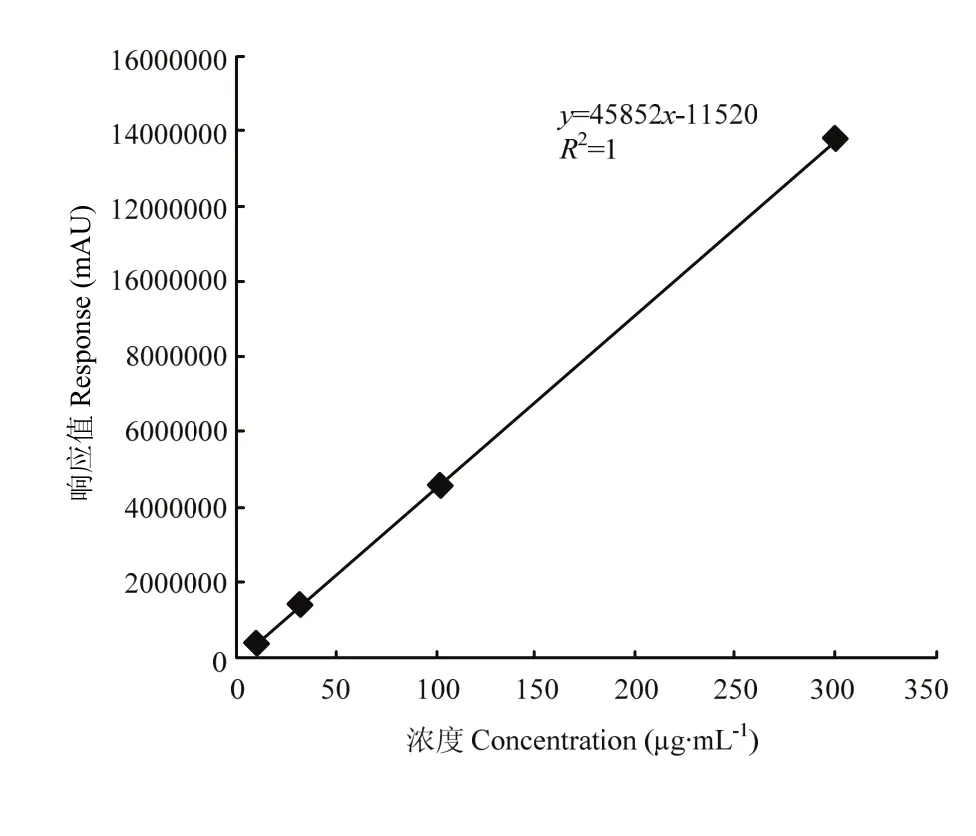
图3 头孢喹肟标准曲线图Fig. 3 The standard curve figure of Cef
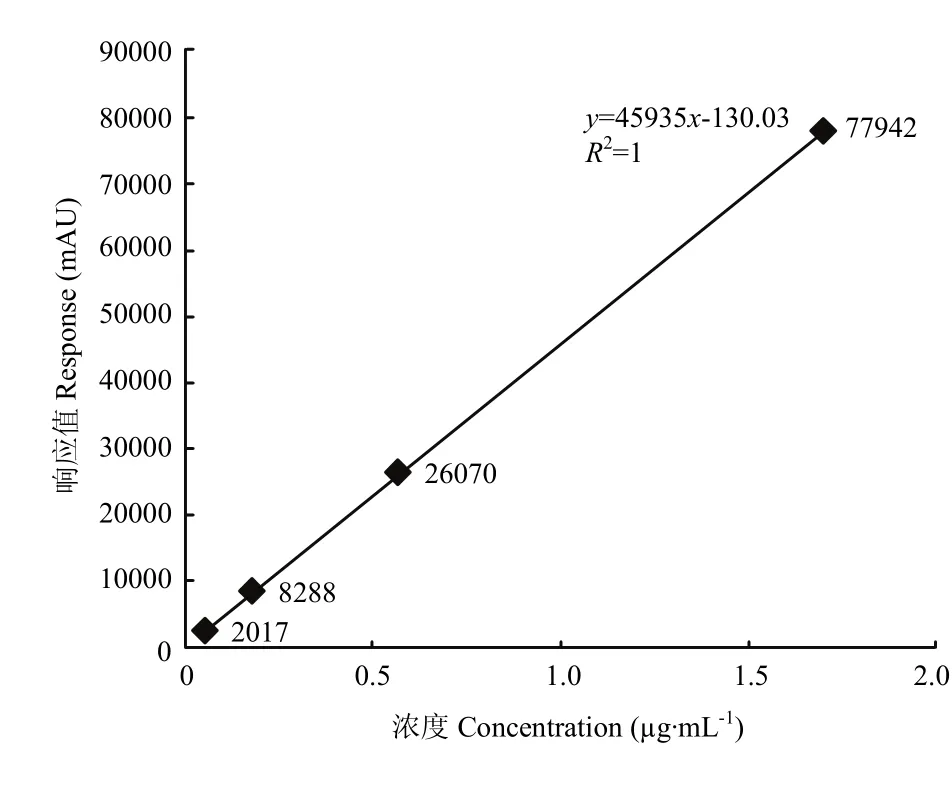
图4 有关物质标准曲线图Fig. 4 The standard curve figure of related-substances
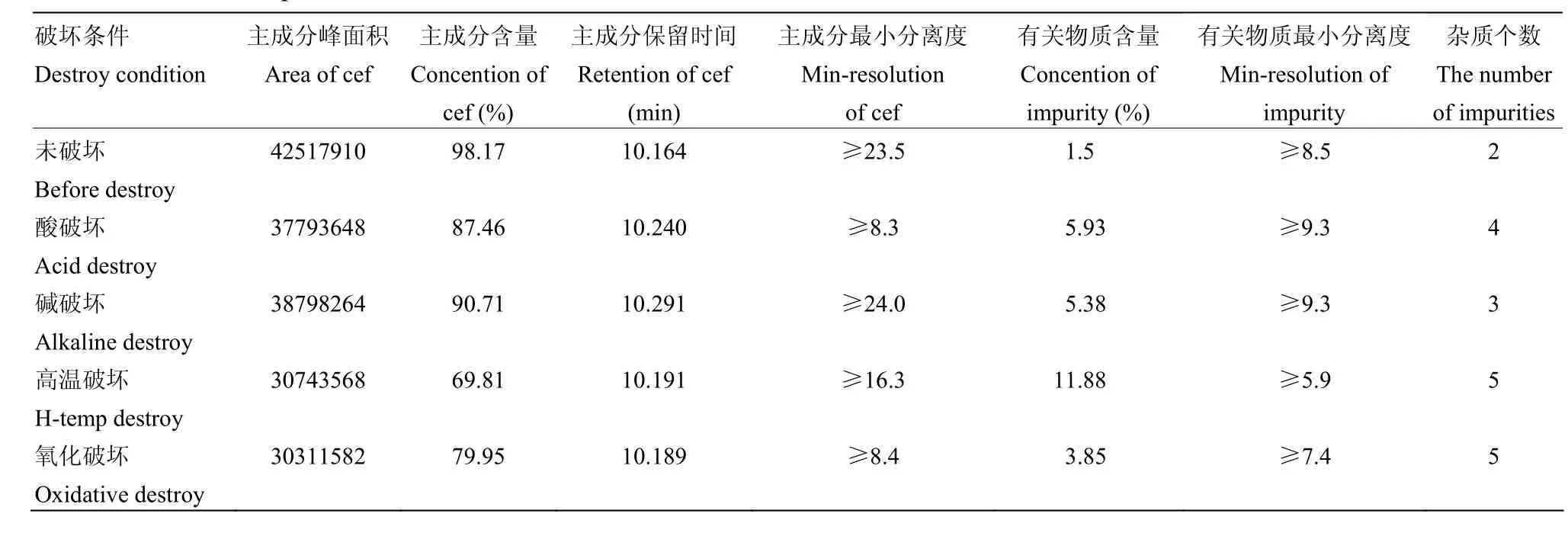
表3 专属性试验Table 3 Results of specific tests
2.4.2经过主成分对照计算,有关物质的浓度范围为0.05—2 µg·mL-1,在此范围内有关物质浓度对峰面积进行线性回归分析,回归方程为y = 45935x-130.03,相关系数r=1,线性相关性良好(图4)。
2.5专属性考察结果
头孢喹肟在强酸、强碱、氧化、高温条件下均有降解,以破坏前样品主成分含量为 100%,氧化破坏主成分降解达30%,高温破坏主成分降解达20%,酸、碱破坏主成分降解在10%左右,破坏前后主成分峰保留时间一致,各峰之间分离度良好。
杂质峰与杂质峰之间分离度达到1.2即可,而被测物与相邻杂质峰的分离度必须大于 1.5[27]。表 3数据中显示,有关物质与其他杂质分离良好。本试验中,在一定时间内硫酸头孢喹肟乳房注入剂在各种破坏条件下样品杂质数量发生变化,有关物质含量均有增加,但有关物质相对保留时间基本不变。在破坏性试验中,有关物质含量明显增加且无其他干扰,表明拟定的色谱条件具有较强的专属性,可应用于头孢喹肟乳房注入剂有关物质检查。
2.6制剂中有关物质测定
按1.3项下的色谱条件及样品处理后,对硫酸头孢喹肟乳房注入剂(干乳期)3批制剂中的有关物质进行测定,结果如下(表4)。
由表4可知,按面积归一法计算,3批制剂中有关物质均未超过主峰面积的2.0%,符合兽药质量标准的规定。笔者使用了3根不同品牌的C18色谱柱,均按上述色谱条件进行硫酸头孢喹肟乳房注入剂中有关物质含量的考察。结果发现除头孢喹肟及有关物质保留时间有一定差异外,杂质个数及含量均无变化。经过调整柱温或者适当调整流动相比例以后,保留时间有所变化,但均未影响含量大小,说明本方法耐用性较好。
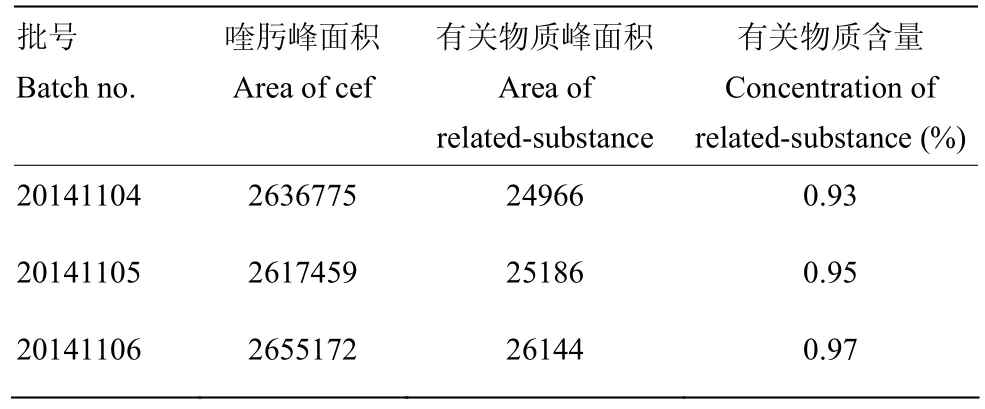
表4 有关物质测定结果Table 4 Results of the determination of the related substances
3 讨论
本试验针对硫酸头孢喹肟乳房注入剂有关物质的方法研究,主要参考了邓晶晶[28]及樊后民等[29]使用高效液相色谱法分别测定头孢美唑钠及头孢噻吩钠中的有关物质。邓晶晶除了考察头孢美唑钠的检测限、精密度、线性相关性等之外,同时进行了酸、碱、氧化、高温以及高湿条件下的破坏,发现该药耐酸,在其他条件下破坏主成分后,产生唯一的一种有关物质,即TMT(1-甲基-1H-四唑-5-硫醇)。在各种破坏条件下,TMT保留时间不变,含量均发生了变化。樊后民同样对头孢噻吩钠进行了酸、碱、氧化、高温4种条件的破坏,破坏后发现该药在各种破坏条件下主成分均有降解,且各种破坏条件下杂质数量发生明显变化,有关物质含量明显增加。这两种方法均有较强的专属性,破坏条件简单快速,但均未明确表述在一定时间内主成分峰及有关物质峰含量的具体变化,而本文所选择的破坏条件及破坏时间,必须保证药物主成分峰降解量控制在10%—30%,在此基础上研究有关物质及其他杂质的数量及含量变化等重要参数。
在硫酸头孢喹肟乳房注入剂有关物质专属性试验的研究过程,笔者对不同破坏条件进行了摸索,对不同浓度的酸、碱、过氧化物溶液以及不同温度下制剂的破坏情况进行了研究,如制剂在 2、1、0.8和 0.2 mol·L-1盐酸及氢氧化钠的浓度进行10 min、20 min、30 min、1 h、2 h的破坏,在30%、20%、10%、5% H2O2溶液进行10、20、30 min的破坏,在80、90、100、110℃温度下进行30 min、1 h、2 h、3 h的破坏等。研究结果显示,硫酸头孢喹肟乳房注入剂经过 30 min 10% H2O2溶液破坏后,主成分降解率为30%;经过4 h 0.2 mol·L-1的酸、碱溶液破坏后,主成分降解率为10%左右;经过90℃高温破坏1 h后,主成分的降解率为20%左右,满足《兽用化学药物杂质研究技术指导原则》的要求。由试验结果可发现硫酸头孢喹肟乳房注入剂对氧化物敏感,而较耐酸碱。破坏后杂质数量及含量均有增加,说明该检查方法具有较强的专属性。
根据质量标准规定,本产品水分含量不得超过0.2%。在实际检测过程中发现,密封性较差的样品可能由于受潮而存在有关物质含量较高的情况。而试验结果发现样品溶液放置超过2 h后,有关物质含量也有上升趋势,因此笔者考虑可能由于制剂水分的原因会直接引起有关物质含量的增加,期望更深入的试验探究水分对有关物质含量的影响。
本试验建立了HPLC法测定硫酸头孢喹肟乳房注入剂的有关物质,该方法快捷,在已知结构的反相色谱有关物质检测中,HPCL法是经济适用、高效分离、准确定量的研究方法。而TLC(薄层分析法)多适用于正相色谱有关物质的分析,GC(气相色谱法)多用来分析可气化且具备热稳定性的药物分析,CE(毛细管电泳法)主要用来分析离子化药物且具有分离程度高,简单高效等优势,但其自身稳定性较差。综上分析,在硫酸头孢喹肟乳房注入剂有关物质分析初期,笔者首选HPLC法对其进行研究分析。
4 结论
本试验参考硫酸头孢喹肟注射液兽药质量标准以及文献中针对有关物质的检测方法,建立了硫酸头孢喹肟乳房注入剂中有关物质的检测方法。试验结果证明本方法灵敏度高,简单高效,专属性强,可用于硫酸头孢喹肟乳房注入剂有关物质考察。
References
[1] 高金兴. 头孢喹肟在牛奶中残留的HPLC检测及消除规律研究[D].扬州: 扬州大学, 2009. GAO J X. Determination of cefquinome residues by HPLC and its residue depletion in milk[D]. Yangzhou: Yangzhou University, 2009. (in Chinese)
[2] BOTTNER A, SCHMID P, HUMKE R. In vitro efficacy of cefquinome (INN) and other anti-infective drugs against bovine bacterial isolates from Belgium, France, Germany, the Netherlands,and the United Kingdom. ZentralbI Veterinarmed B, 1995, 42(6):377-383.
[3] SUHREN G, KNAPPSTEIN K. Detection of cefquinome in milk by liquid chromatography and screening methods. Analytica Chimica Acta, 2003, 483(1): 363-372.
[4] 杜向党, 李新生, 吴宁鹏, 张素梅. 头孢喹诺的最新研究进展. 中国畜牧兽医, 2006, 33(9): 15-17. DU X D, LI X S, WU N P, ZHANG S M. The new research advance of cefquinome. China Animal Husbandry & Veterinary Medicine,2006, 33(9): 15-17. (in Chinese)
[5] 陈道新, 张超, 潘益. 硫酸头孢喹肟的合成. 中国医药工程杂质,2014, 45(8): 708-710. CHEN D X, ZHANG C, PAN Y. Synthesis of cefquinome sulfate. Chinese Journal of Pharmaceuticals, 2014, 45(8): 708-710. (in Chinese)
[6] 邵意阳, 屈一新, 任慧. 硫酸头孢喹肟的合成. 中国医药工程杂志,2007, 38(6): 405-406. SHAO Y Y, QU Y X, REN H. Synthesis of cefquinome sulfate. Chinese Journal of Pharmaceuticals, 2007, 38(6): 405-406. (in Chinese)
[7] 李长青, 闫祥华, 薛俊娟, 马凤龙, 乔彦良. 硫酸头孢喹肟的合成.应用化工, 2008, 37(2): 231-232. LI C Q, YAN X H, XUE J J, MA F L, QIAO Y L. Synthesis of cefquinome sulfate. Applied Chemical Industry, 2008, 37(2): 231-232. (in Chinese)
[8] 杨美丽, 郑国钧. 硫酸头孢喹肟的合成. 化学试剂, 2008, 30(10):787-788. YANG M L, ZHENG G J. Synthesis of cefquinome sulfate. Chemical Reagents, 2008, 30(10): 787-788. (in Chinese)
[9] 刘美瑞, 赵地顺, 刘宝树, 刘林英, 汪学良, 李俊盼, 葛京京. 头孢喹肟研究进展. 中国畜牧兽医, 2013, 40(4): 216-220. LIU M R, ZHAO D S, LIU B S, LIU L Y, WANG X L, LI J P, GE J J. Research advance on cefquinome. China Animal Husbandry & Veterinary Medicine, 2013, 40(4): 216-220. (in Chinese)
[10] 农业部兽药评审中心. 兽用化学药物杂质研究技术指导原则[S].北京: 化学工业出版社, 2012. China Institute of Veterinary Drugs Control. Technology Guiding Principle of The Study on Veterinary Chemical Impurities[S]. Beijing:Chemical Industry Press, 2012. (in Chinese)
[11] 张玉琥. 仿制药有关物质研究的特点及研究思路. 中国执业药师,2010, 6(8): 31-34. ZHANG Y H. The Characteristics and thoughts on the study of related substances in generic drugs. China Licensed Pharmacist, 2010, 6(8):31-34. (in Chinese)
[12 ] PRASADA RAJU V V N K V, REDDY G M, RAVINDRA V,MATHAD V T, REDDY P. Synthesis and spectral characterization of related substances of lacidipine, an antihypertensive drug. Synthetic Communications, 2009, 39(12): 2137-2145
[13] QIU F H, DANIEL L N. Identification of pharmaceutical impurities. Journal of Liquid Chromatography & Related Technologies, 2007,30(5/7): 877-935.
[14] YANG M, RICHARD T, YI H, GENE H. Characterization and control of impurities in the synthesis of an amino acid drug candidate. Journal of Liquid Chromatography & Related Technologies, 2007, 29(3):365-375.
[15] SMIRNOVA T A, GAVRILOV M Y, VOSEKOVA L P, NAZMETDINOV F Y, KOLLA V E. Synthesis and pharmacological activity of isopropylamides of 2-arylamino-5, 6, 7, 8-tetrahydroquinoline- 4-carboxylic acids. Pharmaceutical Chemistry Journal, 1997, 31(3):134-136.
[16] SMIRNOVA T A, GAVRILOV M Y, NAZMETDINOV F Y, KOLLA V E, KON`SHIN M E. Synthesis and antidepressant activity of acylhydrazides of 2-chloroand 2-anilino-5, 6, 7, 8-tetrahydroquinoline-4-carboxylic acids. Pharmaceutical Chemistry Journal, 1999, 33(7):370-371.
[17] 金翔飞, 沈卫阳, 党柱, 宫旭, 柯梦云, 王欢欢. 药物中有关物质的色谱分析研究近况. 药学进展, 2009, 33(12): 542-548. JIN X F, SHEN W Y, DANG Z, GONG X, KE M Y, WANG H H. Recent process in studies on chromatographic method for analysis of the ralated impurities in drugs. Process in Pharmaceutical Sciences,2009, 33(12): 542-548. (in Chinese)
[18] RAJU T S, KALYANARAMAN L, REDDY V V, SWAMY Y P. Development and validation of an UPLC method for the rapid separation of positional isomers and potenial impurities of rivastigmine hydrogen tartrate in drug substance and drug product. Journal of Liquid Chromatography & Related Technologies, 2012, 35(7): 896-911. [19] KADIVAR M H, SINHA P K, PIJUSH J, HITESH S, ATUL B. Study of impurity carryover and impurity profile in febuxostat drug substance by LC-MS/MS technique. Journal of Pharmaceutical and Biomedical Analysis, 2011, 56(4): 749-757.
[20] SATYANARAYANA K, SRINIVAS K, HIMABINDU V, REDDY G M. Impurity profile study of dutasteride. Pharmazie Die, 2007, 62(10):743-746.
[21] Ghassempour A, Rafati H, Adlnasab L, Bashour Y, Ebrahimzadeh H,Erfan M. Investigation of the solid state properties of amoxicillin trihydrate and the effect of powder PH. Aaps PharmSciTech, 2007,8(4): 91-96.
[22] CHEN Y W, LIU Y, NOVAK T, FREY L, CAMPOS K, KLAPARS A,CHEN C Y, PHENIX B. Identification and structural elucidation of process impurities generated in the end-game synthesis of taranabant (MK-0364)via cyanuric chloride. Journal of Pharmaceutical & Biomedical Analysis, 2009, 49(3): 702-710.
[23] STOLARCZYK E U, KUTNER A. Use of hyphenated LC-MS/MS technique for characterization of impurity profile of quetiapine during drug development. Acta Poloniae Pharmaceutica, 2010, 67(6): 599-608.
[24] RAO R N, RAJU A N, NARSIMHA R. Isolation and characterization of process related impurities and degradation products of bicalutamide and development of RP-HPLC method for impurity profile study. Journal of Pharmaceutical and Biomedical Analysis, 2008, 46(3):505-519.
[25] FDA. Quality by design (QbD) for a modified release dosage form [EB/OL]. (2011-12) [2015-11]. http://www.fda.gov/downloads/Drugs/ DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/ ApprovalApplications/AbbreviatedNewDrugApplicationANDAGeneric s/UCM286595. pdf
[26] 农业部兽药评审中心. 兽药质量标准汇编[S]. 北京: 中国农业出版社, 2012. China Institute of Veterinary Drugs Control. Veterinary Drug Quality Standard Assembly[S]. Beijing: China Agriculture Press, 2012. (in Chinese)
[27] 谢沐风. 仿制药研发中有关物质研究思路之我见. 中国医药工程杂质, 2013, 44(11): 1174-1183. XIE M F. Some opinions on the studies of related substances in generic drugs. Chinese Journal of Pharmaceuticals, 2013, 44(11):1174-1183. (in Chinese)
[28] 邓晶晶, 张春然, 唐克慧, 徐明琴, 王宇驰, 邱建军. 反相高效液相色谱法测定头孢美唑钠中的有关物质. 中国新药杂志, 2011,20(9): 828-832. DENG J J, ZHANG C R, TANG K H, XU M Q, WANG Y C, QIU J J. Determination of the related substances in cefmetazole solium by RP-HPCL. Chinese Journal of New Drugs, 2011, 20(9): 828-832. (in Chinese)
[29] 樊后民, 王刚林. 高效液相色谱法测定头孢噻吩钠中的有关物质.中国药房, 2005, 16(11): 860-861. FAN H M, WANG G L. Determination of the related substances in Cefalotin by HPCL. China Pharmacy, 2005, 16(11): 860-861. (in Chinese)
(责任编辑 林鉴非)
The Detection Methods of the Related Substances in Cefquinome Sulfate Intramammary Infusion
LIU Mao-lin1, LIU Yi-ming1, XU Fei1, ZHANG Dao-kang1, HUANG Hui-li1, LI Han2, LI Xiu-bo1
(1Feed Research Institute,Chinese Academy of Agricultural Sciences/National Reference Laboratory of Drug in Feeds, Beijing 100081;2Beijing Institute of Veterinary Drugs Control, Beijing 100107)
【Objective】 The detection methods of the related substances in cefquinome sulfate intramammary infusion were optimized by referencing the cefquinome sulfate injection in Veterinary Drug Quality Standard Assembly. A specific, sensitive,simple and rapid method was developed, which could be used to analyze the related substance in cefquinome sulfate intramammary infusion, effectively. And it will be useful for its quality control and process optimization. 【Method】 The instrument method was made by the pharmacopoeia requirements. The separation was performed on sodium perchlorate buffer (3.45 g NaClO4·H2O was dissolved in 1 000 mL water, mixed in 12 mL phosphoric acid and 115 mL acetonitrile, and adjusted pH to 3.6 with triethylamine) as the mobile phase at flow rate of 1.0 mL·min-1. The detection wave length was 270 nm and the injection amount of sample solution was 20 µL. The LOD and concentration of the related substance in cefquinome sulfate were estimated by HPLC area normalization method. The linearity, the RSD of injection precision and method precision were tested. For the specificity test, by using 0.2 mol·L-1HCL, 0.2 mol·L-1NaOH to destroy the drug for 4 h,using 10% H2O2to destroy the drug for 30 min and 90℃high temperature to destroy the drug for 1 h. The before and after destroyed samples were detected by HPLC after preparation. And the main-substances’ area, related-substances’ concentration, and their resolutions were contrasted with each other, and the number of the peak values of the impurities was also contrasted. 【Result】 After a series of dilutions of the cefquinome sulfate intramammary infusion, when the concerntration of the main component was at 7.5 µg·mL-1, the S/N of the related-substance was no less than 3, and through calculation of the LOD of the related substance was 0.05 µg·mL-1, and the RSD of injection precision and method precision of 100 µg·mL-1were 0.8% and 0.6%, respectively. The calibration curve of the related substances was a liner equation as y = 45935x-130.03 with a correlation coefficient of 1. The infusions were degraded by almost 10%, 10%, 30%,and 20% under the conditions of acid, alkali, an oxidizing agent, and high temperature, respectively. The retention time and resolution of cefquinome and related-substances were good, and the concentration and numbers of the impurities were added. After detecting the concentration of related substances of the 3 batches of cefquinome sulfate intramammary infusion, and calculated by HPLC method, it was found that the area of related substances were less than 2% of Cef, which met the the Quality Standards of Veterinary Drugs Provisions. 【Conclusion】 The method is simple and easy, selective and sensitive, which can be used to analyze the related substances in agents efficiently.
cefquinome sulfate intramammary infusion; related substance; HPLC method
2016-03-01;接受日期:2016-05-14
国家奶牛产业技术体系北京市创新团队项目、国家公益性行业(农业)科研专项(201303038)、中国农业科学院基本科研业务费专项资金项目(2015YWF-ZD-25)
联系方式:刘茂林,E-mail:lmlcaas@foxmail.com。刘义明,E-mail:liuyiming@caas.cn。刘茂林和刘义明为同等贡献作者。通信作者李秀波,E-mail:lixiubo@caas.cn
