生防型菌肥对黄瓜生长及根结线虫病的影响
2016-09-16马玉琴茆振川杨宇红冯东昕谢丙炎
马玉琴,魏 偲,茆振川,杨宇红,冯东昕,谢丙炎
(中国农业科学院蔬菜花卉研究所农业部蔬菜遗传改良重点开放实验室,北京 100081)
生防型菌肥对黄瓜生长及根结线虫病的影响
马玉琴,魏 偲,茆振川,杨宇红,冯东昕,谢丙炎
(中国农业科学院蔬菜花卉研究所农业部蔬菜遗传改良重点开放实验室,北京 100081)
【目的】评价短短芽孢杆菌、淡紫拟青霉、交枝顶孢霉、钩状木霉等生防菌剂配比的生物有机菌肥对黄瓜根结线虫病的防治效果以及对黄瓜生长、产量的影响, 确定高效菌肥组合。【方法】将4种菌剂按照国家标准分别与有机肥进行配比形成单菌剂、多菌剂等1—10号菌肥试验设置,以不施肥为空白对照,以有机肥、噻唑膦分别为肥料及化学药剂对照。通过盆栽接种根结线虫、根结线虫病温室小区试验及无根结线虫病田间测产试验等对10种不同配比组合的生物菌肥进行试验,通过对黄瓜产量、株高、地上部鲜重以及黄瓜根结线虫病病情指数的调查分析,比较不同配比组合的生物菌肥对黄瓜根结线虫病防治效果以及对黄瓜生长势、产量的影响。【结果】在盆栽试验中,化学药剂对照噻唑膦处理防治效果最高达到89.2%,显著高于其他处理。在菌肥处理中,5号、6号、9号菌肥处理,防治效果为分别为52.5%、52.5%、54.2%,均在50%以上,显著高于其他菌肥处理。在温室小区试验中,5号、6号、9号生物菌肥处理的防治效果分别为56.8%、57.6%、59.3%,与化学药剂对照噻唑膦处理(61.3%)之间没有显著差异。通过相关性分析证实盆栽试验与温室小区试验中各处理防治效果呈显著正相关,而且多菌剂配比防效好于单菌剂菌肥。同时综合对比盆栽、温室及田间测产试验中各处理的黄瓜株高、地上部鲜重、产量,与空白对照相比,各菌肥处理均具有极显著的促生长和增产作用(P<0.01),但是不同试验及不同菌肥处理之间存在差异。在田间测产试验中,增产幅度范围为31.7%—74.9%,其中以6号菌肥效果最佳,增产达到74.9%。在盆栽试验和温室小区试验中,1—10号处理中增产效果最为显著的为9号处理,增产分别达到了60.4%和68.1%;其次为1号处理,比对照增产50.8%和55.8%。5号、6号、9号处理不仅可以有效地防治根结线虫病,而且增产促生长作用较为明显,其中9号处理效果最为显著。综合比较盆栽、温室试验的结果,发现菌肥对根结线虫的防治效果与其对黄瓜的增产作用具有一定相关性,但并不显著。【结论】多菌种复合菌肥(5号、6号、9号)对黄瓜根结线虫病防治及增产促生长作用显著,是实现安全高效防治根结线虫病及增产的途径之一,具有重要的应用价值和开发前景。
生防型菌肥;黄瓜;根结线虫;防治效果;增产作用
0 引言
【研究意义】根结线虫(Meloidogyne spp.)严重制约了蔬菜的产量,每年对农作物造成的损失达到几十亿美元[1-2]。施用化学杀线剂防治根结线虫病虽然见效快,但会因农药残留而极大降低蔬菜品质,污染环境,破坏生态平衡,严重威胁农业的可持续发展。利用抗性品种被认为是经济、安全、高效的方法,种植抗病品种比感病品种可提高产量 50%[3],但是作物中可利用的抗线虫基因稀少,只有Mi-1基因成功应用于番茄育种。目前在黄瓜中尚未发现可用于抗根结线虫育种的抗性基因[4-5]。利用生物防治替代化学防治是减轻根结线虫危害的重要策略之一,将生物有机肥与生物菌剂相结合的可持续治理体系日益受到重视,选择合适的生防菌株,并进行搭配组合,使之由单一菌肥向复合菌肥、单功能向多功能方面发展具有重要意义。【前人研究进展】生物菌肥可以通过微生物的生命活动使作物获得特定的肥料效应,该效应中活性微生物起关键作用[6]。目前所使用的菌种已达到100多种,包括细菌、真菌、放线菌及蓝藻等。据报道,淡紫拟青霉(Paecilomyces lilacinus)颗粒剂对黄瓜根结线虫的生防效果为39.8%,同时可增加黄瓜产量[7];交枝顶孢霉(Acremonium implicatum)为线虫条件致病真菌,对南方根结线虫(Meloidogyne incognita)的寄生率为33.8%[8];木霉属(Trichoderma spp.)中的特定种可以成功拮抗及杀死植物寄生性线虫,钩状木霉(Trichoderma hamatum)具有生防活性[9];BECKER等[10]报道了假单胞菌(Pseudomonas spp.)和芽孢杆菌(Bacillus spp.)对根结线虫病害的防治作用。目前国内生物菌肥生产中还存在着产品活菌数低、品种少、效果不稳定、成本和价格较高等问题,有待于深入研究解决。但是从整体来看,研究的范围、深度极其有限,仍需不断地探索。因此亟需加强生物菌肥由单一菌肥向复合菌肥方面的发展, 由单功能向多功能方面发展,最大程度地发挥在农业生产中应有的经济效益、社会效益和生态效益[11]。【本研究切入点】针对黄瓜根结线虫危害成灾的问题,将生防菌与有机肥相结合,研究活性菌肥对黄瓜根结线虫的防病增产作用。芽孢杆菌[12-13]、交枝顶孢霉[9]、木霉[14]、淡紫拟青霉[15]均为重要的生防菌,对根结线虫病均有一定防效。目前菌肥主要集中在土壤肥料转化及提高作物抗性等方面,针对黄瓜生长及根结线虫防治的菌肥研究尚未见详细报道。【拟解决的关键问题】利用实验室分离到的短短芽孢杆菌(Brevibacillus brevis)、淡紫拟青霉、交枝顶孢霉、钩状木霉4种生防菌与生物有机肥进行合理的配比,制备成具有生物防治作用的菌肥;通过盆栽、温室及田间测产试验研究其对黄瓜根结线虫病的防治效果及对黄瓜的促生长、增产作用,为研发替代或减施化学农药及化肥、环境友好型的生防型菌肥提供依据。
1 材料与方法
1.1试验材料
1.1.1病原线虫 供试线虫为南方根结线虫,由中国农业科学院蔬菜花卉研究所病害组提供。南方根结线虫2龄幼虫(J2)培养在温室辣椒(茄门甜椒品种)植株上,挑取根部的线虫卵块,用0.5%的NaClO消毒3—5 min,用无菌水冲洗3—4次,28℃条件下黑暗孵化,收集新鲜的J2用于盆栽接种试验。北京顺义绿奥基地温室土壤中根结线虫种类分子鉴定为南方根结线虫[16],通过多点取样,采用浅盘法分离根结线虫[17],测定土壤中J2的种群密度为24.3条/100 g土。
1.1.2黄瓜 供试黄瓜(Cucumis sativus)品种为中农16,购自中蔬种业科技(北京)有限公司。
1.1.3生防型菌株 短短芽孢杆菌、交枝顶孢霉(CGMCC8300)、淡紫拟青霉和钩状木霉(CGMCC NO. 10923)4种菌株,由中国农业科学院蔬菜花卉研究所病害组分离鉴定并保存。4种生防菌的菌剂加工由西安德龙生物技术有限公司完成。
1.1.4有机肥、基质及其他药剂 供试有机肥为西安德龙生物技术有限公司生产的“家家肥”牌生物有机肥(JJF)。化学药剂处理采用10%的噻唑膦颗粒剂(福气多),由日本石原株式会社生产。基质为德国进口无菌育苗基质,蛭石购自中国农业科学院蔬菜花卉研究所花卉市场。
1.1.5生防型生物有机菌肥种类及配比 根据国家菌肥生产标准(GB20287-2006),依据正交试验设计方法,将生防菌剂按照下表与“家家肥”(JJF)有机肥进行配比,使得每种生防菌的孢子含量为0.2 亿/g,得到1—10号菌肥,具体配方见表1。

表1 生防型菌肥各处理的配比Table 1 Formulation of compound microorganism bioorganic fertilizer
1.2试验方法
1.2.1盆栽试验 试验于2015年9—11月在北京顺义绿奥基的温室中进行。将黄瓜种子用5% NaClO消毒10 min,用无菌水清洗干净后,放置于含有湿润滤纸的培养皿中,28℃催芽1 d,播种于育苗盘中。黄瓜苗在 25—28℃温室中培养至第一片真叶完全展开时进行移栽。每盆加入生长基质约1.5 kg,菌肥20 g。在移栽前混合均匀,然后将黄瓜苗移栽到试验盆中(高:25 cm×直径:25 cm)。根据菌肥配方分别设置为1 —10号菌肥,化学药剂对照为每盆施用0.15 g 10%噻唑膦,以“家家肥”肥料处理为肥料对照,清水处理为空白对照。每盆种植1株黄瓜苗,每个处理10盆,设3次重复。
在黄瓜苗移栽一周后,进行根结线虫接种,在距离黄瓜根5 cm处的基质中均匀打3个1 cm深的小孔,注入线虫悬浮液,每株接种根结线虫2龄幼虫1 000条,接种后进行正常的肥水管理。10、30、60 d时分别检测黄瓜的株高,并在第60天检测地上部及地下部鲜重、产量的差别以及根结线虫的病情指数[18]。
根据根结线虫田间调查方法,对10个处理及肥料对照、化学药剂对照和空白对照处理的根部发病情况进行调查,根据病害症状描述,逐份材料进行调查,记载病情级别。根结等级采用 GARABEDIAN等[18]的分级标准,0 级:根系健康,无根结;1 级:有极少量根结,占全根系1%—20%;2级:有少量根结,占全根系21%—40%;3 级:根结数量中等,占全根系41%—60%;4 级:根结数量很多,占全根系61% —80%;5 级:根结数量极其多且大,占全根系81% —100%。计算出根结指数,确定防治效果。计算公式如下:

1.2.2温室小区试验 于2015年8—11月在北京顺义绿奥基地日光温室进行生防型菌肥防治黄瓜根结线虫病及对黄瓜产量影响的试验。试验设置 1—10号菌肥处理,以不施肥为空白对照,施用有机肥或噻唑膦分别为肥料或化学药剂对照,共13个处理。在移栽前将菌肥作为底肥进行沟施,施肥量为 0.40 kg·m-2,高垄双行种植,株距30 cm,行距50 cm,共种植30 株/小区,每个小区10 m2,其他栽培管理措施按当地生产习惯统一操作,确保植株生长环境一致。各处理随机排列,每个处理3个小区,共计39个小区。在生长期对黄瓜生长情况进行3次测量,记录株高变化,分析生长势。在收获期按批次采摘黄瓜,记录每小区的产量。在生长期末(80 d),将根系挖出,逐一检查根结线虫发生情况,记录病情级别,计算防治效果,方法同 1.2.1。同时记录株高及鲜重,分析长势差别。
1.2.3田间测产试验 试验于2015年8—11月在中国农业科学院国际农业高新技术产业园进行,选择没有根结线虫发生的田块进行 10种不同配比组合的生物菌肥对黄瓜生长及产量的试验,确定生防型菌肥对黄瓜生长的影响。具体方法参考温室试验。在生长期至收获期对黄瓜生长情况进行3次测量,记录株高变化,分析生长势。在生长期间按批次收获黄瓜,记录每小区的产量,分析不同菌肥处理对黄瓜生长的影响。
1.3数据分析
采用SAS 9.1软件的ANOVA和CORR程序,对盆栽试验、温室试验及田间测产试验的黄瓜株高、鲜重、根结线虫防治效果等数据进行单因素方差分析及相关性分析。
2 结果
2.1生防型菌肥对黄瓜根结线虫病的防治效果
在盆栽试验中,接种根结线虫60 d时,将黄瓜根系从盆中倒出,将根系从栽培基质中轻轻抖出,用清水冲洗干净;在温室小区试验中,在生长期末(80 d),将根系挖出,去除茎秆,清洗根系。图1所示为在盆栽条件下处理根系的部分图片,图2则为在温室试验条件下处理根系的部分图片。从图1、图2可以看出,空白处理中的植株根系根结大且多成串状,菌肥处理的根系则恰恰相反,根系发达,根系根结小而少;噻唑膦处理根系的症状与空白对照症状形成鲜明对比。
对盆栽试验和温室小区试验中黄瓜根系按照鉴定方法检测根结发生情况,记载病情级别,计算根结指数,确定防治效果。在盆栽试验中,噻唑膦处理防治效果最好,防效达到89.2%;1—10号生物菌肥处理中,5号(短短芽孢杆菌、交枝顶孢霉)、6号(短短芽孢杆菌、淡紫拟青霉)、9号(短短芽孢杆菌、淡紫拟青霉、交枝顶孢霉、钩状木霉)和10号(淡紫拟青霉、交枝顶孢霉、钩状木霉)处理防治效果为分别为52.5%、52.5%、54.2%和49.2%,这4种菌肥之间没有显著差异,但是显著地高于其他菌肥处理;1号(短短芽孢杆菌)、2号(交枝顶孢霉)、3号(淡紫拟青霉)和 4号(钩状木霉)处理防治效果相对较低,防治效果为 30.0%—41.7%。由盆栽试验可以看出,复合菌肥配方(5—10号)的防治效果要好于单菌剂配方(1—4号)。在温室小区试验中,噻唑膦防治效果达到了61.3%,虽然比盆栽试验中显著降低,仍然为所有处理中防效最高的,但与5号、6号、9号生物菌肥处理的防治效果(56.8%、57.6%、59.3%)之间没有显著差异。其次,3号、7号、8号菌肥处理的防治效果分别为 50.4%、53.4%、54.3%,其余菌肥处理的防治效果为 5.6%—43.5%,与噻唑膦的防治效果存在极显著差异(表2)。

图1 盆栽试验中根结线虫防治效果Fig. 1 Control efficiency of root-knot nematode in the pot experiment by fertilizer with different combinations of microbes
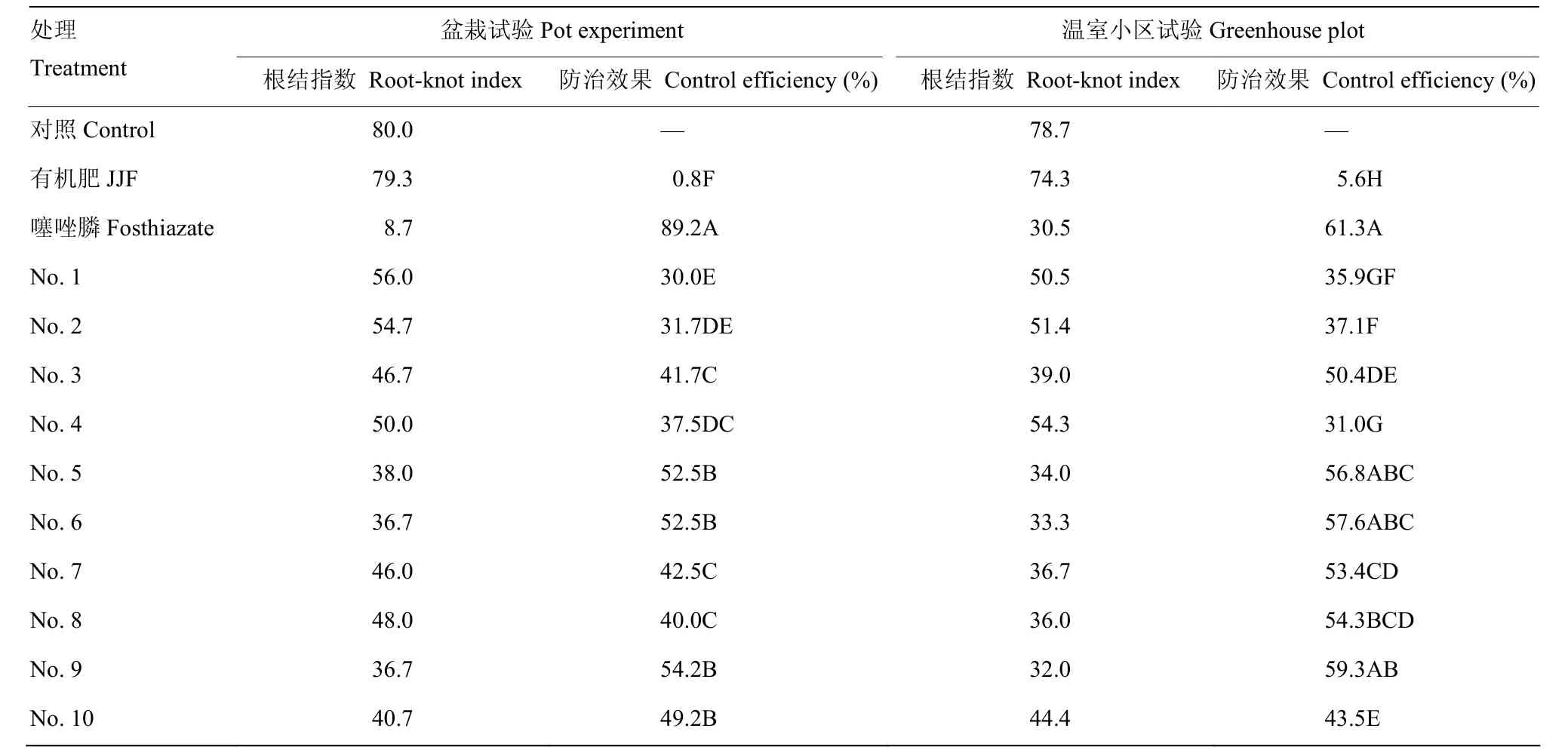
表2 生防型菌肥对黄瓜根结线虫病的防治效果Table 2 Control efficiency of compound microorganism bioorganic fertilizer to cucumber root-knot nematode
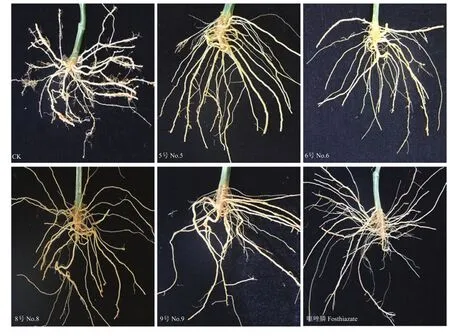
图2 温室试验中根结线虫防治效果Fig. 2 Control efficiency of root-knot nematode in greenhouse plot by fertilizer with different combinations of microbes
对盆栽接种及温室小区试验中菌肥对根结线虫防治效果进行相关性分析,相关系数为0.84,显著性水平为 0.0006<0.01,表明在盆栽试验和温室小区试验条件下根结线虫防治效果呈极显著正相关,说明菌肥对根结线虫的防治效果是相对稳定的。
2.2生防型菌肥对黄瓜长势及产量的影响
在盆栽试验中,1—10号处理黄瓜产量和生长势均极显著高于空白对照,其中增产效果最为显著的为9号处理,达到了60.4%;其次为1号处理,比对照增产 50.8%;其余各处理产量无显著性差异,增产幅度为21.8%—35.9%(表3)。在温室小区试验中,各处理在株高、产量、地上部鲜重方面均极显著高于空白对照,与盆栽试验中结果基本相符。9号处理增产效果较为显著,比对照增产68.1%;1号处理次之,达到55.8%;5号、8号处理增产幅度均在50%以上,分别为54.16%和53.74%;其余各处理增产幅度为24.5%—47.3%(表4)。
在田间测产试验中,各种菌肥处理的增产促生长作用表现显著,1—10号处理在株高、地上部鲜重、产量方面均极显著高于空白对照。相对于空白对照,其增产幅度范围为31.7%—74.9%,其中以6号菌肥效果最佳,增产达到74.9%,其次为2号、3号菌肥,分别为68.3%和68.0%,与6号菌肥之间无显著差异(表 5)。通过试验还可以看出,单独有机肥的增产为 39.6%(表 5),而多数菌肥增产作用均高于有机肥,说明生防菌剂对促进生长也有一定的贡献。对黄瓜株高、地上部鲜重、产量进行相关性分析,结果表明这3个指标之间相关系数均>0.7,呈极显著正相关(P<0.01),说明菌肥处理对黄瓜长势以及产量有显著的影响。
对盆栽、温室和田间测产试验结果进行相关性分析,结果表明盆栽试验结果与田间测产试验结果基本一致,与温室试验结果则完全一致,株高、产量、地上部鲜重之间呈正相关。比较盆栽、温室试验的结果可以看出,根结线虫的防治效果与黄瓜的增产作用具有一定相关性,在盆栽试验中黄瓜增产幅度与根结线虫防治效果之间相关系数为 0.22,而在温室试验中为0.46,均不显著(P>0.05),表明菌肥的增产作用是菌剂和有机肥两种因素共同作用的结果。
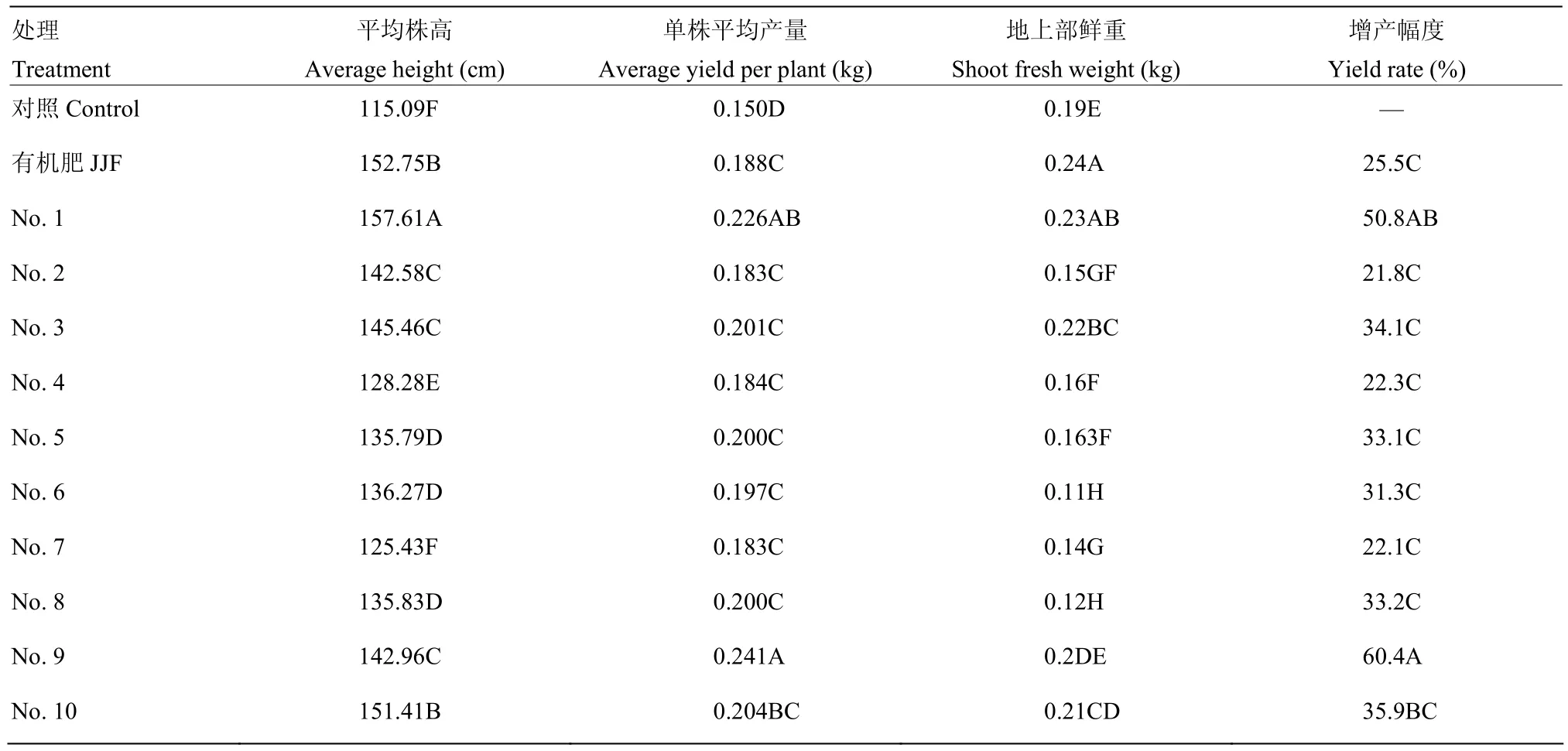
表3 盆栽试验调查结果Table 3 Growth promotion and yield of cucumber in pot experiment
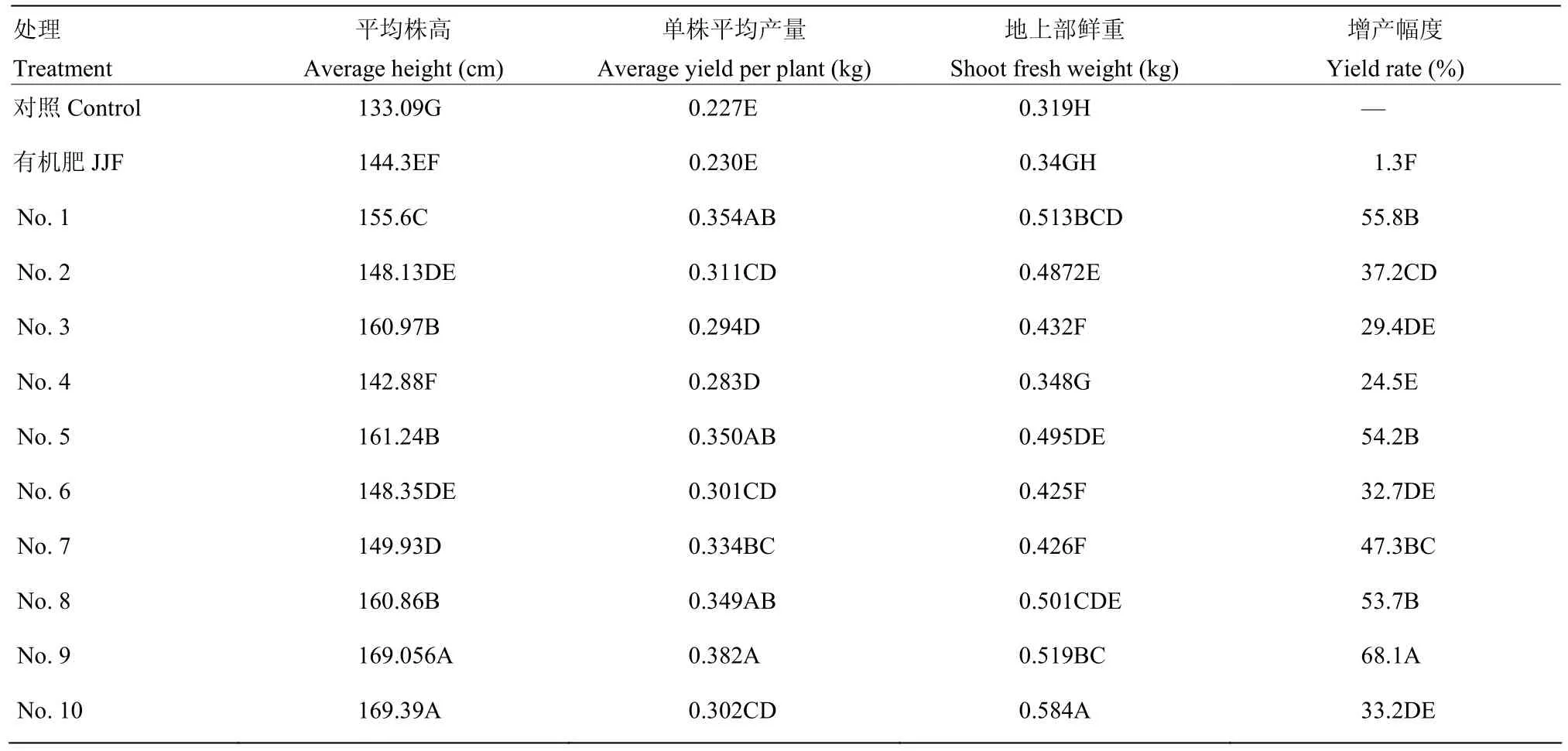
表4 温室小区试验调查结果Table 4 Growth promotion and yield of cucumber in greenhouse plot
3 讨论
在盆栽试验和温室小区试验中,5号、6号、9号处理对黄瓜根结线虫病具有控制作用,防治效果较高且稳定。5号处理为短短芽孢杆菌、交枝顶孢霉和有机肥的结合,6号处理则为短短芽孢杆菌、淡紫拟青霉、有机肥的结合,9号处理则为短短芽孢杆菌、淡紫拟青霉、钩状木霉、交枝顶孢霉和有机肥的结合。表明短短芽孢杆菌与交枝顶孢霉或淡紫拟青霉相容性较好,对黄瓜根结线虫病具有协同防治作用,一方面,淡紫拟青霉[19]和交枝顶孢霉[9]能定殖到植物根部,产生杀线虫活性次级代谢产物;另一方面是因为淡紫拟青霉和交枝顶孢霉对根结线虫具有很好的卵寄生能力,在侵染线虫体表或者卵壳时会产生特殊的侵染结构——附着孢,在此过程中分泌几丁质酶和蛋白酶,破坏卵壳的完整性,进而杀死卵[9,20-22]。
在田间测产试验中,没有根结线虫的发生,而在盆栽试验和温室小区试验中,则有根结线虫病的危害。在盆栽试验中,有机肥增产只有 25.2%,显著低于没有根结线虫危害时田间测产试验的 39.6%,而在温室小区试验中有机肥的增产效果只有1.3%,说明根结线虫对产量具有显著的影响。在盆栽试验和温室小区试验中,增产效果最为显著的为9号处理,其次为1号(短短芽孢杆菌、有机肥)处理,然而1号处理在防治根结线虫病时,较其他处理防效差,表明短短芽孢杆菌增产促生长作用较为显著。在田间测产试验中,6号菌肥效果最佳,增产达到 74.9%,进一步说明了短短芽孢杆菌和淡紫拟青霉相容性好,在这一过程中,作用机制可能为短短芽孢杆菌起增产促生长作用;淡紫拟青霉在黄瓜根部大量生长、繁殖,从而形成优势菌落,对周围微生物的抑制或拮抗作用在一定程度上减少了黄瓜其他病原菌引发的病症,从而有利于黄瓜更好地生长。
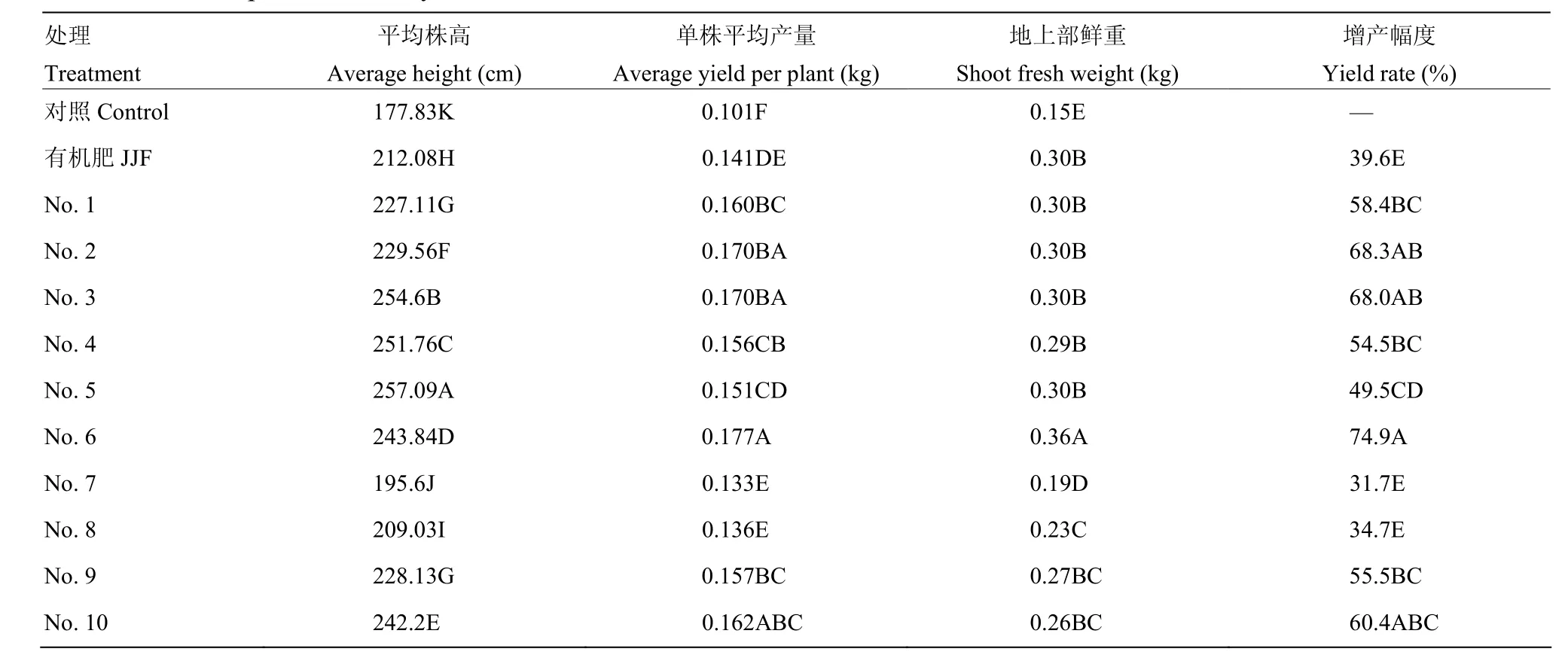
表5 田间测产试验调查结果Table 5 Growth promotion and yield of cucumber in field trials
5号、6号和9号这3种组合菌肥对黄瓜根结线虫病防治及增产作用具有较好的综合表现,其中9号菌肥效果最好。可能是由于芽孢杆菌[23]、淡紫拟青霉[24-26]、交枝顶孢霉[27]、木霉[28]是防治根结线虫病重要的生防菌,4种菌株协同作用,与黄瓜植株形成互利共生的统一体。首先,黄瓜定殖后,短短芽孢杆菌为植物根际促生细菌(PGPR)将发挥作用,能够改善植物对矿物质元素和水分的吸收、改变植物激素平衡、改善根部环境,且可以通过产生生长素、赤霉素、细胞分裂素、乙烯、维生素及其他植物生长调节剂来调节黄瓜的生长[29-31];其次,淡紫拟青霉、交枝顶孢霉、钩状木霉定殖到黄瓜根部;最后,当黄瓜根部受到根结线虫的侵染后,淡紫拟青霉和交枝顶孢霉菌丝将对线虫的卵进行寄生,在卵壳表面形成侵染钉,然后穿透卵壳进入卵内,导致卵壳被破坏,内容物渗出,胚胎发育停止。此外,淡紫拟青霉也可寄生线虫,从而可以杀死线虫。钩状木霉不会寄生线虫和卵,其发酵液对根结线虫无致死作用(未发表数据)。研究发现部分木霉菌株可定殖于植物根际,形成共生体,改变植物的代谢功能,表现在促进植物生长、增加养分吸收利用效率、提高农作物产量以及诱导植物产生抗逆性等。钩状木霉可能通过诱导黄瓜产生局部或系统抗性来提高其抗线虫病的能力[32-33]。4种菌株各司其职,从而达到防治黄瓜根结线虫病和增产促生长的目的。
本研究以纯天然、无害化处理的生物有机肥为载体与生防菌剂进行配比,形成的生防型菌肥完全来自自然生物,具有绿色、安全、无污染、无残留等特点,不但可以改良土壤理化性质,而且增产及防病效果显著。同时,许多生防菌对植物病害具有协同防治作用[34],因此有关生防型菌肥对其他病害的防治效果和优化配比还需进一步研究,以便能够更好地开发利用生防菌,最大效应地发挥菌肥的作用潜力。
4 结论
通过盆栽、温室、田间测产试验,比较了10种不同配比组合的生防型菌肥对黄瓜生长及根结线虫病发生的影响,其中5号组合(短短芽孢杆菌、交枝顶孢霉)、6号组合(短短芽孢杆菌、淡紫拟青霉)、9号组合(短短芽孢杆菌、淡紫拟青霉、交枝顶孢霉、钩状木霉)等3种菌肥对黄瓜根结线虫病防治及增产作用具有较好的综合表现,为进一步开发利用菌肥、实现安全高效防治根结线虫病及增产提供了依据,具有重要的应用价值和开发前景。
References
[1] ESCOBAR C, BARCALA M, CABRERA J, FENOLL C. Overview of root-knot nematodes and giant cells. Advances in Botanical Research, 2015, 73: 1-24.
[2] WESEMAEL W M L, VIAENE N, MOENS M. Root-knot nematodes (Meloidogyne spp.) in Europe. Nematology, 2011, 13(1): 3-16.
[3] DJIAN-CAPORALINO C, PALLOIX A, FAZARI A, MARTEU N,BARBARY A, ABAD P, TAUSSIG C. Pyramiding, alternating or mixing: comparative performances of deployment strategies of nematode resistance genes to promote plant resistance efficiency and durability. BMC Plant Biology, 2014, 14(1): 53.
[4] SKÁLOVÁ D, NAVRÁTILOVÁ B, LEBEDA A. Embryo rescue of cucumber (Cucumis sativus), muskmelon (C. melo) and some wild Cucumis species (C. anguria, C. zeyheri, and C. metuliferus). Journal of Applied Botany and Food Quality, 2008, 82(1): 83-89.
[5] Walters S A, Wehner T C. Incompatibility in diploid and tetraploid crosses of Cucumis sativus and Cucumis metuliferus. Euphytica, 2002,128(3): 371-374.
[6] 栗丽, 洪坚平, 谢英荷, 杨彦, 张璐. 生物菌肥对采煤塌陷复垦土壤生物活性及盆栽油菜产量和品质的影响. 中国生态农业学报,2010, 18(5): 939-944. LI L, HONG J P, XIE Y H, YANG Y, ZHANG L. Effect of bacterial manure on soil biological activity, yield and quality of rape in reclaimed core-mining areas. Chinese Journal of Eco-Agriculture,2010, 18(5): 939-944. (in Chinese)
[7] 席先梅, 白全江, 张庆萍, 李玉民, 贺小勇, 孔庆全, 魏海明, 赵存虎. 5种生物制剂对设施蔬菜根结线虫防治技术研究. 植物保护,2015, 41(4): 203-207. XI X M, BAI Q J, ZHANG Q P, LI Y M, HE X Y, KONG Q Q, WEI H M, ZHAO C H. Control effect of five biological agents on vegetable root-knot nematodes in greenhouse. Plant Protection, 2015,41(4): 203-207. (in Chinese)
[8] YAO Y R, TIAN X L, SHEN B M, MAO Z C, CHEN G H, XIE B Y. Transformation of the endophytic fungus Acremonium implicatum with GFP and evaluation of its biocontrol effect against Meloidogyne incognita. World Journal of Microbiology and Biotechnology, 2015,31(4): 549-556.
[9] KUBICEK C P, ESSER K, DRUZHININA I S. Environmental and Microbial Relationships. Springer Science & Business Media, 2007.
[10] BECKER J O, ZAVALETA-MEJIA E, COLBERT S F, SCHROTH M N, WEINHOLD A R, HANCOCK J G, VAN GUNDY S D. Effects of rhizobacteria on root-knot nematodes and gall formation. Phytopathology,1988, 78(11): 1466-1469.
[11] 葛均青, 于贤昌, 王竹红. 微生物肥料效应及其应用展望. 中国生态农业学报, 2003, 11(3): 87-88. GE J Q, YU X C, WANG Z H. The function of microbial fertilizer and its application prospects. Chinese Journal of Eco-Agriculture, 2003,11(3): 87-88. (in Chinese)
[12] GUO J H, QI H Y, GUO Y H, GE H L, GONG L Y, ZHANG L X,SUN P H. Biocontrol of tomato wilt by plant growth-promoting rhizobacteria. Biological Control, 2004, 29: 66-72.
[13] ALI N I, SIDDIQUI I A, SHAUKAT S S, ZAKI M J. Nematicidal activity of some strains of Pseudomonas spp. Soil Biology and Biochemistry, 2002, 34(8): 1051-1058.
[14] 马金慧, 朱萍萍, 茆振川, 张晓平, 谢丙炎, 李惠霞. 哈茨木霉菌株 TRI2 的鉴定及其对黄瓜根结线虫的防治作用. 中国农学通报,2014, 30(22): 263-269. MA J H, ZHU P P, MAO Z C, ZHANG X P, XIE B Y, LI H X. Identification of Trichoderma harzianum TRI2 and its biological control effect against root-knot nematode. Chinese Agricultural Science Bulletin, 2014, 30(22): 263-269. (in Chinese)
[15] ANASTASIADIS I A, GIANNAKOU I O, PROPHETOUATHANASIADOU D A, GOWEN S R. The combined effect of the application of a biocontrol agent Paecilomyces lilacinus, with various practices for the control of root-knot nematodes. Crop Protection,2008, 27(3): 352-361.
[16] HU M X, ZHUO K, LIAO J L. Multiplex PCR for the simultaneous identification and detection of Meloidogyne incognita, M. enterolobii,and M. javanica using DNA extracted directly from individual galls.Phytopathology, 2011, 101(11): 1270-1277.
[17] 方中达. 植病研究方法. 北京: 中国农业出版社, 1998: 307-311. FANG Z D. Plant Pathology Research Methods. Beijing: China Agriculture Press, 1998: 307-311. (in Chinese)
[18] GARABEDIAN S, VAN GUNDY S D. Use of avermectins for the control of Meloidogyne incognita on tomatoes. Journal of Nematology,1983, 15(4): 503-510.
[19] PARK J O, HARGREAVES J R, MCCONVILLE E J, STIRLING G R, GHISALBERTI E L, SIVASITHAMPARAM K. Production of leucinostatins and nematicidal activity of Australian isolates of Paecilomyces lilacinus (Thom) Samson. Letters in Applied Microbiology,2004, 38(4): 271-276.
[20] HUANG X, ZHAO N, ZHANG K. Extracellular enzymes serving as virulence factors in nematophagous fungi involved in infection of the host. Research in Microbiology, 2004, 155(10): 811-816.
[21] BONANTS P J M, FITTERS P F L, THIJS H, DEN-BELDER E,WAALWIJK C, HENFLING J W. A basic serine protease from Paecilomyces lilacinus with biological activity against Meloidogyne hapla eggs. Microbiology, 1995, 141(4): 775-784.
[22] SINGH S, MATHUR N. In vitro studies of antagonistic fungi against the root-knot nematode, Meloidogyne incognita. Biocontrol Science and Technology, 2010, 20(3): 275-282.
[23] ABBASI M W, ZAKI M J, ANIS M. Application of Bacillus species cultured on different low cost organic substrates for the control of root-knot nematode infection on okra (Abelmoschus esculentus Moench). Pakistan Journal of Botany, 2013, 45(3): 1079-1084.
[24] KIEWNICK S, SIKORA R A. Biological control of the root-knot nematode Meloidogyne incognita by Paecilomyces lilacinus strain 251. Biological Control, 2006, 38(2): 179-187.
[25] HUANG W K, CUI J K, LIU S M, KONG L A, WU Q S, PENG H,PENG D L. Testing various biocontrol agents against the root-knot nematode (Meloidogyne incognita) in cucumber plants identifies a combination of Syncephalastrum racemosum and Paecilomyces lilacinus as being most effective. Biological Control, 2016, 92: 31-37.
[26] 林森, 武侠, 曹君正, 王凤龙. 产生几丁质酶的交枝顶孢(Acremonium implicatum) 对南方根结线虫生防潜力. 植物病理学报, 2013, 43(5): 509-517. LIN S, WU X, CAO J Z, WANG F L. Biocontrol potential of chitinase-producing nematophagous fungus Acremonium implicatum against Meloidogyne incognita. Acta Phytopathologica Sinica, 2013,43(5): 509-517. (in Chinese)
[27] ABD-EL-KHAIR H, EL-NAGDI W M A. Field application of bio-control agents for controlling fungal root rot and root-knot nematode in potato. Archives of Phytopathology and Plant Protection,2014, 47(10): 1218-1230.
[28] CHRISTIANSEN-WENIGER C, VAN VEEN J A. NH4+-excreting Azospirillum brasilense mutants enhance the nitrogen supply of a wheat host. Applied and Environmental Microbiology, 1991, 57(10):3006-3012.
[29] FULCHIEIR M, LUCANGELI C, BOTTINI R. Inoculation with Azospirillum lipoferum affect growth and gibberellin status on corn seedling roots. Plant Cell Physiology, 1993, 34(8): 1305-1309.
[30] SCHIPPERS B, BAKKER A W, BAKKER A H M. Interactions of deleterious and beneficial rhizosphere microorganisms and the effect of cropping practice. Annual Review of Phytopathology, 1987, 25:339-358.
[31] HARMAN G E, HOWELL C R, VITERBO A, CHET I, LORITO M. Trichoderma species-opportunistic, avirulent plant symbionts. Nature Reviews Microbiology, 2004, 2(1): 43-56.
[32] BAE H, ROBERTS D, LIM H, STREM M, PARK S, RYU C,MELNICK R, BAILEY B. Endophytic Trichoderma isolates from tropical environments delay disease onset and induce resistance against Phytophthora capsici in hot pepper using multiple mechanisms. Molecular Plant-Microbe Interactions, 2011, 24(3): 336-351.
[33] BRUNNER K, ZEILINGER S, CILIENTO R, WOO S, LORITO M,KUBICEK C, MACH R. Improvement of the fungal biocontrol agent Trichoderma atroviride to enhance both antagonism and induction of plant systemic disease resistance. Applied and Environmental Microbiology, 2005, 71(7): 3959-3965.
[34] 王振, 李世东, 缪作清, 郭荣君, 孙漫红. 有机物与淡紫紫孢霉对番茄根结线虫病的协同防治. 中国生物防治学报, 2015, 31(1):130-138. WANG Z, LI S D, MIAO Z Q, GUO R J, SUN M H. Synergistic efficacy of Purpureocillium lilacinum and organic material against tomato root-knot nematode. Chinese Journal of Biological Control,2015, 31(1): 130-138. (in Chinese)
(责任编辑 岳梅)
Effects of Bioorganic Fertilizers with Compound Microbes on Cucumber and Root-Knot Nematode
MA Yu-qin, WEI Cai, MAO Zhen-chuan, YANG Yu-hong, FENG Dong-xin, XIE Bing-yan
(Key Laboratory of Horticultural Crops Biology and Genetic Improvement, Ministry of Agriculture, Institute of Vegetables and Flowers, Chinese Academy of Agricultural Sciences, Beijing 100081)
【Objective】 The objective of this study is to evaluate the effects of bioorganic fertilizers with compound microbes (Brevibacillus brevis, Paecilomyces lilacinus, Acremonium implicatum, Trichoderma hamatum) on cucumber growth, yield and the control efficiency against root-knot nematode disease, then screen the efficient combinations of microbes.【Method】Experiments included 10 treatments of bioorganic fertilizers with compound microbes (No.1 to 10), which were from different compounds of thefour kinds of microbes B. brevis, P. lilacinus, A. implicatum, and T. hamatum, the bioorganic fertilizers and the 10% fosthiazate granules were as the fertilizer and chemical control, respectively, the treatment without any fertilizer and pesticide was as the negative control. Based on the experiments performed in greenhouse and field, the differences of 10 treatments were analyzed by measuring the root-knot nematode disease index, cucumber yield, plant height and shoot fresh weight, and then the effects of bioorganic fertilizers with compound microbes on cucumber production and control efficiency of root-knot nematode disease were evaluated.【Result】In pot experiments, the control efficiency of fosthiazate treatment was up to 89.2%, which was significantly higher than other treatments and controls. Among the 10 treatments of bioorganic fertilizers with compound microbes (No.1 to 10),the control efficiency of root-knot nematode of No. 5, No. 6, No. 9 treatments were 52.5%, 52.5%, and 54.2%, respectively, and the control efficiency of these treatments were higher than other fertilizer treatments. In the greenhouse plot, there was no significant difference in control efficiency among No. 5 (56.8%), No. 6 (57.6%), No. 9 treatments (59.3%) and fosthiazate treatment (61.3%). In addition, there was a significant positive correlation in the root-knot nematodes control efficiency between pot experiments and greenhouse plot, and the control efficiency of multi-microorganisms were better than that of single microorganism usually. Compared with the negative control, all fertilizer treatments increased cucumber growth and yield significantly (P<0.01), but there were some difference among bioorganic fertilizers with compound microbes (No.1 to 10). In field trials, the yield increase was in the range of 31.7%-74.9%, the best treatment was No. 6, and the increased range of which was 74.9%. In pot experiment and greenhouse plot,compared with the negative control, the control efficiency of No. 9 ranked the best in yield, and the increased range was 60.4% and 68.1%, followed by No. 9 treatment, the control efficiency of No.1 were 50.8% and 55.8%, respectively. No. 5, No. 6 and No. 9 treatments could not only control the root-knot nematode disease effectively, but also promoted cucumber growth and increased their production, among them No. 9 treatment was the most effective treatment. There was a correlation in control efficiency of root-knot nematode and production increasing between pot experiment and greenhouse plot, but the correlation level was low.【Conclusion】The bioorganic fertilizers with multi-microorganisms (No. 5, No. 6 and No. 9) have better effects on cucumber growth, yield and the control efficiency of root-knot nematode disease, thus prssessing an important utilization value and research potential in agriculture production.
bioorganic fertilizers with compound microbes; cucumber; root-knot nematode; control effect; increase production
2016-03-04;接受日期:2016-05-26
国家自然科学基金(31371923)、国家现代农业产业技术体系建设专项资金(CARS-25)、中国农业科学院科技创新工程(CAAS-ASTIP)
联系方式:马玉琴,Tel:18910754176;E-mail:1179228949@qq.com。通信作者茆振川,Tel:010-82109545;E-mail:maozhenchuan@caas.cn
