DTA-6和S3307对大豆存留荚和脱落荚生理调控的效应
2016-09-16崔洪秋冯乃杰孙福东刘春娟何天明赵晶晶郑殿峰
崔洪秋,冯乃杰,孙福东,刘春娟,何天明,赵晶晶,刘 洋,龚 屾,师 臣,郑殿峰
(1黑龙江八一农垦大学农学院,黑龙江大庆 163319;2黑龙江省农业科学院大庆分院,黑龙江大庆 163316)
DTA-6和S3307对大豆存留荚和脱落荚生理调控的效应
崔洪秋1,2,冯乃杰1,孙福东1,刘春娟1,何天明1,赵晶晶1,刘 洋1,龚 屾1,师 臣2,郑殿峰1
(1黑龙江八一农垦大学农学院,黑龙江大庆 163319;2黑龙江省农业科学院大庆分院,黑龙江大庆 163316)
【目的】在半干旱地区,研究植物生长促进型和延缓型调节剂作用下,大豆花荚发育过程中存留和脱落荚生理效应差别,探讨调节剂减少大豆脱落作用的生理效应,为提高大豆产量寻找途径。【方法】试验于2012—2013年在黑龙江省大庆市林甸县,始花期(R1)对3个大豆品种绥农28(SN28)、垦丰16(KF16)、合丰50(HF50)分别叶面喷施调节剂2-N、N-二乙氨基乙基己酸酯(diethyl aminoethyl hexanoate,DTA-6)和烯效唑(uniconazole,S3307),喷施清水作为对照(CK)。从喷药后第35天(R5)开始第1次取样,每隔7 d取样1次。采集存留和脱落的花荚,并将荚皮与籽粒分开,液氮速冻30 min,取出置于低温冰柜中(-40℃),待全部样品收集完毕,统一测定。比较研究各处理中存留和脱落荚中氧自由基代谢、相关脱落酶、可溶性物质等生理指标的调控效应。【结果】(1)随着荚发育进程,脱落荚中丙二醛(methane dicarboxylic aldehyde,MDA)含量、超氧化物歧化酶(superoxide dismutase,SOD)活性、过氧化物酶(peroxidase,POD)活性、可溶性糖含量、可溶性蛋白质含量显著高于存留荚,脱落纤维素酶(abscission cellulose,AC)、多聚半乳糖醛酸酶(polygalacturonase,PG)活性显著低于存留荚。(2)DTA-6和S3307都能够调控大豆存留荚和脱落荚生理,二者过程不同,结果相似。二者调控效应表现为:总体上降低了存留荚 MDA含量,提高了 SOD、POD活性,效果S3307优于DTA-6,在绥农28和垦丰16鼓粒中早期,合丰50鼓粒后期阶段性的降低了存留荚AC活性、PG活性。存留荚和脱落荚生理差别随着荚的生育进程,随之变化,不同荚生育时期,差异幅度不同。存留荚和脱落荚生理指标的差异也受品种内在遗传因素影响。【结论】脱落后的荚生理指标状态与存留荚相比表现为质膜过氧化作用增强,保护酶系统的平衡被破坏,可溶性物质增加,脱落酶活性降低可能受脱落过程环境影响较大。脱落荚和存留荚生理相关指标存在差异,并受荚发育时期和品种影响。DTA-6和S3307调控后存留荚具有较强的生理调控和自我修复能力,其膜损伤、渗透调节、保护酶系统、脱落酶活性降低等均对降低脱落有积极的响应。
大豆(Glycine max L.);花荚脱落;调节剂;生理;DTA-6;S3307
0 引言
【研究意义】大豆花荚脱落是一种生物学现象,是其自我调节的手段,对外界环境的一种适应性表现。大豆产量形成过程中花荚脱落率占总花数的40% —70%[1-2],其中约一半以荚的形式脱落,在生产上发现大豆往往由于结荚过多导致脱落增加,落荚不具有原发优势,研究存留和脱落荚之间的生理差异,明确大豆落荚的生理学机制。调节剂可以影响植物在生活史中各个阶段的生长发育,提高某种物质的含量,增加关键酶的活性,提高对环境的适应性[3]。生产中使用较多的调节剂有促进型2-N、N-二乙氨基乙基己酸酯(diethyl aminoethyl hexanoate,DTA-6)和延缓型烯效唑(uniconazole,S3307),有研究报道DTA-6 和S3307能增加抗逆性[4-6],研究DTA-6和S3307对揭示调节剂的作用机理,提高大豆产量具有重要的现实意义。【前人研究进展】有关植物生长调节剂对花荚脱落调控的研究较多[7-11]。大豆花荚的形成或败育主要与2个内部生理因素有关即光合同化物供应的有效性[12-14]和植物内源激素的有效性[13-17]。DTA-6和S3307等调节剂可以诱导一些重要水解酶的出现[18-20],影响组织结构[21],或直接影响酶[22-24],调控光合产物[25]等。总之大豆花荚脱落机理和光合产物分配与DTA-6 和S3307调控有着重要的联系。【本研究切入点】同类研究多集中在调节剂对逆境的植株叶片抗性指标的研究,对脱落器官荚的研究较少,关于存留荚和脱落荚对比研究更少,施用DTA-6和S3307可能是通过内源激素信号传导调控了复杂的生理过程,改善大豆花荚脱落,实现增加大豆产量。【拟解决的关键问题】本研究在田间环境下,对大豆存留荚和脱落花荚生理指标的差异进行对比研究,探讨减少大豆花荚脱落的DTA-6、S3307处理和花荚脱落多的对照相关生理差异。研究调节剂改善花荚脱落机理,以期实现提高大豆单产的目的。
1 材料与方法
1.1试验材料
试验于2012年和2013年在黑龙江八一农垦大学林甸县大豆试验基地(大庆市林甸县N47°,E125°)进行,气候特点为半干旱地区,土壤类型为草甸黑钙土(N 178.5 mg·kg-1、P2O525.4 mg·kg-1、K2O 257.4 mg·kg-1、有机质3.08%、盐总量0.1%,pH7.88),土壤肥力中等,前茬为玉米。
以东北地区主栽不同基因型亚有限大豆品种绥农28(母本绥农14,父本绥农10,生育期120 d,株高110 cm,紫花、长叶、灰毛)、垦丰16(母本黑农34,父本垦农5号,生育期120 d,株高65 cm左右,白花、披针形叶、灰毛)、合丰50号(母本合丰35号,父本合95-1101,生育期120 d,株高90.3 cm,紫花、长叶)为研究材料。
植物生长调节剂 2-N、N-二乙氨基乙基己酸酯(diethyl aminoethyl hexanoate,DTA-6)为促进型调节剂,烯效唑(uniconazole,S3307)为延缓型。
1.2试验设计
2013年,选用2种调节剂的适宜浓度(在2012年调节剂喷施浓度和喷施时期筛选试验的基础上)60 mg·L-1DTA-6和 50 mg·L-1S3307,试验小区共6行,行长5 m,垄宽0.65 m,面积为19.50 m2,初花期(R1),采用叶面喷施法,喷施清水作为对照(CK),4次重复,单因素随机区组设计。机器播种,出苗后人工间苗,密度30万株·hm-2,人工除草,田间管理同常规。
从R1期(7月8日)喷施调节剂后第35天(R5)开始第1次取样,以后每隔7 d取样1次。采集存留和脱落的花荚,将荚皮与籽粒分开,液氮速冻30 min,取出置于-40℃保存备用。脱落荚中各时期以瘪荚居多,同一处理中籽粒和荚皮的同一指标值差异较大,因此,统一测定存留荚和脱落荚荚皮的各个指标。
1.3MDA、SOD、POD、可溶性蛋白质和可溶性糖的测定
取1 g荚皮,加入2 mL pH7.8磷酸缓冲液研磨,4℃,5 000 r/min离心20 min,上清液为粗酶液。采用硫代巴比妥酸显色法[26]测定MDA含量(mmol·g-1FW)。可溶性糖[26]计算公式为可溶性糖(mmol·L-1)=11.71 D450。采用愈创木酚法[26]测定POD活性(U·g-1FW),以1 min内A470值增加0.01所需的酶量为1个酶活单位(U)。采用氮蓝四唑(NBT)光化学还原法[26]测定 SOD活性(U·g-1FW),以抑制NBT光氧化还原50%时的酶量为1个酶活力单位(U)。考马斯亮蓝法测定可溶性蛋白质含量。
1.4AC测定
采用羧甲基纤维素钠盐(CMC-Na)法[27]测定AC含量。取荚0.5 g,加入2 mL pH7.2的磷酸缓冲液,0 —4℃冰浴中研磨提取,提取液倒入离心管中,4℃,12 000 r/min离心20 min,取上清液4℃保存,作为纤维素酶粗提液。取2支试管,分别加入1 mL酶液,然后在一支试管中加入 1 mL羧甲基纤维素钠(CMC-Na),在另一支试管中加入1 mL蒸馏水作为对照。将两支试管摇匀后,置电热恒温培养箱中40℃保温24 h,采用3,5-二硝基水杨酸比色法测定反应体系中还原糖的含量。以每小时生成l mg还原糖作为1个酶活单位。
1.5PG测定。
采用DNS显色反应法[28]测定PG含量,取花荚和脱落花荚0.5 g,加入2 mL pH5.0的磷酸-柠檬酸缓冲液,研磨提取,4℃,5 000 r/min离心,取上清液4℃保存,作为粗提液。于甲、乙两支25 mL比色管中加入5 mL 0.5%浓度果胶底物和4 mL磷酸-柠檬酸缓冲液,然后向甲比色管中加入1 mL稀释粗酶液,50℃水浴30 min。向乙管中加1 mL稀释粗酶液,立即放入沸水浴中煮沸5 min,终止反应,冷却;DNS法显色,以标准空白为基准调零,在540 nm处测吸光度值(吸光度要在0. 025—0.843)。
1.6数据分析
采用Excel 2003进行数据处理和作图,用Spss19.0进行方差分析。
2 结果
2.1DTA-6和S3307调控下大豆存留和脱落荚MDA的差别
3个品种CK脱落荚MDA含量显著高于CK存留荚(图1)。3个品种CK存留荚MDA含量相对稳定,脱落荚MDA含量在喷药后35—56 d,呈先增高再降低的趋势,说明大豆脱落荚质膜过氧化作用显著高于存留荚。DTA-6存留荚MDA含量除了在喷药后35 d,绥农28、垦丰16存留荚MDA含量均显著高于脱落荚,其他处理存留荚 MDA含量低于脱落荚。S3307存留荚MDA含量则是除了在喷药后35 d,绥农28和合丰50存留荚MDA含量显著高于脱落荚,其他S3307存留荚MDA含量均显著低于脱落荚。在喷药后35、42和49 d多个时间点上DTA-6或S3307存留荚MDA含量低于CK存留荚,推测DTA-6和S3307存在降低存留荚MDA含量的作用。
2.2DTA-6和S3307调控下大豆存留和脱落荚SOD的差别
CK存留荚SOD活性在喷药后35—42 d显著低于脱落荚,在喷药后56 d显著高于脱落荚,在喷药后49 d 3个品种表现各不相同(图2),还发现在3个品种中存留荚SOD活性表现为先降低再升高又降低的波动变化,CK脱落荚SOD活性呈不断降低的变化趋势。DTA-6 和S3307存留荚SOD活性在喷药后42—49 d显著低于脱落荚,在喷药后56 d整体上表现为存留荚SOD活性显著高于脱落荚,其他时间不同品种存在差异。DTA-6 和S3307存留荚SOD活性呈“抛物线状”变化,脱落荚SOD活性呈不断下降的变化趋势。可见存留荚SOD活性总体上显著低于脱落荚,二者的趋势曲线也存在差异。在喷药后42 d,DTA-6和S3307存留荚SOD活性显著高于CK存留荚,其他时间DTA-6或S3307存留荚SOD活性显著高于CK存留荚,说明DTA-6和S3307在多个时间点提高了存留荚的SOD活性。
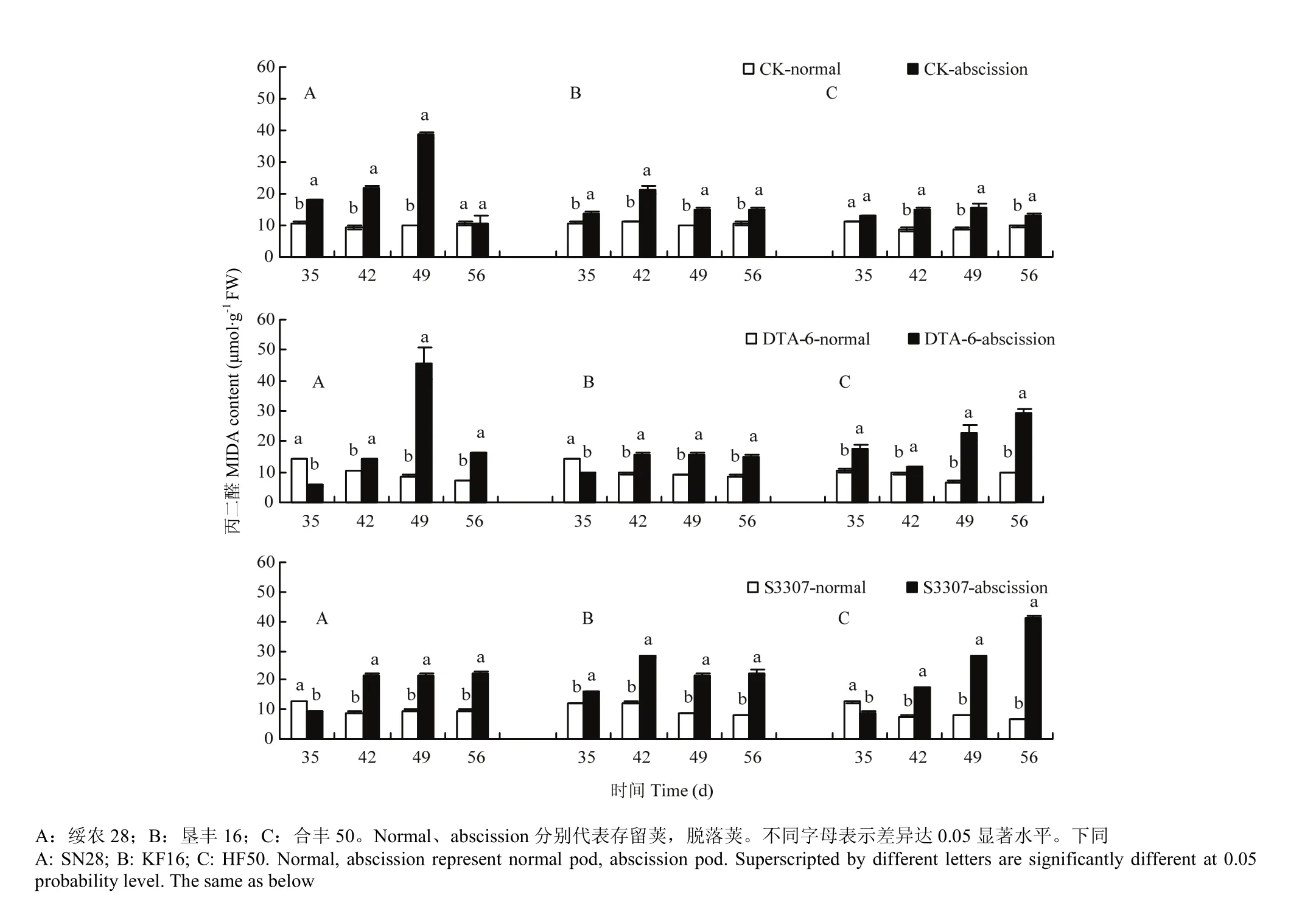
图1 调节剂调控存留和脱落荚MDA差别Fig. 1 Regulating differences between normal and abscission pods of MDA in soybean by PGRs
2.3DTA-6和S3307调控下大豆存留和脱落荚POD的差别
CK处理存留荚的POD活性在3个品种表现为先降低再升高又降低(图3),CK处理脱落荚POD活性变化趋势在3个品种上不完全一致,脱落荚的POD活性都显著高于存留荚。DTA-6和S3307存留荚POD活性整体上显著低于脱落荚;存留荚POD活性整体上在 3个品种上呈先增加再降低的变化趋势;脱落荚POD活性在品种绥农28和垦丰16呈“抛物线状”,合丰50 POD活性变化呈不断递增的趋势。部分品种DTA-6和S3307存留荚POD活性在喷药后42—49 d显著提高,在这一时间DTA-6和S3307有效提高存留荚POD活性效果较好。
2.4DTA-6和S3307调控下大豆存留和脱落荚PG的差别
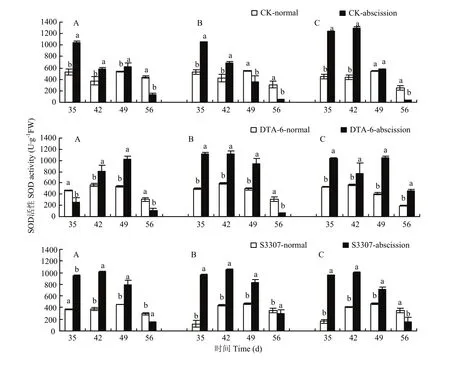
图2 调节剂调控存留和脱落荚SOD差别Fig. 2 Regulating differences between normal and abscission pods of SOD in soybean by PGRs
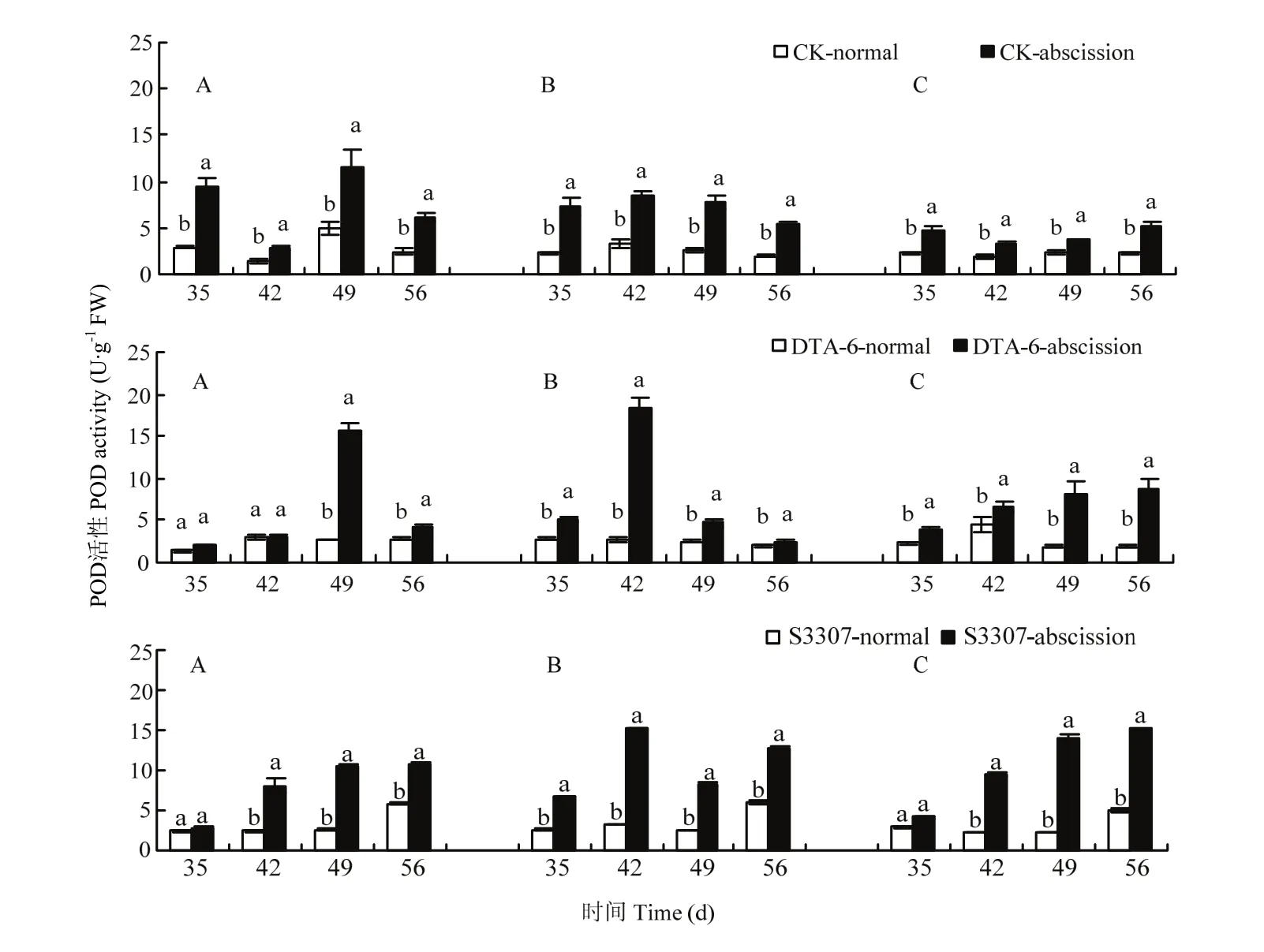
图3 调节剂调控存留和脱落荚POD差别Fig. 3 Regulating differences between normal and abscission pods of POD in soybean by PGRs
CK存留荚PG活性在喷药后35 d,仅在绥农28和垦丰16表现为显著高于CK脱落荚,在喷药后42 d后,3个品种存留荚PG活性显著高于CK脱落荚(图4)。DTA-6存留荚PG活性在喷药后42 d和56 d酶活性较高;脱落荚PG活性大致呈先增加再降低的变化趋势,最大值出现在喷药后42 d。S3307存留荚仅在喷药后42 d显著低于脱落荚,之后显著高于脱落荚。S3307存留荚PG活性和脱落荚也在喷药后42和56 d有最大值。结合田间大豆花荚脱落调查,发现喷药后42 d此期间是花荚集中脱落的高峰阶段,PG活性的升高证实了这一大豆脱落增加的生理状态;喷药后56 d PG活性比42 d高,此时田间并没有出现大量的花荚脱落现象,可能与大豆荚趋于成熟和植株自然衰老有关。在喷药后42和56 d,存留荚PG活性整体上CK>S3307 >DTA-6,证明DTA-6和S3307能够通过抑制PG活性来减少大豆花荚的脱落。
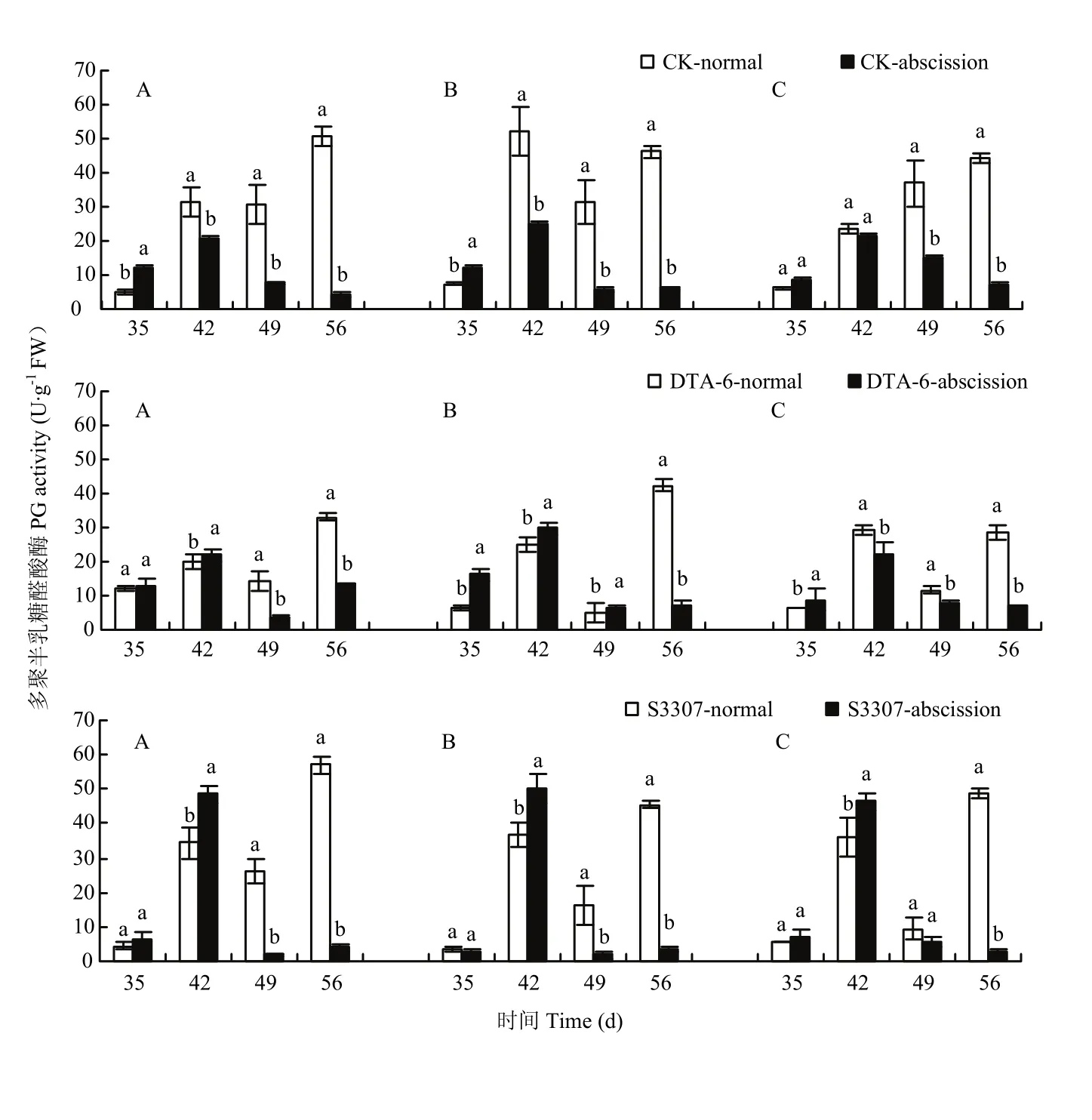
图4 调节剂调控存留和脱落荚多聚半乳糖醛酸酶差别Fig. 4 Regulating differences between normal and abscission pods of PG in soybean by PGRs
2.5DTA-6和S3307调控下大豆存留和脱落荚AC的差别
由图5可知,CK存留荚AC活性在喷药后35 d显著高于脱落荚,以后在3个品种上高低表现不尽相同,仍可以看出存留和脱落荚AC酶活性存在显著性差异。DTA-6存留荚PG活性除了在绥农28喷药后49 d,合丰50喷药后56 d显著低于脱落荚,其他都表现为显著高于脱落荚。DTA-6促进了在喷药后35—42 d 荚AC酶活性增加,控制了在喷药后49—56 d荚酶活性增加。S3307存留荚AC酶活性相对稳定,仅在喷药后 42 d表现为显著降低;整体显著高于脱落荚。S3307脱落荚AC酶活性在3个品种上表现不同,受田间环境影响较大。S3307控制了喷药后35—42 d的荚AC酶活性快速增加,在喷药后49—56 d S3307作用降低,荚AC酶活性接近CK。DTA-6和S3307存留和脱花荚AC活性与CK对比可知,S3307对荚AC活性的调控与DTA-6有所不同,2种调节剂的类型不同,调控过程不同;DTA-6和S3307不仅能够改善存留荚的AC活性,也改变了脱落荚的AC活性。
2.6DTA-6和S3307调控下大豆存留和脱落荚可溶性糖的差别

图5 调节剂调控存留和脱落荚脱落纤维素酶差别Fig. 5 Regulating differences between normal and abscission pods of AC in soybean by PGRs
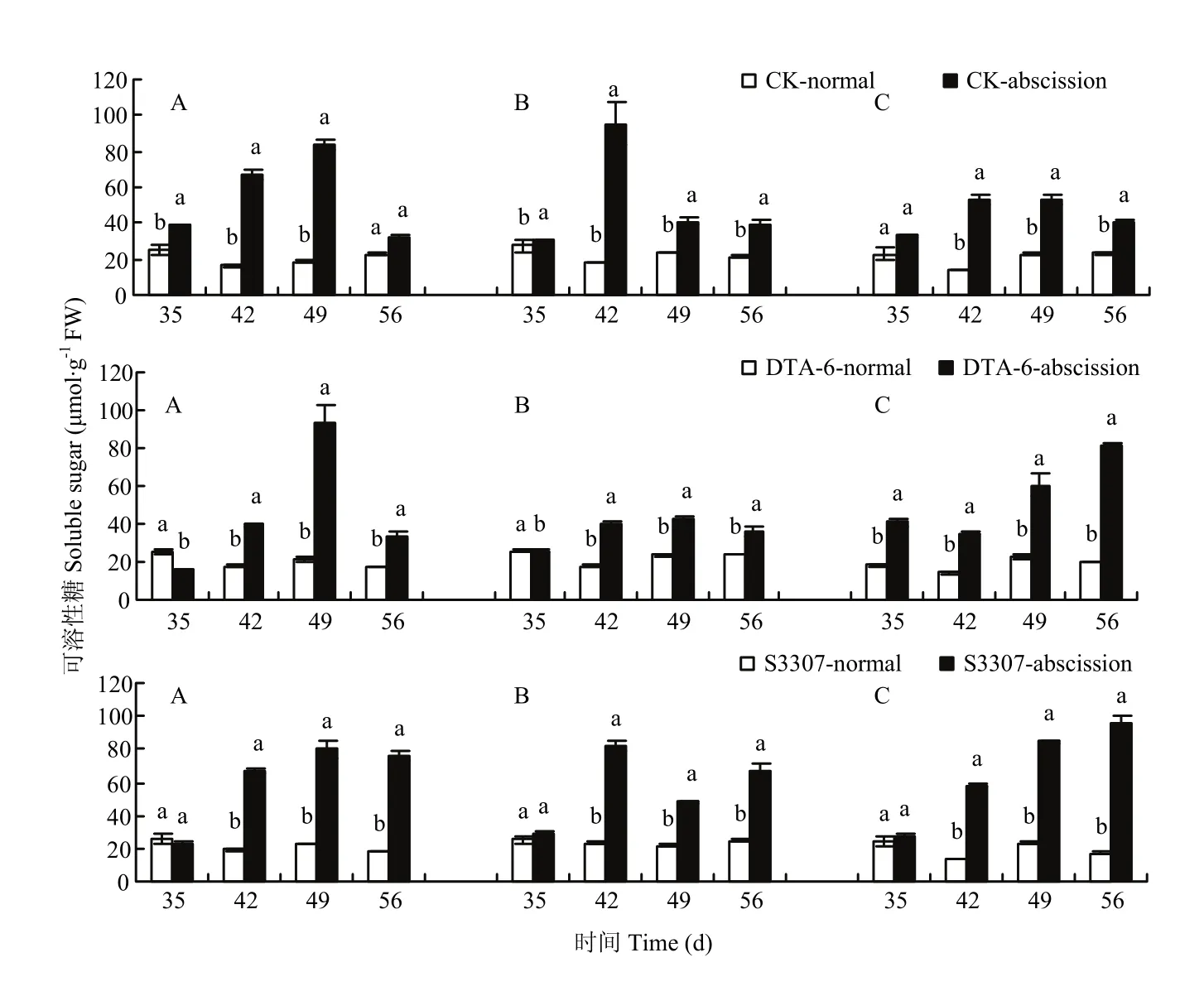
图6 调节剂调控存留和脱落荚可溶性糖差别Fig. 6 Regulating differences between normal and abscission pods of soluble sugar in soybean by PGRs
CK存留荚可溶性糖含量呈先降低再升高的变化趋势,在喷药后42 d有最低点(图6);CK脱落荚可溶性糖含量呈先升高再降低的变化趋势,最高点在42—49 d;CK存留荚可溶性糖含量显著低于脱落荚。DTA-6和S3307存留荚可溶性糖含量整体上显著低于脱落荚,仅在喷药后35 d有部分品种存留荚可溶性糖显著高于脱落荚高。3个品种DTA-6和S3307存留荚可溶性糖含量变化曲线不同,绥农28和垦丰16表现为先增加再降低,合丰50则呈不断增高,最大值在喷药后56 d。DTA-6和S3307改变了存留和脱落荚变化趋势。
2.7DTA-6和S3307调控下大豆存留和脱落荚可溶性蛋白质的差别
CK存留荚可溶性蛋白质含量显著低于脱落荚,二者变化趋势曲线不同,存留荚呈先降低再升高的变化趋势,脱落荚大体呈先升高再降低的变化趋势(图7)。DTA-6和S3307脱落荚可溶性蛋白质含量除了在喷药后35 d,整体显著高于存留荚。DTA-6 和S3307存留荚可溶性蛋白质含量变化幅度较小,脱落荚变化较大。DTA-6脱落荚可溶性蛋白质含量绥农28和垦丰16表现一致,与合丰50不同;S3307则大体呈不断增加的变化趋势。DTA-6和S3307调控了存留和脱落荚可溶性蛋白质的变化趋势,喷药后35 d,存留荚可溶性蛋白质含量高于脱落荚,可能与此时期处于籽粒发育早期荚营养供应相对充足有关。
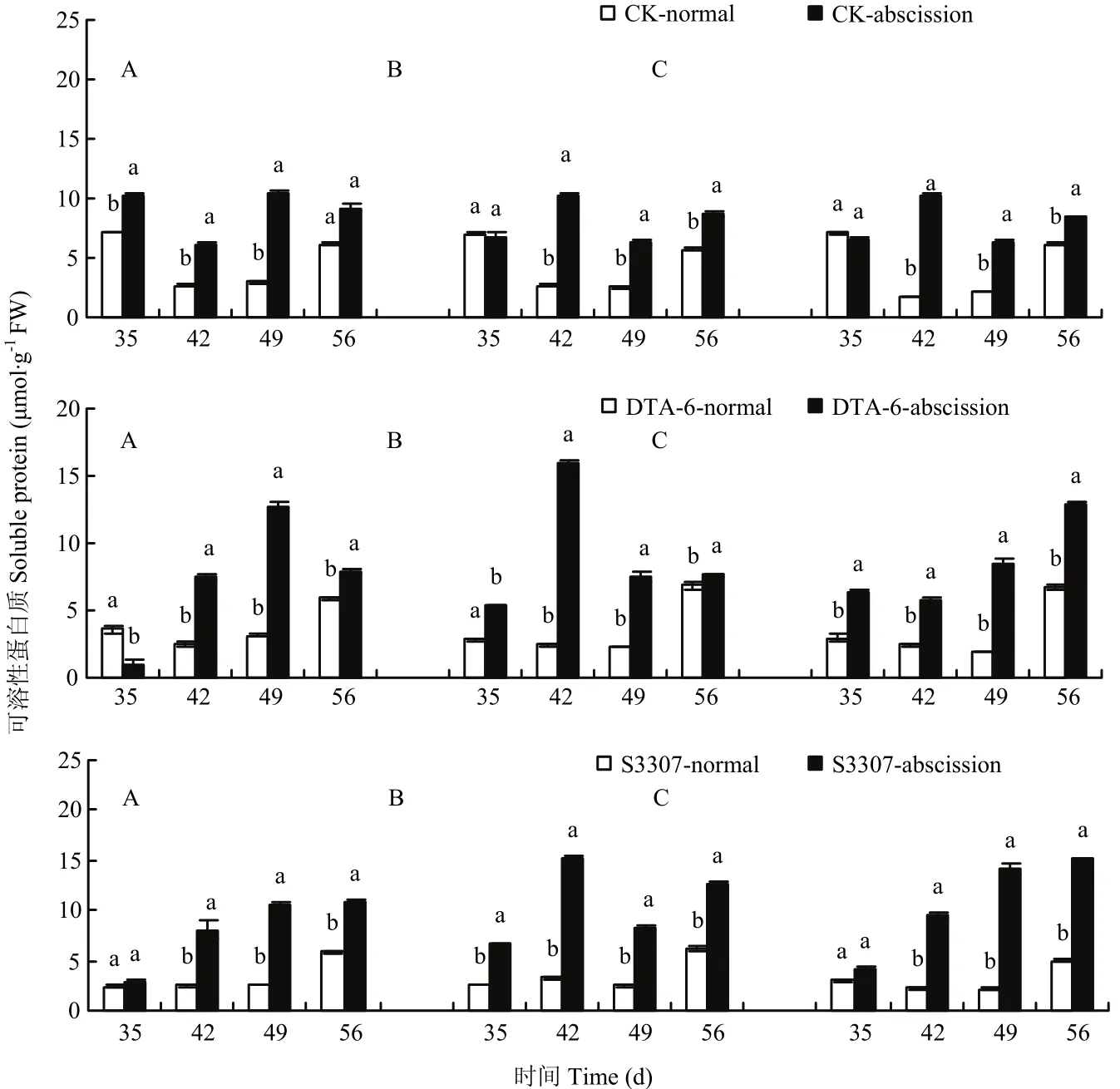
图7 调节剂调控存留和脱落荚可溶性的蛋白质差别Fig. 7 Regulating differences between normal and abscission pods of soluble protein in soybean by PGRs
3 讨论
黑龙江温带大陆性气候雨热同期,大豆开花结荚期正值炎热的夏季,通常受到高温与干旱阶段性胁迫,近年来受厄尔尼诺影响,洪涝频繁发生,都能够引起花荚的过量脱落,导致严重减产。施用DTA-6和S3307通过内源激素信号传导调控复杂的生理过程,改善大豆花荚脱落,实现增加大豆产量。促进型DTA-6和延缓型S3307处理大豆脱落荚和存留荚,其生理指标可能存在差别,然而本研究的脱落相关生理指标中哪些会有变化,这些变化和存留荚相比是增加还是降低,是值得关注和重点探讨的问题。
3.1DTA-6和S3307对大豆存留和脱落荚氧自由基代谢的影响
研究表明,随着荚发育进程,各个处理脱落荚中MDA含量、SOD、POD活性与存留荚存在显著差异,且脱落荚中MDA含量、SOD、POD活性显著高于存留荚。
衰老与脱落有一定的区别,但都有相似的结果。MCCORD等[29]提出生物自由基伤害学说,以活性氧、自由基的累积对器官衰老影响的研究取得了很大的进展。作物衰老过程中产生自由基,保护酶系的活性降低不能将其清除,细胞内自由基代谢平衡被破坏[19-20],引发衰老和器官脱落。本研究各处理脱落荚MDA含量显著高于存留荚,和前人的研究结果基本一致,分析认为脱落荚保护酶系统严重失衡,脱落荚质膜过氧化产物MDA含量的增加印证了这一点。脱落荚保护酶SOD和POD活性比存留荚增强,与前人衰老或脱落过程保护酶活性降低的结果不一致,很多研究认为某些激素或激素类物质如6-BA、GA3、多胺等也可清除活性氧,有研究认为一定条件下SOD活性弱,能够加速器官衰老脱落[30],郑殿峰等[22]研究表明,叶面喷施 DTA-6可调节叶片内源激素水平和保护酶的生理功能,有效控制叶片的衰老进程,认为出现这一现象在脱落过程中,除了S3307和DTA-6增加了荚SOD、POD活性,还有其他途径增加了保护酶活性,如应激反应等,但仍不能满足荚脱落过程中质膜修复的需要。
3.2DTA-6和S3307对大豆存留和脱落荚主要脱落酶影响
随着荚发育进程,各个处理脱落荚中AC、PG活性与存留荚存在显著差异,脱落荚中AC、PG活性显著低于存留荚。
宋莉萍等[19]研究认为叶面喷施植物生长调节剂能够降低大豆荚脱落率及多聚半乳糖醛酸酶活性,对大豆荚的脱落有一定的调控作用。本研究也有类似的结果,DTA-6和S3307处理荚的PG和AC酶活性有被降低的表现。随着大豆生育期的推进,脱落荚的脱落酶活性和存留荚变化趋势曲线近似,脱落荚酶活数值上大多数时间高于存留荚,与CK比,叶喷DTA-6 和S3307缩小了存留荚和脱落荚酶活的差距。国内研究者在水涨龙眼中发现,脱落幼果纤维素酶活性高出正常幼果37%[31]。存留脱落纤维素酶活性随着荚成熟衰老,脱落酶活性增加,与前人研究一致;脱落荚脱落纤维素酶活性显著低于存留荚与前人研究脱落后期脱落酶活性增加结果不一致。分析可能是荚内多种酶活性在脱落的过程和脱落后受当时田间环境影响较大。
3.3DTA-6和S3307对大豆存留和脱落荚可溶性糖和可溶性蛋白质影响
各个处理脱落荚中可溶性糖、可溶性蛋白质含量与存留荚存在显著差异,且脱落荚中可溶性糖、可溶性蛋白质含量显著高于存留荚。
植物器官叶、花和果实等的脱落除了受环境因素影响外,还受植物体内在因素如相关基因表达、内源激素代谢和养分、能量供应等综合影响。国外学者[32]用C14标记氨基酸的示踪试验结果表明,脱落发生时,离层细胞氨基酸和蛋白质的含量增加,与此同时,细胞内mRNA和rRNA的含量也增加,而在ABA诱导的脱落中,RNA和蛋白质能在几小时内迅速增加[33]。现有资料表明,这些蛋白质大部分是与脱落有关的酶[34]。说明相关酶基因表达量与酶活性和蛋白质含量有着重要的对应关系。在调控该基因表达的多种因素中,外源激素效果显著。施用人工植物生长调节剂DTA-6和S3307效果表现为通过内源激素调控了脱落相关的基因表达,降低了存留荚脱落相关酶和蛋白质的增加,这一结果在崔洪秋等[23]研究结果部分一致,还发现外施用DTA-6减少了AC酶对应的GmAC相对表达量,其他酶的基因表达量是否减少还有待进一步研究。可溶性糖是植物光合作用的直接产物,并可转化为其他化合物,是大豆产量形成的基础[35]。园艺学家通过长时间的观察发现,凡是糖类含量高的叶片和果实,不容易脱落;而糖类含量低的,则容易脱落。可溶性蛋白质是植物所有蛋白质组分中最活跃的一部分,包括各种酶源、酶分子和代谢调节物。有研究发现衰老过程中萌发绿豆子叶,小麦旗叶可溶性蛋白质含量也逐渐下降。各个处理大豆脱落荚可溶性物质比存留荚显著增加,与前人研究认为衰老降低的结果不一致。推测原因:器官不同,功能有所不同,作为“源”的叶片在衰老的过程中组织分解,成分降解为可在利用的养分运输到其他组织中,表现为可溶性糖和可溶性蛋白降低的结果,荚作为“库”是养分消耗和贮存器官,即使发生了分解和降解运出的也较少,多数都留在了器官中,出现可溶性糖和蛋白质显著增加的结果。
4 结论
4.1脱落后的荚生理指标状态与存留荚相比表现为质膜过氧化作用增强,保护酶系统的平衡被破坏,可溶性物质增加,脱落酶活性降低可能受脱落过程环境影响较大。脱落荚和存留荚生理相关指标存在差异,并受荚发育时期和品种影响。
4.2DTA-6和 S3307调控的存留荚具有较强的生理调控和自我修复能力,其膜损伤、渗透调节、保护酶系统、脱落酶活性降低等均对降低脱落有积极的响应。
References
[1] HEITHOLT J J, EGLI D B, LEGGETT J E. Characteristics of reproductive abortion in soybean. Crop Science, 1986, 26(3): 589-595.
[2] RYLOTT P D, SMITH M L. Effects of applied plant growth substances on pod set in broad plants (Vicia faba var. major). Journal of Agricultural Science, 1990, 114: 41-47.
[3] 傅华龙, 何天久, 吴巧玉. 植物生长调节剂的研究与应用. 生物加工过程, 2008, 6(4): 8-11. FU H L, HE T J, WU Q Y. Research and application on plant growth regulators. Chinese Journal of Bioprocess Engineering, 2008, 6(4):8-11. (in Chinese)
[4] ZHOU W, LEU M. Uniconazole-induced tolerance of rape plants to heat stress in relation to changes in hormonal levels, enzyme activities and lipid peroxidation. Plant Growth Regulation, 1999, 27(2): 99-104.
[5] ZHANG M C, DUAN L S, TIAN X L, HE Z P, LI J M, WANG B M,LI Z H. Uniconazole-induced tolerance of soybean to water deficit stress in relation to changes in photosynthesis, hormones and antioxidant system. Journal of Plant Physiology, 2007, 64(6):709-717.
[6] UPADHYAYA A, DAVIS T D, LARSEN M H, WALSER R H,SANKHLA N. Uniconazole-induced thermotolerance in soybean seedling root tissue. Physiologia Plantarum, 1990, 79(1): 78-84.
[7] SHAHRIHE W, TAHIR I. Flower senescence: Some molecular aspects. Planta, 2014, 239(2): 277-297.
[8] SHIMON M, SONIA P H, SRIVIGNESH S, SELVARAJ K S V,SHAUL B, RON O, BETTINA K, REID M S, JIANG C Z, AMNON L. Identification of defense-related genes newly-associated with tomato flower abscission. Plant Signaling&Behavior, 2011, 6(4):590-593.
[9] WAJJA-MUSUKWE N. Premature abscission of phaseolus bean pods:The role of plant growth substances. African Crop Science Journal,2010(1): 59-66.
[10] XIE R J, DENG L, JING L, HE S L, MA T, YI L, ZHENG Q. Recent advances in molecular events of fruit abscission. Biologia Plantarum, 2013, 57(2): 201-209.
[11] TAYLOR J E, WHITELAW C A. Signals in abscission. New Phytologist, 2001, 151: 323-340.
[12] HEITHOLT J J, EGLI D B, LEPGGET J E. Characteristics of reproductive abortion in soybean, Crop Science, 1986, 26: 589-595.
[13] KOKUBUN M. Honda I Intra-race mevariation in pod- set probability is associated with cytokine in content in soybeans. Plant Production Sicence, 2000, 3: 354-359
[14] YASHIMA Y, KAIHATSU A, NAKA JINA T. Effects of source /sink ratio and cytokine inapplication on pod set in soybean. Plant Production Science, 2005, 8: 139-144.
[15] 傅金民, 张庚灵, 史春余, 颜环环, 苏芳. 大豆开花后叶片衰老规律的研究. 西北植物学报, 2000, 20: 796-801. FU J M, ZHANG G L, SHI C Y, YAN H H, SU F. Senescence law of leaf after soybean flowering. Acta Botanica Boreali-Occidentalia Sinica , 2000, 20: 796-801. (in Chinese)
[16] 董钻. 大豆栽培生理. 北京: 中国农业出版社, 1997: 16-32. DONG Z. Soybean Cultivation Physiology. Beijing: China Agriculture Press, 1997: 16-32. (in Chinese)
[17] 戴玉玲, 张蜀秋, 杨世杰. 细胞分裂素对大豆种子发育时期同化物卸出及胚代谢的影响. 作物学报, 1998, 24(5): 613-617. DAI Y L, ZHANG S Q, YANG S J. Effect of CTK on assimilate unloading and metabolism of embryo in developing seeds of soybean. Acta Agronomica Sinica, 1998, 24(5): 613-617. (in Chinese)
[18] 宋莉萍, 刘金辉, 郑殿峰, 冯乃杰. 不同时期 PGRs对大豆花荚脱落率及纤维素酶活性的影响. 中国油料作物学报, 2011, 33:253-258. SONG L P, LIU J H, ZHENG D F, FENG N J. Regulation of plant growth regulators on abscission rate and cellulase activity of soybean flowers and pods. Chinese Journal of Oil Crop Sciences, 2011, 33:253-258. (in Chinese)
[19] 宋莉萍, 刘金辉, 郑殿峰, 冯乃杰. 不同时期叶喷植物生长调节剂对大豆花荚脱落率及多聚半乳糖醛酸酶活性的影响. 植物生理学报, 2011, 4: 356-362. SONG L P, LIU J H, ZHENG D F, FENG N J. Effects of different plant growth regulators on abscission rate and poly galacturonase activities of soybean flowers and pods by spraying in different stages. Plant Physiology Journal, 2011, 4: 356-362. (in Chinese)
[20] 宋莉萍. 不同时期叶施PGRs对大豆花荚的调控效应[D]. 大庆: 黑龙江八一农垦大学, 2011. SONG L P. Regulation on soybean flower and pod by foliage applying plant growth regulators in different development stages [D]. Daqing: Heilongjiang Bayi Agricultural University, 2011. (inChinese)
[21] 冯乃杰, 郑殿峰, 刘冰, 张玉先, 杜吉到, 梁喜龙. 三种植物生长物质对大豆叶茎解剖结构的影响. 植物生理学通讯, 2008, 127:351-354. FENG N J, ZHEN D F, LIU B, ZHANG Y X, DU J D, LIANG X L. Effects of plant growth substances on leaf and stem anatomical structure in Glycine max (Linn.) Merrill. Plant Physiology Communication,2008, 127: 351-354. (in Chinese)
[22] 郑殿峰, 赵黎明, 冯乃杰. 植物生长调节剂对大豆叶片内源激素含量及保护酶活性的影响. 作物学报, 2008, 34(7): 1233-1239. ZHENG D F, ZHAO L M, FENG N J. Effects of plant growth regulators (PGRs) on endogenous hormone contents and activities of protective enzymes in soybean leaves. Acta Agronomica Sinica, 2008,34(7): 1233-1239. (in Chinese)
[23] 崔洪秋, 冯乃杰, 孙福东, 刘涛, 李建英, 杜吉到, 韩毅强, 郑殿峰. DTA-6对大豆花荚脱落纤维素酶和 GmAC基因表达的调控.作物学报, 2016, 42(1): 51-57. CUI H Q, FENG N J, SUN F D, LIU T, LI J Y, DU J D, HAN Y Q,ZHENG D F. Regulation of DTA-6 by abscission cellulase and GmAC gene expression in flowers and pods of soybean. Acta Agronomica Sinica, 2016, 42(1): 51-57. (in Chinese)
[24] 赵黎明, 郑殿峰. 不同植物生长调节剂对大豆叶片保护酶活性及同化物代谢的影响. 华北农学报, 2008, 23(3): 106-111. ZHAO L M, ZHENG D F. Effects of different plant growth regulators (PGRs)on protective enzyme activity and metabolism assimilation in soybean leaves. Acta Agriculturae Boreali-Simia, 2008, 23(3):106-111. (in Chinese)
[25] 刘春娟, 冯乃杰, 郑殿峰, 宫香伟, 孙福东, 石英, 崔洪秋, 张盼盼,赵晶晶. 植物生长调节剂S3307和DTA-6对大豆源库碳水化合物代谢及产量的影响. 中国农业科学, 2016, 49(4): 657-666. LIU C J, FENG N J, ZHENG D F, GONG X W, SUN F D, SHI Y,CUI H Q, ZHANG P P, ZHAO J J. Effects of plant growth regulators S3307 and DTA-6 on carbohydrate content and yield in soybean. Scientia Agricultura Sinica, 2016, 49(4): 657-666. (in Chinese)
[26] 刘祖祺, 张石城. 植物抗性生理学. 北京: 中国农业出版社, 1994. LIU Z Q, ZHANG S C. Plant Resistance Physiology. Beijing: Chinese Agriculture Press, 1994. (in Chinese)
[27] 宋莉萍, 刘金辉, 郑殿峰, 冯乃杰. 不同时期 PGRs对大豆花荚脱落率及纤维素酶活性的影响. 中国油料作物学报, 2011, 33: 253-258. SONG L P, LIU J H, ZHEN D F, FENG N J. Regulation of plant growth regulators on abscission rate and cellulase activity of soybean flowers and pods. Chinese Journal of Oil Crop Sciences, 2011, 33:253-258. (in Chinese)
[28] 张飞, 岳田利, 费坚, 袁亚宏, 高振鹏. 果胶酶活力的测定方法研究. 西北农业学报, 2004, 13(4): 134-137. ZHANG F, YUE T L, FEI J, YUAN Y H, GAO Z P. Research on measuring method of PG activity. Acta Agriculture Borealioccidentalis Sinica, 2004, 13(4): 134-137. (in Chinese)
[29] MCCORD J M, FRIDOVICH I. Superoxide dismutase. An enzymic function for erythrocuprein (hemocuprein). Journal of Biological Chemistry, 1969, 244(22): 6049-6055.
[30] MCRAE D G, BAKER J E, THOMPSON J E. Evidence for involvement of the superoxide radical in the conversion of 1-aminocyclopropane-1-carboxylic acid to ethylene by pea microsomal membranes. Plant & Cell Physiology, 1982, 23(3): 375-383.
[31] 刘志成, 苏明华, 庄伊美. 龙眼生理落果中的纤维素酶、果胶酶活性及脱落酸含量. 热带亚热带植物学报, 1979, 5(3): 39-42. LIU Z C, SU M H, ZHUANG Y M. Cellulase and pectinase activities and ABA content in drop fruits of longan. Journal of Tropical and Subtropical Botany, 1979, 5(3): 39-42. (in Chinese)
[32] LEOPOLD A C. The mechanism of foliar abscission. Symposia of the Society for Experimental Biology, 1967, 21: 507-516.
[33] ABELES F B. Abscission regulation of senescence protein synthesis and enzymesretion by ethylene. Hort Science, 1971, 6: 371-376.
[34] GONZALEZ-BOSCH C, CAMPILLO E, BENNETT A B. Immunodetection and characterization of tomato endo-1,4-glucanase cell protein in flower abscission zones. Plant Physiology, 1997, 114:1541-1546.
[35] 王晓慧, 李大勇, 徐克章, 张治安, 武志海, 陈展宇, 杨光宇, 杨春明. 3种进化类型大豆叶片的某些生理特性比较. 植物生理学通讯,2006, 42(2): 191-194. WANG X H, LI D Y, XU K Z, ZHANG Z A, WU Z H, CHEN Z Y,YANG G Y, YANG C M. Comparison on some physiological characteristics of three evolution types of soybean. Plant Physiology Communications, 2006, 42(2): 191-194. (in Chinese)
(责任编辑 李莉)
Effects of DTA-6 and S3307 on Physiological Regulation in Normal and Abscission Pods of Soybean
CUI Hong-qiu1,2, FENG Nai-jie1, SUN Fu-dong1, LIU Chun-juan1, HE Tian-ming1, ZHAO Jing-jing1,LIU Yang1, GONG Shen1, SHI Chen2, ZHENG Dian-feng1
(1Agronomy College of Heilongjiang Bayi Agricultural University, Daqing 163319, Heilongjiang;2Heilongjiang Academy of Agricultural Science Daqing Branch, Daqing 163316, Heilongjiang)
【Objective】The objective of this experiment is to study the effects of plant growth promoter and plant growth retardator on the difference of physiology in normal and abscission pods of soybean during the pods development in the semi-arid area, to dicuss the physiological effects of plant growth regulator on reduction of the abscission of flowers and pods in soybean, andtry to find the ways to increase soybean output. 【Method】 Diethyl aminoethyl hexanoate(DTA-6), Uniconazole(S3307)and water were foliage sprayed at initial flowering (R1) stage of 3 varieties including Suinong 28 (SN28), Kenfeng 16 (KF16), and Hefeng 50 (HF50) in the Lindian county, Daqing city of Heilongjiang province in 2012 and 2013. The first time to take samples was 35 d (R5)after spraying, since then, the normal and abscission pods treated with CK and treatments were collected every seven days. The pod coats and seeds were separated, quick frozen for 30 min in the liquid nitrogen, and then stored in low temperature refrigerator(-40℃). Determination was carried out when all the samples were collected. The regulating differences of DTA-6 and S3307 between normal and abscission pods in oxygen free radical metabolism, related abscisic enzymes and soluble matter in soybean were determined and compared. 【Result】 The results demonstrated that during the pod development process, the malonaldehyde (MDA) content,superoxide dismutase (SOD) activity, peroxidase (POD) activity, soluble sugar and soluble protein of abscission pods were significantly higher than normal pods, the abscission cellulose (AC) activity, polygalacturonase (PG) activity in abscission pods were significantly lower than normal pods. DTA-6 and S3307 could regulate the physiology of normal and abscission pods in soybean. Although DTA-6 and S3307 showed different process in regulating effect, but both in the process had many similar results. The regulating effects of DTA-6 and S3307 showed as follows: DTA-6 and S3307 treatments decreased MDA content, improved SOD,POD activities in normal pods, and decreased AC and PG activities at pod-filling early stage in SN28 and KF16, but decreased at pod-filling late stage in HF50. The physiological difference of normal and abscission pods could change with the pods developmental process in soybean. The extents of increase and decrease were different during pods development process. The physiological difference was influenced by genetically controlled factors.【Conclusion】Compared with normal pods, the physiological indexes of abscission pods were improved, plasma membrane peroxidation was enhanced, balance of protective enzyme system was broken,soluble material were increased, related abscission enzymes activities reduced, and these were affected by environmental factors. The nomal pods regulated by DTA-6 and S3307 showed a positive response to biological membrane damage, osmotic adjustment,protective enzyme system, related abscission enzymes activity reduced, especially in improving the physiological regulation and self-repairing ability.
soybean; pods abscission; plant growth regulator; physiology; DTA-6; S3307
2016-03-07;接受日期:2016-04-25
国家自然科学基金(31171503)、国家“十二五”科技支撑计划(2012BAD20B04)、黑龙江省研究生创新科研项目(YJSCX2012-253HLJ)
联系方式:崔洪秋,E-mail:cuihongqiu@126.com。冯乃杰,E-mail:dqfnj@126.com。崔洪秋和冯乃杰为同等贡献作者。通信作者郑殿峰,E-mail:zdffnj@263.net
