灰树花抗氧化活性多酚的提取纯化及其鉴定
2016-09-16吕旭聪贾瑞博周文斌
吕旭聪,贾瑞博,李 燕,周文斌,刘 斌
(1.国家菌草工程技术研究中心,福建 福州350002;2.福建农林大学 食品科学学院,福建 福州 350002;3.阳光国际集团科技发展有限公司,福建 泉州 362000)
灰树花抗氧化活性多酚的提取纯化及其鉴定
吕旭聪1,2,3,贾瑞博1,2,李燕1,2,周文斌1,2,刘斌1,2
(1.国家菌草工程技术研究中心,福建 福州350002;2.福建农林大学 食品科学学院,福建 福州 350002;3.阳光国际集团科技发展有限公司,福建 泉州 362000)
以抗氧化活性为指标,通过单因素试验和正交试验对灰树花多酚提取工艺进行优化,确定最佳提取条件为提取时间2.5 h,提取温度70℃,料液比1∶50(g∶mL)。提取的多酚经大孔树脂NKA-Ⅱ动态吸附和解吸得到3个不同多酚组分,分别为体积分数为20%、40%及60%乙醇洗脱物。以DPPH自由基清除率、羟基自由基清除率以及总还原力为指标测定不同组分的抗氧化活性,结果表明,体积分数为40%乙醇洗脱物的抗氧化作用最强。采用高效液相色谱-串联质谱对体积分数为40%乙醇洗脱物多酚组分进行分离鉴定,通过对应的质谱结果分析可推测其中的多酚组分包括2-羟基丁二酸、香豆酸、3-羟基白藜芦醇、白藜芦醇、二羟基苯乙酸、咖啡酸和4-羟基苯甲酸等物质。
灰树花;多酚;大孔树脂;抗氧化;高效液相色谱-串联质谱
灰树花(Grifola frondosa)属担子菌亚门层菌纲非褶菌目多孔菌科树花菌属真菌[1],作为一种珍贵的食、药兼用蕈菌,灰树花的多种营养素和生理功效成分居各种食用菌之首,素有“食用菌王子”和“华北人参”之美誉。相关研究表明,灰树花具有增强免疫力、抑制肿瘤、抗病毒、抗氧化防衰老、稳定血压、降血糖血脂、改善脂肪代谢及缓解肝炎症状、增强记忆力等多种医疗保健功效[2-10]。然而,目前对灰树花功效成分的研究主要集中在多糖、蛋白质或肽类、糖蛋白或蛋白聚糖、脂类等[11],对多酚类物质及其活性研究相对较少。
人体内的氧化损伤与动脉粥样硬化、心血管疾病、糖尿病、肿瘤等多种疾病的发生密切相关[12]。近年来,食用菌的抗氧化作用开始受到关注,从食用菌中开发天然、高效,具有医疗保健功能的抗氧化食品或药品具有很高的开发价值和广阔的应用市场,己成为当今一个重要的研究方向[13]。多酚具有抗衰老、抗辐射、清除体自由基等功能,对心脑血管疾病的防治具有良好功效。研究表明,多酚是食用菌中起抗氧化作用的主要活性成分[14],陈向东等[15]从灰树花菌丝体中分离得到粉末状物质,应用光谱技术和化学鉴别试验证明其主要为多酚类物质,并采用红细胞氧化溶血和丙二醛(malondialdehyde)试验证实了灰树花多酚粗提物具有较强的抗氧化作用。但关于灰树花多酚的提取纯化工艺目前尚少见相关的研究报道,因此,本研究以总还原力为评价指标,首先通过单因素和正交试验对灰树花子实体具有抗氧化活性的多酚成分提取工艺进行优化,经大孔树脂NKA-Ⅱ动态吸附和解吸附制备不同的多酚组分,并对其抗氧化活性进行研究,并对抗氧化活性最强的多酚组分进行鉴定。本研究目的在于分离制备具有较强抗氧化活性的灰树花多酚组分,为灰树花多酚的进一步开发利用提供参考。
1 材料与方法
1.1材料与试剂
无水乙醇、磷酸二氢钠、磷酸氢二钠、氯化铁、三氯乙酸、福林酚、无水碳酸钠、硫酸亚铁、30%过氧化氢、浓盐酸、水杨酸、氯化亚铁、铁氰化钾,HPD-600大孔树脂(极性)、NKA-9(极性)、X-5(非极性)、NKA-Ⅱ(极性)、AB-8(弱极性)、HP-20(非极性)、D101(非极性)、S-8(极性)、聚酰胺以及HZ-801(非极性):国药集团化学试剂有限公司;没食子酸标准品、三羟甲基氨基甲烷、1,1-二苯基-2-三硝基苯肼:美国Sigma公司;甲醇、甲酸、乙酸、乙腈均为色谱纯:国药集团化学试剂有限公司;0.22 μm水相滤膜、0.22 μm有机相滤膜、一次性针管:北京索莱宝科技有限公司;灰树花干品:购自庆元县禾帝农产品专业合作社,粉碎,过80目筛备用。
1.2仪器与设备
HH-3A数显三用水浴锅:金坛市精达仪器制造厂;SC-3612低俗离心机:科大创新股份有限公司;EO2140电子分析天平:赛多利斯科学仪器北京有限公司;R201旋转蒸发仪:上海申生科技有限公司;DHG-9240A电热恒温干燥箱:上海一恒科技有限公司;TYPEFDU-1000冷冻干燥机:东京理化器械株式会社;TU-1810紫外可见分光光度计:普析通用有限公司;LC-20AT高效液相色谱仪:日本岛津公司;LCQ Deca XP Plus液相色谱-离子阱质谱联用仪:美国安捷伦公司。
1.3试验方法
1.3.1多酚组分提取单因素试验
精确称取灰树花粉末1.00 g,分别用不同体积分数(0、20%、40%、60%、80%、100%)乙醇,在不同提取温度(40℃、50℃、60℃、70℃、80℃、90℃),不同提取时间(30 min、60 min、90 min、120 min、150 min)及不同料液比(1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL))条件下处理,将抽滤后所得样液进行定容,取样液0.5 mL,补水至1 mL,测定总还原力,考察提取溶剂、提取温度、提取时间、料液比对抗氧化多酚物质提取的影响。
1.3.2多酚组分提取条件优化正交试验
在单因素提取试验的基础上,选择提取温度(A)、提取时间(B)、料液比(C)进行3因素3水平正交试验设计。以总还原力为评价指标,对灰树花抗氧化多酚的提取工艺条件进行优化。正交试验因素与水平见表1。

表1 提取条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for extraction conditions optimization
1.3.3灰树花多酚类物质的含量测定及分离纯化
(1)没食子酸标准曲线的绘制[16]
吸取0、10.0 mg/L、20.0 mg/L、30.0 mg/L、40.0 mg/L、50.0 mg/L的没食子酸标准使用液各1.0 mL,分别加5.0 mL水,1.0 mL福林-酚试剂和3.0 mL碳酸钠溶液,混匀,没食子酸标准溶液质量浓度分别为0、1.0 mg/L、2.0 mg/L、3.0 mg/L、4.0 m/L、5.0 mg/L,显色,放置2 h,以蒸馏水管为空白,在765 nm波长处测定标准溶液的吸光度值,以没食子酸质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制标准曲线。得到回归方程为y=0.014 9x+0.005 0,相关系数R2=0.999 3,标准曲线的拟合度良好,可以用于灰树花多酚含量的测定。
(2)大孔树脂的优选
分别精确称取预处理好的大孔树脂HPD-600(极性)、NKA-9(极性)、X-5(非极性)、NKA-Ⅱ(极性)、AB-8(弱极性)、HP-20(非极性)、D101(非极性)、S-8(极性)、HZ-801(非极性)和聚酰胺各5 g,加入样液100 mL,振荡吸附12 h,测定多酚的含量,从而确定各型号大孔树脂的吸附率和解吸率。以优选的大孔树脂为填料柱层析,用体积分数为20%、40%、60%和80%的乙醇以1.0 mL/min的流速进行洗脱,每个浓度洗脱2个柱体积,收集不同的洗脱液洗脱样品。
1.3.4多酚组分的抗氧化活性测定
(1)羟基自由基(·OH)清除能力[17]
取不同浓度待测样品溶液1 mL,加入9 mmol/L FeSO41 mL、9 mmol/L水杨酸-乙醇溶液1 mL,最后加8.8 mmol/L H2O21 mL启动反应,在37℃水浴下反应30 min,在波长510 nm下测定各浓度溶液的吸光度值。由于H2O2与Fe2+混合会产生·OH,而水杨酸会捕捉·OH并产生有色物质,由于样品本身存在吸光度值,则以9 mmol/L FeSO41 mL、9 mmol/L水杨酸-乙醇溶液1 mL各自加入不同浓度的样品溶液1 mL以及蒸馏水1 mL作为样品的对照吸收值(即蒸馏水代替8.8 mmol/L H2O2)。按下式计算·OH清除率:
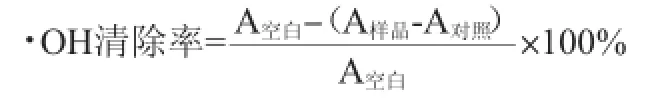
(2)DPPH·清除能力的测定[18]
取2.0 mL不同浓度待测样品溶液,加入0.2 mmol/L DPPH·乙醇溶液2.0 mL,混合均匀后避光放置30 min,在波长517 nm处测定其吸光度值。以2.0 mL体积分数为95%乙醇代替样品为空白对照;以2.0 mL样品与2.0 mL体积分数为95%乙醇混合液为样品对照,以消除样品本身颜色的影响。DPPH·清除率的计算公式如下:
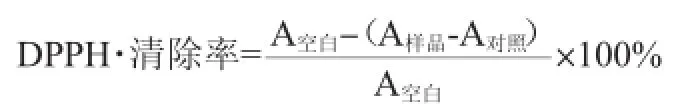
(3)总还原力测定[19]
在试管中分别加入0.2 mol/L pH 6.6的磷酸缓冲液2.5 mL和不同浓度的待测样品溶液1 mL,加入2.5 mL 1%铁氰化钾溶液,混合均匀后于50℃水浴中反应20 min。取出后迅速冷却并加入2.5 mL 10%三氯乙酸终止反应,3 500 r/min离心10 min。取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL 0.1%三氯化铁溶液,混匀后静置10 min,在700 nm波长处测定各溶液的吸光度值A700nm。以吸光度值反映总还原力,吸光度值越大说明还原能力越强。还原力的计算公式如下:

1.3.5多酚组分的HPLC-MS分析
高效液相色谱条件:Agilent ZORBAX SB-Aq色谱柱(4.6 mm×250 mm,5 μm);检测器二极管阵列检测器(diode array detector,DAD);甲醇(A)和0.1%甲酸溶液(B)作为HPLC流动相,洗脱程序为0~30 min:A(5%)+B(95%)→A(60%)+B(40%);30~35 min:A(60%)+B(40%)→A(5%)+B(95%);35~45 min:A(5%)+B(95%)。流速1.0 mL/min;检测波长为280 nm;柱温维持在30℃;进样量为10 μL。
质谱条件:电喷雾离子源(electronic spay ion,ESI),电压为3.0 kV,孔电压20 V,离子源温度130℃,解离温度350℃,结合光谱在负离子模式进行质谱分析,质谱分析范围50~600 m/z。
鉴定方法:一级质谱确定的准分子离子通过欧洲Phenol-Explorer多酚数据库网站http://phenol-explorer.eu/进行鉴定,推测可能的多酚组分,即:通过高效液相色谱串联质谱(high-performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法得出各个色谱峰的分子质量,然后通过质谱得到的分子质量在多酚数据库中搜索相应的多酚种类。然后利用二级质谱碎片离子确定灰树花活性多酚组分的多酚类物质。
2 结果与分析
2.1单因素试验结果
2.1.1不同提取溶剂对多酚总还原力的影响的影响
在提取温度80℃、提取时间2 h、料液比1∶40(g∶mL)的条件下,探究不同提取溶剂对灰树花多酚总还原力的影响,结果如图1所示。
由图1可知,灰树花提取液的总还原力随着乙醇体积分数的升高呈现显著下降趋势。随着乙醇体积分数的升高,溶剂的极性逐渐减弱,这表明极性较强的组分表现出强的抗氧化活性。本研究主要针对抗氧化活性强多酚类物质进行研究,所以选择水(乙醇体积分数0)作为提取溶剂。
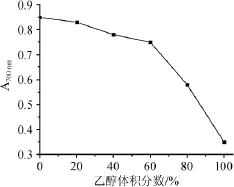
图1 不同乙醇体积分数对多酚的总还原力的影响Fig.1 Effect of different ethanol concentration on total reducing power of polyphenols
2.1.2不同提取温度对多酚提取的影响
在以水为提取溶剂、提取时间2 h、料液比1∶40(g∶mL)的条件下,探究不同提取温度对多酚总还原力的影响结果见图2。
由图2可知,提取温度升高,能够促进灰树花抗氧化多酚类物质的溶出,当提取温度>80℃,其总还原力降低,可能是由于其多酚组分热不稳定性,温度过高会导致其活性成分破坏,导致还原力减弱。因此,选择最佳提取温度为80℃。
2.1.3不同料液比对多酚提取的影响
在以水为提取溶剂、提取时间2h、提取温度80℃的条件下,探究不同料液比对多酚总还原力的影响结果见图3。
由图3可知,随着料液比增加,多酚类物质能够被更好的浸渍出来,总还原力增加,当料液比为1∶40(g∶mL)时,总还原力达到最大,料液比>1∶40(g∶mL)之后,对多酚组分的总还原力影响较小。因此,选择最佳提取料液比为1∶40(g∶mL)。

图3 不同料液比对多酚总还原力的影响Fig.3 Effect of different material-liquid ratio ontotal reducing power of polyphenols
2.1.4不同提取时间对多酚提取的影响
在以水为提取溶剂、提取温度80℃、料液比1∶40(g∶mL)的条件下,探究不同提取时间对多酚总还原力的影响结果见图4。
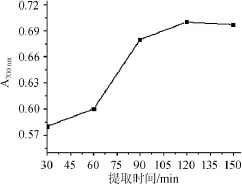
图4 不同提取时间对灰树花多酚总还原力的影响Fig.4 Effect of different extraction time on total reducing power of polyphenols
由图4可知,随着提取时间的增加,灰树花多酚提取率增大,总还原力也随之增大,呈正效应关系;当提取时间为120 min时,总还原力最大,为0.69;当提取时间>120 min后,所测得的灰树花总还原力无显著提升。因此,选择最佳提取时间为120 min。
2.2提取条件优化正交试验结果

表2 提取条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for extraction conditions optimization
由表2可知,提取温度、提取时间和料液比3个因素对提取物的总还原力均有一定的影响,其影响程度为B>C>A,其中,提取时间是影响多酚提取的最关键因素,提取温度的影响最小。极差分析还显示最佳提取条件组合为A1B3C3,即抗氧化多酚提取的最佳工艺为提取时间2.5 h,提取温度70℃,料液比1∶50(g∶mL)。此最佳条件下,提取物总还原力为0.89。
2.3多酚的分离纯化结果
2.3.1多酚大孔吸附树脂优选
不同大孔树脂对灰树花多酚的吸附率及解吸率结果见图5。由图5可知,非极性大孔树脂HP-20、X-5、D101,弱极性AB-8,以及极性大孔树脂S-8、NKA-Ⅱ、NKA-9、HPD-600对灰树花多酚的吸附率均较高,其中NKA-Ⅱ的解吸率相对较高,达69.7%,故本试验选用了NKA-Ⅱ型大孔树脂作为多酚的柱层析填料。NKA-Ⅱ型大孔树脂为红棕色不透明球状颗粒,比表面积为160~200 m2/g。相关研究报道了核桃饼粕、红皮云杉球果、粒毛盘菌的抗氧化多酚物质分别采用了HDP-100、D101和X-5等非极性树脂进行分离纯化[20-22],与本研究灰树花多酚的纯化所采用的NKA-Ⅱ型大孔树脂极性不一样,这可能是由于灰树花抗氧化多酚与此类抗氧化多酚类物质的种类不一样。
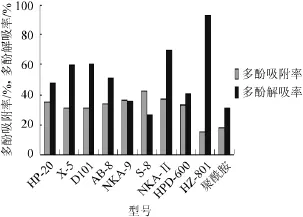
图5 大孔树脂筛选结果Fig.5 Screening results of macroporous resin
2.3.2NKA-Ⅱ型大孔树脂柱层析结果

图6 不同洗脱组分的多酚含量Fig.6 The polyphenol content of different elution components
由图6可知,灰树花多酚的极性较强,大部分在体积分数为20%乙醇洗脱时被洗脱下来。所测定体积分数为20%乙醇洗脱,体积分数为40%乙醇洗脱和体积分数为60%乙醇洗脱得到的多酚质量浓度分别为3.05 μg/mL,0.65 μg/mL和0.11 μg/mL。
2.4多酚组分的抗氧化活性研究
将大孔树脂纯化得到了体积分数为20%乙醇、40%乙醇及60%乙醇洗脱液。分别测定了这三个组分的羟基自由基清除率、DPPH自由基清除率和总还原力,其结果见图7,半抑制浓度结果见表3。
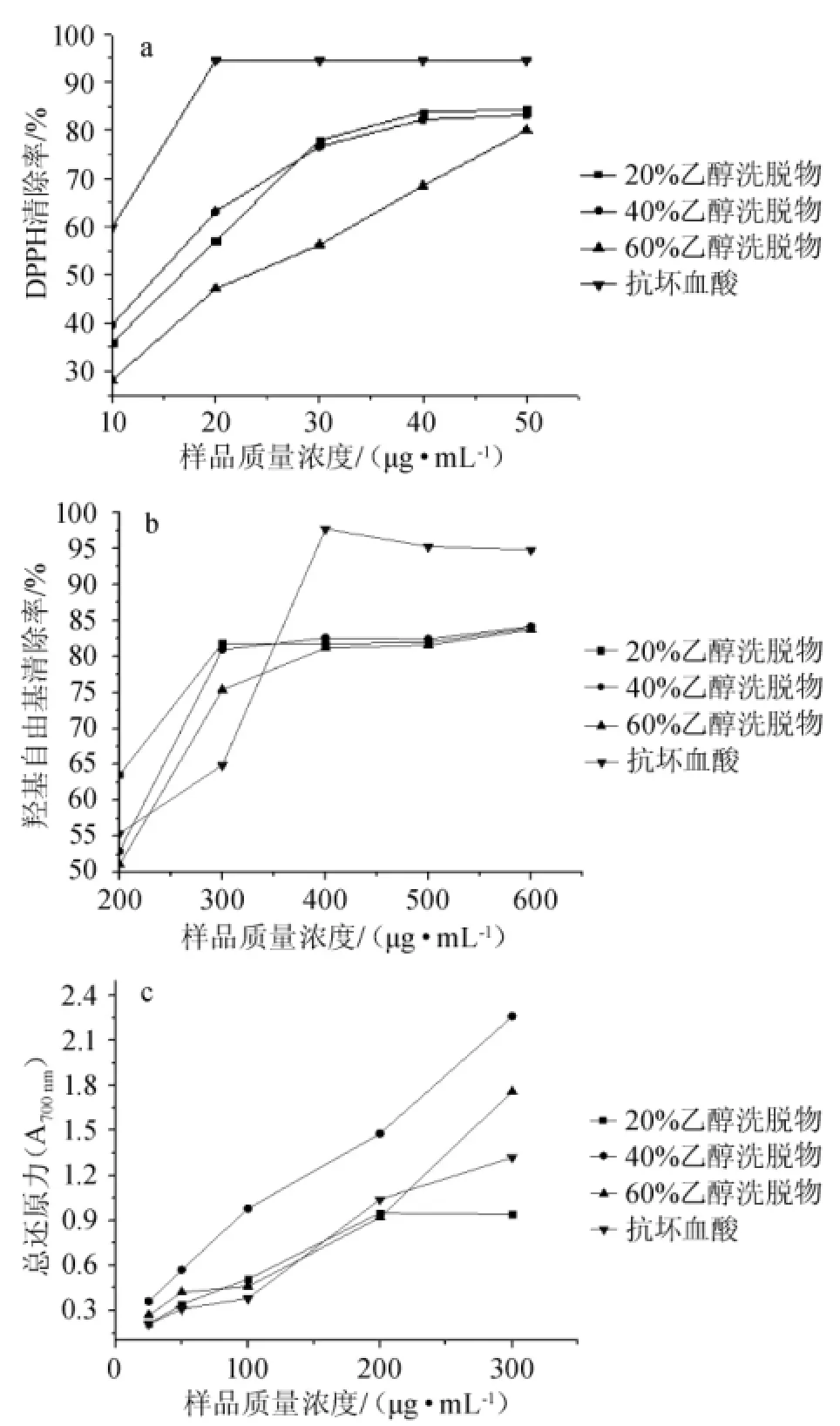
图7 不同洗脱多酚组分的DPPH自由基(a)、羟基自由基(b)清除率及总还原力(c)Fig.7 The scavenging rate of DPPH free radical(a),hydroxyl free radical(b)and total reducing power(c)of different elution polyphenols components
由图7可知,不同质量浓度的样品DPPH清除力见图7a,各样品均具有一定的DPPH清除力,在一定的浓度范围内,显一定的量效关系,其中40%乙醇洗脱物的DPPH清除力优于60%的乙醇洗脱液。由图7b可知,各样品均具有一定的羟自由基清除力,低质量浓度的样品羟自由基清除力甚至优于抗坏血酸。由图7c可知,40%的乙醇洗脱液总还原力优于当前公认的抗氧化剂(抗坏血酸)。
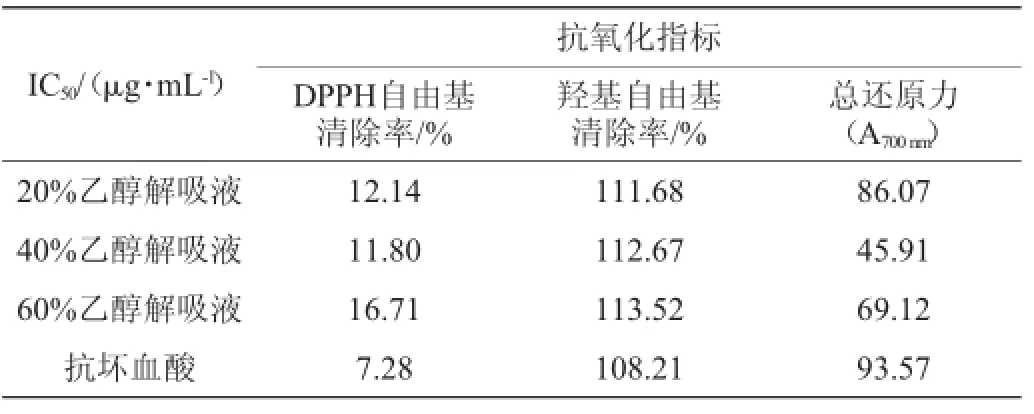
表3 抗氧化半抑制浓度Table 3 The half inhibitory concentration of antioxidant
半抑制浓度越小,表明其抗氧化效果越好。由表3可知,抗坏血酸的总还原力半抑制浓度为93.57 μg/mL,体积分数为20%、40%和60%乙醇解吸液的总还原力半抑制浓度分别为86.07μg/mL、45.19μg/mL和69.12μg/mL,DPPH自由基清除率半抑制浓度分别为12.41 μg/mL、11.80 μg/mL、16.71 μg/mL,羟基自由基清除率半抑制浓度分别为111.68 μg/mL、112.67 μg/mL、113.52 μg/mL。结果表明,3个组分都具有一定的抗氧化活性,其中体积分数为40%乙醇洗脱组分具有较强的抗氧化活性,其还原力甚至优于当前公认的抗氧化剂抗坏血酸。
2.5灰树花多酚液质联用分析结果
对体积分数为40%乙醇洗脱物的灰树花多酚组分进行鉴定,HPLC-MS/MS图结果见图8,各组分鉴定结果见表4。

图8 灰树花活性多酚组分HPLC-MS/MS图谱Fig.8 The HPLC-MS/MS spectrogram ofGrifola frondosa polyphenol components
经一级质谱测得的分子离子(m/z)通过欧洲Phenol-Explorer数据库网站http://phenol-explorer.eu/进行初步鉴定,推测可能的多酚种类;然后利用二级质谱碎片离子确定灰树花活性多酚组分。由表4可知,体积分数为40%乙醇洗脱的灰树花多酚组分包括2-羟基丁二酸(marlic acid)、香豆酸(coumaric acid)、3-羟基白藜芦醇(piceatannol)白藜芦醇(resveratrol)、二羟基苯乙酸(3,4-dihydroxyphenylacetic acid)、咖啡酸(caffeic acid)和4-羟基苯甲酸(4-hy-droxy-ben-zoic acid)等。图8中某些色谱峰由于没有找到相应的质谱数据参考值,还需要进行多级质谱解析才能进一步确定;这些色谱峰也有可能是新的组分,需要进一步采用核磁共振波谱才能够准确地进行结构解析和鉴定。
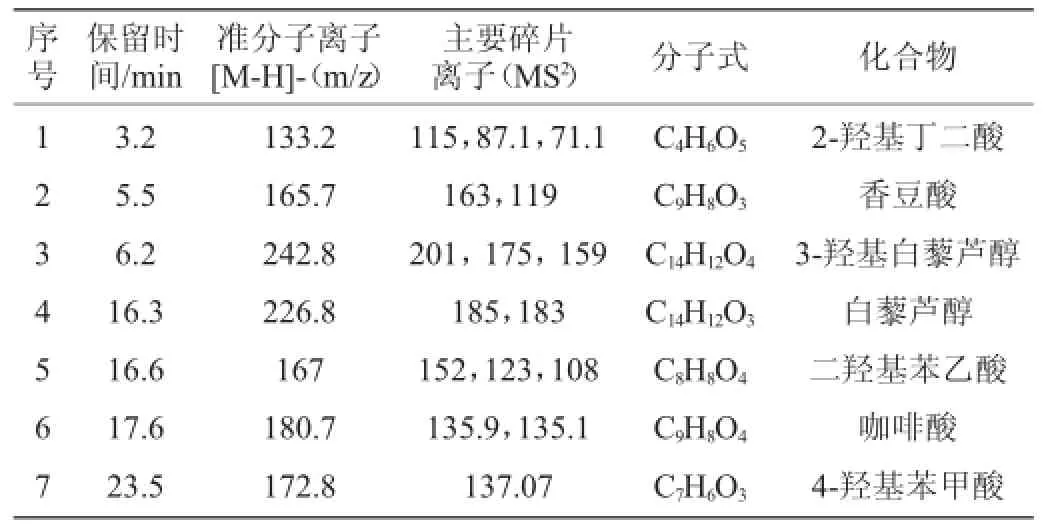
表4 40%乙醇洗脱的灰树花多酚组分HPLC-MS/MS鉴定结果Table 4 HPLC-MS/MS analysis was conducted to identify the composition of the 40%EE
3 结论
采用单因素及正交试验对多酚提取条件进行优化,确定最佳提取条件为提取时间2.5 h,提取温度70℃,料液比1∶50(g∶mL),此最佳条件下总还原力为0.89。
选择NKA-Ⅱ型大孔树脂,然后采用大孔树脂动态吸附和解吸附得到了灰树花3个不同的多酚组分,分别为体积分数为20%、40%和60%乙醇洗脱物。
针对灰树花多酚洗脱组分测定了DPPH自由基清除率、羟基自由基清除率以及总还原力,结果得到3个组分都具有一定的抗氧化活性,体积分数为40%乙醇洗脱物的抗氧化活性最强。
通过体积分数为40%乙醇洗脱的灰树花多酚组分进行鉴定,结果表明,40%乙醇洗脱物中的多酚组分主要是2-羟基丁二酸(marlic acid)、香豆酸(coumaric acid)、3-羟基白藜芦醇(piceatannol)白藜芦醇(resveratrol)、二羟基苯乙酸(3,4-dihydroxyphenylacetic acid)、咖啡酸(caffeic acid)和4-羟基苯甲酸(4-hydroxy-benzoic acid)等。此外,还有一些多酚组分没有找到相应的参考值,还需进行多级质谱解析鉴定,也有可能是一些新的多酚组分,需要进一步采用核磁共振波谱才能进行结构解析和鉴定。
[1]边杉,叶波平,奚涛,等.灰树花多糖的研究进展[J].药物生物技术,2004(1):60-64.
[2]李丽.食用菌的营养成分和活性研究进展[J].食品研究与开发,2015(12):139-142.
[3]KLAUS A,KOZARSKI M,VUNDUK J,et al.Biological potential of extracts of the wild edible Basidiomycete mushroomGrifola frondosa[J]. Food Res Int,2015,67(67):272-283.
[4]GU C Q,LI J W,CHAO F H.Inhibition of hepatitis B virus by D-fraction fromGrifola frondosa:synergistic effect of combination with interferon-alpha in HepG 2 2.2.15[J].Antivir Res,2006,72(2):162-165.
[5]ITO K,MASUDA Y,YAMASAKI Y,et al.Maitake beta-glucan enhances granulopoiesis and mobilization of granulocytes by increasing G-CSF production and modulating CXCR4/SDF-1 expression[J].Int Immunopharm,2009,9(10):1189-1196.
[6]KONNO S.Synergistic potentiation of D-fraction with vitamin C as possible alternative approach for cancer therapy[J].Int J Gen Med,2009(2):91-108.
[7]LEI H,MA X,WU W.Anti-diabetic effect of anα-glucan from fruit body of maitake(Grifola frondosa)on KK-Ay mice[J].J Pharm Pharmacol,2007,59(4):575-582.
[8]SMITH H,DOYLE S,MURPHY R.Filamentous fungi as a source of natural antioxidants[J].Food Chem,2015,185(10):389-397.
[9]CHOI D Y,LEE Y J,JIN T H,et al.Antioxidant properties of natural polyphenols and their therapeutic potentials for Alzheimer's disease[J]. Brain Res Bull,2012,87(2-3):144-153.
[10]HERVERT-HERNÁNDEZ D,GARC A O P,ROSADO J L,et al.The contribution of fruits and vegetables to dietary intake of polyphenols and antioxidant capacity in a Mexican rural diet:Importance of fruit and vegetable variety[J].Food Res Int,2011,44(5):1182-1189.
[11]郭予斌,李洽胜,吴昭晖,等.灰树花化学成分和药理作用的研究进展[J].药物评价研究,2011(4):283-288.
[12]MARGAILL I,PLOTKINE M,LEROUET D.Antioxidant strategies in the treatment of stroke[J].Free Radical Bio Med,2005,39(4):429-443.
[13]侯军,刘方,李乐,等.真菌来源的抗氧化活性物质研究进展[J].食品科学,2008,29(9):648-653.
[14]吴锦文.食用菌的医疗保健作用及其发展趋势[J].生物学通报,1999(9):18-19.
[15]陈向东,刘晓雯,吴梧桐.灰树花多酚的提取和活性研究[J].食品与生物技术学报,2005(4):26-30.
[16]庞伟.苹果多酚的分离纯化及抗氧化性研究[D].西安:西北大学硕士论文,2007.
[17]邵佳,郁建平,胡美忠.草珊瑚水溶性粗多糖提取及抗氧化性能研究[J].食品科学,2007,28(11):283-286.
[18]SHIMADA K,FUJIKAWA K,YAHARA K,et al.Antioxidative properties of xanthan on the autoxidation of soybean oil in cycloextrin emulsion[J].J Agr Food Chem,1992,40(6):945-948.
[19]OYAIZU M.Studies on products of browning reaction-antioxidative activities of products of browning reaction prepared from glucosamine[J]. Jap J Nutr,1986,44(6):307-316.
[20]梁杏,张旭,陈朝银,等.核桃饼粕多酚纯化工艺及其抗氧化活性的研究[J].中国酿造,2015,34(4):55-61.
[21]邓心蕊,王振宇,刘冉,等.红皮云杉球果乙醇提取物的抗氧化功能研究[J].北京林业大学学报,2014(2):94-101.
[22]曹焕英,孙丹宇,杨柳,等.粒毛盘菌DP5胞外多酚的提取及抗氧化活性研究[J].安徽农业科学,2015(17):12-14.
[23]DORA M,CHIARA C,GIORGIO M,et al.Identification of phenolic constituents inCichorium endiviavar.crispum and var.latifolium salads by high-performance liquid chromatography with diode array detection and electrospray ioniziation tandem mass spectrometry[J].J Agr Food Chem,2012,60(49):12142-12150.
Purification and identification of polyphenols with antioxidant activity fromGrifola frondosa
LV Xucong1,2,3,JIA Ruibo1,2,LI Yan1,2,ZHOU Wenbin1,2,LIU Bin1,2
(1.National Engineering Technology Research Center of JUNCAO,Fuzhou 350002,China;2.College of Food Science,Fujian Agriculture and Forestry University,Fuzhou 350002,China;3.Sunshine International Group Technology Development Co.,Ltd.,Quanzhou 362000,China)
Using antioxidant activity as the index,the extraction processes of polyphenols inGrifola frondosawere optimized by single factor and orthogonal experiments.The optimum extraction conditions were determined as followed:extraction time 2.5 h,temperature 70℃and solid-liquid ratio 1∶50(g∶ml).The extracted polyphenols were dynamic adsorbed and desorbed dynamically by macroporous resin NKA-Ⅱ,three different polyphenols components(20%,40%and 60%ethanol elution(EE))were obtained.Using DPPH free radical scavenging rate,hydroxyl free radical scavenging rate and the total reducing power as indexes,the antioxidant activity of the different components were determined.The results showed that the antioxidant activity of 40%EE was the strongest.40%EE polyphenols component was isolated and identified by HPLC-MS/MS.Mass spectrometry analysis results showed that 2-hydroxy succinic acid,cumaric acid,3-hydroxy resveratrol,dihydroxyphenylacetic acid,caffeic acid and 4-hydroxybenzoic acid were the main components in the 40%EE.
Grifola frondosa;polyphenols;macroporous resin;antioxidant activity;HPLC-MS/MS
TS255.1
0254-5071(2016)03-0074-06
10.11882/j.issn.0254-5071.2016.03.017
2015-12-20
中国博士后科学基金项目(2015M570549);福建省教育厅科技计划项目A类课题(JA14107)
吕旭聪(1984-),男,助理研究员,博士,研究方向为食品生物技术。
