混合酒曲对酒糟还原糖转化的研究
2016-09-16纪凤娣赵秀文赵章林郑玉芝艾金忠
纪凤娣,赵 爽,赵秀文,赵章林,郑玉芝*,艾金忠
(1.北京一轻研究院,北京101111;2.北京红星股份有限公司,北京101400)
混合酒曲对酒糟还原糖转化的研究
纪凤娣1,赵爽1,赵秀文1,赵章林1,郑玉芝1*,艾金忠2
(1.北京一轻研究院,北京101111;2.北京红星股份有限公司,北京101400)
采用自制酒曲对酒糟中残留可利用淀粉及纤维素等进行降解,将其转化为可利用的还原糖。对自制酒曲酶解酒糟的条件进行优化,包括,酶解温度、时间、酒糟热处理温度、料水比、酒曲添加量等。结果表明,该自制酒曲在酶解温度40℃,酶解时间24 h,酒糟经过121℃,处理15 min,酒曲添加量10.0%,料水比1∶1.0(g∶mL)时,大曲型酒糟还原糖转化率可达17.5%。
酒糟;混合酒曲;酶解;还原糖
酒糟是白酒生产的大宗副产物,通常每生产1 t白酒可产3 t酒糟,据不完全统计,2013年,全国白酒总产量达到1 226万kL,折算酒糟量达几千万吨之多。白酒酒糟营养丰富、酸度高、易腐败,酒糟中富含蛋白质、淀粉、各种氨基酸、有机酸、微量元素等,如果不及时加以处理,就会腐败变质。目前,除五粮液和茅台企业有部分酒糟被进一步循环利用外,大量酒糟直接被运送至养殖场,工业化加工较少,每年仍有约千万吨的酒糟未经处理或稍加处理就排放到环境中,对环境污染严重。因此,酒糟的综合开发利用技术也已成为酿酒工业亟待解决的问题。
白酒糟研究主要在国内,目前已有大量的研究报道。如生产蛋白饲料[1-3]、生产纤维素酶[4-7]、生产燃料乙醇及功能成分提取[8-11]等方面,实际应用中以生产饲料为主。将酒糟中残留淀粉和纤维素转化为可利用糖,也是酒糟有效利用的方式,目前,酒糟中淀粉和纤维素的降解,以酸水解为主[12-13],也有采用酶法与酸水解法相结合降解淀粉和纤维素[14],而采用自制酒曲酶解酒糟获得还原糖的研究报道较少。任海伟等[12]利用超声波处理酒糟后,酸水解残留的淀粉和纤维素获得还原糖质量浓度11.85 mg/mL。谭力等[13]利用稀盐酸水解白酒糟获得还原糖质量浓度为3.35 g/100 g,虽然酸水解能获得较高的还原糖含量,但是酸水解的方式获得的还原糖不能用于食品生产。刘高梅等[15]采用纯酶制剂组合,降解残留的淀粉和纤维素,酶解得到还原糖的质量浓度达49.75 mg/mL,但纯酶制剂用于生产成本偏高。
本研究采用自制混合酒曲酶解酒糟中残留可利用淀粉及纤维素等成分,将其转化为可利用还原糖,其中自制酒曲为酒糟制曲,整个过程可实现合理地最大资源化利用酒糟,降低生产成本,变废为宝,提高酒糟的附加值,有很好的市场前景。
1 材料与方法
1.1材料与试剂
大曲型酒糟(含水量65%):北京红星酿酒股份有限公司提供;混合酒曲:自制(利用酒糟接种里氏木霉和泡盛曲霉,经过发酵而得酒曲,糖化酶活力184 U/g,滤纸酶活力>30 U/g,羧甲基纤维素钠酶活力>40 U/g);所用试剂均为分析纯,北京化学试剂公司提供;里氏木霉(Trichoderma reesei)和泡盛曲霉(Aspergillus awamori):分别由中国工业微生物菌种保藏中心和中国微生物菌种保藏管理委员会普通微生物中心提供。
1.2仪器与设备
LDZX-75KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;LRH-250生化培养箱、LHS-150SC恒温恒湿箱、MJ-250-1霉菌培养箱:上海一恒科学仪器有限公司。
1.3方法
新鲜酒糟(含水量65%,淀粉含量14.4%)与水按照一定比例混合,加热处理后,添加酒曲进行酶解,研究酒糟与水的混合比例、酒糟加热处理温度、酒曲添加量、酶解时间、酶解温度5个因素对残留可利用淀粉及纤维素转化为还原糖的影响。
1.3.1自制酒曲酶解时间对酒糟还原糖转化率的影响
设置糟水比为1∶2(g∶mL),在121℃处理15 min后,凉至室温,加入自制酒曲10.0%(按质量分数计),在酶解温度50℃,酶解时间分别为1 h、2 h、3 h、4 h、6 h、18 h、24 h和48h,测定酒糟还原糖转化率。
1.3.2自制酒曲酶解温度对酒糟还原糖转化率的影响
设置糟水比为1∶2(g∶mL),在121℃处理15 min后,凉至室温,加入自制酒曲10.0%,在不同温度条件下酶解24 h,测定酒糟还原糖转化率。
1.3.3自制酒曲添加量对酒糟还原糖转化率的影响
设置糟水比为1∶2(g∶mL),在121℃处理15 min后,凉至室温,加入不同量的自制酒曲,在50℃酶解24 h,测定酒糟还原糖转化率。
1.3.4酒糟料水比对酒糟还原糖转化率的影响
设置糟水比分别为1∶0.5、1∶1.0、1∶1.2、1∶1.5、1∶2.0(g∶mL),在121℃处理15 min后,凉至室温,加入自制酒曲10%,在50℃酶解24 h,测定酒糟还原糖转化率。
1.3.5酒糟热处理温度对酒糟还原糖转化率的影响
该试验中酒糟淀粉含量为14.4%,糟水比为1∶2(g∶mL),分别在100℃、105℃、110℃、115℃及121℃处理15 min后,凉至室温,加入自制酒曲10.0%,在50℃酶解24 h,测定酒糟还原糖转化率。
1.3.6检测方法
白酒糟中淀粉的测定参考GB/T 5009.9—2008《食品中淀粉的测定》(酶解法);还原糖测定参考GB/T 5009.7—2008《食品中还原糖的测定》;混合酒曲中糖化酶活力的测定采用菲林试剂法[16];纤维素酶活力的测定参考QB 2583—2003《纤维素酶制剂》的方法;总酸的测定参考GB/T 12456—2008《食品中总酸的测定》。
1.3.7酒糟还原糖转化率定义及计算公式
本研究中还原糖转化率在已有的相关研究中未见报道,因此,特给出还原糖转化率的定义为每100 g干酒糟转化产生的还原糖的量,计算公式如下:还原糖转化率
式中:A为酶解完成后还原糖生成量,g;B为酶解前还原糖含量,g;C为所用干酒糟量,g。
1.3.8统计分析
本研究中,数据统计采用SPSS 18.0 ANOVA单因素方差分析(P<0.05),实验重复两次,每次三个平行,数值以均值±标准差表示。
2 结果与分析
2.1酒糟中营养成分
根据生产工艺的不同,酒糟中残留的可利用淀粉及纤维素等物质的含量也有差异,如浓香型及酱香型等多粮酿造白酒中残留的淀粉含量高,而二锅头等麸曲型白酒酒糟中残留的淀粉含量较低,但是其残留纤维素含量较高,充分利用这些残留的可利用物质,获得还原糖,可进一步提高酒糟的附加值,其经济及社会效益显著。本研究中用到的酒糟为大曲型,酒糟的营养成分如表1所示。

表1 酒糟中营养成分含量Table 1 Nutrient contents of distillers'grains
由表1可知,大曲型白酒酒糟中残留淀粉和还原糖较高,分别为14.4%和2.3 g/100 g,其总酸含量较高,属于高酸性环境,这对微生物利用酒糟会产生一定的影响。
2.2自制酒曲酶解时间对酒糟还原糖转化率的影响
时间对酶解的影响一般来说是非常显著的,自制酒曲酶解时间对酒糟还原糖转化率结果如图1所示。
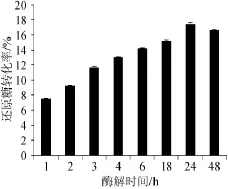
图1 酶解时间对酒糟还原糖转化率的影响Fig.1 Effect of time on the conversion rate of reducing sugar of distillers'grains
由图1可知,酶解时间对酒糟中还原糖转化率的影响显著(P<0.05),随着酶解时间的增加,还原糖转化率显著增加,当酶解时间达到24 h时,还原糖转化率达到最高,约为17%,也就是说,100 g酒糟(干)能够被自制酒曲转化生成17 g的还原糖。由表1可知,100 g酒糟中可利用淀粉的含量约为14.4 g,酶解24 h后,淀粉含量为4.2%,即约71%的淀粉被降解,可见,酒糟中残留淀粉达到了较高的降解,推测另有部分纤维素被转化为还原糖。
2.3自制酒曲酶解温度对酒糟还原糖转化率的影响
温度对酶解的影响是显著的,不同的酒曲酶解温度对酒糟还原糖转化率的影响结果如图2所示。
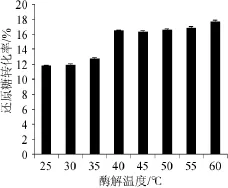
图2 酶解温度对酒糟还原糖转化率的影响Fig.2 Effect of temperature on the conversion rate of reducing sugar of distillers'grains
由图2可知,随着酶解温度的升高,酒糟中还原糖的转化率增加。酶解温度在35℃以下时,酒曲对酒糟中还原糖的转化率为12%左右,没有显著差异(P<0.05)。酶解温度达到40℃以上时,酶解效果显著高于35℃以下(P<0.05),还原糖转化率达到16%以上。该混合酒曲的最适酶解温度为40~60℃。从经济及方便实验操作方面考虑,选择最适酶解温度为40℃。
2.4自制酒曲添加量对酒糟还原糖转化率的影响
酒曲的添加量实际上表示的是酶的活力,本研究中,所用酒曲的糖化酶活力为184 U/g,滤纸酶活力>30 U/g,羧甲基纤维素钠酶活力>40 U/g,即添加量为3.0%、5.0%、10.0%、12.5%的酒曲分别对应的糖化酶活力为1 840 U、3 680 U、7 320 U、9 200 U,酒曲添加量对酒糟还原糖转化率的影响见图3。
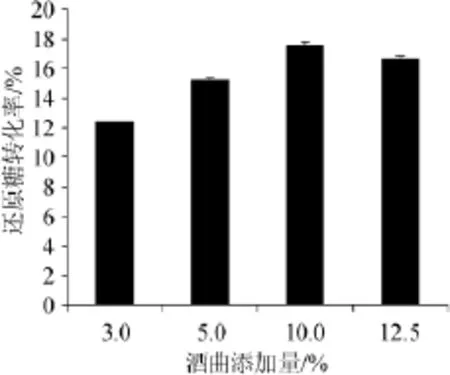
图3 酒曲添加量对酒糟还原糖转化率的影响Fig.3 Effect of koji addition on the conversion rate of reducing sugar of distillers'grains
由图3可知,当酒曲添加量为10.0%(即7 320 U)时,酒糟酶解得到的还原糖转化率最高。结合酒糟中淀粉含量,可知当添加量为10.0%时,已满足酶解的需求。原料酒糟中淀粉含量为14.4%(干基),即100g酒糟中含有14.4g淀粉,那么添加酒曲的量必须能够达到完全降解残留淀粉并且过量,才能对酒糟残留成分的利用起到最大作用。由图3可见,添加量为3.0%和5.0%时,添加的酶活力不足,因此,结果表现出来的是还原糖的转化率在增加,但是没有达到最大转化率。因此,在酒糟中淀粉含量为14.4%时,酒曲添加量10.0%即可。
2.5酒糟料水比对酒糟还原糖转化率的影响
当酒糟加水量不同时,酒曲对酒糟中还原糖转化率的影响见图4。
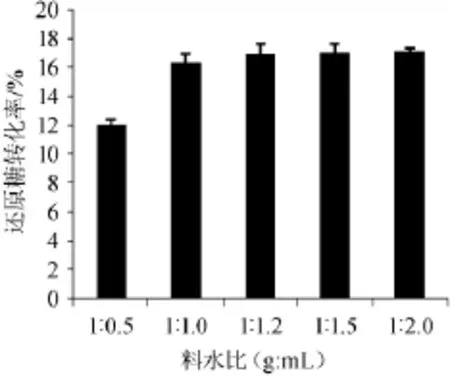
图4 料水比对酒糟还原糖转化率的影响Fig.4 Effect of the ratio of material to water on conversion rate of reducing sugar of distillers'grains
由图4可知,料水比为1∶0.5(g∶mL)时,酒糟还原糖的转化率为12.1%,显著低于料水比在1∶1.0(g∶mL)到1∶2.0(g∶mL)时的还原糖转化率(P<0.05)。当料水比在1∶1.0(g∶mL)到1∶2.0(g∶mL)之间时,酒糟中还原糖的转化率可达16.3%以上,并且没有显著差异(P<0.05)。一般来说,加水量大会利于酶解的进行。在加水量从1倍增加到2倍时,均为固液混合状态,有足够多的游离水将酶分布均匀,这可能是加水量对酶解作用影响不显著的原因,因此,最适料水比为1∶1.0(g∶mL)。
2.6酒糟热处理温度对酒糟还原糖转化率的影响
酒糟加水后采用不同的温度进行热处理,研究其对还原糖转化率的影响,结果见图5。
由图5可见,酒糟的热处理温度对酒糟中还原糖的转化率有显著影响(P<0.05)。随着热处理温度的提高,还原糖转化率增加,在热处理温度为121℃时,还原糖转化率达到最高,为17.3%。也就是说酒糟的热处理温度高对混合酒曲酶解酒糟有利。酒糟作为白酒发酵的副产物,已经经过高温处理,在发酵过程中容易利用的营养成分优先被利用,同时,酒糟中主要的组分是稻壳,稻壳中含有木质素、纤维素及半纤维素达70%以上。因此,一般的热处理对酒糟中残留的淀粉、纤维素等成分结构的破坏效果不显著。这可能是由于高温高压能促进酒糟中木质纤维结构的软化,半纤维素脱掉羧基,降低纤维素的结晶度,从而增加纤维素酶与酒糟的有效接触,提高酶解效率,高温蒸汽使淀粉糊化,有利于α-淀粉酶或糖化酶迅速找到酶切位点[15,17]。
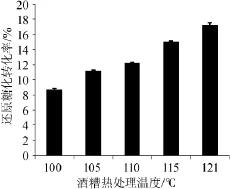
图5 酒糟热处理温度对酒糟还原糖转化率的影响Fig.5 Effect of heat treatment temperature on the conversion rate of reducing sugar of distillers'grains
3 结论
白酒糟为白酒发酵的大宗副产物,其富含各种营养成分。但是,酒糟作为一种经过加热处理的发酵副产物,残留的淀粉类物质不易利用、高酸性环境、稻壳含量高、这都制约了酒糟的利用,本文探讨了提高酒糟中残留可利用淀粉及纤维素转化为还原糖的方法,采用自制混合酒曲,提高还原糖的转化率,为后期继续利用酒糟酿酒或产酸等提供理论依据。
研究表明,通过自制混合酒曲进行酶解,酒糟中残留的淀粉70%以上被转化为还原糖,并且部分纤维素也被转化为还原糖,在对酒糟加热温度,酒曲酶解温度、时间、料水比、酒曲添加量等条件进行优化的基础上,获得了较高的酒糟还原糖转化率,如淀粉含量为14.4%的大曲型酒糟在酶解温度40℃,酶解时间24 h,酒糟经过121℃,处理15 min,酒曲添加量10.0%,料水比1∶1.0(g∶mL)时,还原糖转化率可达17.5%。
[1]王晓力.白酒糟生产高蛋白饲料研究进展及前景[J].中兽医药杂志,2013(6):34-36.
[2]王炫,汪江波,薛栋升.混菌固态发酵小曲白酒糟生产蛋白饲料的研究[J].湖北工业大学学报,2014,29(1):111-115.
[3]邹明鑫,邱树毅,王晓丹,等.利用酱香型白酒丢糟生产微生物饲料添加剂的初步研究[J].酿酒科技,2013(7):91-93.
[4]武香玉,陈存社,张京,等.绿色木霉固态发酵生产纤维素酶的研究[J].中国酿造,2010,29(5):93-96.
[5]程驰,罗惠波,杨欣怡,等.丢糟纤维素分解复合菌系的构建及其酶解特性研究[J].酿酒科技,2012(7):112-114.
[6]邹德勋,郑瑾刘,瑛颖,等.康氏木霉利用废酒糟产纤维素酶的研究[J].太阳能学报,2012,33(3):355-358.
[7]赵碧刚.白腐真菌发酵降解白酒糟木质素的研究[D].成都:四川农业大学硕士论文,2008.
[8]曹新志,游见明,熊俐,等.郎酒酒糟中总酚的提取与检测方法的优化[J].中国酿造,2011,30(7):137-140.
[9]王鑫,刘微微,曹学丽.酶法提取白酒糟中酚酸物质工艺[J].食品科学,2011,32(24):114-119.
[10]孙林涛.白酒发酵副产物丢糟中风味组分的超临界CO2萃取工艺开发研究[D].西安:西北大学硕士论文,2010.
[11]周怀均,金艳梅.酒糟中低聚木糖的分离与提取的研究[J].大众商务,2009(6):273,284.
[12]任海伟,陈晓前,邢超红,等.废弃白酒糟酸水解工艺的优化[J].食品工业科技,2013,34(3):240-242.
[13]谭力,刘跃红,张文学.白酒丢糟两步稀盐酸水解的研究[J].食品与发酵科技,2011,47(2):25-27,31.
[14]刘跃红,张文学,谭力,等.浓硫酸降解白酒丟槽制备降解糖液的条件研究[J].中国酿造,2011,31(1):82-85.
[15]刘高梅,陈海秀,任海伟.酒糟酶解糖化条件的研究[J].食品工业科技,2012,33(15):138-140.
[16]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2011.
[17]江龙法,钱志刚,夏泽华,等.分解酒糟生物质的纤维素酶生产菌的筛选研究[J].淮海工学院学报:自然科学版,2006,15(4):51-54.
Study on the conversion of reducing sugar of distillers'grains by compoundJiuqu
JI Fengdi1,ZHAO Shuang1,ZHAO Xiuwen1,ZHAO Zhanglin1,ZHENG Yuzhi1*,AI Jinzhong2
(1.Beijing Industrial Technology Research Institute,Beijing 101111,China;2.Beijing Red Star Co.,Ltd.,Beijing 101400,China)
HomemadeJiuquwas used to degrade available starch and cellulose residual in distillers'grains into available reducing sugar.The homemadeJiuquhydrolysis conditions,including enzymolysis temperature,time,heat treatment temperature of distillers'grains,material to water ratio,and koji addition were optimized.The results showed that the optimum condition for homemadeJiuquhydrolysis was temperature 40℃,hydrolysis time 24 h,heat treatment temperature of distillers'grains 121℃and time 15 min,andJiuquaddition 10.0%,material to water ratio 1∶1.0(g∶ml).Under these conditions,the conversion of reducing sugar of distillers'grains was 17.5%.
distillers'grains;compoundJiuqu;enzymatic hydrolysis;reducing sugar
TS261.1
0254-5071(2016)03-0066-04
10.11882/j.issn.0254-5071.2016.03.015
2015-11-10
北京市东城科委科技计划项目(2015-3-004)资助
纪凤娣(1977-),女,副研究员,博士,研究方向为食品发酵技术。
郑玉芝(1965-),女,高级工程师,博士,研究方向为食品加工与检测。
