茅台地区酱香型酒糟中高温细菌的分离鉴定
2016-09-16卢红梅莫柳勤
周 莲,陈 莉*,卢红梅,莫柳勤,徐 硕
(1.贵州大学 化学与化工学院,贵州 贵阳 550003;2.贵州大学 食品与酿酒工程学院,贵州 贵阳 550003;3.贵州大学 贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550003)
茅台地区酱香型酒糟中高温细菌的分离鉴定
周莲1,3,陈莉2,3*,卢红梅2,3,莫柳勤2,3,徐硕2,3
(1.贵州大学 化学与化工学院,贵州 贵阳 550003;2.贵州大学 食品与酿酒工程学院,贵州 贵阳 550003;3.贵州大学 贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550003)
从茅台地区酱香型酒糟中分离筛选出耐高温菌株DX和XX,检测其生理生化特征,并进行16S rDNA序列分析。结果表明,菌株DX和XX是革兰氏阳性菌,有芽孢和荚膜,生长温度范围分别为35~60℃和35~55℃,最适生长温度为45℃,繁殖能力非常强,并且对淀粉、纤维素、蛋白质和油脂有着较强的分解能力;经16S rDNA序列分析以及系统发育树分析可以初步鉴定菌株DX是地衣芽孢杆菌(Bacillus licheniformis),菌株XX是空气芽孢杆菌(Bacillus aerius)。
酱香型酒糟;高温菌;分离鉴定;16S rDNA
白酒酒糟是白酒生产的副产物,2014年贵州省的酒糟量就达到100多万t[1],主要集中在贵州省仁怀市地区。白酒酒糟的鲜糟含水量大,加之又具有很多营养成分,白酒酒糟的贮存存在一定时间限制,如不及时处理,会造成极大的浪费,并对环境造成染重污染。因此,白酒酒糟的利用早已被提上日程,然而面对日益增多的酒糟,以现有的处理方式和规模难以满足要求。以多种方式从多个方面开展对酒糟重复利用的研究,实现白酒酒糟的重复利用对我国白酒产业的发展以及环境保护具有十分重要的意义[2]。根据对酒糟资源化利用问题的研究显示,白酒酒糟除用于生产饲料外,还能用于生产有机肥、食用菌、食醋、白炭黑等[3-9]。由此可见,有效利用好白酒酒糟不仅能降低丢糟造成的环境污染,还能大幅提高白酒副产物的附加值,而其中利用酒糟生产有机肥是解决酒糟利用问题的有效方案。
高温菌是一类能在45℃以上生长和繁殖的微生物,具有耐热嗜热,降解性能好,代谢效率高等特点,在很多领域都发挥着重要的作用[10-13]。利用高温菌产生的耐热酶的特性就能很好地加快酒糟成分的降解,明显缩短堆肥周期,把酒糟堆肥发酵为有机肥,这样,不仅能有效解决农作物肥料供应问题,还能解决酒糟资源化利用的问题。但我国的高温菌研究与国外相比起步晚,研究水平相对较低,所以我们有必要在各个层次加强对高温菌的研究,筛选大量降解性能好的优良高温菌株,并深入了解其特性,以便能够更好地利用高温菌资源,拓展其应用领域。
本研究从茅台地区酱香型酒糟中分离筛选出耐高温菌株,通过对其分离和鉴定,以期为后续酒糟高温菌剂和酒糟生物有机肥的制备奠定了基础,这对于加强酒糟资源的综合利用,拓宽高温菌的应用范围,促进可持续发展和循环经济相结合的白酒产业发展体系的构建都将具有积极意义。
1 材料与方法
1.1材料与试剂
1.1.1酱香型酒糟
酒糟:取自仁怀市茅台镇第七轮次抛糟的酱香型酒糟。
1.1.2试剂
碘化钾、碘(分析纯):Guizhou Sciencelab science& Technology Co.,Ltd;无水乙醇、体积分数为95%乙醇(分析纯):天津市富宇精细化工有限公司;龙胆紫(分析纯):天津市恒兴化学试剂制造有限公司;草酸铵(分析纯):成都金山化学试剂有限公司;番红O(分析纯):北京索莱宝科技有限公司;甲基蓝(分析纯):天津市大茂化学试剂厂;乳酸、戊二醛(50%)(分析纯):天津市天力化学试剂有限公司;丙三醇(分析纯):天津市致远化学试剂有限公司;苯酚(重精馏):天津市科密欧化学试剂有限公司;细菌微量生化鉴定管、甲基红试剂盒(5 mL×2):青岛高科技工业园海博生物技术有限公司。
草酸铵结晶紫染液:(A液)龙胆紫2 g,95%vol乙醇20 mL;(B液)草酸铵0.8 g,蒸馏水80 mL;混合A、B液即可。
卢戈氏碘液:I 1 g,KI 2 g,去离子水300 mL,先用少量去离子水溶解KI,再将I加入其中溶解完全,最后补水至300 mL。
0.5%的番红水溶液:2.5%的番红酒精溶液20 mL,去离子水80 mL混匀。
乳酸石碳酸棉蓝染液:苯酚20 g,乳酸20 mL,丙三醇40 mL,甲基蓝0.05 g,去离子水20 mL。先将甲基蓝溶于去离子水,再加入其他物质微热溶化,冷却备用。
1.1.3培养基
牛肉膏蛋白胨培养基:蛋白胨10.0 g/L,牛肉膏3.0 g/L,氯化钠5.0 g/L,琼脂粉20 g/L,pH自然,115℃灭菌30 min。
LB液体培养基:蛋白胨10.0 g/L,牛肉膏5.0 g/L,氯化钠10.0 g/L,pH自然,121℃灭菌20 min。
1.2仪器与设备
BCD-290W冰箱:青岛海尔股份有限公司;DMS-653广西生物数码显微镜:深圳市博宇仪器有限公司;∑IGMA ZEISS电子扫描显微镜:北京普瑞赛司仪器有限公司;SPX-250B智能型生化培养箱:上海琅玕实验设备有限公司;YXQ-LS-5DS11立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;DHG-9140B(101-2B)智能型电热恒温鼓风干燥箱:上海琅玕实验设备有限公司;SN-CJ-IF洁净工作台:上海博讯实业有限公司医疗设备厂。
1.3实验方法
1.3.1酒糟中高温细菌的分离筛选
将酱香型酒糟制成不同稀释梯度的菌液。将稀释菌液均匀涂布在牛肉膏-蛋白胨培养基上,然后置于恒温恒湿培养箱中55℃培养24 h。仔细观察菌落特征和个体形态,将不同特征的生长良好的单个菌落用无菌接种针挑出,在牛肉膏-蛋白胨培养基上划线培养。经过多次重复过程(7~8次),得到了纯的高温菌。
1.3.2形态特征
菌落形态:挑选分离纯化的细菌,用平板划线的方法接种在牛肉膏-蛋白胨培养基上,55℃培养12~24 h,观察菌落的的大小、形态、颜色、边缘等特征。
个体形态:将分离纯化的细菌进行革兰氏染色,光学显微镜下观察菌株形态。由于细菌在光学显微镜下不能很好的区分,故而对细菌制片后,进行电镜扫描,结合电镜图片确定各细菌的一些详细特征[15]。
1.3.3生理生化鉴定
将分离纯化的菌株进行生理生化实验,主要包括接触酶试验、糖发酵试验、甲基红试验、V-P试验、蛋白胨水解实验等,具体实验步骤见参考文献[14]。
1.3.4最适生长温度及生长曲线
最适生长温度:将在冰箱中保存的细菌菌株在筛选温度条件下于LB液体培养基中摇床培养活化12 h,设置35℃、40℃、45℃、50℃、55℃、60℃六个温度梯度,各温度梯度下设置3组对照组,然后活化好的菌液1 mL接种到装有100 mL LB液体培养基的250 mL三角瓶,摇床培养12 h后用分光光度计测定各菌液的OD值,并绘制各细菌的最适生长温度曲线。
生长曲线:将在冰箱中保存于营养琼脂平板的细菌接种到装有100 mL LB液体培养基的250 mL三角瓶中,在50℃、120 r/min条件下,摇床培养12 h,用移液器准确吸取活化好的菌液0.1 mL接种到装有100 mL LB液体培养基的250 mL三角瓶中,每种菌株做3组,置于50℃、120 r/min条件下摇床培养,每隔8 h测一次OD值,连续测5 d。取样时要在超净工作台中进行,避免染菌,测OD值时,以未接种的同批次LB液体培养基作为空白对照。
1.3.5细菌基因组DNA的提取
利用TIANamp Bacteria DNA Kit(天跟生化科技有限公司)提取实验菌株的DNA,其具体步骤参见试剂盒的说明书。DNA提取产物保存于-20℃冰箱中。
1.3.616S rDNA的PCR扩增和测序
以提取的基因组DNA为模板,利用通用引物正向引物27F(5'-AGAGTTTGATCCTGGCTCTAG-3')和反向引物1492R(5'-GGTTACCTTGTTACGACTT-3')进行PCR扩增。所有PCR均在50 μL标准反应体系中进行。反应程序为:94℃预变性5 min;94℃变性1 min,52℃复性1 min,72℃延伸1 min,30个循环;最后于72℃延伸10 min。采用1%的琼脂糖凝胶电泳对PCR扩增产物进行检测,采用琼脂糖凝胶DNA回收试剂盒(离心柱型)回收PCR产物。纯化后的目的基因送上海生工公司进行测序。测序结果用Chromas软件参照正反序列图谱进行人工校正。
1.3.7系统发育树的构建
用基本局部比对搜索工具(basic local alignment cearch tool,BLAST)将测序结果在美国国家生物技术信息中心(national center of biotechnology information,NCBI)中与已知细菌的16S rDNA基因序列进行同源性分析,并用MEGA5.10软的Neighbor-Joining法构建系统发育树,具体确定菌株的种属。
2 结果与分析
2.1菌株的形态特征
通过实验分离出两株高温菌株,分别编号为DX和XX,其菌落形态见图1。
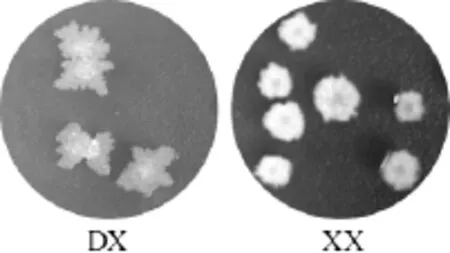
图1 菌株DX和XX的菌落形态Fig.1 Colonial morphology of strains DX and XX
由图1可知,菌株DX菌落粗糙湿润、不透明、边缘多缺刻呈树根状、易挑取,菌落直径约为15mm。菌株XX菌落干燥粗糙、白色、边缘较规整、不易挑取,菌落直径约为6 mm。
在菌落观察得到初步结果后,用革兰氏染色法对细菌进行显微镜镜检,再做电镜镜检。菌株个体形态描述见表1,镜检的部分图片见图2。

表1 菌株的个体形态Table 1 Individual morphology of strains DX and XX

图2 菌株DX和XX镜检图片Fig.2 Microscopy images of strains DX and XX
2.2生理生化实验
对两株细菌DX和XX做生理生化实验,包括糖发酵实验、V-P实验和甲基红实验等,实验结果见表2。
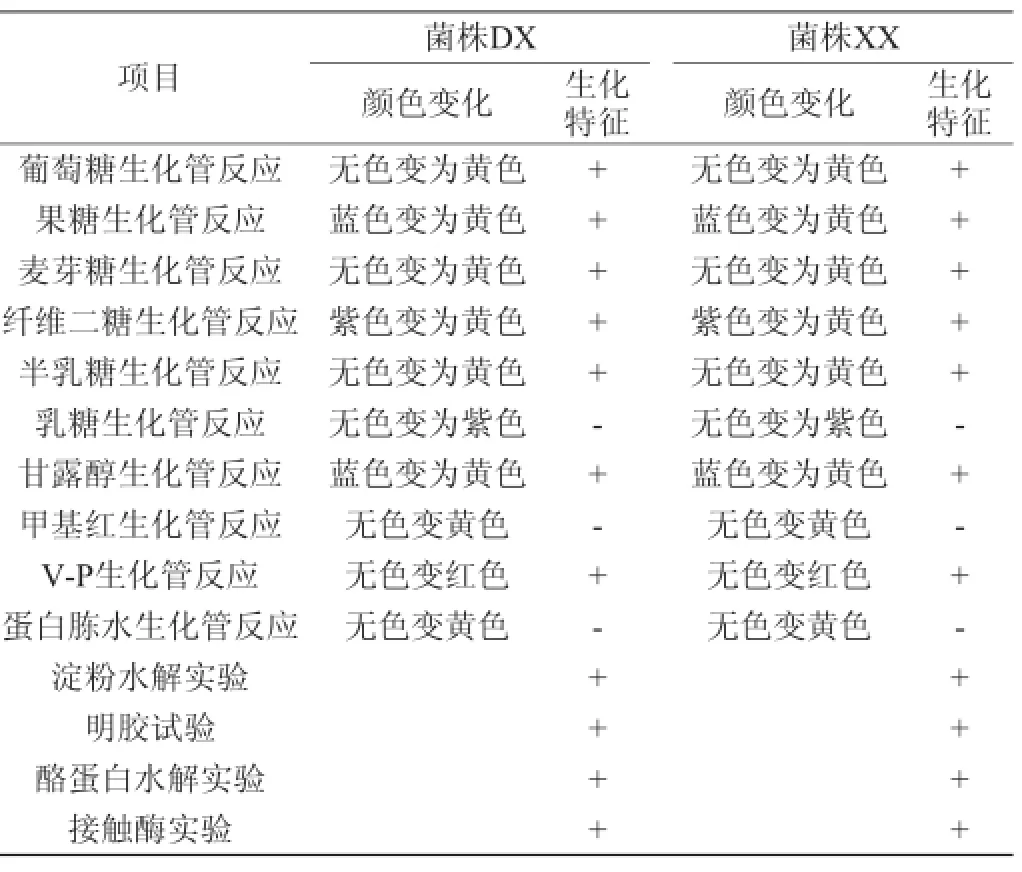
表2 菌株DX和XX生理生化试验结果Table 2 Physiological and Biochemical experiments results of strains DX and XX
2.3最适生长温度及生长曲线
2.3.1菌株的最适生长温度曲线
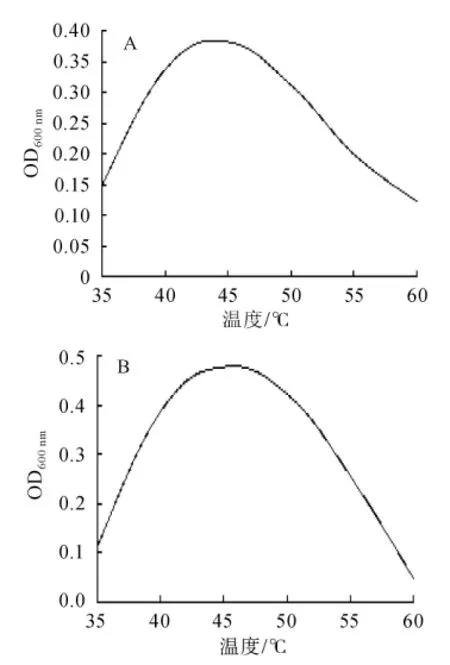
图3 菌株DX(A)和XX(B)的生长最适温度曲线Fig.3 The optimum growth temperature curve of strain DX(A)and XX(B)
从图3可以看出,在35~45℃内,菌株DX的菌体OD值呈逐步上升,在45℃时达到最大值,之后菌体OD值逐步下降,所以菌株DX的最适生长温度为45℃,在35~60℃均能较好的生长;在35~45℃内,菌株XX的菌体OD值呈快速上升,在45℃时达到最大值,之后菌体OD值下降较快,所以菌株XX的最适生长温度为45℃,在35~55℃均能较好的生长。
2.3.2菌株的生长曲线
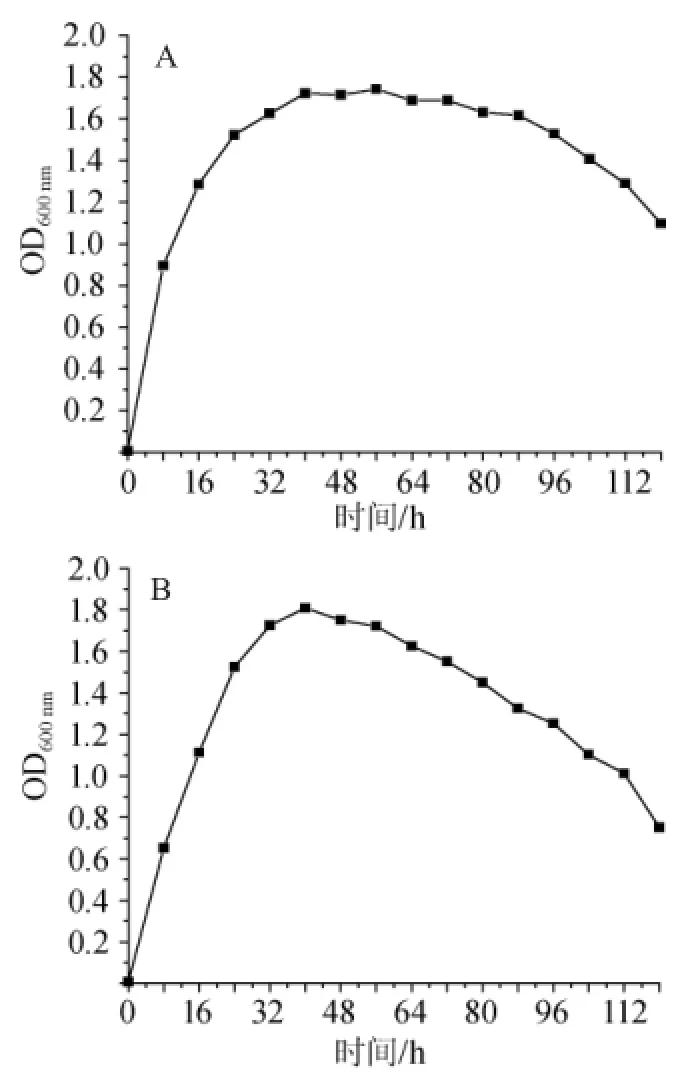
图4 菌株DX(A)和XX(B)的生长曲线Fig.4 Growth curve of strains DX(A)and XX(B)
从图4 A可以看出,在0~24 h时,DX处于对数生长期,菌体快速繁殖,OD值变化最大,随后由于营养物质的急剧消耗,32~40 h时DX生长开始变缓,40~96 h时菌株DX进入稳定期,细菌数目和代谢产物达到最高水平,菌体OD值较稳定,96 h后菌株DX进入衰亡期,菌体大量死亡,OD值开始明显下降,从OD值变化趋势来看,DX具有较快的生长速度,发酵周期在24~36 h。
从图4B可以看出,在0~32h时菌株XX处于对数生长期,菌体快速繁殖,OD值快速增加,32~40 h时开始变缓,在经历及其短暂的稳定期后,菌株XX就开始进入衰亡期,从OD值变化趋势来看,菌株XX也具有较快的生长速度,发酵周期在24~36 h。
2.416S rDNA及基因系统发育分析
用1%琼脂糖凝胶电泳检测16S rDNA扩增产物,电泳图见图5。由图5可知,在1 000 bp~2 000 bp正中间处有一明亮条带,测序结果为1 522 bp和1 536 bp,与检测结果相符合。将菌株DX和XX的16S rDNA序列测序结果与NCBI中已报道的模式菌株序列序列进行比对,结果表明,菌株DX和XX与Bacillus属成员有较高的序列同源性,在94%~99%之间,其中菌株DX、XX与Bacillus licheniformis、Bacillus aerius、Bacillus sonorensis的同源性达到99%,说明从中可以看出菌株DX、XX与这3个种具有最高的序列同源性。用MEGA5.10构建的系统发育树如图6和图7所示,通过与进化关系比较亲近的属种进行系统发育学分析,结果表明菌株DX与菌株XX均属于芽孢杆菌属,菌株DX与芽孢杆菌属中的Bacillus licheniformis亲缘关系最近,两者在同一进化分支上;菌株XX与芽孢杆菌属中的Bacillus aerius的亲缘关系最近。结合菌株DX和菌株XX的细胞形态、菌落形态、生理生化特征、16S rDNA序列分析以及系统发育分析可以初步鉴定菌株DX是地衣芽孢杆菌(Bacillus licheniformis)、菌株XX是空气芽孢杆菌(Bacillus aerius)。
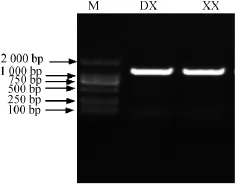
图5 菌株DX和XX的16S rDNA PCR扩增电泳图Fig.5 16S rDNA PCR amplification electrophoretogram of strains DX and XX

图6 菌株DX基于16S rDNA建立的系统发育树Fig.6 The phylogenetic tree of strain DX based on 16S rDNA sequence
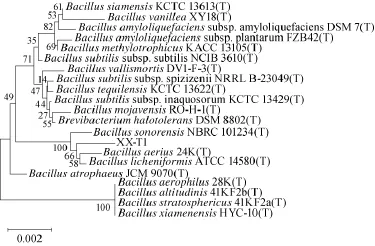
图7 菌株XX基于16S rDNA建立的系统发育树Fig.7 The phylogenetic tree of strain XX based on 16S rDNA sequence
3 结论
从茅台菌株地区酱香型酒糟中分离筛选出耐高温菌株DX和XX,根据形态及生理生化特征和16S rDNA序列分析,菌株DX是一株革兰氏阳性杆菌,有芽孢、荚膜,产接触霉,能降解淀粉、纤维素、蛋白质、明胶等大分子有机物,其中对蛋白质有着十分强烈的分解能力。兼性厌氧型,生长温度范围为35~60℃,最适生长温度是45℃。菌株DX与Bacillus licheniformis的同源性在NCBI中对比为99%,并且通过系统发育学分析,菌株DX与Bacillus licheniformis亲缘关系最近。初步鉴定该菌株是芽孢杆菌属的地衣芽孢杆菌。菌株XX是一株革兰氏阳性杆菌,有芽孢、荚膜,产接触霉,能降解淀粉、纤维素、蛋白质、明胶等大分子有机物,其中对纤维素的分解能力较强。兼性厌氧型,生长温度范围为35~55℃,最适生长温度是45℃。菌株XX与Bacillus aerius的同源性在NCBI中对比为99%,并且通过系统发育学分析,菌株XX与Bacillus aerius亲缘关系最近。初步鉴定该菌株是芽孢杆菌属的空气芽孢杆菌。菌株DX和菌株XX的繁殖能力非常强,属于非致病菌,对淀粉、纤维素、蛋白质和油脂有着较强的分解能力,并且是从酒糟中分离出来的,所以对于酒糟中环境有着天然的适应能力,所以可以很好的用于酒糟生物有机肥的制备以及其他其他工业生产中。
[1]宇博智业.2014-2018年中国白酒行业市场研究与预测报告[R].北京:中国报告大厅,2015.
[2]李建,叶翔.酒糟综合利用多元化研究[J].中国酿造,2013,32(12):121-124.
[3]张蜀艳.丢糟中木聚糖的提取工艺优化[J].中国酿造,2015,34(2):100-103.
[4]张敏.酒糟制甘油的生产工艺及研究进展[J].零陵师范高等专科学校学报,2001(8):47-49.
[5]刘桂云.酒糟高产栽培平菇新技术[J].北京农业,1999(5):20.
[6]李相前.生物工程酒糟的生物技术处理-固态发酵法生产菌体蛋白和纤维素酶的研究[J].粮食与饲料工业,2000(1):26-27.
[7]胡德全,漆英,余国华,等.酒糟饲料在肉牛生产中的应用[J].营养与日粮,2014(8):44-47.
[8]余有贵,曾传广,贺建华.白酒糟开发蛋白质饲料的研究进展[J].中国饲料,2007(1):12-15.
[9]王晓力.白酒糟生产高蛋白饲料研究进展及前景[J].中兽医医药杂志,2013(6):34-36.
[10]郭春雷,彭谦.高温菌研究进展[J].生物学杂志,2003,20(4):1-3.
[11]董锡文,薛春梅,吴玉德.极端微生物及其适应机理的研究进展[J].微生物学杂志,2005(1):74-77.
[12]宫晓梅,张磊,孙嘉,等.高温菌剂的添加时间对污泥堆肥指标影响研究[J].环境工程,2013,31(4):114-117.
[13]曹井国,赵树欣,程丽娟,等.高温菌及其在有机废液处理中的应用[J].工业水处理,2006,26(1):9-12.
[14]东秀珠,蔡妙英,等.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[15]沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007.
Isolation and identification of thermophilic bacterium from Moutai-flavor vinasse in Moutai region
ZHOU Lian1,3,CHEN Li2,3*,LU Hongmei2,3,MO Liuqin2,3,XU Shuo2,3
(1.College of Chemistry and Chemical Engineering,Guizhou University,Guiyang 550003;2.College of Liquor and Food Engineering,Guizhou University,Guiyang 550003;3.Guizhou Province Key Laboratory of Fermentation Engineering and Biopharmacy,Guizhou University,Guiyang 550003)
The thermophilic bacteria strains DX and XX were isolated and screened from Moutai-flavor vinasse in Moutai region.The physiological-biochemical characteristics of strains were detected and 16S rDNA sequence was analyzed.The results showed that the strains DX and XX were gram-positive bacterium,and had spore and capsule.The strains growth temperature ranges were 35-60℃and 35-55℃,respectively.The optimum growth temperature was 45℃.The strains had a strong growth ability and strong ability of decomposition on starch,cellulose,protein and fats.By the 16S rDNA sequence and phylogenetic tree analysis,the strains DX and XX could be identified preliminarily asBacillus licheniformisandBacillus aerius,respectively.
Moutai-flavor vinasse;themophilic bacteria;isolation and identification;16S rDNA
Q93
0254-5071(2016)03-0061-05
10.11882/j.issn.0254-5071.2016.03.014
2015-12-10
产学研合作项目(HX2014002)
周莲(1990-),男,硕士研究生,研究方向为生物化工。
陈莉(1981-),女,副教授,硕士,研究方向为微生物。
