新疆药桑叶中黄酮类化合物的分离及其抗氧化活性评价
2016-09-16张贵会塔里木大学生命科学学院新疆阿拉尔843300新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室新疆阿拉尔843300
张贵会,王 贺,杨 玲*(1.塔里木大学 生命科学学院,新疆 阿拉尔 843300;2.新疆生产建设兵团 塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300)
新疆药桑叶中黄酮类化合物的分离及其抗氧化活性评价
张贵会1,2,王贺1,2,杨玲1,2*
(1.塔里木大学 生命科学学院,新疆 阿拉尔 843300;2.新疆生产建设兵团 塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300)
以自由基清除率为评价指标,利用制备液相从药桑叶醇提物的乙酸乙酯萃取部分中分离黄酮单体化合物,并采用1,1-二苯基-2-硝基苯肼(DPPH)自由基和2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐(ABTS)自由基清除法对单体化合物进行抗氧化活性评价。结果表明,从乙酸乙酯萃取部分分离得到4个单体化合物,分别为化合物Ⅰ、化合物Ⅱ、化合物Ⅲ、化合物Ⅳ,对DPPH自由基清除率的半数抑制浓度(IC50)分别为0.004 4 mg/mL、0.003 7 mg/mL、0.003 0 mg/mL、0.078 0 mg/mL,对ABTS自由基清除率IC50分别为0.021 mg/mL、0.014 mg/mL、0.012 mg/mL、0.087 mg/mL。4个单体化合物均具有很强的抗氧化活性,且抗氧化活性顺序化合物Ⅲ>化合物Ⅱ>化合物Ⅰ>化合物Ⅳ。
药桑叶;黄酮单体化合物;DPPH自由基;ABTS自由基
药桑(Morus nigraL.)是桑科植物桑的叶,是新疆独有的品种之一,是我国国内唯一的具有22倍体花性染色体的桑品种,是新疆目前桑品种分类鉴定中唯一的黑桑种[1]。新疆南疆阿克苏地区的库车县及新和县分布着中国最大的药桑林,药桑叶约占桑树地上部产量的64%[2]。桑叶是常用的维吾尔族医药材,桑叶被用于治疗一些疾病,应用于关节肿痛、手足麻木、风湿痹痛、瘫痪等疾病[3]。桑叶含化学物质种类多,而且具有多种生物活性,尤其所含黄酮类成分居多,黄酮类化合物是桑叶的主要功能性成分之一,包括芸香苷、槲皮素、异槲皮素、二氢山奈素等[4-5],含量约占干质量的1.0%~3.0%,是所有植物茎叶中含量较高的一种[6]。桑叶中的黄酮类化合物,具有明显的抗氧化活性[7]。近年来各国学者对桑叶研究较多的国家为日本和韩国,日本学者研究了桑叶的化学成分,发现具有降血糖的作用的有效成分是1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)[8]并对其结构进行了分析。韩国学者研究了桑叶的抗氧化作用,发现桑叶具有抗氧化的功效。KIM S Y等[5]从桑叶中分离得到了包括山萘酚,葡萄糖苷、紫云英苷等9个黄酮苷类化合物。我国学者主要是对其他品种桑叶的化学成分、抗氧化以及降低血糖作用方面进行研究[9-10],对新疆药桑叶中黄酮类化合物的分离纯化和抗氧化的研究综合报道较少。
本研究利用现代分离手段和制备液相对药桑叶黄酮类化合物进行分离纯化,采用1,1-二苯基-2-硝基苯肼(1,1-diphenyl-2-pccryhydrazyl,DPPH)自由基和2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐(2,2′-Azinobis-(3-ethylbenzthiazoline-6-sulphonate,ABTS)自由基清除法对化合物进行抗氧化活性评价,旨在为更深入研究和开发新疆药桑叶的药用和经济价值提供理论基础。
1 材料与方法
1.1材料与试剂
药桑(Morus nigraL.)2014年7月采集,采自新疆库车,经塔里木大学邱爱军副教授鉴定为药桑叶(Morus nigraL.)。药桑叶粉碎过100目筛备用。
芦丁标准品:德国Merck公司;1,1-二苯基-2-芳基肼(DPPH)自由基、2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐(ABTS)标准品:美国Sigma公司;甲醇、甲酸均为色谱纯:天津市风船化学试剂科技有限公司;体积分数为95%乙醇、石油醚、乙酸乙酯、氯仿、正丁醇、氢氧化钠、亚硝酸钠、硝酸铝(均为分析纯):天津市光复科技发展有限公司。
1.2仪器与设备
2767 Waters制备液相色谱:美国Waters公司;岛津LC-20AT型高效液相色谱仪:日本岛津公司;S54紫外可见分光光度计:上海棱光技术科技有限公司;RE-5205旋转蒸发仪:上海亚荣生化仪器厂;CP224C电子天平:奥豪斯仪器有限公司;GZX-9420电热恒温鼓风干燥箱:上海博迅实业有限公司。
1.3方法
1.3.1药桑叶黄酮的提取[11-12]
取过100目筛的药桑叶粉末,用药桑叶粉末与体积分数80%的乙醇与以料液比1∶25(g∶mL)混匀,在25℃条件下浸泡5 h,重复浸提3次,合并上清液,用布氏漏斗抽滤,减压浓缩成浸膏。加入等体积的体积分数为95%乙醇并置于4℃冰箱12 h除去多糖,得到提取物浓缩至无醇味,用蒸馏水溶解,选用AB-8型大孔吸附树脂对上述提取物进行纯化得到粗提物。
1.3.2黄酮单体化合物的分离与纯化
将粗提物真空减压浓缩成浸膏用水分散,依次用石油醚、氯仿、乙酸乙酯、正丁醇萃取,回收乙酸乙酯萃取部分,将乙酸乙酯萃取部分用硅藻土拌样,经中压制备液相色谱(Flash反相C18色谱柱(460 mm×36 mm,5 μm);检测器检测波长354 nm,上样量6 g),用蒸馏水-甲醇(90∶10、75∶25、50∶50、30∶70、0∶100,V/V),流速20 mL/min梯度洗脱,每段洗脱体积800 mL,得到a、b、c、d、e五段馏分,用高效液相色谱检测各段馏分,馏分a、c、d、e中主要成分保留时间非常相近的化合物,经常规色谱柱和制备液相很难得到很好的分离,不做下一步分离。本实验只对馏分b中各成分进行分离。
1.3.3馏分b中各物质分离条件
分析型液相色谱条件:Waters-Xbridge色谱柱(250 mm× 4.6 mm,5 μm);流速:1.0 mL/min;检测波长354 nm;柱温40℃;进样质量浓度1 g/L;进样量20 μL;流动相0.3%甲酸水溶液(A)-甲醇(B),梯度洗脱条件5%~25%B洗脱10 min;25%~75%B洗脱30 min;75%~100%B洗脱10 min,馏分b中各化合物之间实现了基线分离。
制备型液相色谱条件:Waters-Xbridge色谱柱(25 mm× 19mm,5μm);流速15mL/min;柱温40℃;进样量为500μL,样品质量浓度为200g/L;其余条件与分析型色谱条件相同。
1.3.4单体化合物纯度的测定
高效液相色谱条件:Waters-C18色谱柱(250 mm×4.6 mm,5 μm):流速:1.0 mL/min;检测波长354 nm;进样量20 μL;柱温40℃;流动相:0.3%甲酸水溶液(A)-甲醇(B);等度洗脱(A∶B=65∶35,V/V)10 min。
1.3.5芦丁标准曲线的制备[13-14]
芦丁标准溶液:精密称取芦丁标准品10.00 mg,加体积分数为65%乙醇溶解定容至100 mL容量瓶中并摇匀,配制成质量浓度为0.1 mg/mL的芦丁标准溶液。
芦丁标准曲线制作:准确吸取0、1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL于10mL的容量瓶中,加入5%NaNO2溶液0.4 mL,摇匀,放置6 min,再加入10%Al(NO)3溶液0.4 mL,摇匀,放置6 min,加入4%NaOH溶液4.0 mL,用体积分数为65%乙醇溶液定容,摇匀、放置15 min。以第一份溶液为空白,在波长510 nm处测定吸光度值,以吸光度值(Y)为纵坐标,以芦丁标准品质量浓度(X)为横坐标,绘制标准曲线,其线性回归方程为Y=11.07X+0.004(相关系数R2=0.999 0)。
1.3.6 DPPH自由基清除率测定[15-16]
DPPH自由基溶液的配制,准确称取0.019 7 g DPPH,用体积分数为95%乙醇溶解并定容于250mL容量瓶,DPPH浓度为0.2 mmol/L,静置30 min,避光保存(0~4 ℃)。
用体积分数为95%的乙醇配制样品溶液,以抗坏血酸和芦丁作阳性对照液。分别取各样品溶液2.0 mL和DPPH溶液2.0 mL于25 mL试管中,混匀。在28℃恒温条件下下避光反应30 min,以体积分数为95%乙醇为空白参照,在波长517 nm处测定吸光度值,DPPH自由基清除率计算公式如下:
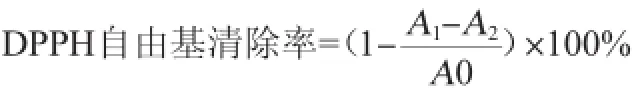
式中:A1为含样品与DPPH溶液反应后的吸光度值;A2为含样品与以无水乙醇代替DPPH溶液的吸光度值;A0为以无水乙醇代替样品与DPPH溶液的吸光度值。
1.3.7 ABTS工作液制备及ABTS自由基清除率测定[17-18]
准确称取378.448mg过硫酸钾,用蒸馏水定容至10 mL,配制成140 mmol/mL的A液,准确称取0.019 2 g ABTS标准品,用蒸馏水定容至5 mL,然后在此溶液中加入88 μL的A溶液,室温避光静置16 h,形成ABTS储备液,在波长734 nm条件下测吸光度值,临时用蒸馏水稀释至A734nm=0.70±0.20,制成ABTS工作液。
用蒸馏水配制样品溶液以抗坏血酸和芦丁做阳性对照液。取样品溶液1 mL和ABTS溶液3 mL于25 mL试管中,混匀。28℃恒温条件下避光反应15 min,以蒸馏水为空白参照,在波长734 nm处测定吸光度值。平行3次,ABTS自由基清除率计算公式如下:

式中:A1为含样品与ABTS溶液反应后的吸光度值;A2为含样品与以去离子水代替ABTS溶液的吸光度值;A0为以去离子水代替样品与ABTS溶液的吸光度值。
2 结果与分析
2.1各萃取部分总黄酮含量测定

表1 药桑叶不同萃取部分总黄酮的含量Table 1 Results of total flavonoids contents in four different extracts of mulberry leaves
由表1可知,各萃取部分总黄酮含量依次为乙酸乙酯>正丁醇>水相>石油醚>氯仿,结果表明,药桑叶黄酮类物质主要存在于乙酸乙酯萃取物和正丁醇萃取物中。
2.2黄酮单体化合物高效液相色谱图分析
通过对药桑叶乙醇提取物乙酸乙酯萃取部分中黄酮化合物进行提取和分离,采用大孔树脂AB-8、制备液相色谱分离得到4个单体化合物,经高效液相色谱检测化合物Ⅰ、Ⅱ、Ⅲ纯度,结果见图1。
由图1可知,由HPLC图谱按峰面积归一化法计算化合物1、化合物2、化合物3、化合物4纯度分别为98.3%、97.7%、97.0%、98.1%。化合物2、化合物3有两个杂质峰,可能原因收集范围宽所致,化合物从保留时间上分析,保留时间微小差异可能与所连接的糖种类与数目有关;推测这4种化合物应该结构相似的黄酮类化合物。


图1 黄酮类单体化合物HPLC色谱图Fig.1 HPLC chromatograms of flavonoids monomer compounds
2.3黄酮单体的鉴定
芦丁是黄酮类化合物,具有α-苯基色原酮的基本结构,羰基与二个芳香环形成两个较强的共轭系统,黄酮类化合物在3个区域有很强的特征吸收。通过制备液相从乙酸乙酯部分分离出4个单体化合物,芦丁标准品及4个单体化合物紫外-可见光谱图结果见图2。
由图2可知,4个单体化合物均在吸收带Ⅰ在330~380 nm波长范围有吸收,吸收峰归属色原酮结构氧原子n→π*的电子跃迁R带吸收;吸收带Ⅱ在240~280 nm波长范围有吸收,吸收归属苯环共轭结构π→π*的电子跃迁B吸收带;吸收Ⅲ在200~240 nm,吸收峰归属苯环双键π→π*的电子跃迁E带吸收[19-21]。4个单体化合物与芦丁标准品3个吸收带相似,表明4个单体化合物是黄酮类物质。

图2 芦丁标准品和黄酮类单体化合物紫外-可见光谱图Fig.2 UV-vis spectroscopy of rutin standard substance and flavonoids monomer compounds
2.4不同黄酮单体对DPPH自由基清除

图3 不同化合物的DPPH自由基清除效果Fig.3 The DPPH free radical scavenging effect of different compounds
由图3可知,化合物Ⅲ对DPPH自由基的清除能力强于化合物Ⅰ、化合物Ⅱ、化合物Ⅳ、芦丁,弱于抗坏血酸。在0.07 mg/mL时化合物Ⅲ的清除率最大,之后随质量浓度的增加清除率基本保持不变,化合物Ⅰ和化合物Ⅱ的清除能力随着质量浓度的增加呈线性增加,当质量浓度>0.07 mg/mL时,对DPPH自由基的清除率几乎保持不变,化合物Ⅳ对自由基的清除能力增长缓慢,当0.07 mg/mL清除率达到最大。化合物Ⅰ、化合物Ⅱ、化合物Ⅲ、化合物Ⅳ、芦丁、抗坏血酸对DPPH自由基的半数抑制率(50%inhibitive concentration,IC50)分别为0.004 4 mg/mL、 0.0037mg/mL、0.0030mg/mL、0.0780mg/mL、0.0045mg/mL、0.002 7 mg/mL。结果表明,对DPPH自由基的清除效果由大到小顺序为抗坏血酸>化合物Ⅲ>化合物Ⅱ>化合物Ⅰ>芦丁>化合物Ⅳ。
2.5不同黄酮单体对ABTS自由基清除

图4 不同化合物的ABTS自由基清除效果Fig.4 The ABTS free radical scavenging effect of different compounds
由图4可知,化合物Ⅱ、化合物Ⅲ对ABTS自由基的清除能力强于芦丁和化合物Ⅰ且弱于抗坏血酸,在0.04 mg/mL时化合物Ⅱ、Ⅲ对ABTS自由基的清除率最大,之后随质量浓度的增加,对ABTS自由基清除率基本保持不变,化合物Ⅳ的ABTS自由基清除能力随着质量浓度的增加缓慢增长,当质量浓度为0.04 mg/mL时清除率达到最大,随着质量浓度的变化清除率几乎保持不变,化合物Ⅰ和芦丁对ABTS自由基清除能力相当。化合物Ⅰ、化合物Ⅱ、化合物Ⅲ、化合物Ⅳ、芦丁、抗坏血酸、对ABTS自由基的半数抑制率(IC50)分别为0.021mg/mL、0.014mg/mL、0.012mg/mL、0.087 mg/mL、0.021 mg/mL、0.009 mg/mL。结果表明,化合物Ⅱ和化合物Ⅲ具有很强的ABTS自由基的清除能力,且化合物Ⅲ清除ABTS自由基能力强于化合物Ⅱ。
3 结论
通过对药桑叶醇提物乙酸乙酯部分总黄酮的提取和分离,采用大孔树脂AB-8、制备液相分离纯化得到4个单体化合物,经液相色谱检测化合物Ⅰ、Ⅱ、Ⅲ、Ⅳ的纯度分别为98.3%、99.7%、97.0%、98.1%。通过紫外-可见光谱鉴定为黄酮类化合物。结果表明,化合物Ⅰ、Ⅱ、Ⅲ均具有较强的抗氧化能力,化合物Ⅳ的清除自由基能力弱于其他几个化合物,可能是因为分子结构之间存在差异。其结构与活性的相关性作用机制还有待进一步研究。
[1]王丽玲.药桑红色素纯化工艺研究[J].中国食品添加剂,2010(2):78-81.
[2]彭琼,陈丛瑾.桑叶不同溶剂提取物对DPPH自由基的清除作用[J].光谱实验室,2008,37(3):307-309.
[3]WANG L,GONG T,CHEN R Y.Two new prenylflavonoids fromMorus nigraL.[J].Chinese Chem Lett,2009,20(5)∶1469-1471.
[5]KIM S Y,GAO J J,LEE W.Antionxiative flavonoids from the leaves of Morus alba[J].Arch Pharm Res,1999,22(1)∶81-85.
[6]杨燕,王洪庆,陈若芸.桑叶中的黄酮类化合物[J].药学学报,2010,45(1):77-81
[7]王芳,乔璐,淡小艳,等.桑叶黄酮的提取及抗氧化研究[J].广东农业科学,2011,15(9):76-79.
[8]ASANO N,TOMIOKA E,KIZU H,et al.Sugars with nitrogen in the ring isolatedfromtheleavesofMorusbombycis[J].Carbohyd Res,1994,253(3)∶235-245.
[9]张庆建,陈若芸,于德泉.鸡桑中化学成分及其抗癌和抗氧化活性研究[J].中草药,2007,38(5):663-666.
[10]杨梅,李新霞,热娜·卡斯木,等.HPLC双波长法同时测定药桑中芦丁、异虎皮苷、槲皮素和绿原酸的含量[J].西北药学杂志,2013,28(2):111-113.
[11]邢小莉,杨玲.新疆药桑桑皮总黄酮提取工艺的优化[J].中国酿造,2013,32(1):57-60.
[12]李国柱,孟庆艳,罗碧,等.循环制备液相色谱分离芳香新塔花中的化学成分[J].色谱,2015,33(1):84-89.
[13]孟庆焕,王化,王洪政,等.牡丹种皮黄酮提取及对ABTS自由基清除作用[J].植物研究,2013,33(4):504-507.
[14]李敏,杨建华,李渊,等.酒花黄酮提取工艺和含量测定[J].食品科学,2011,32(6):16-19.
[15]江岩,聂文静.新疆药桑椹营养成分分析及其体外抗氧化作用[J].食品科学,2014,22(22):126-129.
[16]姜玉兰,朴惠善,李镐.桑叶抗氧化活性成分的研究[J].中药材,2008,31(4):519-522.
[17]刘静.黑桑抗氧化成分的分离纯化及活性研究[D].重庆:西南大学硕士论文,2014.
[18]李培源,霍丽妮,苏炜,等.鸡眼草3种不同溶剂提取物对ABTS自由基和羟自由基清除活性的研究[J].中国药房,2012,23(11):964-966.
[19]池静瑞,刘爱茹.HPLC法测定苦荞麦中三种黄酮成分含量[A]//中国化学学会色谱学会第五次色谱化工学术报告文集[C].北京:中国化学学会色谱委员会,1998.
[20]赵强,廖天录,王俊峰,等.槐花中芦丁的提取及检测方法的建立研究[J].甘肃畜牧兽医,2010,40(3):17-20.
[21]黄汉昌,姜招峰.芦丁与人血清白蛋白相互作用的紫外可见光谱特性研究[J].天然产物研究与开发,2011,23(3):476-481.
Isolation of flavonoids compounds in Morus nigra leaves from Cinjiang and their antioxidant activity
ZHANG Guihui1,2,WANG He1,2,YANG Ling1,2*
(1.College of Life Science,Tarim University,Alar 843300,China;2.Key Laboratory of Protection and Utilization of Biological Resources in Tarim Basin,Xinjiang Production&Construction Corps,Alar 843300,China)
With the free radical scavenging rate as the evaluation index,the flavonoids monomer compounds were separated from ethyl acetate extraction phase of alcohol extract ofMorus nigraleaves by preparative liquid chromatograph.The antioxidant activity of flavonoids monomer compounds was evaluated using the DPPH and ABTS free radical scavenging method.The results showed that four monomer compounds including compoundⅠ,Ⅱ,Ⅲ,and IV were separated from ethyl acetate extraction phase.The compoundⅠ,Ⅱ,Ⅲ,and IV on IC50of DPPH free radical scavenging rate were 0.004 4 mg/ml,0.003 7 mg/ml,0.003 0 mg/ml and 0.078 0 mg/ml,respectively,and on IC50of ABTS free radical scavenging rate were 0.021 mg/ml,0.014 mg/ml,0.012 mg/ml,0.087 mg/ml,respectively.All four monomer compounds had a strong antioxidant activity,and the antioxidant activity in order was compoundⅢ,compoundⅡ,compoundⅠand compoundⅣ.
Morus nigraleaves;flavonoids monomer compounds;DPPH free radical;ABTS free radical
TQ920.9
0254-5071(2016)02-0101-05
10.11882/j.issn.0254-5071.2016.02.023
2015-12-08
国家自然科学基金项目(NO.31460080)
张贵会(1986-),男,硕士研究生,研究方向为天然产物分子结构与功能。
杨玲(1965-),女,教授,硕士,研究方向为天然产物分子结构与功能。
[4]K,KOJIMA T,MAKINO M,et al.Studies on the constituents of the leaves ofMorus albaL.[J].Chem Pharm Bull,2011,49(2)∶151-153.
