枯草芽孢杆菌液态发酵的研究
2016-09-16李情敏何名芳张凤英张超凤陈卫平江西农业大学食品科学与工程学院江西南昌330045赣州农业学校食品教研组江西赣州3400
李情敏,何名芳,张凤英,张超凤,陈卫平*(.江西农业大学 食品科学与工程学院,江西 南昌 330045;.赣州农业学校 食品教研组,江西 赣州 3400)
枯草芽孢杆菌液态发酵的研究
李情敏1,何名芳2,张凤英1,张超凤1,陈卫平1*
(1.江西农业大学 食品科学与工程学院,江西 南昌 330045;2.赣州农业学校 食品教研组,江西 赣州 341100)
该研究选取了一株从无花果中分离出的枯草芽孢杆菌(Bacillussubtilis)作为试验菌株,它可以产生抗逆性强的芽孢,非常适合应用于益生菌饲料加工生产。在单因素试验基础上,进行L9(33)正交试验,获得芽孢产量高、原料成本低廉的液态发酵培养基最佳配方为碎米水解液6%、酵母粉0.7%、KH2PO40.5%;对该菌的摇瓶发酵条件进行了初步研究,确定了液态发酵的最佳条件为pH值为5,温度37℃,接种量6%,转速200 r/min,培养时间19 h。在此最佳培养基配方及发酵条件下,发酵液OD600nm值可达7.38。
枯草芽孢杆菌;液态发酵;培养基配方;培养条件;优化
益生菌的生理功能有很多,最重要的是可以促进肠道有益微生物的繁殖,降低病原菌数量,提高机体免疫的功能[1]。益生菌制剂以无毒、无残留、无副作用、不污染环境等优点,使其成为了有效的抗生素替代物,在防治动植物疾病,促进机体发育,延缓人类衰老等方面被人们广泛使用[2],并成为生态循环农业中的一个重要纽带。由于枯草芽孢杆菌(Bacillus subtilis)可形成抗逆性极强的芽孢,在稳定性方面具有先天优势,且枯草芽孢杆菌是我国农业部和美国食品药品监督管理局(Food and Drug Administration,FDA)允许作为饲料添加剂的菌种[3-4],其可以产生抑菌活性物质[5-6],也可以作为一种理想的抗生素替代物。最近还有文献报道枯草芽孢杆菌对马铃薯辣椒等蔬菜疫病具有很好的防治效果[7-10]。
枯草芽孢杆菌(B.subtilis)从无花果中分离获得,具有较强抑菌特性,可以产蛋白酶,脂肪酶和淀粉酶,是良好的植物生防和动物饲料添加菌剂。但在益生菌制剂的实际应用中,常存在有效活菌数低、产品稳的定性差、保质期短等问题,限制了其工业化生产和大规模应用。本研究采用农业废弃资源水解碎米粉、玉米粉、小麦粉为液态发酵培养的材料,以枯草芽孢杆菌(B.subtilis)的生物量为评价指标,获得了枯草芽孢杆菌(B.subtilis)最佳培养基配方及液态发酵工艺条件。本研究充分利用农业废弃物资源,制备益生菌制剂,明显降低了成本,为益生菌制剂在植物疾病防治和畜牧业中替代抗生素、更广泛地应用奠定基础。
1 材料与方法
1.1材料与试剂
1.1.1菌种和原料
枯草芽孢杆菌(B.subtilis):江西农业大学食品科学与工程学院微生物实验室分离及保藏。
碎米、小麦、玉米:市售加工厂下脚料。
1.1.2培养基
种子液培养基:牛肉膏0.3%,蛋白胨1%,NaCl 0.5%,水,pH 5。
碳源基础培养基:酵母粉0.5%,NaCl 0.5%,pH 5。
氮源基础培养基:葡萄糖2%,NaCl 0.5%,pH 5。
无机盐基础培养基:酵母粉0.5%,葡萄糖2%,pH 5。
所有培养基均于灭菌锅0.1 MPa、121℃灭菌15 min。
1.1.3化学试剂
食品级液化酶(105U/g)、糖化酶(2 000 U/g):江苏锐阳生物科技有限公司;氯化钠(分析纯)、葡萄糖(分析纯):西陇化工股份有限公司;蔗糖(分析纯):成都市科龙化工试剂厂;蛋白胨(生化试剂)、酵母粉(生化试剂):北京奥博星生物技术有限公司;磷酸二氢钾(分析纯):天津市永大化学试剂有限公司。
1.2仪器与设备
SW-CJ-1FD超净工作台:苏州安泰空气技术有限公司;BYY-200万能高速粉碎机药品冷藏箱:中科生命科技股份有限公司;LRH-150B生化培养箱:广东省医疗器械厂;CWB22电子秤:上海伟业仪器厂;WFZUV-2100紫外可见分光光度计:尤尼柯(上海)仪器有限公司;SYQ-DSX-280B手提式不锈钢压力蒸汽灭菌锅:上海申安医疗器械厂;HH-2恒温水浴锅:江苏金坛市中大仪器厂;SHZ-D(III)循环水式真空泵:巩义市予华仪器有限公司。
1.3方法
1.3.1种子液的制备
取一环已活化好的菌种,接入盛有种子液的三角瓶中,初始pH值为5,培养温度35℃,摇床转速180 r/min,培养12 h。
1.3.2水解液的制备
水解糖液的制备:将玉米、小麦、碎米粉碎,各称取100 g于烧杯中加入400 mL蒸馏水,放入100℃水浴锅中预糊化20 min后,将其取出放置适宜的温度后用冰乙酸、NaOH调pH。将pH调至6.5后放入60℃水浴锅中液化20 min,并且加入0.4 g无水氯化钙、α-淀粉酶0.05 g。20 min后将水浴锅温度调至100℃,在100℃水浴锅中预煮10 min,使α-淀粉酶失活。将液化好的玉米粉、小麦粉、碎米粉冷却后用冰乙酸调pH至4.0,加入糖化酶0.075 g在60℃水浴锅中糖化6 h。用碘液作为指示剂滴定,若无颜色反应则糖化完全,若有则糖化不完全,继续进行糖化,直至碘液滴定至无颜色反应。再进行灭酶,100℃水浴10 min,使糖化酶完全失活。将水解好的玉米、小麦、大米水解液用抽滤器进行抽滤,灭菌(121℃、10 min)备用。
1.3.3测定方法
菌体生物量的测定:在波长600 nm处测其吸光度值,控制OD600nm值在0.10~0.65(以未接种培养基稀释)。菌体生物量以OD600nm值表示,直接以OD600nm值作为试验的评价指标。
芽孢率检测:简单染色法[11]。
1.3.4培养基优化
碳源基础培养基分别以2%碎米水解液、玉米粉水解液、小麦粉水解液、葡萄糖、蔗糖、淀粉为碳源;氮源基础培养基分别以0.5%牛肉膏、蛋白胨、酵母粉、尿素、硫酸铵、亚硝酸钠为氮源;无机盐基础培养基分别以0.5%硫酸锌、氯化钠、磷酸氢二钾、磷酸二氢钾、硫酸镁、氯化钙为无机盐。接种2.5 mL种子液到灭菌后各培养基中,置于35℃、180 r/min的摇床上培养16h,每个水平做3个重复,测定液态培养菌体生物量(OD600nm值),选出最佳碳源、氮源、无机盐。
在以上单因素试验基础上,考察不同含量碎米水解液(2%、4%、6%、8%、10%)、酵母粉(0.5%、1.0%、1.5%、2.0%、2.5%)、磷酸二氢钾(0.2%、0.4%、0.6%、0.8%、1.0%)对菌体生物量的影响,并在单因素试验基础上进行L9(33)正交试验[12]。
1.3.5培养条件优化
按优化后的培养基配方,考察不同初始pH(4、5、6、8、10),不同的培养温度(33℃、35℃、37℃、39℃、41℃),不同摇床转速(140 r/min、160 r/min、180 r/min、200 r/min、220 r/min),不同培养时间(1 h、3 h、5 h、7 h……25 h),对枯草芽孢杆菌的生物量的影响,确定最佳培养条件。
2 结果与分析
2.1培养基配方优化
2.1.1不同碳源对枯草芽孢杆菌生长的影响
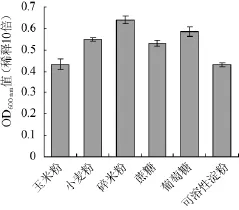
图1 不同碳源对枯草芽孢杆菌生长的影响Fig.1 Effect of different carbon sources on the growth ofB.subtilis
由图1可知,6种碳源对枯草芽孢杆菌生长的影响大小为碎米水解液>葡萄糖>玉米粉水解液>小麦粉水解液>蔗糖>可溶性淀粉。枯草芽孢杆菌是乳糖不耐受菌,且利用糖的能力为单糖>双糖>三糖>多糖[13],所以3种糖对菌生长的影响为葡萄糖>蔗糖>可溶性淀粉;由结果可知,3种水解液都有比较好的效果,尤其是碎米水解液,效果最显著,这很可能是因为它葡萄糖含量较高。因此选择碎米水解液作为液态发酵枯草芽孢杆菌的最佳碳源。
2.1.2不同氮源对枯草芽孢杆菌生长的影响

图2 不同氮源对枯草芽孢杆菌生长的影响Fig.2 Effect of different nitrogen sources on the growth of B.subtilis
由图2可知,6种氮源中,酵母粉的效果最明显,OD600nm值达到0.51,牛肉膏与蛋白胨次之分别为0.32、0.28,尿素、硫酸铵、亚硝酸钠的作用很小,尤其是硫酸铵。这是因为有机氮不仅有大量蛋白质,还含有糖类、脂肪等,无机氮则不能提供这些营养物质[14]。酵母粉可能含较多促进菌体生长的激素才使枯草芽孢杆菌生长最好,该结果与于雷等[15]的研究一致。因此选择酵母粉作为最佳氮源。
2.1.3不同无机盐对枯草芽孢杆菌生长的影响
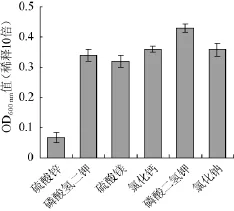
图3 不同无机盐对枯草芽孢杆菌生长的影响Fig.3 Effect of different Inorganic salts on the growth of B.subtilis
由图3可知,磷酸二氢钾对菌体的生长影响最大,OD600nm值达0.42,氯化钠、磷酸氢二钾、硫酸镁次之,硫酸锌最小,所以选择磷酸二氢钾为培养基的主要无机盐。而磷酸二氢钾和磷酸氢二钾影响程度不同,在于磷、钾浓度和比例,所以一般在实际生产中,除了添加磷酸二氢钾,还考虑加入其他无机盐[16]。
2.1.4碳源、氮源与无机盐含量的确定
由图4A可知,所加碎米水解液添加量达6%时,OD600nm值达到0.63,碎米水解液添加量>6%,虽然随着添加量的增加OD600nm值也在增大,但增幅较小,虽然高浓度碎米水解液能使菌体快速生长,但不利于促进芽孢的形成[17-18],结合经济性考虑,所加碎米水解液添加量选择6%为宜。由图4B及图4C可知,随着氮源、无机盐添加量的增加,OD600nm值呈现先增大后减小的趋势,酵母粉、磷酸二氢钾添加量分别在0.5%、0.4%时菌液OD600nm值达到最大值,分别为0.45和0.51,随后OD600nm值均减小,说明酵母粉、磷酸二氢钾添加量过大还会抑制菌体的生长,因此分别选择酵母粉添加量为0.5%、磷酸二氢钾添加量为0.4%。

图4 碎米水解液(A),酵母粉(B)及磷酸二氢钾(C)含量对枯草芽孢杆菌生长的影响Fig.4 Effect of different contents of broken rice hydrolysis liquid(A),yeast powder(B)and KH2PO4(C)on the growth ofB.subtilis
2.1.5培养基配方优化正交试验
为了确定培养基的最优配方,在单因素试验基础上,采用正交试验考察碎米水解液、酵母粉及磷酸二氢钾添加量对枯草芽孢杆菌生物量的影响,正交试验结果与分析见表1,方差分析结果见表2。

表1 培养基配方优化正交试验结果与分析Table 1 Results and analysis of orthogonal experiments for culture medium formula optimization
对表1进行极差分析可知,RB>RC>RA。由此初步判定3个因素对试验结果影响最大的是B,A、C两因素对试验的影响作用并不明显,经极差分析初步得出最佳培养基配方组合为A3B3C3,即碎米水解液6%,酵母粉0.7%,磷酸二氢钾0.5%。在此最佳培养基条件下,OD600nm值达7.18。
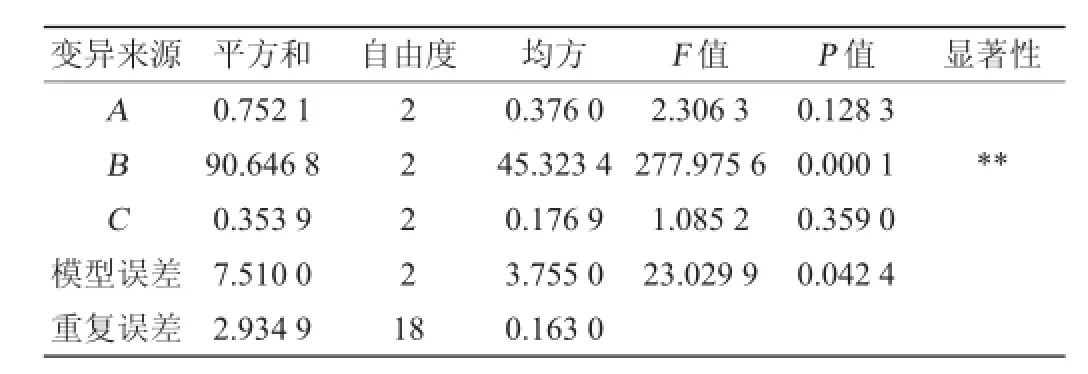
表2 正交试验结果方差分析Table 2 Variance analysis of orthogonal experiments results
由表2可知,B因素(酵母粉添加量)对试验结果的影响差异极显著(P<0.01),而A、C对结果的影响均不显著。
2.2发酵条件的优化
2.2.1初始pH的优化

图5 不同初始pH对枯草芽孢杆菌发酵的影响Fig.5 Effect of different initial pH on the growth of B.subtilis
由图5可知,在pH自然(初始pH值为5)时,OD600nm值达最大,为0.71;随着初始pH增大,OD600nm值越小。因为在过酸和过碱条件下,都不利于菌体生长和芽孢形成[19]。因此,选择初始pH值为5。
2.2.2摇床温度的优化

图6 不同温度对枯草芽孢杆菌发酵的影响Fig.6 Effect of different temperature on the growth ofB.subtilis
由图6可知,随着温度的增加,OD600nm值也随着升高。但在温度达到37℃时,OD600nm值达到最高。随着温度>37℃之后,其OD600nm值反而下降。温度主要是通过改变酶的反应速率来影响菌体的生长[20]。随着培养环境温度升高,菌体内酶活性增强、反应速率也增大,因此可以促进其生长代谢,缩短生长期。但酶很多属于蛋白质类,过热会使其失活,菌体就容易衰老。因此,选择最适温度为37℃。
2.2.3接种量的选择
初始pH值为5,摇床温度为37℃,摇床转速为180 r/min,培养时间16 h,分别测定6个不同接种量(3%、4%、5%、6%、7%、8%)发酵液的OD600nm值,考察不同接种量对枯草芽孢杆菌发酵生长的影响,结果见图7。

图7 不同接种量对枯草芽孢杆菌发酵的影响Fig.7 Effect of different inoculum on the growth ofB.subtilis
由图7可知,随着接种量的增加,其OD600nm值也随之升高,6%的接种量时OD600nm值达到0.72,接种量>6%之后,随着接种量的增加其OD600nm值趋于平稳。因此选择最适接种量为6%。
2.2.4摇床转速的优化
枯草芽孢杆菌是需氧型菌,主要是通过改变转速可以调节通气量从而改变三角瓶内含氧量,而含氧量又直接影响菌体生长及芽孢的形成[21]。

图8 不同转速对枯草芽孢杆菌发酵液的影响Fig.8 Effect of different rotate speed on the growth of B.subtilis
由图8可知,随着转速的增加,其OD600nm值随着升高。在转速为200 r/min时其OD600nm值为最大。超过200 r/min,其OD600nm值反而出现下降趋势。因此,选择200 r/min转速作为枯草芽孢杆菌液态发酵的最佳转速。
2.2.5枯草芽孢杆菌培养时间的选择

图9 枯草芽孢杆菌生长曲线Fig.9 The growth curve ofB.subtilis
由图9可知,在1~7 h枯草芽孢杆菌处于延滞期;在7~13 h,菌体数目急剧增加,OD600nm值也急剧增大,处于对数期;在15~19 h菌体处于稳定期,而在19 h时OD600nm值达到最大,因此菌体数也最大,此阶段为菌体获取最佳时间;19 h后,菌体数量减少,菌体进入衰亡期,OD600nm值随之减少。由芽孢率曲线可知,菌株芽孢的形成主要是在稳定期。因此,枯草芽孢杆菌最佳培养时间为19 h,在此条件下,发酵液OD600nm值为7.38。
3 结论
优化后的培养基配方为碎米水解液6%、酵母粉0.7%、磷酸二氢钾0.5%,发酵液OD600nm值可达到7.18;并通过单因素试验法确定了培养基的最佳培养条件:初始pH值为5、培养温度37℃、接种量6%、培养转速200 r/min,培养时间19 h后收获菌液,在此最佳条件下OD600nm值达到7.38。
[1]李军训,罗学刚,高洁,等.益生菌的分类,生理功能与有效性评价研究进展[J].中国农业科技导报,2010(6):49-55.
[2]孙强正,徐建国.乳酸乳球菌食品级表达载体的研究进展[J].中国微生态学杂志,2006,18(3):260-261.
[3]孙肖明.微生物饲料添加剂的生产与应用[J].养殖与饲料,2013(4):45-46.
[4]胡学智译.日本益生菌市场透视[C].第十届全国微生态学术会议论文集,沈阳,2010.
[5]杨永青,谢远红,张红星,等.枯草芽孢杆菌C3产抗菌物质发酵条件优化[J].中国酿造,2014,33(3):28-31.
[6]沈跃丽,陈蕊,张莉,等.枯草芽孢杆菌生产抗菌物质的食品级发酵培养基优化[J].食品科学,2014,35(9):168-173.
[7]黄大野,姚经武,朱志刚,等.枯草芽孢杆菌水分散粒剂防治辣椒疫病的效果及其对辣椒的促生作用[J].湖北农业科学,2015,54(19):4737-4739.
[8]YANG M M,Xu L P,XUE Q Y,et al.Screening potential bacterial biocontrol agents towardsPhytophthora capsiciin pepper[J].Eur J Plant Pathol,2012,134(4)∶811-820.
[9]杨文强.1 000亿芽孢/g枯草芽孢杆菌防治马铃薯晚疫病效果[J].植物医生,2015(5):32-34.
[10]郭卫华.枯草芽孢杆菌防治马铃薯晚疫病药效试验 [J].农村科技,2014(12):47-48.
[11]张冬冬,高同国,朱宝成.小麦全蚀病生防芽孢杆菌产芽孢培养基的响应面法优化[J].麦类作物学报,2014,34(3):418-424.
[12]瑞江,张业旺,闻崇炜,等.正交试验设计和分析方法研究[J].实验技术与管理,2010,24(9):52-55.
[13]周德庆.微生物学教程[M].北京:高等教育出版社,2001.
[14]俞俊棠,唐孝宣.生物工艺学[M].广州:华东理工大学出版社,1999.
[15]于雷,雷霆,裴晓林,等.L-乳酸发酵培养基中氮源的优化[J].食品科技,2007,22(6):49-53.
[16]郭小华,陆文清,邓萍,等.益生枯草芽孢杆菌MA139增殖培养基的优化[J].中国农业大学学报,2006,11(3):41-46.
[17]MONTEIRO S M,CLEMENTE J J.A procedure for high-yield spore production byBacillus subtilis[J].Biotechnol Progr,2005,21(4)∶1026-1031.
[18]郭荣君,王步云,李世东.营养对生防菌株BH 1芽抱产量的影响研究[J].植物病理学报,2005,35(3):283-285.
[19]YOUSTEN A,WALLIS D A,SINGER S.Effect of oxygen on growth,sporulation maker enzymes in aBacillusspecies mutant[J].Agr Biol Chem,1981,45(8)∶2417-2423.
[20]RAHMAN M S,ANO T,SHODA M.Second stage production of iturinA by induced germination ofBacillus subtilisRB14[J].J Biotechnol,2006,125(4)∶513-515.
[21]AMBAT P,AWANNA C.Optimisation medium constituents and fermentation conditions for citric acid production from palmyra jaggery using responsesu methods[J].World J Microbiol Biotechn,2005,21(4)∶399-404.
Liquid-state fermentation of Bacillus subtilis
LI Qingmin1,HE Mingfang2,ZHANG Fengying1,ZHANG Chaofeng1,CHEN Weiping1*
(1.College of Food Science and Engineering,Jiangxi Agricultural University,Nanchang 330045,China;2.Food Teaching and Research Group,Ganzhou Agricultural College,Ganzhou 341100,China)
UsingBacillus subtilisseparated fromFicus caricaas experimental strain,the strain can generate strong-resistance spores,which was suitable for processing production of probiotics feed.On the basis of single factor experiments,the optimum formula of liquid fermentation medium of high spore yield and cheap material cost was obtained by L9(33)orthogonal tests.The optimum formula were broken rice hydrolysis liquid 6%,yeast powder 0.7%and KH2PO40.5%.The shaking flask fermentation conditions of the strain was studied preliminarily,and the optimum conditions of liquid fermentation were determined as follows∶pH 5,temperature 37℃,inoculum 6%,rotate speed 200 r/min,culture time 19 h.Under the optimum culture medium formula and fermentation conditions,the OD600nmof fermentation liquor could reach to 7.38.
Bacillus subtilis;liquid fermentation;medium formula;culture condition;optimization
TQ920.6
0254-5071(2016)02-0043-05
10.11882/j.issn.0254-5071.2016.02.010
2015-12-14
江西省科技支撑重点计划项目(2009BNA09400)
李情敏(1991-),女,硕士研究生,研究方向为食品微生物。
陈卫平(1956-),男,教授,本科,研究方向为食品微生物。
