中国西部单中心二级医院呼吸道感染住院患儿鼻咽部肺炎链球菌携带及其血清型和耐药性的横断面调查
2016-09-16陈长会彭拥军程小平姚开虎
陈长会 史 伟 彭拥军 熊 维 袁 林 高 薇 程小平 姚开虎
·论著·
中国西部单中心二级医院呼吸道感染住院患儿鼻咽部肺炎链球菌携带及其血清型和耐药性的横断面调查
陈长会1,4史伟2,4彭拥军1熊维1袁林2高薇2程小平3姚开虎2
目的了解不发达地区二级医院呼吸道感染住院患儿鼻咽部肺炎链球菌的携带情况及分离株的血清型分布和耐药性特征。方法 采集重庆市酉阳土家族苗族自治县人民医院(简称酉阳医院)2015年1~12月呼吸道感染住院患儿鼻咽拭子标本,培养并分离肺炎链球菌,采用荚膜肿胀实验对分离株进行血清分型。随机选取50%的肺炎链球菌分离株以E-test法和纸片扩散法对16种常见抗菌药物检测其敏感性。结果研究期间共采集鼻咽拭子标本1 054份,分离出肺炎链球菌267株,分离率为25.3%。≤5岁儿童分离率较高,冬春季分离率较高。267株肺炎链球菌分离株中最常见的血清型为19F型(47株,17.6%),其次为6A(35株,13.1%)、14(31株,11.6%)、19A(28株,10.5%)、23F(28株,10.5%)和6B型(25株,9.4%)。13价肺炎链球菌结合疫苗(PCV13)的覆盖率为73.8%(197/267)。136株肺炎链球菌行抗生素药敏试验,所有菌株对头孢曲松、万古霉素和左氧氟沙星敏感,对利奈唑胺、亚胺培南和泰利霉素的敏感率较高,分别为96.3%、87.5%和84.5%;静脉青霉素的敏感率为100%,口服青霉素的敏感率为16.9%。99.3%(135/136)的分离株对红霉素和阿奇霉素耐药。PCV13覆盖株对口服青霉素、头孢吡肟、头孢呋辛和亚胺培南的不敏感率明显高于非PCV13覆盖株(P<0.01)。19A型菌株对口服青霉素、头孢吡肟不敏感率为100%。结论酉阳医院呼吸道感染住院患儿鼻咽部肺炎链球菌的分离率为25.3%,常见血清型为19F、6A、14、19A、23F和6B,PCV 13覆盖率较高,且PCV13覆盖株对口服青霉素、头孢吡肟、头孢呋辛和亚胺培南的不敏感率明显高于非PCV13覆盖株。
肺炎链球菌;儿童;血清型;耐药性;肺炎链球菌结合疫苗
AbstractObjectiveTo investigate the status of nasopharyngeal carriage rate, serotype distribution and antibiotic resistance pattern ofStreptococcuspneumoniaeisolates collected from children with respiratory tract infections inpatiented in Youyang county.MethodsThe nasopharyngeal swab was collected from children with respiratory tract infections inpatiented in People′s Hospital of Chongqing Youyang County from January to December in 2015. The serotype was determined by Quellung reaction, and the antibiotic susceptibility was tested by E-test method and disc diffusion.ResultsThe nasopharyngeal carriage rate ofStreptococcuspneumoniaewas 25.3% (267/1054), major in winter and spring among children younger than 5 years old. Serotype 19F(47, 17.6%), 6A(35, 13.1%), 14(31, 11.6%), 19A(28, 10.5%), 23F(28, 10.5%) and 6B(25, 9.4%) were the common serotypes, and the coverage rate of 13-pneumococcal conjugate vaccine (PCV13) was 73.8%(197/267). All of the isolates were sensitive to ceftriaxone, vancomycin and levofloxacin. The sensitive rates to linezolid, imipenem and telithromycin were 96.3%, 87.5% and 84.5%, respectively. All of the isolates were sensitive to penicillin using the parenteral breakpoints, but the sensitive rate was just 16.9% according to the oral breakpoints. 99.3% (135/136) of the isolates were resistant to erythromycin and azithromycin. The non-suscepibility rates to oral penicillin, cefepime, cefuroxime and imipenem were higher in PCV13 isolates than non-PCV13 isolates (P<0.01). Isolates of serotype 19A were more resistant than the other serotype isolates.ConclusionThe nasopharyngeal carriage rate of Streptococcus pneumoniae was 25.3%, the common serotypes were 19F, 6A, 14, 19A, 23F and 6B. PCV13 coverage rate was high, and the non-suscepibility rates to oral penicillin, cefepime, cefuroxime and imipenem were higher in PCV13 isolates than non-PCV13 isolates.
由于抗生素的大量使用,肺炎链球菌对常用抗菌药物的耐药性明显增加并迅速播散,且不同时期不同地区报道的抗生素敏感性数据存在差异。不同血清型菌株的抗生素敏感性亦有所不同[1~4]。国内已经开展儿童人群肺炎链球菌流行状况和耐药性的研究,但报告多来源于大中型城市,基层报告较少,本研究评估重庆市酉阳土家族苗族自治县人民医院(我院)儿科住院的呼吸道感染儿童鼻咽部肺炎链球菌的分离情况,检测分离株的血清型和抗生素耐药性,供临床用药和疫苗免疫决策时参考。
1 方法
1.1纳入标准2015年1~12月在我院儿科病房住院的呼吸道感染[5](上呼吸道感染、支气管炎和肺炎)的连续病例,同时符合以下条件:①年龄1月龄至12岁;②病程<3 d;③具备发热、咳嗽表现;④父母或法定监护人了解本研究的意愿配合标本采集,并签署书面知情同意。
1.2排除标准符合以下任意一项:①现存的或潜在的可能会影响取鼻咽拭子的情况(如出血体质、重度呼吸窘迫等);②根据临床特征已疑诊为某特定病原感染者(麻疹、毛细支气管炎);③同时具明显的呼吸系统以外的异常临床表现(腹泻、脱水、反复抽搐、喷射性呕吐等)。
1.3标本采集和保存北京儿童医院微生物研究室的2名资深技术人员在研究开展前对我院儿科病房负责鼻咽拭子标本采集的工作人员进行培训,确保采集医生能够标准地采集到合格的鼻咽拭子标本。每例患儿原则上在入院后尽早采集鼻咽拭子标本,采集后立即放入脱脂奶粉-胰蛋白胨-葡萄糖-甘油(skim milk-tryptoneglucose-glycerol, STGG)转运培养基中。2 h内将标本置于-80℃冰箱冻存。每6个月将冻存标本转运至北京儿童医院微生物研究室行细菌分离和培养 。
1.4细菌分离、培养和鉴定标本解冻后震荡混匀,取20 μL接种到含5% 脱纤维羊血TSA琼脂(Oxoid,英国)平板上,于35℃、5% CO2孵箱中孵育。分别在培养24 、48 h后检查平板,挑草绿色溶血可疑菌落,optochin 纸片试验和全价血清凝集试验阳性鉴定为肺炎链球菌。
1.5肺炎链球菌血清分型采用荚膜肿胀试验确定分离株的血清型,分型血清购自丹麦国家血清研究所,操作步骤和判断标准按文献[6]进行。
1.6抗生素敏感性检测菌株选取①同一血清型≥4株的血清型菌株,以分离菌株号排序,从随机数字表中依序取2位数除以同型的菌株数,将排序号与余数对应的菌株取出,直至从各个血清型中选取到50%菌株;②菌株数<4的血清型菌株合并排序后直接随机选取50%菌株。

1.8观察指标截取和汇总以第1次采集的鼻咽拭子标本检测结果进入后续分析。截取以下资料行描述性分析,①标本采集时季节和患儿的年龄;②肺炎链球菌分离株的血清型分型;③抗生素药敏试验结果;按PCV13覆盖和非覆盖菌株,不同血清型分层分析。
1.9统计学分析采用软件WHONET 5.6录入抗生素敏感性检测数据并进行药物敏感性分析。采用SPSS 16.0软件进行统计学分析。计数资料用百分比(%)表示,组间比较采用χ2检验或Fisher′s确切概率法。P<0.05表示差异有统计学意义。
2 结果
2.1肺炎链球菌携带率研究期间共纳入呼吸道感染病例1 054例。1 054份鼻咽拭子标本分离出肺炎链球菌267株,携带率为25.3%。男童和女童肺炎链球菌的分离率分别为26.1%(177/679)和24.0%(90/375),差异无统计学意义(χ2=0.55,P=0.460)。
不同年龄呼吸道感染患儿鼻咽部肺炎链球菌分离率见图1。总体上≤7岁患儿分离率较高,4岁患儿肺炎链球菌分离率达29.6%。各个月份的肺炎链球菌分离率见图2。分离高峰出现在4月和11月,分别为29.4%和30.6%, 8月份最低,为11.8%。
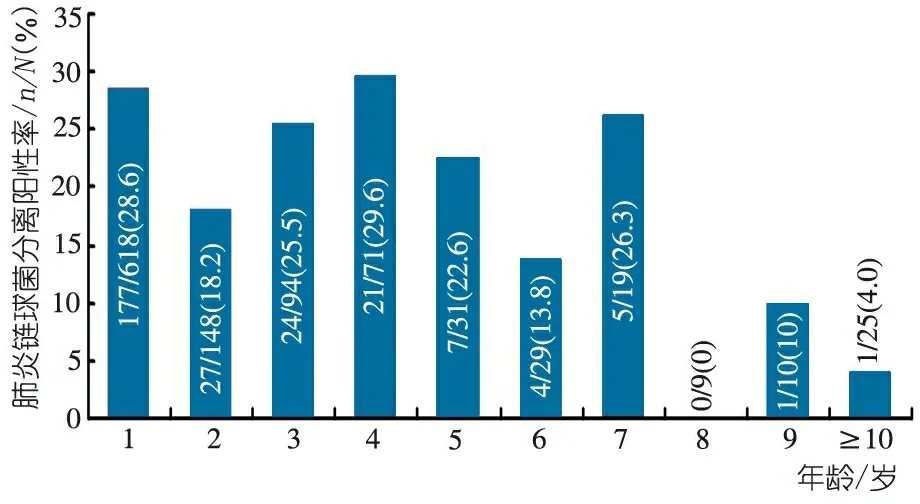
图2呼吸道感染患儿鼻咽部肺炎链球菌分离率月份分布
2.2血清型分布及疫苗覆盖率267株肺炎链球菌分离株中最常见的血清型为19F型(47株,17.6%);其次为6A(35株,13.1%)、14(31株,11.6%)、19A(28株,10.5%)、23F(28株,10.5%)和6B型(25株,9.4%)。13价肺炎链球菌结合疫苗(PCV13:1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F型)覆盖率为73.8%(197/267)。非PCV13覆盖的血清型主要包括15B(13株,4.9%)、15C(11株,4.1%)、23A(8株,3.0%)、6C(6株,2.2%)、15A(4株,1.5%)、10B(4株,1.5%)、34(3株,1.1%)、42(3株,1.1%),10A、11A、20、22A、28A型各2株;7C、13、15F、16F、19B、21、35B、41A型各1株。23价荚膜多糖疫苗(PPV23,包括1、2、3、4、5、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17F、18C、19A、19F、20、22F、23F 和33F型)覆盖率为67.8%(181/267)。


表1 136株肺炎链球菌对16种常见抗菌药物的敏感性检测结果
注MIC:最低抑菌浓度;MIC50:抑制50%分离株生长的最低药物浓度;MIC90:抑制90%分离株生长的最低药物浓度;采用2种青霉素敏感性判定标准,静脉青霉素:敏感 ≤2 mg·L-1,中介为4 mg·L-1,耐药≥8mg·L-1;口服青霉素:敏感≤0.064 mg·L-1,中介为0.12~2 mg·L-1,耐药≥2 mg·L-1;-:CLSI中未对相应折点做出规定
2.4PCV13覆盖菌株与非PCV13覆盖菌株抗生素耐药性的差异表2显示,PCV13覆盖株对口服青霉素、头孢吡肟、头孢呋辛和亚胺培南的不敏感率(中介+耐药)明显高于非PCV13覆盖株(P≤0.01);对其他抗生素的不敏感率差异无统计学意义。
2.5不同血清型菌株对β-内酰胺类抗生素的敏感性差异表3显示,19F、6A、14、19A、23F、6B型血清型菌株对口服青霉素和头孢呋辛的不敏感率高于其他血清型菌株。6B型菌株对口服青霉素和头孢吡肟的不敏感率较低;19A型菌株对口服青霉素和头孢吡肟的不敏感率为100%,其MIC分布集中在1.5~3 mg·L-1,明显高于非19A型菌株。
表2PCV13覆盖与非覆盖菌株抗生素不敏感(中介+耐药)率的比较[n(%)]

抗生素PCV13覆盖株(n=100)非PCV13覆盖株(n=36)χ2P青霉素(口服)94(94.0)19(52.8)32.01<0.001阿莫西林-克拉维酸48(48.0)12(33.3)2.310.129头孢吡肟72(72.0)12(33.3)16.76<0.001头孢呋辛88(88.0)16(44.4)27.91<0.001红霉素100(100)35(97.2)-0.261)阿奇霉素100(100)36(100)-1.001)亚胺培南61(61.0)6(16.7)20.820.01氯霉素46(46.0)22(61.1)2.420.05泰利霉素19(19.0)2(5.6)3.660.05磺胺甲唑-甲氧苄啶90(90.0)31(86.1)0.110.05四环素97(97.0)35(97.2)0.260.05
注1) Fisher′s确切概率法

表3 不同血清型肺炎链球菌对β-内酰胺类抗生素的耐药性差异
注MIC:最低抑菌浓度(mg·L-1);MIC90:抑制50%分离株生长的最低药物浓度;MIC90:抑制90%分离株生长的最低药物浓度
3 讨论
肺炎链球菌常定植于儿童鼻咽部。由于研究目的、标本收集时间及分离技术等的差异,各个地区报道的儿童鼻咽部肺炎链球菌的分离率为16.6%~36.0%[9,10]。本研究呼吸道感染患儿鼻咽部肺炎链球菌的分离率为25.3%,≤5岁儿童分离率较高,冬春季多见,与国内其他地区的报道基本一致[11~13]。
本文研究结果显示,我院住院呼吸道感染患儿鼻咽部分离肺炎链球菌的常见血清型为19F(17.6%)、6A(13.1%)、14(11.6%)、19A(10.5%)、23F(10.5%)和6B(9.4%),PCV13 的覆盖率为73.8%。与国内其他地区报道结果比较,常见血清型种类相似,但具体排序有所不同,PCV13覆盖率较高。2010~2013年大连地区住院患儿分离肺炎链球菌131株,常见血清型为19F(28.2%)、19A(19.1%)、6B(17.6%)和23F(14.5%),PCV13覆盖血清型占87.8%[14];2012年南京地区分离到的584株肺炎链球菌以19F(38.1%)、19A(27.5%)、14(10.1%)、23F(7.2%)和9V(5.2%)为主[15];2013~2014年北京儿童医院门诊就诊的2 941例上呼吸道感染儿童鼻咽拭子标本中分离到肺炎链球菌699株,常见血清型为6A(12.0%)、19F(12.0%)、6B(10.0%)、23F(9.0%)和14型(8.0%),PCV13覆盖率为59.0%[11];同期北京儿童医院住院患儿分离到的187株肺炎链球菌的常见血清型分布为19F(31.5%)、19A (19.8%)、23F(11.2%)、6A(9.1%)、14 (9.1%) 和15B (5.9%),PCV13覆盖血清型占86.1%[16]。以上数据提示,肺炎链球菌血清型分布因地区和选择人群有所不同,大多数菌株属于PCV13覆盖型别,积极推广使用PCV13有助于预防肺炎链球菌感染。
本研究136株肺炎链球菌对静脉青霉素的敏感率为100%,对口服青霉素的敏感率仅为16.9%,低于2014年北京地区报道的33.0%[11]。提示重庆市酉阳县肺炎链球菌的耐药性问题可能比一线城市更为严重。分离株对大环内酯类抗生素(红霉素和阿奇霉素)的耐药率高达99.3%,且MIC > 256 mg·L-1的菌株占97.0%,这与中国其他地区的报道结果一致[3,11~14,17]。肺炎链球菌等对大环内酯类抗生素的耐药问题应该引起国内儿科医生的重视。
上海地区Pan等[2]和北京地区Zhou等[4]的研究结果显示,19A型菌株对头孢呋辛的不敏感率高于非19A型菌株。本研究中6种常见血清型中,19A型的抗生素耐药性也较为突出:虽然23F和19F呈现了较高的头孢呋辛耐药率,但19A型菌株的MIC分布更集中在相对较高的3和4 mg·L-1;19A型菌株对口服青霉素和头孢吡肟的耐药率也高于非19A型菌株。其他常见血清型中,除了6B型耐药性相对较弱外,其他型别抗生素耐药性相似。因为耐药性较严重的常见血清型都属于PCV13覆盖血清型,因此PCV13覆盖株对口服青霉素、头孢呋辛、头孢吡肟和亚胺培南的不敏感率明显高于非PCV13覆盖株,提示推广计划免疫PCV13对阻止肺炎链球菌对β-内酰胺类抗生素的耐药性恶化具有积极意义。欧美等发达国家实施PCV计划免疫后不仅有效降低了肺炎链球菌疾病的发病率,也使得耐药性肺炎链球菌减少[18~23]。
本研究在一个完整年度较好地控制了鼻咽拭子采集标本的基础上,由北京儿童医院微生物研究室进行了细菌分离和培养,描述本县肺炎链球菌血清型分布和耐药性特征,为我院有针对性的用药提供参考。本研究另一个主要目的是为肺炎链球菌疫苗免疫决策提供层次更丰富的流行病学依据。众所周知,不同地区和人群的肺炎链球菌血清型分布和耐药性存在差异,中国幅员辽阔,各地经济水平、卫生水平参差不齐,从贫困到发达、从闭塞到开放的层次明显。既往的相关研究均来源中大型发达和开放城市,本研究考察了相对欠发达和闭塞的小型城市肺炎链球菌血清型分布和耐药性特征,虽然揭示了一些地区性的流行病学特点,但与既往中大型发达城市数据比较没有显著的特征性差异。但本研究仅基于一个西部县城,且主要基于县城区及邻近区域儿童人群,以此反映西部小城市的状况是不够的,希望今后能积累更为丰富的来自不同层次人群的高质量数据,包括多个小城市,以及从农村散居、村镇到县城的综合数据。另外,PCV7虽然曾经在中国使用,但属二类疫苗,且因价格等原因只进入了经济发达地区的市场,中国儿童普遍接种率不高,不足以影响肺炎链球菌血清型和耐药性分布的流行病学特征,因此,小城市和中大型发达城市肺炎链球菌分离株的特征也不会因疫苗使用情况的不同而产生差异。
[1]Liu L, Oza S, Hogan D,et al. Global, regional, and national causes of child mortality in 2000-13, with projections to inform post 2015 priorities: an updated systematic analysis. Lancet, 2015, 385(9966): 430-440
[2]Pan F, Han L, Kong J, et al. Serotype distribution and antimicrobial resistance of Streptococcus pneumoniae causing noninvasive diseases in a Children′s Hospital, Shanghai. Braz J Infect Dis, 2015, 19(2):141-145
[3]张泓, 李万华, 孔菁, 等. 儿童肺炎链球菌血清型分布及其对抗菌药物的耐药性. 中国感染与化疗杂志, 2011, 11(4): 287-290
[4]Zhou L, Yu SJ, Gao W, et al. Serotype distribution and antibiotic resistance of 140 pneumococcal isolates from pediatric patients with upper respiratory infections in Beijing, 2010. Vaccine, 2011, 29(44): 7704-7710
[5]江载芳, 申昆玲, 沈颖. 主编. 诸福棠实用儿科学. 第8版. 北京:人民卫生出版社. 2015: 1247-1288
[6]Sørensen UB. Typing of pneumococci by using 12 pooled antisera. J Clin Microbiol. 1993, 31(8):2097-100
[7]Clinical and Laboratory Standards Institute (CLSI). Performance Standards for antimicrobial susceptibility testing. In: Twenty-sixth Informational Supplement. Wayne, PA: Clinical and Laboratory Standards Institute; 2016. M100-S26
[8]He M, Yao K, Shi W, et al. Dynamics of serotype 14 Streptococcus pneumoniae population causing acute respiratory infectious among children in China (1997-2012). BMC Infectious Dis, 2015, 15:266
[9]Hu JY, Sun XD, Huang ZY, et al. Streptococcus pneumoniae and Haemophilus influenzae type b carriage in Chinese children aged 12-18 months in Shanghai, China: a cross-sectional study. BMC Infect Dis, 2016, 16:149
[10]Yu S, Yao K, Shen X, et al. Serogroup distribution and antimicrobial resistance of nasopharyngeal isolates of Streptococcus pneumo-niae among Beijing children with upper respiratory infections (2000-2005). Eur J Clin Microbiol Infect Dis, 2008, 27:649-655[11]俞桑洁, 高薇, 史伟, 等. 上呼吸道感染儿童鼻咽部携带肺炎链球菌状况及血清型和耐药性研究. 中国当代儿科杂志, 2014, 16(10): 988-992[12]龚松迪, 华春珍, 李建平, 等. 2006-2014年我院1109例肺炎链球菌感染及其耐药模式分析. 中国抗生素杂志, 2015, 40(11):859-864, 880
[13]刘获, 厉小玉, 周俊. 2011-2014年杭州部分地区儿童感染肺炎链球菌的耐药性变迁. 浙江临床医学, 2015,17(12):2129-2130
[14]王延伟, 牛淼. 大连地区儿童肺炎链球菌耐药及血清分型研究. 中国实验诊断学, 2014, 18(11): 1793-1796
[15]李松涛, 岳玉林, 孙航, 等. 584株临床分离儿童痰液肺炎链球菌血清型/群分布研究. 国际检验医学杂志, 2014, 35(18): 2565-2566
[16]Lyu S, Yao KH, Dong F, et al. Vaccine serotypes of Streptococcus pneumoniae with high-level antibiotic resistance isolated more frequently 7 years after the licensure of PCV7 in Beijing. Pediatr Infect Dis J, 2016, 35(3): 316-321
[17]徐静, 解宝君, 李恩杰, 等. 122株儿童肺炎链球菌耐药性结果分析. 临床输血与检验, 2015, 17(2): 163-164
[18]Centers for Disease Control and Prevention (CDC). Pneumonia hospitalizations among young children before and after introduction of pneumococcal conjugate vaccine United States, 1997-2006. MMWR Morb Mortal Wkly Rep, 2009, 58(1): 1-4
[19]Durando P, Crovari P, Ansaldi F, et al. Universal childhood immunisation against Streptococcus pneumoniar: the five year experience of Liguria Region, Italy. Vaccine, 2009, 27(25/26):3459-3462
[20]Halasa NB, Grijalva CG, Arbogast PG, et al. Nearly complete elimination of the 7 valent pneumococcal conjugate vaccine serotypes in Tennessee. Pediatr Infect Dis J, 2013, 32(6):604-609
[21]Diawara I, Zerouali K, Katfy K, et al. Invasive pneumococcal disease among children younger than 5 years of age before and after introduction of pneumococcal conjugate vaccine in Casablanca, Morocco. Int J Infect Dis, 2015, 40:95-101
[22]Tan TQ. Pediatric invasive pneumococcal disease in the United States in the era of pneumococcal conjugate vaccines. Clin Microbiol Rev, 2012, 25(3):409-419
[23]Shibl AM, Memish ZA, Al-Kattan KM. Antibiotic resistance and serotype distribution of invasive pneumococcal diseases before and after introduction of pneumococcal conjugate vaccine in the Kingdom of Saudi Arabia (KSA). Vaccine, 2012, 30(S6): G32-36
(本文编辑:张萍)
Nasopharyngeal carriage rate, serotype distribution and antibiotic resistance pattern of Streptococcus pneumoniae isolates collected from hospitalized children with respiratory tract infections in a single-center grade two hospital in western of China: a cross-sectional study
CHENChang-hui1,4,SHIWei2,4,PENGYong-jun1,XIONGWei1,YUANLin2,GAOWei2,CHENGXiao-ping3,YAOKai-hu2
(1DepartmentofPediatrics,YouyangHospital,TheFirstAffiliatedHospitalofChongqingMedicalUniversity;People′sHospitalofChongqingYouyangCounty,Chongqing409899; 2KeyLaboratoryofMajorDiseasesinChildren,MinistryofEducation,NationalKeyDisciplineofPediatrics(CapitalMedicalUniversity),NationalClinicalResearchCenterforRespiratoryDiseases,BeijingKeyLaboratoryofPediatricRespiratoryInfectionDiseases,BeijingPediatricResearchInstitute,BeijingChildren′sHospitalaffiliatedtoCapitalMedicalUniversity,Beijing100045; 3DepartmentofClinicalLaboratory,YouyangHospital,TheFirstAffiliatedHospitalofChongqingMedicalUniversity;People′sHospitalofChongqingYouyangCounty,Chongqing409899; 4co-firstauthors)
CHENG Xiao-ping,E-mail:yywt2004@163.com; YAO Kai-hu,E-mail:yaokaihu@bch.com.cn
Streptococcuspneumoniae; Children;Serotype;Antibiotic resistance; PCV
国家自然科学基金:81371853;国家科学技术部项目:2013BAI09B11;北京市科委行业定额经费自主项目:2016-bjsekyjs-3
1 重庆市酉阳土家族苗族自治县人民医院,重庆医科大学附属第一医院酉阳医院儿科重庆,409899;2 首都医科大学附属北京儿童医院、北京市儿科研究所,儿科学国家重点学科,教育部儿科重大疾病研究重点实验室,国家呼吸系统疾病临床医学研究中心,儿童呼吸道感染性疾病研究北京市重点实验室北京,100045;3 重庆市酉阳土家族苗族自治县人民医院,重庆医科大学附属第一医院酉阳医院检验科重庆,409899;4 共同第一作者
程小平,E-mail: yywt2004@163.com ;姚开虎,E-mail: yaokaihu@bch.com.cn
10.3969/j.issn.1673-5501.2016.04.001
2016-06-30
2016-08-21)
