沉水植物对受重金属镉、锌污染的水体底泥的修复效果
2016-09-16乔云蕾李铭红谢佩君晏丽蓉朱剑飞
乔云蕾, 李铭红*, 谢佩君, 晏丽蓉, 朱剑飞
(1.浙江师范大学行知学院, 浙江 金华 321004; 2.浙江师范大学 生态研究所, 浙江 金华 321004)
沉水植物对受重金属镉、锌污染的水体底泥的修复效果
乔云蕾1,2, 李铭红1,2*, 谢佩君2, 晏丽蓉2, 朱剑飞2
(1.浙江师范大学行知学院, 浙江 金华 321004; 2.浙江师范大学 生态研究所, 浙江 金华 321004)
为了探究常见沉水植物对水体底泥中重金属污染的富集效果,选取浙江水域较为常见的3种沉水植物苦草(Vallisnerianatans(Lour.) Hara)、黑藻(Hydrillaverticillata(Linn.f.) Royle)、金鱼藻(CeratophyllumdemersumL.),在模拟天然水体环境中,将3种沉水植物培养在含有重金属Cd、Zn的底泥中生长一个生活周期.依据沉水植物对重金属Cd、Zn的富集量和生物-沉积物生物富集因子(biota-sediment accumulation factor, BSAF)等指标,筛选出对2种重金属元素富集效果较好的沉水植物,为受重金属污染底泥生态修复的植物选择提供一定的参考.结果表明:3种沉水植物对重金属Cd、Zn的耐受性均较强,同时对重金属Cd、Zn都有较高的富集能力,生物富集因子大于1,对底泥中的Cd、Zn均具有较好的祛除效果;由相关分析可知,3种沉水植物体中的Cd、Zn的质量分数与其根部底泥中Cd、Zn的质量分数呈极显著的负相关(p<0.01),因此这3种植物均可作为重金属Cd、Zn污染的修复物种.苦草对重金属Cd、Zn的富集量及BSAF均大于黑藻和金鱼藻,对重金属Cd的富集量分别达到了黑藻和金鱼藻的1.90和3.02倍.因此可考虑苦草作为水体底泥Cd、Zn复合污染生态修复的先锋物种.
苦草;黑藻;金鱼藻;底泥;镉;锌;富集作用
随着我国工业的迅速发展,各种重金属污染物不断进入水体[1].底泥是河流、湖泊等水生生态系统的重要组成部分,也是环境污染物的聚集场所.进入水环境的重金属主要通过吸附、络合、沉淀等复杂的界面交换和反应迁移至底泥中,使底泥沉积物中的重金属含量远高于水相.当外界环境变化时,沉积于底泥中的重金属很可能被释放,造成二次污染[2],恶化水质,毒害水生生物,并可能通过食物链直接或间接影响人类和动物的健康[3].目前底泥的重金属污染治理主要采用物理、化学和生物修复手段.其中植物修复与传统的物理和化学修复相比,具有成本低、不易引起二次污染等优点,不仅可以减轻重金属污染,还可以美化环境,尤其适合大面积需异位处理的底泥[4].
在修复水体和底泥重金属污染的众多植物中,水生植物格外受到关注.水生植物可将重金属离子吸收进体内,其体内的谷胱甘肽、植物螯合素、金属硫蛋白、有机酸等成分可以降低重金属离子的毒性[5],通过络合及区域化作用,使重金属离子在植物体内存留并富集,从而降低其对环境的污染.因此,利用水生植物修复受重金属污染的底泥是绿色环保的,其中沉水植物起非常重要的作用.沉水植物生活在水中,其根、茎、叶均可蓄积较高含量的重金属[6],其富集能力强于浮水植物和挺水植物.苦草、黑藻、金鱼藻为浙江水域常见沉水植物,生物量大且繁殖能力强,因此选用这3种沉水植物作为实验材料.
之前关于重金属修复的研究大多注重单一重金属的环境效应,对多种重金属共存于同一环境以及相互作用所形成的环境污染效应重视不够[7].Cd和Zn具有相近的核外电子构型,易发生同晶代替,它们的化学性质及生物行为也颇为相似,因此在自然界中,Cd一般与Zn共生,构成Cd、Zn的复合污染[8].针对湖泊、河流等水体底泥中重金属污染越来越严重的问题,本研究以3种沉水植物为材料,采用生态模拟方法,通过沉水植物对底泥中重金属Cd、Zn的吸附作用,比较3种沉水植物对重金属Cd、Zn的富集能力,初步筛选出吸附效果较好的沉水植物,为底泥中重金属污染的生态修复提供一定的科学依据.
1 材料与方法
1.1实验材料
实验植物苦草(Vallisnerianatans(Lour.) Hara)、黑藻(Hydrillaverticillata(Linn.f.) Royle)和金鱼藻(CeratophyllumdemersumL.)为我国东南地区常见的3种沉水植物,均采自浙江水域.实验用水为经过暴晒后的自来水.
将采自浙江师范大学周边水体的实验底泥混匀、风干后测得2种重金属Cd、Zn的质量分数分别为0.82,187.52 mg·kg-1.随后将2种重金属盐的混合溶液(用分析纯的重金属盐[CdCl2·2.5H2O、Zn(NO3)26H2O]配制而成)倒入原始底泥中,搅拌均匀后风干.经过处理的底泥中2种重金属质量分数分别为:Cd 35.82 mg·kg-1、Zn 387.52 mg·kg-1,均达到JENSEN底泥污染评价级别的重度污染水平.
1.2实验方法
1.2.1沉水植物培养方法
本实验通过模拟天然水体环境,在玻璃制生态缸(长60 cm,宽30 cm,高50 cm)内进行培养实验.在生态缸内铺入厚约10 cm的配制好的底泥,加入50 L暴晒过的自来水,将相同株数(本实验均为36株)的3种沉水植物植入污染底泥中.实验中蒸发的水分用暴晒的自来水补充.实验共设置15个生态缸,其中1#~5#植入苦草,6#~10#植入黑藻,11#~15#植入金鱼藻.每个生态缸划分为3个小区域,分别在3个小区域取样,作为实验的3个重复.实验共进行一个生长周期(105 d),分5个阶段取植物样、植物根部底泥样.采样阶段、釆样时间及采样区域见表1.

表1 采样阶段、采样时间及采样区域
1.2.2重金属测定方法
将采集的植物样品用超纯水冲洗干净,105 ℃下杀青30 min,90 ℃烘干至恒重,将烘干后的植物样磨碎后过60目筛.取植物根部底泥,90 ℃下烘至恒重,将烘干的底泥磨成粉末状过100目筛.取植物和土壤样品各约0.25 g待用.采用硝酸-高氯酸消解法消解待测样品后用电子耦合等离子发射法(inductively coupled plasma-atomic emission spectrometry, ICP-AES)测定Cd、Zn的质量分数.
1.3数据分析
实验所得数据采用Origin8、SPSS17.0等软件工具进行分析处理.
1.3.1植物生长率的计算
生长率是衡量植物生物量变化的一个量化指标,当生物量为w,时间为t时,生长率(GR)=dw/dt,即单位时间内生物量增加的部分为生长率.
1.3.2沉水植物对重金属的吸附速率
沉水植物对重金属的吸附速率为单位时间内植物体内的重金属质量分数增加的数值.
1.3.3沉水植物吸收重金属的生物-沉积物生物富集因子(BSAF)计算
分别在5个取样阶段采集相应生态缸中3个小区域的植株及其根部底泥,测定样品中重金属Cd、Zn的平均质量分数.BSAF为沉水植物体内重金属质量分数与其相应的根部底泥中重金属质量分数的比值.
1.3.4沉水植物对重金属的去除率计算
沉水植物对重金属的去除率为实验结束后培养3种沉水植物的底泥中重金属的质量分数与相应原始底泥中重金属质量分数的比值.
2 研究结果
2.13种沉水植物生长及生物量变化情况
黑藻和金鱼藻在实验初期长势较好,叶片绿而茂盛.实验初期苦草叶片生长并不茂盛,且根部有繁殖芽出现.随着培养时间的延长,3种植物生长状况良好.在实验后期,3种植物多数叶片出现发黄症状,且植物叶片表面都有藻类附着,沉水植株受害症状明显.
实验期间3种植物的生物量有明显的增加.实验结束时苦草生物量鲜重的增加量为633.90 g,黑藻的增加量为452.58 g,金鱼藻的增加量为589.01 g.3种沉水植物在实验开始阶段的生长率最低,随后逐渐增加.苦草和黑藻在第4阶段时生长率达到最高,金鱼藻在第3阶段内生长率达到最大.实验的最后阶段3种沉水植物的生长率虽然有所下降,但仍维持在较高水平(见图1).

图1 沉水植物的生长率时间动态Fig.1 Temporal dynamics of growth rate of submerged plants
2.2沉水植物对底泥中镉、锌的富集效应分析
2.2.13种沉水植物对镉的富集效应
自然状况下,重金属Cd在供试植物苦草、黑藻、金鱼藻中质量分数都比较低,背景值分别为3.90,2.35,2.35 mg·kg-1,差异不显著.实验结束时苦草、黑藻、金鱼藻中Cd质量分数明显增加,分别为背景值的23.28,20.33,12.78倍,苦草中重金属Cd的质量分数明显高于黑藻和金鱼藻(见图2),是黑藻和金鱼藻中的1.90和3.02倍.通过对3种沉水植物不同天数之间重金属Cd质量分数进行多重比较知:苦草中Cd质量分数除21 d与42 d之间、42 d与63 d之间差异不显著(p>0.05)外,其余两两之间均差异显著(p<0.05);黑藻中Cd质量分数除 0 d与21 d之间、84 d与105 d之间差异不显著(p>0.05)外,其余两两之间均差异显著(p<0.05);金鱼藻中Cd质量分数除0 d与21 d之间差异不显著(p>0.05)外,其余不同天数之间均差异显著(p<0.05).
第1阶段内苦草的生长率最低,但苦草吸附Cd的速率较大,实验进行到第4阶段时,苦草的生长率达到最高,吸附Cd的速率急剧增加,在第5阶段达到最大;实验期间金鱼藻吸附Cd的速率较低,金鱼藻的生长率在第3阶段达到最大,在第4阶段吸附Cd的速率最大;黑藻的生长速率与对Cd的吸附速率基本保持一致(见图2).
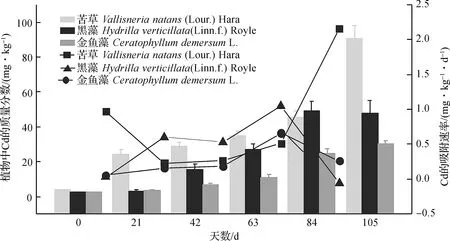
图2 3种沉水植物对Cd的富集效应Fig.2 Enrichment effect for Cd of three submerged plants柱状图为植物中重金属Cd质量分数图,拆线图为重金属Cd吸附速率图.
2.2.23种沉水植物对锌的富集效应
3种沉水植物苦草、黑藻、金鱼藻中重金属Zn的背景值分别为246.41, 318.33, 321.43 mg·kg-1,差异不显著.3种植物中重金属Zn的质量分数均随着培养时间的延长而增加.实验结束时,3种植物中重金属Zn的质量分数分别为初始值的3.83,1.92,1.82倍,苦草中重金属Zn质量分数明显高于黑藻和金鱼藻(见图3),说明苦草对重金属Zn的富集能力强于黑藻和金鱼藻.对3种沉水植物不同天数之间重金属Zn质量分数进行多重比较可知:苦草中Zn质量分数任意天数之间均差异显著(p<0.05);黑藻中Zn质量分数除21 d与42 d之间差异不显著(p>0.05)外,其他天数之间均差异显著(p<0.05);金鱼藻中Zn质量分数在任意天数之间均差异显著(p<0.05).
实验中苦草吸附重金属Zn的速率明显高于黑藻和金鱼藻.苦草在第1阶段的生长率最低,吸附Zn的速率最大,在第4阶段的生长率最高,此时吸附Zn的速率却很小;黑藻在第1阶段的生长率最低,此时吸附Zn的速率最大.第2阶段内黑藻吸附Zn的速率最小,几乎为0;金鱼藻在第2阶段内吸附Zn的速率达到最大,但金鱼藻的生长率较低(见图1与3).

图3 3种沉水植物对Zn的富集效应Fig.3 Enrichment effect for Zn of three submerged plants柱状图为植物中重金属Zn质量分数图,拆线图为重金属Zn吸附速率图.
2.3沉水植物吸收重金属的生物富集因子及动态
沉积物生物富集因子(BSAF)是衡量植物对重金属富集能力的重要指标之一.BSAF值越大,表示植物对重金属的富集能力越强[10-12].本研究采用BSAF值来衡量沉水植物去除底泥中重金属的能力.
2.3.1沉水植物吸收镉的生物富集因子及动态
苦草、金鱼藻对Cd的BSAF逐渐增加,在实验结束时达到最大.黑藻对Cd的BSAF也逐渐增加,在第4阶段时达到最大.苦草对重金属Cd的生物富集因子在1.02~19.66,且在最后阶段BSAF值显著大于前4个阶段.黑藻和金鱼藻分别在实验进行到第3和第4阶段时对Cd的BSAF值才大于1,2种植物此前对重金属Cd没能起到生物富集作用(见图4).
统计分析表明,苦草、黑藻、金鱼藻3种沉水植物中重金属Cd与底泥中Cd质量分数达到极显著负相关(苦草、黑藻、金鱼藻的相关系数分别为:γ=-0.95,p<0.01;γ=-0.98,p<0.01;γ=-0.99,p<0.01).

图4 3种沉水植物对Cd的生物富集因子Fig.4 BSAF for Cd of three submerged plants
2.3.2沉水植物吸收锌的生物富集因子及动态
实验期间,苦草、黑藻、金鱼藻对重金属Zn的BSAF都逐渐增大,说明在一定时间内,3种沉水植物对重金属Zn的富集能力逐渐增强.苦草对Zn的生物富集因子在2.23~19.29,黑藻对Zn的生物富集因子在2.36~7.08,金鱼藻对Zn的生物富集因子在1.22~5.37(见图5).由此可知,3种沉水植物对重金属Zn都有很好的富集作用.
统计分析表明,苦草、黑藻、金鱼藻3种沉水植物中重金属Zn与底泥中Zn质量数分达到极显著负相关(苦草、黑藻、金鱼藻相关系数分别为:γ=-0.99,p<0.01;γ=-1.00,p<0.01;γ=-1.00,p<0.01)

图5 3种沉水植物对Zn的生物富集因子Fig.5 BSAF for Zn of three submerged plants
2.4沉水植物对底泥中重金属的去除率
由表2可知,3种沉水植物对重金属Cd、Zn均有较高的去除率.其中黑藻对Cd的去除率最大,苦草对Cd的去除能力与黑藻相近,金鱼藻最弱;苦草对Zn的去除率明显高于黑藻和金鱼藻,黑藻次之,金鱼藻最低.同时可知,苦草对Cd的去除率略小于对Zn的去除率;黑藻和金鱼藻对Cd的去除率显著大于Zn.

表2 3种沉水植物对底泥中重金属Cd、Zn的去除率
3 分析与讨论
已有研究证明,植物对有毒有害物质的吸收以被动吸收为主,植物对重金属的吸收存在浓度或时间效应,即随着环境中重金属离子浓度的升高或处理时间的延长,植物富集的重金属量增加[13].因而延长植物和污染底泥的接触时间,可提高植物对其的去除率.本研究考察了3种沉水植物在105 d内对重金属Cd、Zn的富集情况,基本覆盖了3种沉水植物的整个生长周期.
相较于挺水植物和浮水植物,沉水植物更容易吸收和富集水体中的重金属,相对地也就更容易出现毒害症状.重金属毒害植物的一个重要特征是使其叶绿素减少、植物失绿[14].本研究观察到苦草最先出现叶片枯萎发黄,即最先表现出受害症状,这与张饮江等[15]对3种沉水植物对水体重金属镉去除效果的实验结果一致.这可能与苦草在实验初期吸附重金属Cd、Zn的速率较快有关.随后3种沉水植物褪绿症状逐步明显.这一方面可能是由于Cd2+抑制了叶绿素合成所必需的原叶绿素酸酯还原酶(Protochlophyllide reductase)的活性和影响氨基-g-酮戊酸(Aminolaevulini acid)的生物合成[16];另一方面也可能由于Cd2+在细胞内积累过多,与叶绿体中蛋白质上的—SH基结合,或取代其中的Fe2+、Zn2+、Mg2+等,破坏了叶绿体的结构和功能[17].同时Zn2+可对叶绿体被膜产生影响,进而破坏叶绿体的结构,也对叶绿素合成有关酶系统和电子传递造成了一定的影响.
由于不同的沉水植物所吸附的重金属分布于体内不同部位,对重金属的反应各异[15],表现出的耐受能力也各不相同,其生物量变化也各异.而耐受能力是筛选重金属富集植物的一个重要指标,因此可根据3种沉水植物的生物量变化筛选富集重金属Cd、Zn能力强的植物.本研究中,苦草的生物量增量最大,因此苦草相较黑藻和金鱼藻对重金属Cd、Zn的耐受性更强.
由3种沉水植物对Cd的富集量及BSAF值可知,苦草富集重金属Cd的能力最强.苦草对Cd的富集能力大于黑藻这一结果与陈国梁等[18]的研究不同.植物对重金属元素吸附的差异与植物自身所处的环境有关,重金属沉积物间的差异,导致不同地域植物对重金属的富集能力不同[19].陈国梁等的数据[18]是在广西刁江流域取沉水植物样后直接测定的,而本研究的取样植物是模拟室外天然水体环境培养的.2组实验的光照强度、水中溶氧量、温度、水体pH值、底泥中重金属质量分数及其他影响因素均不同,从而导致了实验结果的差异.黑藻中Cd质量分数及对Cd的BSAF值在84 d时达到最大,说明黑藻对Cd的吸收机能受到阻碍,这可能与Cd对黑藻体内的氧化还原酶系统有较强的抑制作用有关,使活性氧的产生速率明显加快,从而造成黑藻的功能性损伤[20].因而在本研究中可以得出黑藻对Cd的最大富集量为48.95 mg·kg-1.苦草和金鱼藻对重金属Cd的富集随着实验的进行逐渐增强,因而对Cd的富集量没能达到阈值.苦草在最后阶段BSAF值显著大于之前,表明其对重金属Cd的富集作用主要集中在苦草生长周期的后期.黑藻和金鱼藻分别在第3和第4阶段对Cd的富集因子大于1,此前2种植物对Cd没有生物富集作用.黑藻和金鱼藻对重金属的富集作用也主要集中在生长周期的中后期.因而从生物富集因子角度考虑,在84 d内黑藻对重金属Cd的富集能力最强;在105 d内苦草对重金属Cd的富集能力最强.水生植物对沉积物的修复效果随修复时间尺度的变化而变化[19].因此需要根据修复时间选择适宜的沉水植物.
本研究中,3种植物重金属Zn质量分数以及对Zn的富集因子均随着培养时间的延长而增加.苦草中重金属Zn质量分数及BSAF值明显高于黑藻和金鱼藻,表明苦草对重金属Zn的富集能力强于黑藻和金鱼藻.3种沉水植物在实验的各个阶段对重金属Zn的生物富集因子均大于1,因此3种植物对重金属Zn均可以起到很好的富集作用.苦草对Zn的BSAF值在最后阶段达到最大,因而苦草对重金属Zn的富集作用与对重金属Cd的富集作用类似,主要集中在生长后期.这可能与沉水植物在生长后期生物量较大有关.
苦草在实验第1阶段生长率最低,但是富集重金属Cd、Zn的速率较大,且富集Zn的速率明显大于Cd.这可能与实验初期苦草吸附重金属Cd、Zn的量较少,其体内有充足的吸附位点活性基团,能够满足对二者的吸附有关[21].随后苦草吸附Cd的速率降低,84 d之后逐渐加快,在最后阶段达到最大.这可能是因为随着苦草体内重金属Cd质量分数的增加,毒害作用增强,损害了其细胞膜的完整性,从而丧失了对Cd吸收的选择性,因而大量Cd被动流入了苦草体内[22],造成了苦草对Cd吸附速率的加快和吸附量的急速增加.黑藻吸附Cd、Zn的速率表现出明显的差别,说明同一植物对不同的重金属元素的吸附动力学不同.这可能与重金属在植物体内的分布、化学形态等有关.Cd在黑藻细胞壁中的质量分数多于原生质体,而毒性相对小的Zn在原生质体中的质量分数则大于细胞壁[22].同时黑藻体内Cd和Zn都以NaCl溶液提取态为主,Cd的NaCl溶液提取态占比显著大于Zn[20].金鱼藻的生长率高于黑藻,其吸附重金属Cd、Zn的速率均低于黑藻.金鱼藻根部的退化可能是导致这一结果的原因.根是植物富集重金属的主要部位,水生植物的根系越发达对重金属的富集能力也越强.
3种沉水植物对重金属Zn的富集量及吸附速率显著高于Cd,这可能与底泥初始态的重金属质量分数有关.不同植物对重金属的富集有一定的选择性,其富集作用与土壤背景值有一定的相关性,土壤中重金属的背景值越高,植物对重金属的富集量就越高[23].而且Zn是植物体的必需元素,而Cd是非必需元素,因而植物对Zn的吸附量及吸附速率会明显高于Cd.作为过渡金属,Zn与Cd具有相似的电荷排布和某些类似的化学性质,因此,适量Zn的供应能够通过竞争植物体对Cd的吸收,减少植物富集Cd的量[24].BUNLUESIN等[25]报道了高Zn/Cd比例有助于降低Cd的积累. 汪鹏合[24]通过研究适量Zn2+对浮萍Cd2+毒害的缓解效应,指出Zn的增加对Cd胁迫下的浮萍体现出一定的缓解效应.然而除了苦草对Cd的去除率略小于Zn外,黑藻和金鱼藻对Cd的去除率均显著大于Zn.这可能与2种重金属的初始质量分数有关.
本实验中,3种沉水植物的Cd、Zn质量分数与相应底泥中的Cd、Zn质量分数之间都存在极显著的负相关性.通过分析3种沉水植物富集Cd、Zn的量、富集系数以及去除率知,污染修复能力排序为苦草>黑藻>金鱼藻.苦草对重金属Cd、Zn的高富集能力可能与重金属在苦草体内分布较为均匀有关.同时苦草也是长江中下游湖泊水生植物中的优势种.因此,可考虑将苦草作为浙江水域底泥Cd、Zn复合污染生态修复的先锋物种.
[1]杨正亮,冯贵颖,呼世斌,等.水体重金属污染研究现状及治理技术[J].干旱地区农业研究,2005,23(1):219-222.
YANG Zhengliang, FENG Guiying, HU Shibin, et al. Heavy metal pollution of water body and treatment[J]. Agricultural Research in the Arid Areas,2005,23(1):219-222.
[2]NATHALIE C, CHRISTOPHE T, CORINNE L, et a1. Solubility of metals in an anoxic sediment during prolonged aeration[J]. Science of the Total Environment,2003,301(1/2/3):239-250.
[3]黄勤超.利用睡莲、荷花对黑臭河道底泥中PAHs和重金属的修复研究[D].上海:华东师范大学,2013.
HUANG Qinchao. Study on Removal of PAHs and Heavy Metals in Malodorous River Sediment UsingNymphaeatetragonageorgiandNelumbonucifera[D]. ShangHai: East China Normal University,2013.
[4]李明明,甘敏,朱建裕,等.河流重金属污染底泥的修复技术研究进展[J].有色金属科学与工程,2012,3(1):67-71.
LI Mingming, GAN Min, ZHU Jianyu, et al. Remediation technology for river sediment polluted by heavy metals[J]. Nonferrous Metals Science and Engineering,2012,3(1):67-71.
[5]李文学,陈同斌.超富集植物吸收富集重金属的生理和分子生物学机制[J].应用生态学报,2003,14(4):627-631.
LI Wenxue, CHEN Tongbin. Physiological and molecular biological mechanisms of heavy metal absorption and accumulation in hyperaccumulators[J]. Chinese Journal of Applied Ecology,2003,14(4):627-631.
[6]王谦,成水平.大型水生植物修复重金属污染水体研究进展[J].环境科学与技术,2010,33(5):96-102.
WANG Qian, CHENG Shuiping. Review on phytoremediation of heavy metal polluted water by macrophytes[J]. Environmental Science&Technology,2010,33(5):96-102.
[7]郑振华,周培疆,吴振斌.复合污染研究的新进展[J].应用生态学报,2001,12(3):469-473.
ZHENG Zhenhua, ZHOU Peijiang, WU Zhenbin. New advances in research of combined pollution[J]. Chinese Journal of Applied Ecology,2001,12(3):469-473.
[8]张慧,王超,王沛芳,等. P·Cd·Zn交互作用对沉水植物吸收积累P·Cd·Zn的影响[J].安徽农业科学,2011,39(5):2855-2858.
ZHANG Hui, WANG Chao, WANG Peifang, et al. Effects of P·Cd·Zn interactions on the absorption and accumulation of submerged plants to P·Cd·Zn[J]. Journal of Anhui Agri Sci,2011,39(5):2855-2858.
[9]晏丽蓉.几种沉水植物对底泥中镉、铜、铅、锌修复作用的研究[D].金华:浙江师范大学,2013.
YAN Lirong. The Restoration Effect of Several Kinds of Submerged Macrophytes on Cd, Cu, Pb, Zn in Sediments of Aquatic System[D]. Jinhua:Zhejiang Normal University,2013.
[10]魏树和,周启星,王新,等.农田杂草的重金属超积累特性研究[J].中国环境科学,2004,24(1):105-109.
WEI Shuhe, ZHOU Qixing, WANG Xin, et al. Studies on the characteristics of heavy metal hyperaccumulation of weeds in farmland[J]. China Environmental Science,2004,24(1):105-109.
[11]MATTINA M J I, LANNUCCI-BERGER W, MUSANTE C, et al. Concurrent plant uptake of heavy metals and persistent organic pollutants form soil[J]. Environmental Pollution,2003,124(3):375-378.
[12]SALT D E, BLAYLOCK M, KUMAR N P B A, et al. Phytoremediation:A novel strategy for the removal of toxic metals from the environment using plants[J]. Nature Biotechnology,1995,13(5):468-474.
[13]胡金朝.重金属污染对不同生境水生植物的毒害机理研究[D].南京:南京师范大学,2006.
HU Jinzhao. The Toxic Mechanism Study of Heavy Metal Pollution on Aquatic Plant under Different Growth Conditions[D]. Nanjing:Nanjing Normal University,2006.
[14]徐勤松,施国新,王学,等.镉、铜和锌胁迫下黑藻活性氧的产生及抗氧化酶活性的变化研究[J].水生生物学报,2006,30(1):107-112.
XU Qinsong, SHI Guoxin, WANG Xue, et al. Generation of active oxygen and change of antioxidant enzyme activity inHydrillaverticillataunder Cd, Cu and Zn stress[J]. Acta Hydrobiol Sin,2006,30(1):107-112.
[15]张饮江,易冕,王聪,等.3种沉水植物对水体重金属镉去除效果的实验研究[J].上海海洋大学学报,2012,21(5):784-793.
ZHANG Yinjiang, YI Mian, WANG Cong, et al. Research on phytoremediation of cadmium contaminated water by three submerged macrophytes[J]. Journal of Shanghai Ocean University,2012,21(5):784-793.
[16]BRUMEL KAMP T R, BEMARDS R, AGAMI R. A system for stable expression of short interfering RNAs in mammalian cells[J]. Science,2002,296(5567):550-553.
[17]杨海燕,施国新,徐勤松,等.Cd2+胁迫对竹叶眼子菜的毒理学效应分析[J].应用与环境生物学报,2008,14(3):366-370.
YANG Haiyan, SHI Guoxin, XU Qinsong, et al. Phytotoxicity of Cd on leaf cells ofPotamogetonmalaianus[J]. Chin J Appl Environ Biol,2008,14(3):366-370.
[18]陈国梁,林清.不同沉水植物对Cu,Pb,Cd,Zn元素吸收积累差异及规律研究[J].环境科技,2009,22(1):9-12.
CHEN Guoliang, LIN Qing. Research on accumulation of Cu, Pb, Cd, Zn in different submerged plants[J]. Environmental Science and Technology,2009,22(1):9-12.
[19]张海锋,胥焘,黄应平,等.水生植物修复沉积物中重金属污染的机制及影响因素研究进展[J].亚热带水土保持,2015,27(1):37-41.
ZHANG Haifeng, XU Tao, HUANG Yingping, et al. Mechanism and research advances in restoration of heavy metals in the sediments of water bodies by aquatic plants[J]. Subtropical Soil and Water Conservation,2015,27(1):37-41.
[20]徐勤松,施国新,许丙军,等.Cu、Zn在黑藻叶片中的富集及其毒理学分析[J].水生生物学报,2007,31(1):1-8.
XU Qinsong, SHI Guoxin, XU Bingjun, et al. Bioaccumulation and toxicity of Cu and Zn inHydrillaverticillata(Linn.F) Royle[J]. Acta Hydrobiol Sin,2007,31(1):1-8.
[22]徐勤松.黑藻对水体Cd、Cu、Zn污染的反应机制研究[D].南京:南京师范大学,2004.
XU Qinsong. Response ofHydrillaverticillata(Linn.f.) Royle to Cd, Cu, Zn Stress[D]. Nanjing: Nanjing Normal University,2004.
[23]简敏菲,弓晓峰,游海,等.水生植物对铜、铅、锌等重金属元素富集作用的评价研究[J].南昌大学学报:工科版,2004,26(1):85-88.
JIAN Minfei, GONG Xiaofeng, YOU Hai, et al. Assessment of pollution and enrichment of heavy metals of Cu, Pb, Zn on aquatic plants[J]. Journal of Nanchang University:Engineering & Technology,2004,26(1):85-88.
[24]汪鹏合.适量Zn2+对浮萍Cd2+毒害的缓解效应及过量Zn2+对水花生愈伤组织的毒害效应研究[D].南京:南京师范大学,2013.
WANG Penghe. Alleviating Effect of Moderate Zn in Cd TreatedLemnaminorL. and Toxicity of Excessive Zn inAlternantheraphiloxeroidesCallus[D]. Nanjing: Nanjing Normal University,2013.
[25]BUNLUESIN S, POKETHITIYOOK P, LANZA G R, et al. Influences of cadmium and zinc interaction and humic acid on metal accumulation inCeratophyllumdemersum[J]. Water, Air & Soil Pollution,2007,180(1/2/3/4):225-235.
A study on the absorption of cadmium and zinc in the water sediments with submerged plants.
QIAO Yunlei1,2, LI Minghong1,2, XIE Peijun2, YAN Lirong2, ZHU Jianfei2
(1.XingzhiCollegeZhejiangNormalUniversity,Jinhua321004,ZhejiangProvince,China; 2.InstituteofEcology,ZhejiangNormalUniversity,Jinhua321004,ZhejiangProvince,China)
Journal of Zhejiang University(Science Edition), 2016,43(5):601-609
Three common submerged plants in Zhejiang province, namelyVallisnerianatans(Lour.) Hara,Hydrillaverticillata(Linn.f.) Royle andCeratophyllumdemersumL., are investigated to explore their enrichment effects of heavy metals in the sediments of water. During the study, a simulated outdoor natural water environment was setup, three different submerged plants were cultivated for 105 d in the sediments of water which containing high concentration of cadmium (Cd) and zinc (Zn), the accumulation amount and biota-sediment accumulation factor (BSAF) of two heavy metals were measured to identify the species with best enrichment effect, providing a theoretical reference for selecting suitable plants that could restore ecologically contaminated sediments. The results show that BSAF for Cd and Zn are both greater than 1 for all species after for 105 d, suggesting that these submerged plants had powerful absorption ability, good removal effect on Cd and Zn in sediments, and a strong tolerance for the combined pollution of Cd and Zn. Meanwhile, there was a significant negative correlation between the content of Cd and Zn in sediment and that in these three plants (all withp<0.01), Therefore,Vallisnerianatans(Lour.) Hara,Hydrillaverticillata(Linn.f.) RoyleandCeratophyllumdemersumL. could be considered as common species to lieve the sediment pollution caused by Cd and Zn. In particular,Vallisnerianatans(Lour.) Hara can be selected as a pioneer plant for ecological restoration of Cd and Zn jointly polluted sediments in water.
Vallisnerianatans(Lour.) Hara;Hydrillaverticillata(Linn.f.) Royle;CeratophyllumdemersumL.; sediment; cadmium; zinc; accumulation

2015-11-23.
浙江省科技计划项目(2008C23093).
乔云蕾(1988-),ORCID:http://orcid.org/0000-0001-6598-511x,女,硕士研究生,主要从事重金属污染治理研究,E-mail: 919003710@qq.com.
,ORCID: http://orcid.org/0000-0001-5070-3220,E-mail: sky82@zjnu.cn.
10.3785/j.issn.1008-9497.2016.05.018
X 524;Q 948.1
A
1008-9497(2016)05-601-09
