胸腔闭式引流后给予免疫调节剂对老年肺癌恶性胸腔积液的临床疗效
2016-09-15沙海发
沈 辉 沙海发
胸腔闭式引流后给予免疫调节剂对老年肺癌恶性胸腔积液的临床疗效
沈辉沙海发
目的探讨胸腔闭式引流后给予免疫调节剂对老年肺癌恶性胸腔积液的临床疗效。方法选择62例老年肺癌恶性胸腔积液患者,按照随机数字法分为实验组与对照组,每组各31例,两组患者胸腔闭式引流后,注入白介素-2(IL-2),对照组注入顺铂(DDP),比较两组患者胸腔积液改善情况、生活质量好转情况、近期生存率及不良反应。结果实验组胸腔积液治疗效果、生活质量显著优于对照组,比较差异均具有统计学意义(P<0.05)。实验组半年生存率为90.32%,1年生存率为58.06%,高于对照组(67.74%和29.03%),比较差异均具有统计学意义(P<0.05)。实验组骨髓抑制、消化道症状及胸痛等不良反应发生率均显著低于对照组,比较差异均具有统计学意义(P<0.05)。结论对于老年肺癌恶性胸腔积液患者,采取胸腔闭式引流后给予免疫调节剂,能够有效控制患者的胸腔积液,改善患者的生存质量,提高生存率,减少不良反应。
胸腔闭式引流;免疫调节剂;老年肺癌;胸腔积液
(The Practical Journal of Cancer,2016,31:1308~1310)
恶性胸腔积液是肺癌患者中晚期常见并发症,可引起患者胸痛、胸闷、呼吸困难等症状,进而造成呼吸、血液循环障碍,严重影响其生存质量,如不积极治疗可危及患者生命安全[1]。有研究指出,恶性胸腔积液主要原因为肿瘤肿瘤阻塞壁层胸膜血管、淋巴管等,是胸腔积液的回流受到阻碍,以及肿瘤直接侵犯和伴随的炎症时毛细血管的通透性增加引起的[2]。为探讨胸腔闭式引流后给予免疫调节剂改善老年肺癌恶性胸腔积液临床疗效,本次研究选择2010年1月-2015年6月在我院接受治疗的62例老年肺癌恶性胸腔积液患者作为研究对象,现报告如下。
1 资料与方法
1.1一般资料
选择2010年1月-2015年6月在我院接受治疗的62例老年肺癌恶性胸腔积液患者,均经病理或细胞学证实,未经放疗、化疗或生物治疗的初治患者。按照随机数字法分为实验组与对照组,每组各31例。其中男性38例,女性24例;年龄60~82岁,平均年龄(69.33±6.82)岁;胸腔积液:大量51例,中量11例;胸腔积液性质:血性55例,草黄色17例;KPS评分:≥60分19例,50~60分21例,≤50分21例,两组患者在年龄、性别、胸腔积液量、胸腔积液性质、KPS评分比较差异无统计学意义(P>0.05),具有可比性,见表1。
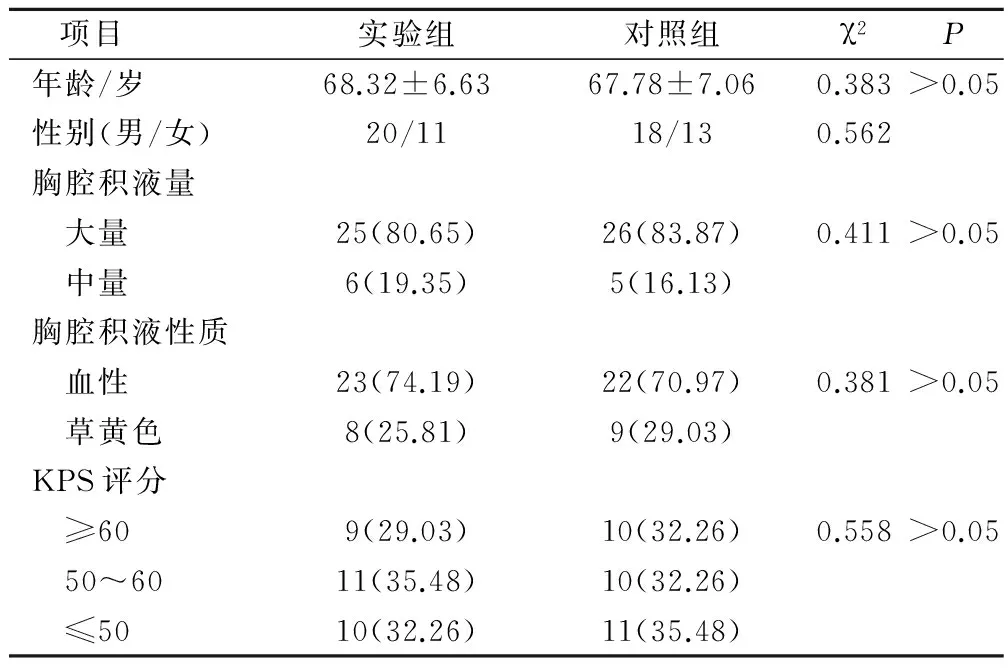
表1 两组患者一般资料比较(例,%)
1.2方法
两组患者均采用中心静脉导管(由广东百合医疗科技有限公司生产,型号为14Ga-20 cm)行胸腔闭式引流术,在B超定位下实施胸腔穿刺,通过导引钢丝引中心静脉导管进入患者胸腔内,外部与引流口连接,每次胸腔积液的引流量为500~800 ml,引流完毕用2 ml肝素封管,以避免堵管,1 d内<2 000 ml,在1~3 d内将患者的胸腔积液排尽[3],然后再经B超检查胸腔积液是否完全排尽,无胸腔积液后,实验组患者胸腔内注入0.9%氯化钠注射液20 ml+白介素-2(即IL-2,由北京双鹭药业股份有限公司生产,批号为20100901)40 U+2%利多卡因10 ml,1周后重复1次;对照组先常规予以胃舒安30 mg静脉滴注,然后胸腔内注入0.9%氯化钠注射液20 ml+顺铂(即DDP,由江苏金丝利药业有限公司生产,批号为s10970054)40~60 mg+利多卡因10 ml,夹管,两组患者注入药物后嘱患者每30 s变换体位1次,持续30 min,使药物均匀分布,1周后重复1次,两组患者在治疗2周后评定疗效。
1.3疗效评价标准[4]
参照WHO定的癌性渗液疗效评价标准评价患者的近期疗效,将其分为完全缓解、部分缓解、稳定、进展4个等级。完全缓解(CR):患者胸腔无积液且症状缓解持续时间≥4周;部分缓解(PR):与用药前比较胸腔积液量明显减小(≥50%),相关症状不同程度缓解且持续时间≥4周;稳定(NC):与用药前比较胸腔积液量减少<50%或者无减少,临床症状有所改善且持续时间≥4周;进展(PD):与用药前比较胸腔积液量增大,临床症状进一步加重。有效率(%)=(完全缓解例数加部分缓解例数)/总例数×100%。
1.4生活质量评分[5]
按Karnofsky评分标准在治疗前及治疗后4周予以评定,好转:评分增加≥10分,并维持4周以上;稳定:评分无明显变化;恶化:评分减少≥10分。好转率/%=好转例数/总例数×100%。
1.5统计学处理
应用SPSS 18.0 统计学软件对数据进行统计学分析。计数资料采用χ2检验,计量资料采用t检验,P<0.05 表示差异有统计学意义。
2 结果
2.1两组老年肺癌恶性胸腔积液患者疗效比较
实验组完全缓解9例(29.03%),部分缓解16例(51.61%),稳定4例(12.90%),进展2例(12.90%),总有效率为80.65%,对照组完全缓解6例(19.35%),部分缓解10例(32.26%),稳定7例(22.58%),进展7例(22.58%),总有效率为51.61%,两组比较差异均具有统计学意义(P<0.05)。
2.2两组患者治疗后生活质量好转情况
实验组好转19例(61.29%),稳定8例(25.81%),恶化4例(12.90%),好转率为61.29%。对照组好转13例(41.94%),稳定11例(35.48%),恶化7例(22.58%),好转率41.94%,两组比较差异均有统计学意义(P<0.05)。
2.3两组老年肺癌恶性胸腔积液患者近期生存率比较
实验组半年生存率为90.32%,1年生存率为58.06%;对照组半年生存率为67.74%、1年生存率为29.03%,两组比较差异均具有统计学意义(P<0.05)。
2.4两组老年肺癌恶性胸腔积液患者不良反应比较
实验组骨髓抑制、消化道症状及胸痛不良反应发生率均显著低于对照组,比较差异均具有统计学意义(P<0.05),见表2。

表2 两组老年肺癌恶性胸腔积液患者不良反应比较(例,%)
3 讨论
肺癌是恶性肿瘤中最为常见的肿瘤之一,近年来发病率呈上升趋势。有资料显示,肺癌的发病率及死亡率位居恶性肿瘤之首,严重威胁人类健康、生命的疾病之一[6]。胸腔积液在肺癌晚期患者中比较常见,其病因为肺癌累及胸膜或原发性胸膜肿瘤引起的,患者会出现不同程度的胸痛、胸闷气短、呼吸困难等症状,若不能及时的治疗可导致患者呼吸、血液循环功能障碍,严重可危及生命。恶性胸腔积液不易治疗,且预后较差、生存期短,在治疗上常采用穿刺放液后胸腔内注药,以防止胸水再次形成,减轻患者的临床症状。胸腔局部治疗的药物主要有胸膜硬化剂、抗癌药物及生物制剂等,由于化疗药物及硬化剂具有较重的副作用而在临床上应用较少,而生物制剂效率高、副作用小,且在杀灭癌细胞的同时产生胸膜炎症反应可达到胸膜腔封闭的作用[7]。
中心静脉管胸腔闭式引流较传统的穿刺抽液具有操作简单、安全、减少因多次穿刺带来的痛苦和损伤,降低穿刺风险,将积液尽可能排尽后向患者胸腔内注入细胞毒性物质与免疫调节剂,使胸腔壁层与脏层胸膜密切接触、粘连增厚,药物作用于肿瘤组织,以控制胸积液的产生。IL-2为一生物制剂,在国际淋巴因子学术会议上统一命名为白介素-2。IL-2是一种由激活的T细胞产生的淋巴因子,能够促进和维持T细胞的增值及分化,是免疫反应中关键性的调节物,它可使细胞毒性T细胞,自然杀伤NK细胞和淋巴因子活化的杀伤细胞增殖,并诱导和增强其杀伤活性增强,从而发挥抗肿瘤作用[8]。IL-2局部局部注入胸腔后其药物浓度要比血液高10~100倍,不仅有效的解除肿瘤局部免疫抑制状态,还能增强免疫状态,以提高患者肿瘤抗原对机体免疫应答的激活能力[9];IL-2能促进淋巴细胞分泌抗体及干扰素,胸腔用药后使胸膜粘连,减少胸积液产生,增强抗肿瘤及机体免疫功能。有研究显示,胸腔内注射LAK细胞悬液及白介素-2,在治疗有肺癌引起的恶性胸积液的有效率达90%,且不良反应较少[10]。白介素-2对于中晚期体质较弱、有大量胸积液而不能采取全身化疗的患者非常适宜。本次研究结果中,实验组胸腔积液治疗效果、生活质量率显著优于对照组;而实验组半年生存率为90.32%,1年生存率为58.06%,高于对照组67.74%半年生存率、29.03%的1年生存率;实验组在骨髓抑制、消化道症状及胸痛不良反应均显著低于对照组,比较差异均具有统计学意义(P<0.05)。
综上所述,对于老年肺癌恶性胸腔积液患者采取胸腔闭式引流后给与免疫调节剂,能够有效控制患者的胸腔积液,改善患者的生存质量,提高生存率,减少不良反应。
[1]刘粉霞.中心静脉导管在恶性胸腔积液治疗中的应用〔J〕.现代肿瘤医学,2014,22(1):92-94.
[2]陈婷,贾冬云,郑军.细管引流联合胸腔内注射重组人白介素-2治疗恶性胸腔积液的疗效观察及护理〔J〕.实用临床医药杂志,2011,15(2):33-35.
[3]周承志,欧阳铭,李时悦,等.96例肺癌患者合并恶性胸腔积液的临床疗效观察〔J〕.中国医药指南,2011,9(22):5-7.
[4]张善露.吉西他滨小剂量单药化疗联合胸腔闭式引流及IL-2注入治疗恶性胸腔积液临床疗效〔J〕.海南医学院学报,2013,19(7):924-926,929.
[5]周春玲,刘宇清,郑宪艳,等.胸腔置管引流联合灌注顺铂及白介素-2治疗恶性胸腔积液32例效果分析〔J〕.广西医学,2012,34(9):1268-1269.
[6]吴俊才,邓翠东,代萍.中心静脉导管闭式引流并金葡素胸腔注射治疗恶性胸腔积液〔J〕.中国医药指南,2010,8(35):91-93.
[7]冯志红,聂秀红.肺癌恶性胸腔积液患者胸腔内注射治疗的临床研究〔J〕.实用癌症杂志,2015,30(11):1643-1645,1655.
[8]蔡宇星,郝毅.胸腔置管引流并灌注白细胞介素Ⅱ联合顺铂治疗肺癌恶性胸腔积液疗效观察〔J〕.齐齐哈尔医学院学报,2008,29(13):1537-1538.
[9]张超,胡泽福,周翔.胸腔闭式引流与胸腔穿刺在治疗胸腔积液的效果比较〔J〕.当代医学,2014,20(7):114.
[10]赛福丁·柯尤木,马兰英,唐勇.IL-2胸腔内注射治疗恶性胸腔积液对肺功能的影响〔J〕.第三军医大学学报,2013,35(15):1651-1652.
(编辑:吴小红)
Clinical Efficacy of Immunomodulatory Agents after Thoracic Drainage for Malignant Pleural Effusion in Elderly Patients with Lung Cancer
SHEN Hui,SHA Haifa.
The First People's Hospital of Liangshan,Liangshan,615000
ObjectiveTo investigate the clinical efficacy of immunomodulatory agents after thoracic drainage for malignant pleural effusion in elderly patients with lung cancer.Methods62 cases of lung cancer in elderly patients with malignant pleural effusion were randomized into the experimental group and the control group,each with 31 cases,after the closed drainage,both groups received injection of interleukin-2 (IL-2),the control group were injected with cisplatin (DDP),pleural effusion,improvement of quality of life,recent survival and adverse reactions were compared.ResultsThe pleural effusion treatment and quality of life of the experimental group were significantly better than the control group,the difference was statistically significant (P<0.05).6-month survival rate of the experimental group was 90.32%,1-year survival rate was 58.06%,6-month survival rate and 1-year survival rate were 67.74% and 29.03%,the difference was statistically significant (P<0.05).In the experimental group,bone marrow suppression,gastrointestinal symptoms and chest pain adverse reactions were significantly lower than those of the control group,the difference was statistically significant (P<0.05).ConclusionFor elderly patients with lung cancer and malignant pleural effusion,immunomodulatory agents after thoracic drainage can effectively control the patient's pleural effusion,improve the quality of life and survival,and reduce adverse reactions.
Thoracic drainage;Immunomodulator;Elderly lung cancer;Pleural effusion
615000 凉山彝族自治州第一人民医院
10.3969/j.issn.1001-5930.2016.08.028
R734.2
A
1001-5930(2016)08-1308-03
2016-03-09
2016-07-07)
