PARP-1表达与晚期卵巢癌组织血管生成及新辅助化疗耐药的关系研究
2016-09-15成莉李琳邢辉
成 莉 李 琳 邢 辉
PARP-1表达与晚期卵巢癌组织血管生成及新辅助化疗耐药的关系研究
成莉李琳邢辉
目的探讨晚期卵巢癌组织中聚腺苦酸二憐酸核糖聚合酶(PARP-1)的表达与血管生成及新辅助化疗敏感性的相关性。方法选取恶性卵巢癌患者76例、良性卵巢癌患者21例及健康对照组15例,采用RT-PCR及免疫组化法,测定三组研究对象的PARP-1及血管内皮生长因子(VEGF)表达水平;在恶性卵巢癌患者经过3个疗程的化疗后评定其化疗敏感性及化疗效果,并分析化疗敏感性及有效性与PARP-1的表达的相关性。结果在恶性卵巢癌组织中,PARP-1及VEGF均呈高表达,且二者呈正相关关系(γ=0.3460,P=0.0022;γ=0.5469,P<0.0001);在化疗敏感及有效的患者中,PARP-1也呈高表达(P<0.05);PARP-1的表达水平对晚期卵巢癌患者的化疗敏感及有效均具有较高的灵敏度和特异度(80.95%和64.71%;94.12%和66.10%)。结论在晚期卵巢癌患者中,PARP-1呈高表达状态,下调PARP-1的表达可以提高患者的化疗敏感性,PARP-1可以作为预测患者化疗敏感的生物标志物。
晚期卵巢癌;血管生成;新辅助化疗
(The Practical Journal of Cancer,2016,31:1225~1229)
卵巢癌(ovarian cancer,OC)是妇科恶性肿瘤中死亡率最高的一种恶性肿瘤,其原因之一是卵巢癌发病隐匿,>70%的患者在确诊时已为晚期;同时,该病具有较高的侵袭性,恶性程度高,这也是导致该病预后较差的重要原因之一[1-3]。对于恶性肿瘤的治疗而言,目标之一即为促进心血管的生成,因为新生血管的形成可对肿瘤的生长速度、血行转移产生重要的影响。目前已经探明:肿瘤血管的生成与许多的细胞因子有关,如:血管内皮生长因子(VEGF)、血管生成素(Angiogenin)、血管营养素(Angiotropin)等,其中,VEGF-A被认为在血管生成中发挥着核心作用[4-7]。聚腺苦酸二憐酸核糖聚合酶(PARP)在机体内参与细胞内的DNA损伤修复、细胞周期、基因组稳定等多种生物学过程。有研究结果显示:PARP-1表达较高的大肠癌组织中,PARP-1水平与微血管密度、VEGF的表达正相关,提示:PARP-1可能具有促进肿瘤血管生成的作用[8]。研究结果显示,PARP-1在发挥DNA修复功能的同时,对恶性肿瘤的放化疗敏感性可以产生重要的影响,下调PARP-1表达可提高肿瘤对化疗的敏感[8-9]。但是在卵巢癌中,PARP-1水平与恶性肿瘤血管生成及其放化疗敏感性的研究较少,目前尚无确切结论。为了进一步探讨PARP-1的表达与卵巢癌组织血管生成及新辅助化疗敏感性的关系,本研究采用病例对照研究设计,观察分析PARP-1的表达与晚期卵巢癌组织中新血管生成与新辅助化疗敏感性的相关性,旨在为卵巢癌的治疗提供参考依据。
1 材料与方法
1.1研究对象
选取2009年1月-2011年1月在我院接受手术治疗、经病理诊断证实为原发性晚期卵巢癌的患者76例为研究对象,患者的年龄为25~70岁,中位年龄51岁,包括浆液性腺癌52例,透明细胞癌5例,子宫内膜样腺癌7例,粘液性腺癌12例。选取卵巢良性肿瘤患者21例为研究对象,患者的年龄为27~71岁,中位年龄50岁,包括黏液性囊腺瘤9例、浆液性囊腺瘤12例。另取同期在我院治疗的15例正常卵巢组织作为对照,该类患者为子宫肌瘤患者行附件切除者;手术后1 h内,迅速将卵巢组织冻存于-70 ℃冰箱。
1.2纳入及排除标准
1.2.1纳入标准①所有卵巢组织标本均经病理证实;②化疗前经心、肺、肝、肾功能检查均正常,可耐受化疗;③进入本研究之前未接受任何其他抗肿瘤治疗;④卵巢上皮癌患者均为FIGO2000手术病理Ⅲ~Ⅳ期;⑤所有患者均接受肿瘤减灭术或分期手术,术前均未进行任何放化疗、免疫治疗等;⑥标本均经10%中性福尔马林固定,石醋包埋;⑦对照组研究对象在年龄、性别等基本特征方面与病例组具有可比性。
1.2.2化疗方案76例原发性晚期卵巢癌患者术后均接受3个疗程以上以铂类为基础的联合化疗,方案以"铂类+环磷酞胺"或"紫杉醇+铂类"为主。
1.3实验步骤
1.3.1主要实验仪器及试剂主要实验仪器:PCR仪器(Leica公司,德国);冰箱-70 ℃(海尔公司,中国);微型水平电泳槽(Bio-Rad公司,美国);高速低温台式离心机(Sigma3K30,德国);凝胶成像系统(Bio-Rad公司,美国);离心机(Sigma,美国);电泳仪、电泳槽(SCIE-PLAS Biochrom,英国);微量电子天平(北京博远祥德科学仪器有限公司)。
主要实验仪器:RT-PCR试剂盒、蛋白酶K、琼脂糖、DNA Marker (500 bp)等由生工生物工程(上海)股份有限公司提供;Tris碱、三氯甲烷、异戊醇、异丙醇、乙醇等由西安化学试剂优先公司提供。
1.3.2RT-PCR实验购买Trizol Reagent试剂盒,从约100 mg冷冻的卵巢癌组织标本中分离总RNA;高容量cDNA反转录基因试剂盒将1 μg RNA合成cDNA。行实时定量PCR实验测定PARP-1及VEGF mRNA的表达水平;并以18 S为内参,采用2-△△Ct法[10]换算上述基因mRNA相对表达量后,进行定量分析。
引物序列如下。PARP-1引物序列:上游引物,5'-CAGCTGACCCGAGCATTCCTCGCAG-3';下游引物:5'-GAAGGAGGGCACCGAACACCA-3'。VEGF引物序列:上游引物,5'-GCCAGCTGTAGGCCAGACCCTGGCA-3';下游引物,5'-GACAGGGGCAAAGTGAGTGACCTGC-3'。18S引物序列:上游引物,5'-CTGTACCCTTACTCATCG-3';下游引物:5'-CTACACATATCCTGCCATC-3'。
上述mRNA引物及其他PCR实验相关试剂盒均由北京六合华大基因科技股份有限公司合成或提供。
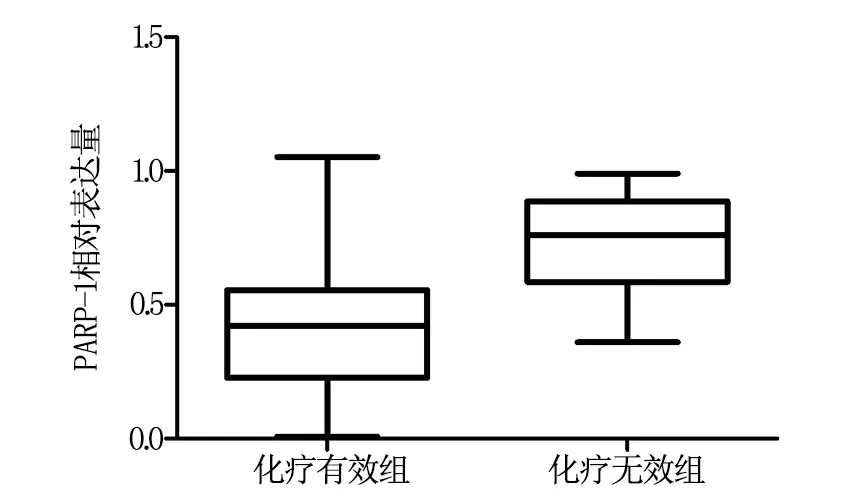
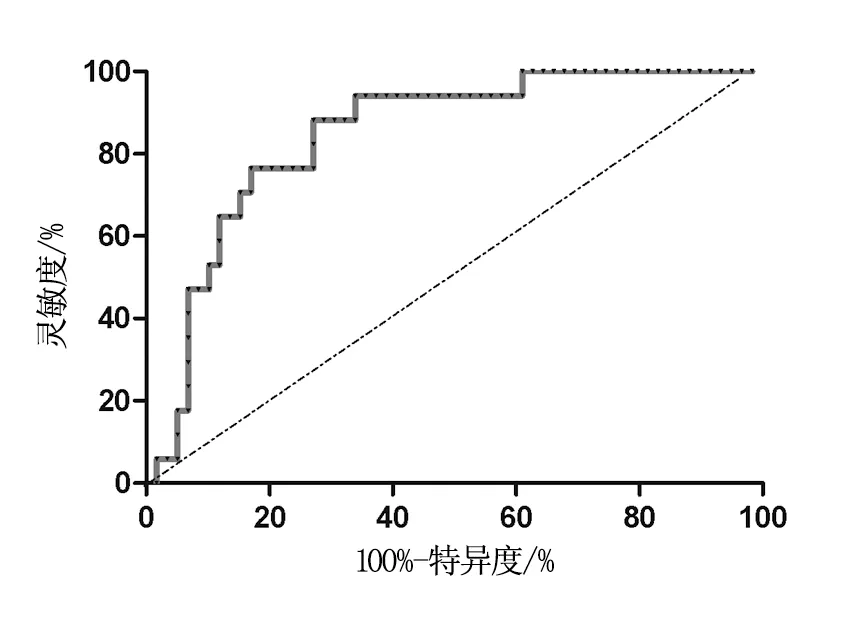
1.3.3PARP-1免疫组化染色及结果判定收集卵巢癌患者的癌组织标本,用D-Hank液冲洗干净后剪成约1 mm的组织块,经0.25%的胰酶充分消化收集单细胞悬液,离心后取悬液的乳白色层,Power vision二步法进行PARP-1免疫组化染色,严格按照说明书进行操作,阳性信号定位于细胞核或细胞质。参照文献[10-11]的方法计算细胞核或细胞质指数LI=阳性卵巢癌细胞/1000×100%,计分标准如下:0分,LI≤10%;1分,10% 1.4疗效等级评定 1.4.1化疗疗效等级评定[6-10]化疗完毕4周后,行盆腔及腹部检查、CA-125水平检测及B超、CT等影像检查,并根据WTO推荐的实体恶性肿瘤的近期化疗疗效评价标准判定化疗疗效,具体如下。完全缓解(CR):可见肿瘤完全消失,至少持续4周;部分缓解(PR):肿瘤体积缩小>50%,无疾病进展表现,至少4周;稳定(SD):肿瘤体积缩小<50%,增大<25%,至少4周;进展(PD):肿瘤体积增大>25%或出现新病灶。76例恶性肿瘤组患者在3个疗程化疗结束后进行疗效评定,CR+PR为化疗有效,SD+PD为化疗无效。 1.4.2化疗敏感性评定化疗敏感界定为接受化疗后有效,停药半年内无复发;化疗不敏感界定为接受化疗后有效,停药半年内出现复发。 1.5统计分析 2.1两组患者基本特征比较 经χ2检验,恶性卵巢肿瘤组、良性卵巢肿瘤组和对照组研究对象的性别、年龄、职业等基本特征比较差异无统计学意义(P>0.05),即可认为本研究的研究对象无偏性,见表1。 2.2三组PARP-1、VEGF mRNA表达水平比较 三组PARP-1、VEGF mRNA相对表达量比较结果见表2,经单因素方差分析,三组的PARP-1、VEGF mRNA相对表达量比较差异均具有统计学意义(P<0.05);进而采用LSD法进行两两比较,结果显示:PARP-1、VEGF mRNA相对表达量均在恶性卵巢肿瘤组中最高,其次为良性卵巢肿瘤组,在健康对照组患者中最低。 表2 三组PARP-1、VEGF mRNA相对表达量比较 注:经LSD法两两比较,*为VS对照组,P<0.05;#为VS良性卵巢肿瘤组,P<0.05。 2.3PARP-1、VEGF mRNA表达水平的相关性分析 恶性卵巢肿瘤组PARP-1与VEGF mRNA表达水平呈相关关系(γ=0.3460,P=0.0022),具有统计学意义;在恶性卵巢肿瘤组、良性卵巢肿瘤组、对照组患者中,PARP-1、VEGF mRNA表达水平也呈相关关系(γ=0.5469,P<0.0001),见图1。 2.4PARP-1表达与化疗敏感性的关系 76例恶性肿瘤患者均完成了3个疗程的化疗,随访半年,42例(55.26%)患者为化疗敏感;34例(44.74%)患者为化疗不敏感。化疗敏感及不敏感组的PARP-1mRNA相对表达及PARP-1免疫组化阳性表达细胞计分比较见表3,经t检验,两组患者的PARP-1表达具有统计学差异(t=4.317,P=0.0028);经秩和检验,PARP-1阳性卵巢癌细胞计分两组比较也具有统计学差异,化疗敏感组患者的PARP-1表达水平明显低于对照组(P<0.05)。 2.5PARP-1表达量对化疗敏感性的预测价值 采用ROC曲线分析PARP-1表达量对化疗敏感性的预测价值,结果显示:ROC曲线下的面积具有统计学意义(AUC:0.6320~0.8591,P=0.0002);当PARP-1 mRNA相对表达量=0.5658,灵敏度和特异度均达到最高值,分别为80.95%和64.71%,见图2。 A为恶性卵巢肿瘤组;B为恶性卵巢肿瘤组、良性卵巢肿瘤组及对照组。 图2 PARP-1表达量预测化疗敏感性的ROC曲线 2.6PARP-1表达与化疗疗效的关系 76例恶性肿瘤患者完成3个疗程的化疗4周后,根据盆腔及腹部检查、CA-125水平检测及B超、CT等影像检查结果评估治疗效果,共有59例(77.63%)患者化疗有效,17例(22.37%)化疗无效。化疗有效组PARP-1 mRNA相对表达量为(0.37±0.27),化疗无效组PARP-1 mRNA相对表达量为(0.78±0.21),经t检验,化疗有效组的PARP-1相对表达量明显低于化疗无效组(t=4.943,P<0.0001),见图3。采用ROC曲线分析PARP-1表达量对化疗疗效的预测价值,分析结果显示:ROC曲线下的面积具有统计学意义(AUC:0.7523~0.9406,P<0.0001);当PARP-1 mRNA相对表达量=0.4814,灵敏度和特异度均达到最高值,分别为94.12%和66.10%,图4。 图3 化疗有效和无效组PARP-1相对表达量的比较 图4 PARP-1表达量预测化疗效果的ROC曲线 卵巢癌是目前世界范围内广大妇女受威胁最大的妇科恶性肿瘤,虽然在过去的二十年内,卵巢癌的手术治疗技术及新辅助化疗方案取得了很大进展,但其5年生存率仍然较低,据报道:卵巢癌的5年生存率仅为30%左右[10-12]。随着分子生物学的发展,人们逐渐探明:恶性肿瘤是1种多因素作用的复杂型疾病,在此过程中,个体遗传因素发挥了重要作用。目前人们认为:卵巢癌是1种多基因疾病,特别是癌基因的激活表达、抑癌基因的失活可以促进卵巢癌的发生和发展[13]。关于卵巢癌的治疗,一般以手术治疗和新辅助化疗相结合的综合性治疗方案,其疗效与多种因素有关。从病理学角度而言,卵巢癌组织新生血管的发育和生成,可促进治疗效果的改善;有学者甚至认为:恶性肿瘤组织中新血管的生成可以作为治疗方案有效的生物标志物之一[14]。近年来,人们已知血管的生成与众多的细胞因子有关,其中VEGF因子在心血管生成的过程中发挥着核心作用,因此,可以讲VEGF的表达作用恶性肿瘤心血管生成的生物标志物[14-17]。 表3 化疗敏感与不敏感组PARP-1相对表达水平比较(例,%) 聚腺苦酸二憐酸核糖聚合酶[poly(ADP-ribose) polymerase,PARP]在机体内的一种重要的生物酶,参与细胞内的DNA损伤修复、细胞周期、基因组稳定等多种生物学过程。在大肠癌等恶性肿瘤组织中,人们发现PARP-1与新血管的生成具有一定关系,但在晚期卵巢癌组织中上午报道。本研究以晚期卵巢癌患者为研究对象,同时选取良性恶性卵巢癌患者及健康对照者为研究对象,采用RT-PCR实验分析检测了3组研究对象的PARP-1 mRNA及VEGF mRNA的表达水平,结果显示:在恶性卵巢癌组织中PARP-1及VEGF均呈高表达,同时二者呈明显正相关关系,因此本研究认为:在晚期卵巢癌组织中,PARP-1可能促进恶性卵巢组织中新生血管的生成。至于二者在恶性卵巢癌患者中均呈高表达的原因,我们推测:恶性肿瘤细胞的存在,刺激机体产生某种应激反应,在这种应激反应的背景下,VEGF水平和PARP-1水平升高,以应对肿瘤组织心血管生成的生理应激[18-19]。 由于个体存在差异性,同样的新辅助化疗方案未必取得同等的治疗效果,该机制至今尚不明确。以往有研究表明:PARP-1与恶性肿瘤的放化疗效果有一定的关系,下调PARP-1的表达可以提高化疗的敏感性,改善化疗效果[20-22]。本研究分析结果显示:PARP-1在晚期卵巢癌患者中,也有相似的表达规律,在化疗敏感的个体中,PARP-1 mRNA明显下调;同时PARP-1的相对表达量在预测晚期卵巢癌患者对铂类为基础的化疗方案敏感性方面具有较高的灵敏度和特异度。化疗敏感性与化疗的疗效直接相关,在化疗有效的晚期卵巢癌患者中,PARP-1表达也是下调的,在预测化疗效果方面也具有较高的预测价值。 综上:在晚期卵巢癌患者中,PARP-1呈高表达状态,下调PARP-1的表达可以提高患者的化疗敏感性,可将PARP-1作为预测患者化疗敏感的生物标志物。 [1]Doufekas K,Olaitan A.Clinical epidemiology of epithelial ovarian cancer in the UK〔J〕.Int J Womens Health,2014,6:537-545. [2]Edmondson RJ,Monaghan JM.The epidemiology of ovarian cancer〔J〕.Int J Gynecol Cancer,2001,11(6):423-429. [3]Igisinov N,Umaralieva G.Epidemiology of ovarian cancer in Kyrgyzstan women of reproductive age〔J〕.Asian Pac J Cancer Prev,2008,9(2):331-334. [4]Li L,Wang L,Zhang W,Tang B,et al.Correlation of serum VEGF levels with clinical stage,therapy efficacy,tumor metastasis and patient survival in ovarian cancer〔J〕.Anticancer Res,2004,24(3b):1973-1979. [5]Li X,Gu F,Niu C,et al.VEGF111b,a C-terminal splice variant of VEGF-A and induced by mitomycin C,inhibits ovarian cancer growth〔J〕.J Transl Med,2015,13:164. [6]Liang B,Guo Z,Li Y,et al.Elevated VEGF concentrations in ascites and serum predict adverse prognosis in ovarian cancer〔J〕.Scand J Clin Lab Invest,2013,73(4):309-314. [7]Liang B,He Q,Zhong L,et al.Circulating VEGF as a biomarker for diagnosis of ovarian cancer:a systematic review and a meta-analysis〔J〕.Onco Targets Ther,2015,8:1075-1082. [8]Kieback DG.Adenovirus-mediated thymidine kinase gene therapy induces apoptosis in human epithelial ovarian cancer cells and damages PARP-1〔J〕.In Vivo,2009,23(1):77-80. [9]Gunderson CC,Moore KN.Olaparib:an oral PARP-1 and PARP-2 inhibitor with promising activity in ovarian cancer〔J〕.Future Oncol,2015,11(5):747-757. [10]Johnson CC,Kessel B,Riley TL,et al.The epidemiology of CA-125 in women without evidence of ovarian cancer in the Prostate,Lung,Colorectal and Ovarian Cancer (PLCO) Screening Trial〔J〕.Gynecol Oncol,2008,110(3):383-389. [11]Plaxe SC.Epidemiology of low-grade serous ovarian cancer〔J〕.Am J Obstet Gynecol,2008,198(4):459 e1-8. [12]Segelman J,Flöter-Rådestad A,Hellborg H,et al.Epidemiology and prognosis of ovarian metastases in colorectal cancer〔J〕.Br J Surg,97(11):1704-1709. [13]Haruta S,Furukawa N,Yoshizawa Y,et al.Molecular genetics and epidemiology of epithelial ovarian cancer (Review)〔J〕.Oncol Rep,26(6):1347-1356. [14]Luo H,Jiang BH,King SM,et al.Inhibition of cell growth and VEGF expression in ovarian cancer cells by flavonoids〔J〕.Nutr Cancer,2008,60(6):800-809. [15]Luo H,Rankin GO,Liu L,et al.Kaempferol inhibits angiogenesis and VEGF expression through both HIF dependent and independent pathways in human ovarian cancer cells〔J〕.Nutr Cancer,2009,61(4):554-563. [16]Monk BJ,Choi DC,Pugmire G,et al.Activity of bevacizumab (rhuMAB VEGF) in advanced refractory epithelial ovarian cancer〔J〕.Gynecol Oncol,2005,96(3):902-905. [17]Monk BJ,Han E,Josephs-Cowan CA,et al.Salvage bevacizumab (rhuMAB VEGF)-based therapy after multiple prior cytotoxic regimens in advanced refractory epithelial ovarian cancer〔J〕.Gynecol Oncol,2006,102(2):140-144. [18]Zaremba T,Thomas HD,Cole M,et al.Poly(ADP-ribose) polymerase-1 (PARP-1) pharmacogenetics,activity and expression analysis in cancer patients and healthy volunteers〔J〕.Biochem J,2011,436(3):671-679. [19]Zeng H,Zhang H,Jang F,et al.Molecular modeling studies on benzimidazole carboxamide derivatives as PARP-1 inhibitors using 3D-QSAR and docking〔J〕.Chem Biol Drug Des,2011,78(3):333-352. [20]Liang BY,Xiong M,Ji GB,et al.Synergistic suppressive effect of PARP-1 inhibitor PJ34 and HDAC inhibitor SAHA on proliferation of liver cancer cells〔J〕.J Huazhong Univ Sci Technolog Med Sci,2015,35(4):535-540. [21]Ohanna M,Giuliano S,Bonet C,et al.Senescent cells develop a PARP-1 and nuclear factor-kB-associated secretome (PNAS)〔J〕.Genes Dev,2011,25(12):1245-1261. [22]Postawski K,Monist M,Keith G.PARP-1 activity in normal and cancerous human endometrium and its relationship with quantity of abasic sites (AP)〔J〕.Ginekol Pol,2011,82(1):16-21. (编辑:吴小红) Relationship between the Expression of PARP-1 and Angiogenesis and Effect of New Adjuvant Chemotherapy in Advanced Ovarian Cancer Tissues CHENG Li,LI Lin,XING Hui. Xiangyang Central Hospital Affiliated to Hubei University of Arts and Science,Xiangyang,441021 ObjectiveTo explore the expression of poly gland bitter acid fluidized acid ribose polymerase-1 (PARP-1) and angiogenesis and effect of new adjuvant chemotherapy in advanced ovarian cancer tissues.Methods76 patients with malignant ovarian cancer,21 benign ovarian cancer patients and 15 healthy controls were selected into this study.PARP-1 and vascular endothelial growth factor (VEGF) expression levels were measured by RT-PCR and immunohistochemistry.The sensitivity and efficacy of chemotherapy were evaluated after 3 courses of treatment for patients with malignant ovarian cancer.ResultsIn malignant ovarian cancer,VEGF and PARP-1 were highly expressed and VEGF and PARP-1 showed a positive correlation (γ=0.3460,P=0.0022;γ=0.5469,P<0.0001);PARP-1 was also highly expressed in patients with sensitive and effective response to chemotherapy (P<0.05).The expression level of PARP-1 had high sensitivity and specificity (66.10% and 80.95%;94.12% and 64.71%) in predicting the effect of the new adjuvant chemotherapy for patients with advanced ovarian cancer.ConclusionPARP-1 is highly expressed in patients with advanced ovarian cancer,and down regulation of the expression of PARP-1 can improve the sensitivity of chemotherapy in patients with advanced ovarian cancer. Advanced ovarian cancer;Angiogenesis;Neoadjuvant chemotherapy 湖北省卫生厅青年科技人才基金项目(编号:2012FFB01904) 441021 湖北文理学院附属襄阳巿中心医院 邢辉 10.3969/j.issn.1001-5930.2016.08.003 R737.31 A 1001-5930(2016)08-1225-05 2015-09-09 2016-05-31)2 结果



3 讨论

