脑水肿干湿重法的测定条件分析*
2016-09-15李羽中瑶岳志伟黄金贺冷丽娜司道文
李羽中瑶,岳志伟,刘 丽,黄金贺,冷丽娜,司道文
脑水肿干湿重法的测定条件分析*
李羽中瑶1,岳志伟2,刘 丽1,黄金贺1,冷丽娜1,司道文3△
(1.华北理工大学基础医学院2013级临床本科生 ,2.2013级硕士研究生 ,3.基础医学院解剖学教研室 ,河北省慢性疾病重点实验室 ,唐山市慢性病临床基础研究重点实验室 ,唐山063000)
目的:分析干湿重法测定脑水肿的温度条件和时间条件 ,探讨优化测量方案。方法:健康SD大鼠随机分为3组(n= 4):取脑组织称其湿重 ,分别连续烘烤16 h,用于不同温度条件下60°C、90°C、110°C的干湿重法脑水肿测定 ,检测不同时间点脑组织重量变化以及重量差值变化情况。结果:在不同温度下 ,随着时间的延长 ,脑组织重量逐渐减轻;温度在110°C条件下 ,9 h两次称量干重之差小于0.0002 g,已经烘烤至恒重 ;90°C温度条件下12 h至恒重 ;60°C温度条件下15.5 h至恒重。结论 :干湿重法测量脑水肿的优化方案为110°C 9 h、90°C 12 h、60°C 15.5 h,为脑水肿的测定提供实验依据。
脑水肿;干湿重法;测定条件 ;大鼠
【DOI】10.13459/j.cnki.cjap.2016.03.025
脑水肿是继发于多种脑疾病的最终病理现象,是形成脑疝而致死的主要因素,多年来一直是脑科学研究的热点[1]。脑水肿的测量方法主要有干湿重法、微比重法和电阻抗法等。微比重法是用煤油-溴苯梯度测量脑水肿,Kuroiwa等认为该方法操作较为繁琐,现在使用较少[2];电阻抗法是近年发展起来的无损伤检测技术,用于脑损伤患者检测[3],主要应用于临床;干湿重法目前实验室主要采用经典方法[4-6],将待测样本放入烤箱,在一定温度下烘烤一段时间,通过测量湿重和干重,利用Elliot公式“脑含水量(%)=(湿重 -干重)/湿重×100%”来计算脑组织含水量。
但是,干湿重法测量脑水肿的具体方法却存在很大差异,对烤箱的温度和烘烤的时间报道不一,例如Shahrokhi N、Gilmer LK以及其他学者[4-6]所用的时间和温度各不相同 ,烤箱温度的设置从60℃到110℃不等、时间为24 h至72 h不等,缺乏系统的研究和报道。鉴于脑水肿是实验室极为常用检测指标,而且测定的条件不尽相同,因此本研究通过检测不同温度条件下、不同时间点连续测量脑组织重量变化情况,分析不同温度下水含量丢失的速率,阐明温度和时间最优化方案,为脑水肿的测量提供实验依据。
1 材料与方法
1.1 动物与分组
健康成年SD大鼠12只,由华北理工大学动物实验中心提供,体重200~250 g,标准大鼠饲料饲养,自由进食水,室温控制在22℃~25℃;经适应性饲养1周后 ,随机分为3组(n =4),分别用于不同温度条件下60℃、90℃、110℃的干湿重法脑水肿测定。
1.2 脑水肿测定
用10%的水合氯醛按照大鼠体重0.3ml/100 g进行腹腔麻醉 ,断头处死 ,开颅取脑,快速剥离全脑,用滤纸吸尽脑表面的血渍后,在大鼠顶叶处取皮质约0.2 g组织块[6],置于已烤干并称质量的锡纸上,用精密电子分析天平(精确度0.0001 g,FA2004型,上海精科天平厂)测其湿重,然后分别放入60℃、90℃、110℃电热恒温干燥箱(GRX-20A型,上海森信实验仪器有限公司),每隔30min称重,连续烘烤16 h至恒重(两次干重之差小于0.0002g),对每一温度条件下各个时间点脑组织重量变化做好记录。
1.3 统计学分析
记录各个温度下组织块在各时间点重量变化数值,并计算出每次称重和前一次称重的重量差值;分析水含量丢失速率和不同温度下烘烤的最佳时间。
2 结果
在不同温度、不同烘烤时间条件下,组织块标化为0.2 g后重量变化情况见表1。在不同温度下,随着时间的延长,重量逐渐减轻。温度在110℃条件下,9 h两次称量干重之差小于0.0002 g,已经烘烤至恒重;同理,90℃温度条件下,12 h至恒重;60℃温度条件下,15.5 h至恒重。
Tab.1 Change ofweightand differenceofbrain tissueon different temperature ateach time point(g,±s,n=4)
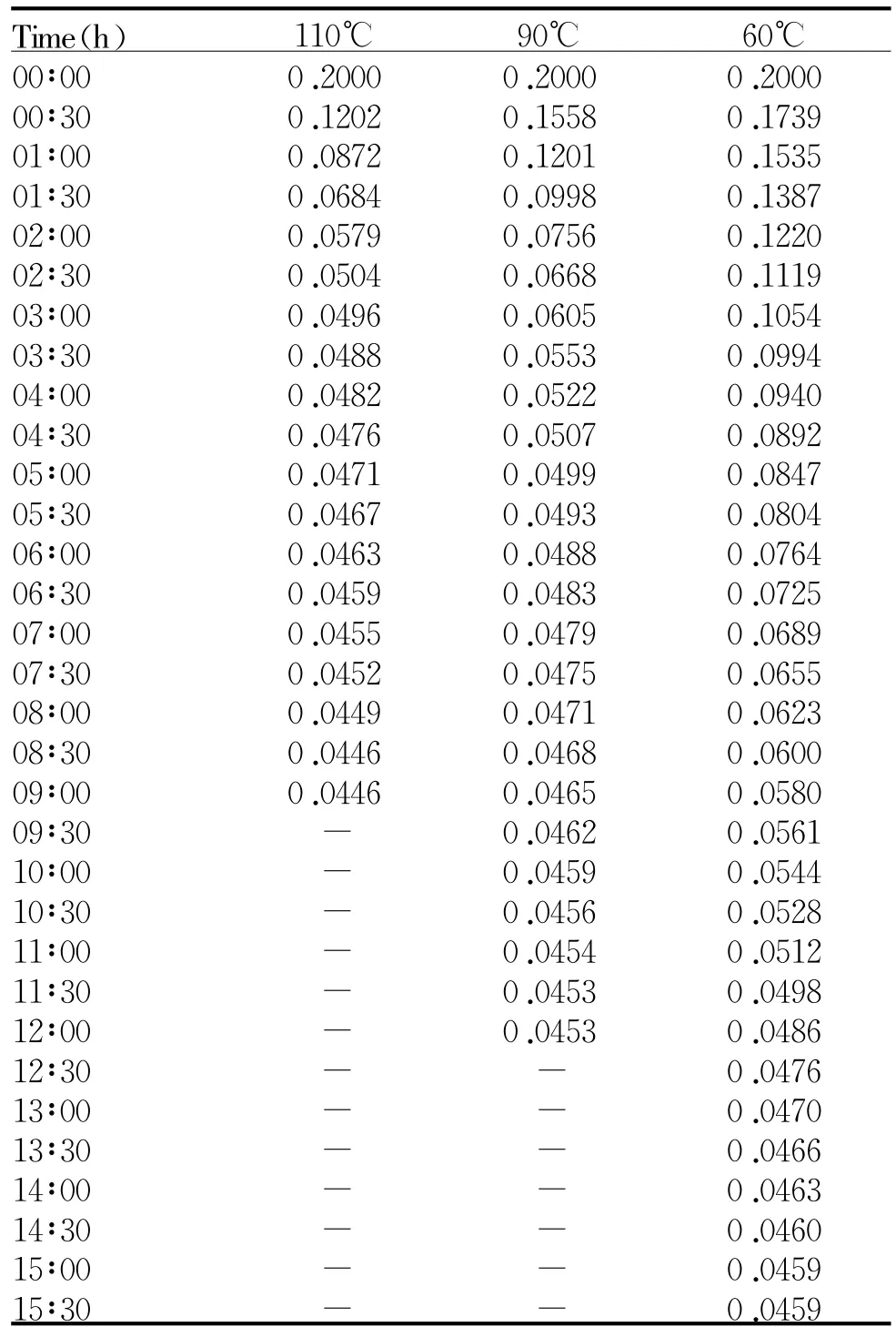
Tab.1 Change ofweightand differenceofbrain tissueon different temperature ateach time point(g,±s,n=4)
Time(h) 110℃ 90℃ 60℃00∶00 0.2000 0.2000 0.2000 00∶30 0.1202 0.1558 0.1739 01∶00 0.0872 0.1201 0.1535 01∶30 0.0684 0.0998 0.1387 02∶00 0.0579 0.0756 0.1220 02∶30 0.0504 0.0668 0.1119 03∶00 0.0496 0.0605 0.1054 03∶30 0.0488 0.0553 0.0994 04∶00 0.0482 0.0522 0.0940 04∶30 0.0476 0.0507 0.0892 05∶00 0.0471 0.0499 0.0847 05∶30 0.0467 0.0493 0.0804 06∶00 0.0463 0.0488 0.0764 06∶30 0.0459 0.0483 0.0725 07∶00 0.0455 0.0479 0.0689 07∶30 0.0452 0.0475 0.0655 08∶00 0.0449 0.0471 0.0623 08∶30 0.0446 0.0468 0.0600 09∶00 0.0446 0.0465 0.0580 09∶30 - 0.0462 0.0561 10∶00 - 0.0459 0.0544 10∶30 - 0.0456 0.0528 11∶00 - 0.0454 0.0512 11∶30 - 0.0453 0.0498 12∶00 - 0.0453 0.0486 12∶30 - - 0.0476 13∶00 - - 0.0470 13∶30 - - 0.0466 14∶00 - - 0.0463 14∶30 - - 0.0460 15∶00 - - 0.0459 15∶30 - - 0.0459
3 讨论
干湿重法测量脑水肿是目前实验室采用的主要方法。湿重是将生物样品取出后称得的重量,干重是指生物体除了水分以外其他组成物质的重量,包括无机盐和各种有机物。测量时将样品放于一定温度的恒温烘箱中,放置一段时间后烘干至恒重,再通过公式计算样品含水率 ,是目前脑水肿测量的常用方法[4-6]。微比重法是取待测脑组织放入煤油-溴苯梯度柱可测得脑组织的比重,由于脑组织水分增加时脑比重降低,通过计算脑组织比重可得出脑组织水含量。电阻抗法是通过测量大脑半球的电阻抗之差,来反映脑水肿变化,是在临床应用的无损伤检测技术,可以动态实时的监测和反映脑水肿的演变过程,是近年来才发展起来主要应用于临床患者脑水肿的无创伤监测[3]。微比重法与干湿重法相比,操作较为繁琐 ,已经较少使用[2]。由于脑水肿在颅脑损伤和其他脑部疾病中具有重要意义[7],因此本研究对干湿重法测量脑水肿方法做了进一步研究。
本实验研究发现,在不同温度下至干重所用的最短时间不同 ,110℃温度条件下至少需要9 h达到恒重 ,90℃温度条件下至少需要12 h达到恒重,60℃温度条件下至少需要15.5 h达到恒重。从表1可以看出 ,通过前后相邻两次称重重量变化情况可以反映出水含量丢失的速率,失水速率的整体趋势是先快后慢;单位时间内失水速率是温度越高水分丢失越快,两次称重差值趋近于0所用的时间越短,反之亦然。因此,在干湿重法脑水肿测定时,可以根据不同温度和需要的最短时间进行选择,为脑水肿的测量提供实验依据,以提高检测效率。
[1]涂 悦,杨细平,商崇智.醒脑静对颅脑创伤的保护作用[J].中国应用生理学杂志,2014,30(3):230-232.
[2]Kuroiwa T,Nagaoka T,UekiM,et al.Correlationsbetween the apparent diffusion coefficient,water content,and ultrastructure after induction of vasogenic brain edema in cats[J]. JNeurosurg,1999,90(3):499-503.
[3]何兰英,王 健,张 蓓,等.无创脑电阻抗测定在脑梗死患者脑水肿监测中的应用[J].中华医学杂志 ,2010,90(43):3063-3067.
[4]ShahrokhiN,Haddad MK,Joukar S,et al.Neuroprotective antioxidant effect of sex steroid hormones in traumatic brain injury[J].Pak JPharm Sci,2012,25(1):219-225.
[5]Gilmer LK,Roberts KN,Scheff SW.Efficacy of progesterone following amoderate unilateral cortical contusion injury[J].J Neurotrauma,2008,25(6):593-602.
[6]马 骏.低氧预处理对大鼠脑损伤后神经行为学评分和脑水肿的影响[D].长春,吉林大学:2008.
[7]苗笑梅,程世翔,杨 震,等.十二井穴刺络放血联合亚低温治疗对颅脑创伤急性期大鼠脑水肿的影响[J].中国应用生理学杂志 ,2015,31(3):249-253.
bain edema;dry-wetweightmethod;measurement conditions
R651.1
A
1000-6834(2016)03-282-02
华北理工大学2015年大学生创新创业训练计划项目(X2015139)
2015-05-25
2016-02-26
Tel:0315-3725241;E-mail:sidaowen@126.com
