湿热应激和习服对小鼠气道黏液分泌的影响*
2016-09-15赖鹏华单晓梅卢大为李鹏程何宽其
赖鹏华,单晓梅,卢大为,李鹏程,何宽其
湿热应激和习服对小鼠气道黏液分泌的影响*
赖鹏华△,单晓梅,卢大为,李鹏程,何宽其
(厦门大学医学院中医系 ,福建厦门361102)
目的:通过观察高温高湿环境暴露下小鼠气道黏液分泌相关蛋白在不同时间段的变化,探讨应激和习服在湿热环境中对呼吸系统疾病的作用。方法:45只BABL/c小鼠随机分成5组(n=9):对照组、湿热1组、湿热2组、湿热3组、湿热4组。对照组普通环境饲养,7 d后处死。其余各组置入气候箱接受湿度(95±5)%,温度(33± 0.5)℃的高温高湿刺激,第12小时处死为湿热1组,第24小时处死为湿热2组,第4天处死为湿热3组,第7天处死为湿热4组。免疫组化法检测小鼠肺黏蛋白5AC(MUC5AC)、表皮生长因子受体(EGFR)、水通道蛋白1(AQP1)、水通道蛋白5(AQP5)蛋白表达。结果:把小鼠置入高温高湿环境后,小鼠肺组织在12 h时AQP5增高,在24 h时MUC5AC、EGFR的蛋白表达增高,与正常组比较差异均有统计学意义(P<0.05);第7天,MUC5AC蛋白表达水平显著低于正常组(P<0.05);其余时间段,MUC5AC、EGFR、AQP5蛋白表达均与正常组无明显差异。AQP1蛋白表达在湿热各组均与正常组无差异,与湿热1组、湿热2组比较,湿热3组、湿热4组表达则减弱(P<0.05)。结论:湿热应激可引起小鼠气道黏液高分泌,持续处于该环境则可能产生一系列更复杂的反应。
湿热;应激;习服;黏液高分泌;小鼠
【DOI】10.13459/j.cnki.cjap.2016.03.020
现代流行病学显示,不仅寒冷、干燥与呼吸系统疾病的发病率、死亡率密切相关,高温、潮湿亦影响其发病率、死亡率。据报道流行性感冒在我国北方流行高峰一般在冬季,南方地区全年则有2个峰,分别在12月份和7月份[1]。在泰国,温暖多雨的南部流感发生率亦高于北部、中部等地区[2]。气道黏液由水、黏蛋白(mucin)、脂类及无机盐等组成,具有维持气道湿化、协助气道上皮细胞功能、预防感染和清除环境异物的作用,是呼吸道重要的防御机制之一。但是研究发现气道黏液高分泌(mucus hypersecretion,MH)会导致气道黏液粘稠度增高,气道阻力增加,影响黏液的清除,容易引起病原菌在呼吸道的驻留和增殖,加重感染,是气道慢性炎性病变的共同特征,与慢性支气管炎、哮喘、支气管扩张、慢性阻塞性肺疾病等密切相关[3]。因此,本研究拟通过气候模拟,观察比较湿热环境应激及继发习服对小鼠气道黏液分泌的影响,以期探讨湿热应激和习服在湿热环境中对呼吸系统疾病的作用。
1 材料与方法
1.1 实验动物
健康清洁级BABL/c小鼠45只,4周龄,体重18 ~20 g,由厦门大学实验动物中心提供,实验动物质量合格证编号:11400700052964。
1.2 实验试剂及仪器
MUC-5AC抗体(ABCAM公司,批号:ab3649)、EGFR抗体(ABCAM公司,批号:ab2430)、AQP1抗体(ABCAM公司,批号:ab15080)、AQP5抗体(ABCAM公司,批号:ab104751),人工气候箱(宁波赛福仪器有限公司,PRX-1000B),恒温培养箱(上海精宏实验设备有限公司,GNP-9080),显微镜(奥林巴斯CX41)、转轮式切片机(徕卡RM2016)。
1.3 实验动物分组及造模方法
将45只小鼠普通环境下(温度22℃~24℃,相对湿度65%)适应性饲养1周后按随机数字表法分成5组(n=9):对照组、湿热1组、湿热2组、湿热3组、湿热4组。每组小鼠单笼饲养。对照组继续室温下饲养,第7天处死。其余4组小鼠均置于人工气候箱接受高温高湿刺激,人工气候箱设置为湿度(95±5)%,温度(33±0.5)℃。置入气候箱后第12小时处死湿热1组,第24小时处死湿热2组,第4天处死湿热3组,第7天处死湿热4组。
1.4 标本采集及预处理
采用急性大失血法处死小鼠后迅速开胸,取右肺中叶用生理盐水清洗后浸入10%中性甲醛中固定24 h,脱水、包埋制成蜡块、切片。
1.5 免疫组化法检测小鼠肺组织 MUC5AC、EGFR、AQP1、AQP5蛋白表达
采用过氧化物酶标记的链酶卵白素(SP)染色法,切片经常规脱蜡、水化后,用3%过氧化氢除去内源性的过氧化氢酶,柠檬酸缓冲液,高压修复3 min,10%血清37℃封闭0.5 h。余步骤按试剂说明书进行,并用Image Pro Plus 6.0图像系统分别计量黏蛋白5AC(mucin 5AC,MUC5AC)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、水通道蛋白1(aquaporin 1,AQP1)、AQP5蛋白阳性表达(棕黄色)的累积光密度(integrated optical density,IOD),每张切片随机选取5个不连续视野(×400),取平均值。
1.6 统计学处理
2 结果
2.1 肺组织MUC5AC的蛋白表达水平
与对照组比较,置入气候箱后第24小时,即湿热2组小鼠肺组织MUC5AC蛋白表达明显增强(P <0.05),第7天,即湿热4组表达减弱(P<0.05),第12小时和第4天,即湿热1组和湿热3组则无明显变化。与第24小时比较,对照组和其余时间段表达均减弱(P<0.05,表1,图1)。结果表明在置入湿热环境初期气道黏蛋白分泌增加,在24 h达高峰,随后逐渐恢复正常,到第7 d甚至出现黏蛋白分泌减少现象。
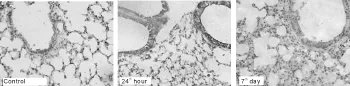
Fig.1 Immunohistochemistry analysisofMUC5AC protein expression in lungs ofmice(DAB×400)
2.2 肺组织EGFR的蛋白表达水平
与对照组比较,置入气候箱后第24小时,即湿热2组小鼠肺组织EGFR蛋白表达增强(P<0.05,表1,图2),其余3组则表达无明显增强。与第24小时比较,第4天、第7天,即湿热3组、湿热4组表达均减弱(P<0.05)。结果表明在置入湿热环境初期,EGFR变化与MUC5AC变化趋势一致,即第24小时变化最明显。
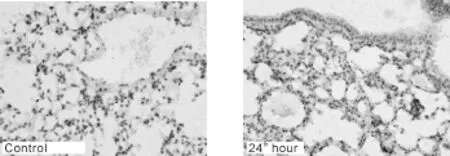
Fig.2 Immunohistochemistry analysis of EGFR protein expression in lungs ofmice(DAB×400)EGFR:Epidermal growth factor recepter
2.3 肺组织AQP1的蛋白表达水平
与对照组比较,置入气候箱高温高湿刺激小鼠肺组织AQP1蛋白表达变化均不显著。与第12小时,即湿热1组比较,第4天、第7天,即湿热3组、湿热4组表达减弱(P<0.05)。与第24小时比较,第7天表达亦减弱(P<0.05,表1,图3)。结果提示,在置入湿热环境后7天内AQP1变化不显著。

Fig.3 Immunohistochemistry analysis of AQP1 protein expression in lungsofmice(DAB×400)AQP1:Aguaporin 1
2.4 肺组织AQP5的蛋白表达水平
与对照组比较,置入气候箱后第12小时,即湿热1组AQP5增强(P<0.05,表1,图4);其余时间段则表达无明显变化。与第12小时比较,第24小时、第4天、第7天AQP5表达均减弱(P<0.05)。结果显示AQP5在置入湿热环境初期,即第12小时变化最明显,可能因其负性调节作用,MUC5AC在此时变化不明显。
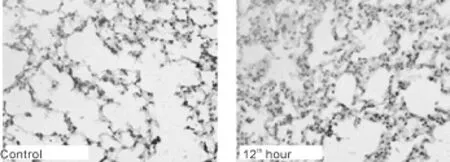
Fig.4 Immunohistochemistry analysis of AQP5 protein expression in lungsofmice(DAB×400)AQP5:Aguaporin 5

Tab.1 Comparision ofMUC5AC,EGFR,AQP1,AQP5 protein expression in different times
3 讨论
黏蛋白只占气道黏液总量的2%,但却是决定气道黏液弹性、粘性最主要的成分。MUC5AC则为最主要的分泌型蛋白,在气道上皮的杯状细胞中高度表达,也是病理性增加的主要黏蛋白表型[4]。表皮生长因子受体(EGFR)与其配体TGF-α结合后,可使受体同源或异源二聚化或寡聚化,激活其酪氨酸激酶 ,使下游信号分子酪氨酸位点发生磷酸化[5],进一步促发一系列生物学效应。研究表明,EGFR的信号转导途径在黏蛋白合成过程中起到主要的调节作用 ,香烟烟雾[6]、过敏原[7]、氧化应激[8]、细胞因子[9]等能通过磷酸化的EGFR将细胞外信号传到下游信号分子,启动MUC5AC转录,导致黏蛋白合成、分泌增加。EGFR酪氨酸激酶抑制剂则能阻断EGFR配体的诱导作用,从而阻断大鼠气道上皮MUC5AC分泌增加和杯状细胞增生[10]。水通道蛋白(AQP)是小分子跨膜蛋白,主要参与渗透压驱动下水的转运,有时也转运小分子甘油。AQP1在整个肺血管网的毛细血管内皮细胞膜高表达,AQP5在肺泡I型细胞和支气管粘膜下腺中浆液腺泡上皮细胞的顶质膜高表达。AQP5还是引起气道高反应的目标基因之一[11]。一系列研究显示AQP1、AQP5表达与MUC5AC表达呈负相关,如陈智鸿等[12]研究显示,在卵白蛋白致敏后,MUC5AC在AQP5敲除鼠中表达比野生型小鼠更丰富。熊本强等[13]实验结果显示随着臭氧应激的气道高反应大鼠肺组织AQP1 mRNA和蛋白水平表达的下降,黏液分泌量明显增多,MUC5AC的表达也增多。
应激是机体对外界或者内部的各种异常刺激(创伤、环境温度剧烈变化、饥饿疲劳等)所产生的非特异性应答反应的总和[14],应激原的作用过度强烈将导致机体正常稳态被破坏、疾病的发生,甚至生命的终结。习服,又称“服习”,指本来对某种气候不适应的动物,因反复或较长期处于该动物生理所能忍受的气候环境中,逐渐引起生理机能的变化,使原来因气候应激失常的生理指标和生产性能,逐渐趋于正常或有所恢复,而能习惯于这种气候环境[15]。大量流行病学资料和实验表明:应激容易引起感染[16]、消化道溃疡[17]、心血管病[18]、精神病[19]等。而通过持续暴露于不良环境的习服训练则有助于应对环境变化所带来的不良反应,目前此研究被广泛应用于运动医学、国防医学等领域。如湿热环境下体能习服训练能够显著增强心血管功能和肌肉运动能力[20]。机体产生习服的时间各异,与所接触应激原的程度和时间相关,邱仞之等观察结果显示在高温高湿环境下第7~14天可达习服状态[21-23],故本研究以7 d为观察时间。
本实验结果示高温高湿环境应激早期,AQP5作为气道高反应的易感基因之一,积极反应,分泌增加,应对环境骤变可能带来的黏液高分泌,但高温高湿环境持续存在,应激过于强烈导致小鼠肺组织EGFR蛋白表达水平上调,从而诱导MUC5AC表达随之上调,黏液分泌增加。置于湿热环境24 h后,MUC5AC、EGFR、AQP5的蛋白表达水平均逐渐下降,提示持续置于高温高湿环境,健康小鼠能迅速适应,产生习服,各项指标逐渐恢复正常。但习服只能短暂缓解应激带来的剧烈变化,若长期处于恶劣环境而无任何干预措施,机体可能产生一系列更为复杂的病理反应,而非单纯良性反应。如本研究所示小鼠置于湿热环境后第7天MUC5AC蛋白表达水平下降至低于正常水平,提示黏液逐渐有分泌不足的趋势,这与季丽萍等[24]研究显示小鼠在45℃高温环境的耐热时间有随习服天数的增加而减少的趋势相似。
综上所述,湿热刺激能使健康小鼠产生急性应激反应,导致气道粘液分泌增加,其机理可能与EGFR对MUC5AC的诱导作用、AQP5对MUC5AC的负性调节相关。若持续置于湿热环境,小鼠能迅速产生习服,气道黏液分泌降至正常。但若习服时间过长,则可能出现纠枉过正现象,其具体机理和意义尚待进一步研究。
[1]徐 红.2002~2003年中国南、北方地区流感监测分析[J].世界感染杂志,2003,3(4):282-285.
[2]Syou thao,M.Jaroensu tasinee,K.Jaroensu tasinee.Analysisof Influenza Cases and Seasonal Index in Thailand[J]. Proceedings of World Academy of Science,Engineering and Technology,2007,26:212-215.
[3]Nadel JA.Mucous hypersecretion and relationship to cough [J].Pulm Pharmacol Ther,2013,26(5):510-513.
[4]Hovenberg HW,Davies JR,Herrmann A,et al.MUC5AC,but notMUC2,is a prominentmucin in respiratory secretions [J].Glycoconj J,1996,13(5):839-847.
[5]Hunter T,Cooper JA.Epidermal growth factor induces rapid tyrosine phsphorylation of protein in A431 human tumor cells [J].Cell,1981,24(3):741-752.
[6]Takeyama K,Jung B,Shim JJ,et al.Activation of epidermal growth factor receptors is responsible formucin synthesis induced by cigarette smoke[J].Am JPhysiol Lung CellMol Physiol,2001,280(1):165-172.
[7]Takeyama K,Tamaoki J,KondoM,etal.Roleof epidermal growth factor receptor inmaintaining airway goblet cell hyperplasia in rats sensitized to allergen[J].Clin Exp Allergy,2008,38(5):857-65.
[8]Takeyama K,Dabbagh K,Jeong Shim J,et al.Oxidative stress causesmucin synthesis via transactivation of epidermal growth factor receptor:Role of neutrophils[J].J Immunol,2000,164(3):1546-1552.
[9]Shim JJ,Dabbagh K,Ueki IF,et al.IL-13 inducesmucin production by stimulating epidermal growth factor receptors and by activating neutrophils[J].Am J Physiol Lung Cell Mol Physiol,2001,280(1):L134-140.
[10]Goldkorn T,Balaban N,Matsukuma K,et al.EGF-receptor phosphorylation and signaling are targeted by H 2O2 redox stress[J].Am JRespir CellMol Biol,1998,19(5):786-798.
[11]Krane AM,Fortner CN,Hand A,et al.Aquaporin 5-deficientmouse lungs are hyperresponsive to cholinergic stimulation[J].Proc Natl Acad Sci USA,2001,98(24):14114-14119.
[12]陈智鸿 ,沈 瑶,董春玲,等.水通道蛋白敲除对支气管哮喘小鼠气道黏蛋白谱表达的影响[J].国际呼吸杂志,2008,28(23):1409-1412.
[13]熊本强,李 翔,李喜兵,等.水通道蛋白1对气道高反应大鼠黏液高分泌的影响[J].湖南师范大学学报(医学版),2012,9(1):6-10.
[14]Selye H.A syndrome produced by diverse nocuous agents. 1936[J].JNeuropsychiatry Clin Neurosci,1998,10(2): 230-231.
[15]Lagerspetz,KYH.What is thermal acclimation[J].J Therm Biol,2006,31,332-336.
[16]周祥吉,裴国献,魏宽海,等.高温高湿环境下犬肢体火器伤后细胞免疫学变化[J].解放军医学杂志,2003,28(4):297-299.
[17]范先保.应激性溃疡发生机制研究[J].国外医学消化系统疾病分册,1998,18(3):131.
[18]钟丽莎 ,郭兴明,肖守中,等.应激状态下人群心脏储备的调研[J].中国应用生理学杂志,2012,28(5): 409-410.
[19]潘光花.创伤后应激障碍与急性应激障碍对比研究[J].中国社会医学杂志,2012,29(4):251-252.
[20]房 晓,张 雷,邓 元,等.湿热生理习服训练对运动后血清钾、钠浓度及白细胞计数的影响[J].第二军医大学学报,2010,31(10):1104.
[21]邱仞之 ,伍超英,胡德泉,等.高湿热环境习服锻炼对全身汗液中营养成分含量的影响[J].航天医学与医学工程,1992,5(3):193-200.
[22]邱仞之,朱受成,华旭初,等.冷热习服对能量代谢的影响[J].第一军医大学学报,1993,13(1):37-42.
[23]谭 森,邱仞之.热应激与热习服对大鼠下丘脑肾上腺素α2受体的影响[J].中华劳动卫生职业病杂志,1996,14(2):91-92.
[24]季丽萍 ,黄晶晶 ,冯照军.不同热习服小鼠的热耐受性研究[J].安徽农业科学 ,2010,38(28):15647-15648.
Influence of hot-hum id stress and acclimation on airway mucus production in lungs ofmice
LAIPeng-hua△,SHAN Xiao-mei,LU Da-wei,LIPeng-cheng,HE Kuan-qi
(Department of Medical College,Xiamen University,Xiamen 361102,China)
【ABSTRACT】Objective:To study the change of airwaymucus secretion under a high temperature and humidity environment,and explore the effects of hot-humid stress and acclimation on themorbidity andmortality of respiratory disease.Methods:Forty-five BABL/cmicewere random ly divided into five groups:normalgroup,hot-humid group I,hot-humid group II,hot-humid group III,hot-humid group IV,with 9 mice in each group.Mice in normal group were continuously placed in the common environment and sacrificed after 7 days.Mice in other groupswere housed in a temperature-and-humidity-controlled environment(33℃±0.5℃,95%±5%).Mice in hot-humid group I,hot-humid group II,hot-humid group IIIand hot-humid group IVwere sacrificed after 12 hours,24 hours,4 days,7 days respectively.The protein expression ofmucin 5AC(MUC5AC)、epidermal growth factor receptor(EGFR)、aquaporin 1(AQP1)and aquaporin 5(AQP5)in lung were tested by immunohistochemisty.Results:After housed in a high temperature and humidity environment,immunohistochemisty revealed a significant increase of AQP5 12 h later,MUC5AC and EGFR 24 h later,comparedwith normalgroup(P<0.05).Therewas a significant decreaseof MUC5AC 7 d later,compared with normalgroup(P<0.05).Therewas no significant difference in MUC5AC,EGFR and AQP5 expression among allgroupsatother time points.Therewasno differenceof AQP1 in humid heatgroups,comparedwith normalgroup,buta significantdecrease in humid heat IIIand IV groups,comparedwith humid heat Iand IIgroups.Conclusion:These findings indicate thathot-humid stress inducesmucus hypersecretion in airways,whichmay be related to theup-regulation of EGFR and down-regulation of AQP5 inMUC5AC.Although acclimationmitigates above-mentioned response,a series ofmore complex responsesmay be induced if still in the hot-humid environment.
hot-humid; stress; acclimation; mucus heypersecretion
R188.8
A
1000-6834(2016)03-266-04
福建省自然科学基金项目(2013J05123)
2015-11-30
2016-02-01
Tel:0592-2183069;E-mail:drlph@163.com
