胍丁胺对大鼠应激性体温升高的抑制作用*
2016-09-15杨永录胥建辉
熊 资,杨永录,胥建辉,卜 舒,罗 蓉,陈 冰
胍丁胺对大鼠应激性体温升高的抑制作用*
熊 资,杨永录△,胥建辉,卜 舒,罗 蓉,陈 冰
(成都医学院体温与炎症 四川省高校重点实验室 ,成都610500)
目的:观察胍丁胺(AGM)是否能降低或反转应激性体温过高反应。方法:61只雄性SD大鼠随机分为3部分,每部分再分为对照组和AGM组。在实验过程中,人工气候箱和开放实验箱内的温度均保持在22℃。①用无线遥测技术连续测量大鼠的体温和活动,观察腹腔注射AGM对安静状态下大鼠正常体温和活动的影响(n=8);②将大鼠放置在开放实验箱中60min复制应激性体温过高的模型,用无线遥测技术连续测量开放实验箱内大鼠体温和活动的变化(n=7~8);③用美国哥伦布公司动物代谢分析系统测量AGM对大鼠能量代谢的影响(n=7)。结果:①腹腔注射AGM 80mg/kg能引起正常大鼠出现明显低温反应(-0.46±0.11)℃,而注射AGM 40mg/kg则对正常体温无明显影响。②对照组大鼠腹腔注射生理盐水后,置于开放实验箱内体温升高达(0.78±0.16)℃;给大鼠注射AGM 40或80mg/kg后,置于开放实验箱内60min时,体温则分别降低(0.34±0.11)℃和 (0.81±0.14)℃。③AGM 80mg/kg能明显降低大鼠的耗氧量和产热量。结论:AGM能引起正常大鼠出现低温反应和明显翻转应激性体温升高反应,其作用可能与AGM能降低能量代谢有关。
胍丁胺;应激性体温过高;低温反应;能量代谢;大鼠
【DOI】10.13459/j.cnki.cjap.2016.03.021
人和哺乳动物面对各种应激事件会出现应激性体温过高(stress hyperthermia)反应。开放环境对啮齿动物是一种心理应激刺激,因为啮齿类动物喜欢避开宽阔的环境,寻找狭小而隐蔽的安全环境藏身。将啮齿类动物放入开放环境中,可以激活交感-肾上腺髓质系统导致肾上腺素和去甲肾上腺素分泌增多以及下丘脑视前区提高前列腺素E2(PGE2)的合成,而引起体温升高[1-3]。所以,人们认为应激性体温过高的机制可能与致热原性发热机制相似[1]。
胍丁胺(agmatine,AGM)是哺乳动物体内发挥诸多生理效应的神经递质和/或调质,参与调节许多系统的功能[4,5]。近几年来发现,外源性AGM具有抗炎、镇痛和降低吗啡引起的体温过高反应[4-7],但AGM是否能降低应激性体温过高反应还不清楚。因此,本实验观察了AGM对应激性体温过高的影响,为探讨AGM在应激性体温过高中作用提供一定的实验依据。
1 材料与方法
1.1 实验动物与试剂
实验用SPF级雄性SD大鼠(3~4月龄)61只(购自成都达硕生物医学科技有限公司),体重270 ~330 g。胍丁胺购自于Sigma公司,用无菌生理盐水溶解配制成40 mg/ml、80 mg/ml的溶液,储存于-36℃低温冰箱中备用。
1.2 实验分组
实验分为3部分:(1)AGM对正常大鼠体温的影响:24只大鼠分为3组(n=8):对照组腹腔注射无菌生理盐水(1 ml/kg);AGM 40 mg组腹腔注射AGM 40mg/kg;AGM 80mg组:腹腔注射AGM 80mg/ kg。(2)AGM对大鼠应激性体温过高反应的影响:23只大鼠分为对照组(n=8)、AGM 40mg组(n=7)和AGM 80 mg组(n=8),给药方法同实验(1)。(3)AGM对大鼠能量代谢的影响:14只大鼠分为对照组和AGM 80mg组(n=7)。所有实验均在实验前1 天15∶00将大鼠放入22℃人工气候箱内进行适应性过夜,气候箱明暗时间设定为12∶12 h。6∶00开灯,18∶00关灯。
1.3 动物手术与体温和活动的记录
用10%水合氯醛(300 mg/kg)腹腔注射麻醉大鼠,常规手术方法,腹腔植入美国DSI公司生产的无线遥测温度传感器(model TA10TA-F40),用于测量大鼠的体温和活动,术后肌肉注射青霉素2×104U预防感染。单笼饲养,自由进食进水,饲养7 d后进行实验。实验当天7∶00开始记录大鼠的体温和活动。10∶00腹腔注射生理盐水或AGM。13∶00停止实验。
1.4 应激性体温过高动物模型的复制与实验方法
1.4.1 手术与动物模型的复制 腹腔植入无线遥测温度传感器(成都泰盟公司,型号:TA-F40),手术操作同前。动物应激开放实验箱是用厚度为0.5 cm树脂玻璃做成的60 cm×60 cm×60 cm四周为白色,底部为棕色,上部敞开的方形实验箱[8]。应激性体温过高模型的复制是将大鼠放置于开放实验箱中60min,用无线遥测技术连续测量开放实验箱内大鼠体温和活动的变化。
1.4.2 实验方法 实验前1天15∶00将大鼠置于清洁鼠笼,然后与应激开放实验箱一并放入22℃和湿度45%~60%的人工气候箱内进行适应性过夜。实验当天7∶00开始记录大鼠在鼠笼中的体温和活动作为实验前的对照值,10∶00给大鼠腹腔注射生理盐水或AGM后,立即将大鼠移入开放实验箱内60min,观察体温和活动的变化。11∶00将动物从开放实验箱内移回到原鼠笼中,继续记录体温和活动2 h。
1.5 能量代谢的测定
用美国哥伦布公司(Columbus Instruments)动物代谢分析系统测量大鼠的能量代谢。实验当天7∶00开始测量大鼠的耗氧量和产热量作为实验前的对照值,10∶00腹腔注射生理盐水或AGM,持续测量到14∶00。设备自动同步测量动物的耗氧量和二氧化碳生成量,并计算出产热量。
1.5 统计分析
2 结果
2.1 AGM对正常大鼠体温与活动的影响
给药前对照组、AGM 40mg组和AGM 80mg组3组之间体温无明显差异(图1A)。对照组给予盐水后,体温出现了短暂轻微的应激性升高,但体温未出现明显的变化;腹腔注射AGM 40mg/kg后,未出现应激性体温升高反应,体温与对照组比较无明显差异;注射AGM 80mg/kg后,即刻出现体温降低反应,给药60 min后体温较给药前降低(0.42±0.11)℃(P<0.05),大约100min后体温恢复至注药前水平(图1A)。
对照组给盐水1 h后,大鼠每10min平均活动为(6.26±3.60)次,而同时间AGM 40mg组和AGM 80mg组大鼠活动均出现降低反应,分别为(5.69± 2.65)次和(4.71±3.70)次(图1B),AGM 80mg组与对照组比较有明显差异(P<0.05)。
2.2 AGM对大鼠应激性体温过高的影响
给大鼠注射盐水后移入开放实验箱内立即出现体温升高反应,15min时体温从(37.51±0.11)℃上升到(38.29±0.12)℃,与在鼠笼中的体温比较上升(0.78±0.16)℃,虽然在45min时体温出现轻度下降反应,但体温仍然高于正常水平(图2A)。当给大鼠分别注射40 mg/kg和80 mg/kg AGM后,移入开放实验箱内体温均先出现轻度短暂的升高反应,6min后体温开始降低,动物在开放实验箱内60 min末,AGM 40mg组和AGM 80mg组的体温分别降低(0.34±0.11)℃和(0.81±0.14)℃,80 mg组体温下降幅度明显大于40mg组的体温(P<0.01;图2A)。将大鼠从开放实验箱中移回到鼠笼中,大约30min后体温恢复到实验前水平。在开放实验箱内,盐水组大鼠每10min的平均活动为(25.92±11.60)次,AGM 40 mg组的活动为(22.16±19.74)次,而AGM 80mg组动物的活动为(20.63±15.52)次,明显低于盐水组(P<0.05,图2B)。2.3 AGM对大鼠能量代谢的影响
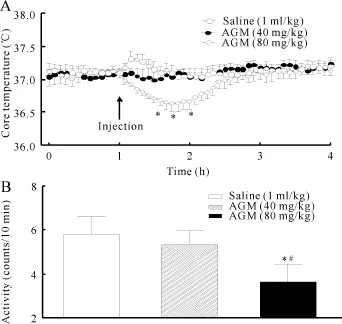
Fig.1 Effect of agmatine on core temperature(A)and activity (B)in rats(±s,n=8)AGM:Agmatine
注射生理盐水和AGM前,两组动物的产热量无显著差异。对照组注射生理盐水30min后,产热量出现增加现象;AGM组注射AGM(80mg/kg)30min后,产热量较对照组明显降低(P<0.05),大约90 min后恢复到给药前水平(表1)。
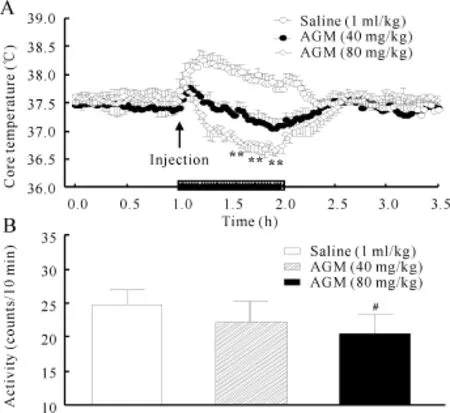
Fig.2 Effectof agmatine on stress-induced hypothermia in ratsA:Core temperature;B:Motor activity in open-field chanmber for60min;Horizontal bar represents the open-field phase
Tab.1 Effectof agmatine on energy production in rats(kKal/h,±s,n =7)

Tab.1 Effectof agmatine on energy production in rats(kKal/h,±s,n =7)
AGM:Agmatine*P<0.05 vs controlgroup
Groups Before After intraperitoneal injection(min)administration 30 60 90 120 Control 1.74±0.13 2.03±0.22 1.91±0.13 1.68±0.06 1.73±0.11 AGM(80mg/kg) 1.76±0.19 1.43±0.18* 1.55±0.16 1.60±0.12 1.61±0.09
3 讨论
应激是机体对各种内外环境刺激因素所产生的适应性反应过程,最直接的表现是精神紧张和体温升高。在实验过程中,移动动物、调换动物笼以及将动物移入到新的环境中,甚至用手触摸动物,均能引起体温快速升高反应;人处于精神紧张状态或情绪激动时也会出现这种体温过高现象[1,3,8]。通常应激性体温升高的反应曲线和幅度与脂多糖引起的发热曲线和幅度相似,退热药阿斯匹林和消炎痛可以阻断应激性体温过高的反应[1,8]。动物出现应激性体温过高反应时,血浆中白介素6含量明显升高,白介素1受体阻断剂可阻止应激性体温升高反应。所以,认为应激性体温升高的机制可能与致热原性发热机制相似[1,8]。AGM是生物体内的一种内源性活性物质,能促进机体内T细胞抗炎因子的分泌和阻断吗啡引起的体温过高[4,5,7]。为此 ,我们观察了AGM对大鼠正常体温和应激性体温过高反应的影响。
为了研究AGM对大鼠应激性体温过高的影响,实验首先观察了AGM对大鼠正常体温的影响。当给大鼠腹腔注射AGM 40mg/kg能抑制注射操作引起的应激性体温升高反应,随后的体温变化与对照组比较无明显差异;注射AGM 80mg/kg能明显降低大鼠的体温,同步记录大鼠的活动也低于对照组的活动。实验证明,较小剂量AGM(40 mg/kg)能抑制实验操作引起的应激性体温升高反应,而较大剂量AGM(80mg/kg)能引起大鼠出现明显低温反应。另外,本实验也观察到AGM能明显降低大鼠的产热量,其作用大约持续60min。与相同计量AGM降温持续的时间相似,表明AGM降温作用与其能够降低能量代谢有关;而对照组动物产热量出现轻度增加反应,这种反应与注射操作刺激引起动物活动增加有关。但Bhalla等往小鼠腹腔分别注射3个不同剂量AGM(1、10和100 mg/kg)未观察到明显降温反应[9]。这可能是由于作者使用人工方法测量直肠温度引起动物应激性体温变化掩盖了AGM的降温作用,而干扰了实验结果的准确性,因为实验中移动动物和注射刺激动物能引起应激性体温升高反应[1,8]。
在相同环境温度和湿度条件下,给大鼠腹腔注射生理盐水后,将大鼠从鼠笼中移入到开放实验箱内15 min后,体温升高达0.78℃,与文献报道相似[3],表明本实验使用开放实验箱复制的应激性体温过高模型完全符合实验要求。有趣的是当给大鼠注射两个不同剂量AGM并移入开放实验箱内时,不仅未出现应激性体温升高反应,而且均出现降低反应,AGM 80mg组的大鼠降温反应明显大于AGM 40 mg组。由此可见,AGM不仅能完全阻止应激性体温升高反应,而且还能翻转大鼠在开放实验箱内的体温升高反应,增加剂量翻转作用也增大。实验证明,AGM能明显抑制应激性体温升高反应。
上述实验结果表明,AGM不仅能引起正常大鼠出现低温反应,而且也能明显阻止和翻转应激性体温升高反应。虽然大鼠在开放实验箱中不能测量能量代谢,只能在能量代谢测定箱中测定,但本实验中AGM能引起正常大鼠出现低温反应和能量代谢降低,因而我们分析AGM抑制应激性体温过高反应可能与其能降低开放环境中大鼠的代谢产热有关。
[1]杨永录.体温与体温调节生理学[M].北京:人民军医出版社,2015:235-251.
[2]陈家旭,杨建新,赵 歆,等.慢性束缚应激大鼠中枢糖皮质激素受体变化及中药复方的影响 [J].中国应用生理学杂志,2005,21(4):402-406.
[3]Uzbay TI.The pharmacological importance of agmatine in the brain[J].Neurosci Biobehav Rev,2012,36(1):502-519.
[4]Ahn SK,Hong S,Park YM,et al.Protective effects of agmatine on lipopolysaccharide-injured microglia and inducible nitric oxide synthase activity[J].Life Sci,2012,91(25-26):1345-1350.
[5]兰忠平,陈雅慧,顾 楠,等.脊髓水平给予胍丁胺对鞘内吗啡镇痛的影响[J].中国应用生理学杂志 ,2014,30(3):197-198.
[6]Rawls SM,Amin M,Zisk J.Agmatine blocksmorphine-evoked hyperthermia in rats[J].Brain Res,2007,1147(8): 89-94.
[7]Gordon CJ,Yang YL.Reduction in open field-induced hyperthermia in the rat exposed to chlorpyrifos,an anticholinesterase pesticide[J].JTherm Biol,2001,26(4-5): 313-318.
[8]Adriaan Bouwknecht J,Olivier B,Paylor RE.The stress-induced hyperthermia paradigm asa physiological animalmodel for anxiety:a review of pharmacological and genetic studies in themouse[J].NeurosciBiobehav Rev,2007,31(1):41-59.
[9]Bhalla S,Andurkar SV,GulatiA.Involvementofα2-adrenoceptors,imidazoline,and endothelin-A receptors in the effect of agmatine onmorphine and oxycodone-induced hypothermia inmice[J].Fundam Clin Pharmacol,2013,27(5):498-509.
Inhibitory effects of agmatine on stress-induced hypertherm ia in rats
XIONG Zi,YANG Yong-lu△,XU Jian-hui,BU Shu,LUO Rong,CHEN Bing
(Key Laboratory of Thermoregulation and Inflammation of Sichuan Higher Education Institutes,Chengdu Medical College,Chengdu 610500,China)
【ABSTRACT】Objective:To examinewhetheragmatine(AGM)would alter stress-induceshyperthermic response.Methods:Sixty-onemale SD ratswere randomly divided into three experiments.Each experimentwas divided into control group and AGM group.During the experiments,theanimalsweremaintained in a chamberat 22℃.①Effectsof intraperitoneal injecting 40 or80mg/kg AGM on normal core temperature and activity were observed in undisturbed rats using radiotelemetry(n=8).②Stress-induced hyperthermiamodelwas established by placing rats in an open-field chamber for 60min.Ratswere dosed intraperitoneally with AGM or saline,and placed immediately inside the open-field chamber.Core temperature andmotor activityweremonitored by radiotelemetry in an open-field chamber(n=7~8).③Effectof AGM on energymetabolism wasmeasured by ColumbusOxymax Lab AnimalMonitoring System(n=7).Results:①Rats administered with 80mg/kg AMG showed significanthypothermic responses(-0.46±0.11)℃,while 40mg/kg AMG had no significant effect on the normal core temperature.②Core temperature of control group increased by(0.78±0.16)℃during open-field exposure,whereas rats administered 40 and 80mg/kg AGM underwenta(0.34±0.11)℃and(0.81±0.14)℃reductions in core temperaturewithin 60min,respectively.③Oxygen consumption and energymetabolism were significantly reduced by AGM (80mg/kg).Conclusion:The data demonstrated that AGM induced hypothermic responses in rats and reversed stress-induced hyperthermia,and its effectmight attribute to the suppression of energy metabolism.
agmatine; stress hyperthermia; hypothermic response; energymetabolism; rats
R364.6
A
1000-6834(2016)03-270-04
四川省教育厅科研基金资助项目 (12ZB204,15ZA0251)
2015-12-07
2016-02-14
Tel:028-62739330;E-mail:ylyang9@sohu.com
