脐血来源造血干细胞体外培养扩增技术研究进展
2016-09-15李猛盛宏霞张斌陈虎
李猛 盛宏霞 张斌 陈虎
·综述·
脐血来源造血干细胞体外培养扩增技术研究进展
李猛 盛宏霞 张斌 陈虎
随着造血干细胞(HSC)移植技术的发展,脐血已成为干细胞的主要来源之一。为突破HSC来源及数量不足的制约,HSC体外扩增技术发展迅速,涉及到细胞因子、小分子化合物的应用以及联合培养及三维培养技术的发展和氧环境在干细胞扩增技术的作用以及基因修饰技术。本文就近年上述技术中采用的主要方法进行综述。
造血干细胞; 基因扩增; 脐血
造血干细胞(hematopoietic stem cell,HSC)为血液系统中的成体干细胞,能够通过不断自我更新长期存在于骨髓中并可多向分化发育为血液系统中各种细胞类型。HSC移植为治疗化疗效果不佳及复发白血病患者最为有效的手段。目前HSC主要来源有骨髓、外周血、脐血及胎盘四种途径。其中骨髓及动员外周血为造血干细胞移植的主要来源。由于供受者人类白细胞主要抗原(human leukocyte antigen,HLA)的配型限制,很多患者错失了移植机会,脐血及胎盘来源HSC具有HLA配型相合程度要求低的优点,成为HSC移植新的突破点,然而脐血中HSC数量较少,低数量的脐血HSC输注会导致中性粒细胞恢复延迟并增加细菌及病毒感染的风险[1]。而双份脐血则会带来移植物抗宿主病(graftversus-host disease,GVHD)发病率增加、血小板恢复时间延长和较高的移植费用等一系列问题[2],因此研究者一直尝试应用多种方法对HSC(主要针对脐血来源HSC)进行体外扩增培养,以此解决单份脐血中HSC数量不足的问题。本文依据近年来国内外针对脐血来源的HSC体外扩增技术的最新进展及效果进行综述。
一、待扩增造血干细胞的确定与评价标准
欲对HSC进行体外扩增培养的首要步骤是确立待培养细胞的选择标准,目前对于HSC的判定尚无统一标准,既往各扩增体系多以简单的免疫表型分析确定并评价扩增效果。大量研究表明在Lin-CD34+CD38-及CD34+CD45RA-细胞中富含造血干细胞,且CD34+CD38-CD45RA-CD90+细胞中含量更高[3]。目前HSC体外扩增评价体系主要通过免疫分型测定扩增后细胞中各组分细胞含量及比例高低。然而Chen等[4]最新研究结果认为只有HoxB5+细胞才为HSC,依此标准对目前的采纳较多的各干细胞评价体系进行了验证标明,仅有7%~35%的细胞为长时程造血干细胞。除免疫分型测定外,短时程及长时程集落实验可以用来测定干细胞更新及分化频率,而通过非肥胖糖尿病/重症联合免疫缺陷(NOD/SCID)小鼠进行的移植实验则被认为衡量干细胞扩增效果的金标准。
二、细胞因子扩增HSC技术
1963年,Ginsburg等[5]发现在缺乏其他细胞支持下造血细胞无法在体外长期存活,并指出造血细胞的体外培养需要可以调控细胞形成和发育的特定物质支持。后续研究表明,处于G0期的HSC的增殖分化过程受到各类抑制或刺激因子相互调控,这些因子多为造血微环境及HSC龛产生的分泌蛋白,并在HSC表面拥有相应的受体。随着1967年刺激粒细胞与巨核细胞分化的细胞因子“mashran gm”[后确定并更名为集落刺激因子(colony stimulating factor,CSF)]的发现,迄今已被发现的各类因子六十余种,它们分为细胞释放的可溶性分子或与细胞膜结合的配体两类。而依据其针对HSC生长周期发育阶段的不同,可分为三类:第一类因子主要调节HSC从G0期向G1期发育,如干细胞因子(stem cell factor,SCF)、fms样酪氨酸激酶3(fms-like tyrosine kinase 3,FLT3)、血小板生成素(thrombopoietin,TPO)、MP1等;第二类因子可抑制HSC进入G0期,如转化生长因子-β (transforming growth factor β,TGF-β),MIP-1α、p38等;第三类因子主要促进S期HSC扩增,如胰岛素生长因子2(insulin growth factor 2,IGF-2)、白介素3(interleukin 3,IL-3)、白介素6(interleukin 6,IL-6)、Notch配体等。
(一)主要细胞因子及其作用机制
各类细胞因子机制尚不完全明确,但目前应用最为广泛,效果最为确切的细胞因子主要包括SCF、TPO、FLT3。
1. SCF:Zsebo等[6]于1990年报道了一种从大鼠肝脏细胞培养基中分离出的新型蛋白,该蛋白促进骨髓干细胞增殖效果较GM-CSF更为有效,其功能区可与HSC表面酪氨酸激酶受体c-kit结合,该蛋白命名为SCF。研究表明SCF为间充质干细胞分泌的糖蛋白,包括可溶性及跨膜两种形式,并在体内外发挥不同的作用。只表达可溶性SCF的基因突变小鼠具有严重的生殖和造血缺陷,表明膜结合的形式与体内细胞增殖与分化有密切关系[7]。在体外HSC培养中发现,基质细胞膜表达更多跨膜形式的SCF,且其在支持HSC方面较可溶性SCF更为有效。进一步研究表明SCF在结构上与GMCSF,G-CSF,IL-4,-6,-7,-10,生长激素相似,同为短链四螺旋束细胞因子。而在功能上则与血小板衍生生长因子,VEGF,PlGF同为半胱氨酸结细胞因子[8]。大量实验表明应用SCF进行HSC体外培养可有效减少HSC凋亡,在促红细胞生成素(erythropoietin,EPO),G-CSF,FLT3-L或TPO等因子存在状况下可发挥增殖刺激作用,但缺乏SCF进行HSC体外扩增其效率明显下降[9],其确切的作用使得其几乎在所有HSC体外扩增细胞因子组合中出现。
2. TPO及其受体:TPO是一种调节巨核细胞谱系发育及血小板生成的特异性细胞因子。近年研究表明,TPO在调节HSC增殖分化方面发挥重要作用:一方面可通过延长HSC细胞周期维持其稳定性[10],另一方面也可促进HSC产生及扩增,并可促进HSC及祖细胞的迁徙及归巢[11],其具体机制尚不明确。TPO受体Mpl可在部分造血组织及所有HSC表达,其与TPO结合后可导致酪氨酸激酶JAKs家族蛋白的磷酸化,进而激活下游(STAT)3,STAT5,Ras/MAPK和PI3K/Akt等转导及转录因子[12],从而在HSC产生和增殖中发挥作用。
3. FLT3及其配体:FLT3为表达于HSC及早期祖细胞表面的Ⅲ型酪氨酸激酶受体家族成员之一,该类受体家族还包括SCF受体c-kit及M-CSF受体c-fms等。其配体FLT3-L为骨髓胸腺及肝脏产生的具有酪氨酸激酶活性受体的一种细胞因子。体内及体外研究均表明FLT3与其配体FLT3-L结合可影响造血祖细胞和干细胞生长、分化及凋亡,可显著提高HSC体外培养扩增效率[13],该作用可与IL-7通过不同细胞通路发挥协同刺激作用[14]。最新研究表明FLT3-L可诱导多能祖细胞向髓细胞/淋巴细胞谱系分化而抑制巨核细胞/红细胞产生[15]。
(二)其他细胞因子
随着HSC扩增技术的发展及细胞因子研究的深入,除上述三种细胞因子外,其他因子也在扩增技术中得以应有并取得一定的效果。
1. Notch配体:Notch信号通路为体内重要的转导通路之一,几乎涉及所有细胞的增殖及分化过程,其在造血功能激活过程中发挥重要作用,可通过与HSC及祖细胞表明的受体Notch-1-4结合调节其的生存及增殖过程[16]。HSC龛中表达Notch配体Jagged和Delta,其中Jagged-1配体与Notch-1受体结合后可发挥HSC的早期增殖作用,Delta1可刺激脐带血CD34+阳性细胞Notch信号转导通路从而显著增加HSC和祖细胞扩增效率[17]。
2. IGF-2及其结合蛋白:近年来,涉及IGF及其结合蛋白在HSC增殖分化的研究日益增多,IGF-2特异表达于支持HSC扩增的细胞群中,胎肝及骨髓HSC均表达其受体IGFBP2,多项研究表明IGF 及IGFBP联合细胞因子可提高HSC扩增效果[18],Huynh等[19]指出IGFBP2支持老鼠和人类的HSC体外扩增,并在进一步研究中验证IGFBP2通过刺激骨髓细胞而非HSC发挥作用。
3.白介素类细胞因子:白介素类细胞因子家族在HSC扩增中发挥重要作用,该类因子包括IL-3、4、6、10及11等,其中IL-6作用较为确切,广泛应用于多种细胞因子联合培养HSC扩增技术中,其主要通过JAK/STAT3通路发挥作用。白介素类细胞因子联合其他细胞因子可提高扩增效率,但也有研究表明该类因子可促进HSC分化,影响扩增后细胞的再生潜能[20]。
(三)不同细胞因子联合应用
研究表明,不同的细胞因子在HSC扩增过程中具有协同作用,扩增效果高于单细胞因子,且在保持HSC特性基础上提高造血祖细胞含量,达到较好的移植效率。目前最佳的组合及浓度尚未有定论,但采用最为广泛的细胞因子组合主要包括SCF、TPO和FLT3-L,研究表明这三种细胞因子组合具有维持造血细胞活力、提高端粒酶活性,以及调节粘附分子和促HSC扩增等特性。由于较多的研究选取在ST-HSC仍发挥重要作用的早期(一般小于10周)进行的移植实验,因此相关实验的SRC水平可能会被高估,这些结果的可信程度尚需进一步探讨。
三、化学分子扩增HSC技术
近年来,化学合成分子逐渐成为HSC扩增技术中的越来越重要的工具,其单独或者与细胞因子联合应用均可显著提高扩增效率。而对于这些分子及其与细胞因子协同作用机制的研究,更有助于我们理解HSC分化扩增的机制。
1.铜离子及其螯合剂:临床发现铜离子缺乏患者多伴随血细胞生成障碍,铜离子作为多种细胞酶的辅因子,在细胞增殖分化过程中发挥重要作用。铜的含量对于脐血造血干/祖细胞增殖和分化的调节至关重要,最新研究表明通过高亲和力铜离子螯合剂TEPA调节铜离子浓度可延迟HSC分化提高增殖活性[21]。Peled等[22]采用TEPA联合细胞因子进行的HSC体外扩增效率可达83倍。
2.甲基化酶及组蛋白乙酰化酶抑制剂:DNA甲基化酶及组蛋白脱乙酰酶为调节基因表观遗传程序表达的组件,可通过干扰DNA甲基化和组蛋白脱乙酰化调节细胞的功能。首次利用这一原理进行HSC体外扩增的分子为组蛋白乙酰化酶(HDAC)抑制剂曲古抑菌素A(TSA)和组蛋白甲基转移酶抑制剂5-氮杂-2-脱氧胞苷(5azaD),结果表明其二者联合细胞因子可显著提高HSC进行体外扩增效率[23],小鼠移植实验也验证了扩增后HSC的活性。后续针对甲基化酶的小分子丙戊酸和赖氨酸甲基转移酶G9a/GLP的小分子抑制剂UNC063824的研究均表明其可以有效提高CD34+扩增细胞中的比例。最新研究再次验证了HDAC抑制剂在HSC扩增技术中的积极作用,并证实转录因子SALL4在其中扮演重要角色[25]。近年来关于沉默信息调节因子2相关酶1(SIRT1)非竞争抑制剂烟酰胺(NAM)的研究较多,研究表明NAM可通过抑制SIRT1去乙酰化酶抑制CD34+分化[26],最新研究表明NAM联合细胞因子可使CD133+扩增效率达72倍[27]。
3.芳香族受体拮抗剂SR1:芳香族受体拮抗剂SR1为嘌呤衍生物,低浓度SR1联合细胞因子SCF、FL及IL-6进行的脐血CD34+细胞体外培养实验显示,共培养3周及6周后,扩增效率可达669及17 100倍,其中CD34+扩增达50倍[28]。随后Wagner开展的多项研究也验证了SR1在HSC扩增中的确切作用,CD34+细胞扩增效率约为328倍[29-30]。虽然利用SR1进行脐血HSC扩增相关的临床试验已经开展,但其具体机制目前尚需进一步研究。
4. UM171:UM171是2014利用大型化学库筛选出的可用于HSC扩增的另一强效小分子,长时程观察显示UM171支持长期再生HSC(LT-HSC)扩增,扩增效率强于SR1,而应用UM171培养的HSC进行的移植实验显示UM171对LT-HSC作用确切,研究显示UM171并非通过AhR通路发挥作用,但其机制目前尚不明确,可能与抑制红系和巨核细胞分化基因相关[31]。
5.其他化学分子:除此之外,近年来也相继报道了一些具有HSC扩增能力的其他小分子化合物。天然多芬分子白藜芦醇[32]和OAC1激活剂Oct4[33]联合细胞因子较单用细胞因子HSC培养效率分别增加2和2.8倍,并可促进NSG小鼠HSC植入率。
四、联合培养扩增技术
干细胞龛是干细胞的生长微环境,由构成信号转导的可溶性细胞因子及粘附因子组成。HSC龛在维持HSC自我更新及多向分化中发挥重要作用[34-35],随着HSC研究的深入,HSC龛成为研究的热点问题。而通过模拟造血微环境促进HSC体外扩增的技术也日益成熟。HSC龛中间充质干细胞(MSC)对HSC拥有重要的造血支持作用,研究表明MSC可通过直接接触或分泌内源性细胞因子等方式调控HSC[36]。利用MSC饲养层培养及扩增HSC可避免CD34及CD133分选造成的干细胞数量减少,增加HSC扩增倍数,并可促进HSC的归巢[37]。
五、三维培养系统
传统细胞培养及扩增均在相对静态封闭的小空间内进行,这与体内环境差异较大,随着科技的发展,近年来,三维培养技术得到越来越多关注。三维培养是指将三维载体与细胞在体外共培养,可以模拟体内微环境,并实时清理废物以给予细胞更好的营养支持,并可稳定调节各细胞因子及小分子化合物的浓度。三维培养的方式很多,不同方式之间培养效果也存在差异。研究表明采用细胞外基质蛋白涂层的三维支架HSC培养单核细胞数量扩增169倍,其中CD34+CD38-细胞比例达32%[38],Mousavi[39]进行的实验表明采用同样条件进行3D培养和2D培养,CD34+细胞分别扩增40倍和2.6倍。采用搅拌反应器培养模式显示,不同的搅拌速度可以调节干细胞向不同细胞系分化。
六、氧气对干细胞培养的影响
氧在人体内发挥重要生理作用,各组织氧浓度一般不超过13%,骨髓中氧浓度在1%至7%之间,显著低于目前细胞体外培养模式大气中21%氧浓度,研究表明暴露于高氧环境中不适合HSC正常的增殖分化[40],Christine等的进一步研究表明8%的氧浓度可以减少HSC向红系和巨核系分化[41]。未来HSC体外培养及扩增体系中,氧浓度将会发挥更重要的作用[42]。
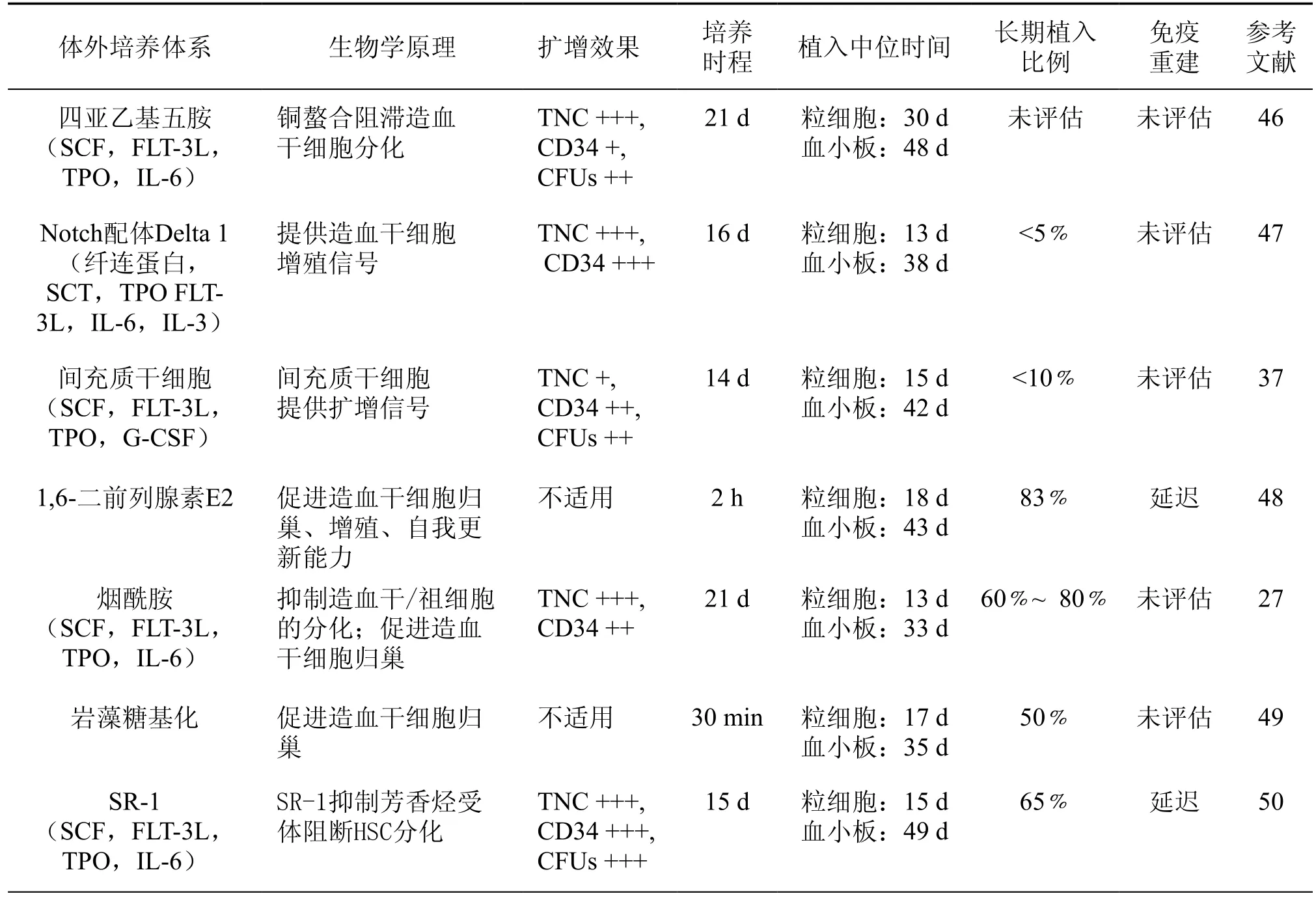
表1 目前临床试验中的脐血干细胞的体外培养方法
七、基因修饰技术
基因修饰技术也被尝试应用于HSC体外扩增中,其涉及的基因主要为HoxB4及SALL4。HoxB4在早期造血细胞中高表达,随着HSC分化,其表达逐渐下降直至消失,最新研究表明HoxB4通过与OCT4形成OCT4-HoxB5信号通路参与HSC自我更新及造血祖细胞的体外扩增[33]。研究者采用基因修饰技术利用反转录病毒或慢病毒将HoxB4直接转入造血干细胞中后发现可显著提高植入效率。SALL4为锌指结构转录因子,SALL4基因过表达的CD34+细胞在体外扩增培养后扩增效率及植入率均显著增强[43]。由于转基因技术的安全性问题,且有文献报道高表达HoxB4造血干细胞移植后可增加白血病的发生几率[44],研究者继而采用间接方法,将HoxB4转入骨髓细胞或间充质干细胞中,利用共培养技术同样可提高造血干细胞的扩增效率[45]。
八、展望
临床试验已经验证了扩增后HSC移植的安全性及有效性(各临床实验情况详见表1[51]),但HSC最佳的扩展条件至今尚没有明确的共识。随着科技的进步以及对造血干细胞研究的深入,造血干细胞扩增技术由既往简单的提高某种细胞因子浓度向多因素联合应用发展,在谋求HSC扩增数量增加的同时减少对细胞干性的损伤,降低移植后各项风险。现行体外扩增技术中,细胞因子仍是最重要的工具,无论是几种细胞因子联合还是与其他小分子联合应用,或者将细胞因子与其他影响HSC扩增的因素相结合,几乎所有成熟的扩增体系中均有细胞因子的参与,而加入细胞因子的时间不同其效果也有不同的改变,未来随着对各因子机制研究的深入,其在各扩增体系中的应用将更为标准化。小分子化合物在提高HSC扩增倍数以及维持其移植后长期效应均有重大突破,但无论是这些小分子自身的细胞毒性,还是基于基因水平的改造对HSC的长期影响,都让人对于扩增后HSC的安全问题产生质疑,尚需进一步观察验证。细胞共培养技术以及对细胞生长适宜氧浓度的探索都将在未来发挥重要的作用,而三维培养模式随着技术的成熟,或许会成为未来HSC扩增技术的基础平台。随着技术的迅速进步,我们相信未来HSC扩增技术在解决临床HSC数量不足问题上将有更大的发展前景。
1 Oran B, Shpall E. Umbilical cord blood transplantation: a maturing technology[J]. Hematology Am Soc Hematol Educ Program, 2012 (1):215-222.
2 Wagner J, Eapen M, Carter S, et al. One-Unit versus Two-Unit Cord-Blood transplantation for hematologic cancers[J]. N Engl J Med, 2014, 371(18):1685-1694.
3 Majeti R, Park CY, Weissman IL. Identification of a hierarchy of multipotent hematopoietic progenitors in human cord blood[J]. Cell Stem Cell, 2007, 1(6):635-645.
4 Chen JY, Miyanishi M, Wang SK, et al. Hoxb5 marks longterm haematopoietic stem cells and reveals a homogenous perivascular niche[J]. Nature, 2016, 530(7589):223-227.
5 Ginsburg H, Sachs L. Formation of pure suspensions of mast cells in tissue culture by differentiation of lymphoid cells from the mouse thymus[J]. J Natl Cancer Inst, 1963,31:1-39.
6 Zsebo KM, Wypych J, Mcniece IK, et al. Identification,purification, and biological characterization of hematopoietic stem cell factor from Buffalo rat liver--conditioned medium [J]. Cell, 1990, 63(1):195-201.
7 Brannan CI, Lyman SD, Williams DE, et al. Steel-Dickie mutation encodes a c-kit ligand lacking transmembrane and cytoplasmic domains [J]. Proc Natl Acad Sci U S A, 1991,88(11):4671-4674.
8 Tarasova A, Haylock D, Winkler D. Principal signalling complexes in haematopoiesis: Structural aspects and mimetic discovery [J]. Cytokine Growth Factor Rev, 2011,22(4):231-253.
9 Gullo F, Van Der Garde M, Russo G, et al. Computational modeling of the expansion of human cord blood CD133+ hematopoietic stem/progenitor cells with different cytokine combinations [J]. Bioinformatics, 2015, 31(15):2514-2522.
10 Qian H, Buza-Vidas N, Hyland CD, et al. Critical role of thrombopoietin in maintaining adult quiescent hematopoietic stem cells [J]. Cell Stem Cell, 2007,1(6):671-684.
11 Yoshihara H, Arai F, Hosokawa K, et al. Thrombopoietin/ MPL signaling regulates hematopoietic stem cell quiescence and interaction with the osteoblastic niche [J]. Cell Stem Cell, 2007, 1(6):685-697.
12 Sasazawa Y, Sato N, Suzuki T, et al. C-mannosylation of thrombopoietin receptor (c-Mpl) regulates thrombopoietindependent JAK-STAT signaling [J]. Biochem Biophys Res Commun, 2015, 468(1/2):262-268.
13 Li F, Xu YY, Xu XX, et al. Fms-related tyrosine kinase 3 ligand promotes proliferation of placenta amnion and chorion mesenchymal stem cells in vitro [J]. Mol Med Rep,2014, 10(1):322-328.
14 Åhsberg J, Tsapogas P, Qian H, et al. Interleukin-7-induced Stat-5 acts in synergy with Flt-3 signaling to stimulate expansion of hematopoietic progenitor cells [J]. J BiolChem, 2010, 285(47):36275-36284.
15 Tsapogas P, Swee LK, Nusser A, et al. In vivo evidence for an instructive role of fms-like tyrosine kinase-3 (FLT3)ligand in hematopoietic development [J]. Haematologica,2014, 99(4):638-646.
16 Milner LA, Bigas A. Notch as a mediator of cell fate determination in hematopoiesis: evidence and speculation [J]. Blood, 1999, 93(8):2431-2448.
17 Mayani H. Notch signaling: from stem cell expansion to improving cord blood transplantation [J]. Expert Rev Hematol, 2010, 3(4):401-404.
18 Fan X, Gay FP, Lim FW, et al. Low-dose insulin-like growth factor binding proteins 1 and 2 and angiopoietinlike protein 3 coordinately stimulate ex vivo expansion of human umbilical cord blood hematopoietic stem cells as assayed in NOD/SCID gamma null mice[J]. Stem Cell Res Ther, 2014, 5(3):71.
19 Huynh H, Iizuka S, Kaba M, et al. Insulin-like growth factor-binding protein 2 secreted by a tumorigenic cell line supports ex vivo expansion of mouse hematopoietic stem cells [J]. Stem Cells, 2008, 26(6):1628-1635.
20 Nitsche A, Junghahn I, Thulke S, et al. Interleukin-3 promotes proliferation and differentiation of human hematopoietic stem cells but reduces their repopulation potential in NOD/SCID mice [J]. Stem Cells, 2003,21(2):236-244.
21 Huang X, Pierce LJ, Cobine PA, et al. Copper modulates the differentiation of mouse hematopoietic progenitor cells in culture [J]. Cell Transplant, 2009, 18(8):887-897.
22 Peled T, Mandel J, Goudsmid RN, et al. Pre-clinical development of cord blood-derived progenitor cell graft expanded ex vivo with cytokines and the polyamine Copper chelator tetraethylenepentamine [J]. Cytotherapy, 2004,6(4):344-355.
23 Milhem M, Mahmud N, Lavelle D, et al. Modifcation of hematopoietic stem cell fate by 5aza 2'deoxycytidine and trichostatin A [J]. Blood, 2004, 103(11):4102-4110.
24 Chen X, Skutt-Kakaria K, Davison J, et al. G9a/GLP-dependent histone H3K9me2 patterning during human hematopoietic stem cell lineage commitment [J]. Genes Dev, 2012, 26(22):2499-2511.
25 Tatetsu H, Wang F, Gao C, et al. SALL4 is a key factor in HDAC inhibitor mediated Ex vivo expansion of human peripheral blood mobilized stem/progenitor CD34+CD90+cells [J]. Blood, 2014, 124(21):1566-1566.
26 Peled T, Shoham H, Aschengrau D, et al. Nicotinamide,a SIRT1 inhibitor, inhibits differentiation and facilitates expansion of hematopoietic progenitor cells with enhanced bone marrow homing and engraftment [J]. Exp Hematol,2012, 40(4):342-55.e1.
27 Horwitz ME, Chao NJ, Rizzieri DA, et al. Umbilical cord blood expansion with nicotinamide provides longterm multilineage engraftment [J]. J Clin Invest, 2014,124(7):3121-3128.
28 Boitano AE, Wang J, Romeo R, et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells [J]. Science, 2010,329(5997):1345-1348.
29 Wagner JE, Brunstein CG, Mckenna DA, et al. Safety and exploratory efficacy of Ex vivo expanded umbilical cord blood (UCB) hematopoietic stem and progenitor cells (HSPC) using cytokines and Stem-Regenin 1 (SR1): interim results of a phase 1/2 dose escalation clinical study [J]. Blood, 2013, 122(21):698-698.
30 Wagner JE, Brunstein C, Mckenna D, et al. StemRegenin-1 (SR1) expansion culture abrogates the engraftment barrier associated with umbilical cord blood transplantation (UCBT) [J]. Blood, 2014, 124(21):728-728.
31 Fares I, Chagraoui J, Gareau Y, et al. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal [J]. Science, 2014, 345(6203):1509-1512.
32 Heinz N, Ehrnström B, Schambach A, et al. Comparison of different cytokine conditions reveals resveratrol as a new molecule for Ex vivo cultivation of cord Blood-Derived hematopoietic stem cells [J]. Stem Cells Transl Med, 2015,4(9):1064-1072.
33 Huang X, Lee MR, Cooper S, et al. Activation of OCT4 enhances ex vivo expansion of human cord blood hematopoietic stem and progenitor cells by regulating HOXB4 expression [J]. Leukemia, 2016, 30(1):144-153.
34 Sugimura R. Bioengineering hematopoietic stem cell niche toward regenerative medicine [J]. Adv Drug Deliv Rev,2016,99(Pt B):212-20.
35 Robinson SN, Simmons PJ, Yang H, et al. Mesenchymal stem cells in ex vivo cord blood expansion [J]. Best Pract Res Clin Haematol, 2011, 24(1):83-92.
36 Chu PP, Bari S, Fan XB, et al. Intercellular cytosolic transfer correlates with mesenchymal stromal cell rescue of umbilical cord blood cell viability during ex vivo expansion [J]. Cytotherapy, 2012, 14(9):1064-1079.
37 De Lima M, Mcniece I, Robinson SN, et al. Cord-blood engraftment with ex vivo mesenchymal-cell coculture [J]. N Engl J Med, 2012, 367(24):2305-2315.
38 Csaszar E, Kirouac DC, Yu M, et al. Rapid expansion ofhuman hematopoietic stem cells by automated control of inhibitory feedback signaling [J]. Cell Stem Cell, 2012,10(2):218-229.
39 Hosseinizand H, Ebrahimi M, Abdekhodaie MJ. Agitation increases expansion of cord blood hematopoietic cells and promotes their differentiation into myeloid lineage [J]. Cytotechnology, 2015 :1-10.
40 Eliasson P, Jönsson JI. The hematopoietic stem cell niche: low in Oxygen but a Nice place to be [J]. J Cell Physiol,2010, 222(1):17-22.
41 Jobin C, Cloutier M, Simard C, et al. Heterogeneity of in vitro-cultured CD34+ cells isolated from peripheral blood [J]. Cytotherapy, 2015, 17(10):1472-1484.
42 Jež M, Rožman P, Ivanović Z, et al. Concise review: the role of Oxygen in hematopoietic stem cell physiology [J]. J Cell Physiol, 2015, 230(9):1999-2005.
43 Aguila JR, Liao W, Yang J, et al. SALL4 is a robust stimulator for the expansion of hematopoietic stem cells [J]. Blood, 2011, 118(3):576-585.
44 Zhang XB, Beard BC, T RT, et al. H igh incidence of leukemia in large anim als after stem cell gene therapy with a HOXB4-expressing retroviral vector [J]. J Clin Invest,2008, 118(4):1350-1353.
45 Chen T, Zhang P, Fan W, et al. Co-transplantation with mesenchymal stem cells expressing a SDF-1/HOXB4 fusion protein markedly improves hematopoietic stem cell engraftment and hematogenesis in irradiated mice [J]. Am J Transl Res, 2014, 6(6):691-702.
46 De Lima M, Mcmannis J, Gee A, et al. Transplantation of ex vivo expanded cord blood cells using the Copper chelator tetraethylenepentamine: a phase I/II clinical trial [J]. Bone Marrow Transplant, 2008, 41(9):771-778.
47 Delaney C, Heimfeld S, Brashem-Stein C, et al. Notchmediated expansion of human cord blood progenitor cells capable of rapid myeloid reconstitution[J]. Nature medicine, 2010, 16(2): 232-236.
48 Cutler C, Multani P, Robbins D, et al. Prostaglandinmodulated umbilical cord blood hematopoietic stem cell transplantation [J]. Blood, 2013, 122(17):3074-3081.
49 Popat U, Mehta RS, Rezvani K, et al. Enforced fucosylation of cord blood hematopoietic cells accelerates neutrophil and platelet engraftment after transplantation [J]. Blood,2015, 125(19):2885-2892.
50 Wagner Jr. JE, Brunstein CG, Boitano AE, et al. Phase I/II trial of StemRegenin-1 expanded umbilical cord blood hematopoietic stem cells supports testing as a Stand-Alone graft [J]. Cell Stem Cell, 2016, 18(1):144-155.
51 Nikiforow S,Ritz J.Dramatic expansion of HSCs:new possibilities for HSCs transplants?[J].Cell Stem Cell,2016,18(1):10-12.
(本文编辑:李少婷)
Study progress of ex vivo expansion of human cord blood hematopoietic stem cell
Li Meng,Sheng Hongxia, Zhang Bin, Chen Hu. Department of Hematopoietic Stem Cell Transplantation,the 307 Hospital of Chinese People's Liberation Army, Beijing 100071, China.
Corresponding author:Zhang Bin, Email:zb307ctc@163.com; Chen Hu, Email:chenhu217@ aliyun.com
With the development of hematopoietic stem cell transplantation technology,umbilical cord blood has become one of the main sources of hematopoietic stem cells(HSC). Significant efforts have gone into developing technologies for ex vivo expansion of HSC in order to overcome the limited number of HSC. A variety of approaches for HSC ex vivo expansion are reviewed in the article, such as cytokine, small molecule compounds, aerobic environment, gene modification technique, co-culture and three-dimensional cell culture technology.
Hematopoietic stem cell; Gene amplification; Fetal blood
10.3877/cma.j.issn.2095-1221.2016.02.010
100071 北京,中国人民解放军三〇七医院造血干细胞移植科
张斌,Email:zb307ctc@163.com;陈虎,Email:chenhu217@aliyun.com
2016-01-19)
