玉竹多糖纯化工艺的优化研究
2016-09-14李新华孙步云沈阳农业大学食品学院辽宁沈阳110866
郑 爽,李新华,杨 强,孙步云(沈阳农业大学食品学院,辽宁沈阳110866)
玉竹多糖纯化工艺的优化研究
郑爽,李新华*,杨强,孙步云
(沈阳农业大学食品学院,辽宁沈阳110866)
选择合适的玉竹多糖脱蛋白方法进行单因素实验与正交实验,得出最优脱蛋白条件;在此基础上,对比不同类型的树脂对玉竹多糖的脱色效果,选出最适合玉竹多糖脱色的树脂类型及最优动态参数。实验结果表明酶法与sevag法联用为最佳的脱蛋白方法,在酶用量0.1 g,酶解温度40℃,酶解时间1 h,pH为5的条件下,玉竹多糖的脱蛋白效果最好,蛋白质脱除率为72.43%,多糖损失率为13.14%;对玉竹多糖脱色效果好的是大孔阴离子交换树脂脱色1号,上样浓度为4 mg/mL,上样速率为1 mL/min,上样量为2 BV条件下,玉竹多糖的脱色效果最好,脱色率达到80.65%,多糖保留率达到87.82%。
玉竹多糖,脱蛋白,脱色,多糖损失,树脂
玉竹[Polygonatum odoratum(Mill.)Druce]别名玉参、葳蕤、甜草根等,是百合科黄精属植物玉竹的干燥根茎是一种营养价值高的多年生草本药食两用植物,具有滋阴润燥、除烦祛暑、扩张冠脉、降血脂、降血压、改善心肌缺血[1]、降血糖[2]和增强免疫力[3]等功效。玉竹营养丰富[4],含有许多营养物质,如氨基酸、蛋白质、多糖、淀粉、黄酮、生物碱、苷类、甾醇、挥发油[5]以及多种微量元素,其中,多糖是玉竹根中最主要的成分。
现代药理实验研究证明,玉竹多糖生理活性显著,具有降血压、降血脂、改善心肌缺血等作用,对玉竹多糖结构及功能性的进一步深入研究有利于玉竹资源的合理利用。玉竹粗多糖的提取分离和纯化需要除去共存的蛋白、色素等杂质。目前,分离纯化有多种方法,选择和优化玉竹多糖分离、纯化方法及工艺参数是合理分析检测玉竹多糖生理功效的前提。大孔树脂是一类新型高分子聚合物,其具有脱色范围广、可重复利用、可洗脱等优点。现如今应用领域越来越广,尤其是在天然产物提取纯化方面。陈振兴等[6]利用D900树脂对巴戟天多糖进行了脱色工艺优化,获得了较好的脱色率以及较高的多糖保留率。目前,针对玉竹多糖进行大孔树脂脱色的优化实验还很少。
本文通过考察不同脱蛋白方法即sevag法、三氯乙酸法(TCA法)、酶法与sevag法联用等对玉竹多糖蛋白质脱除效果的影响,选择合适的方法进行单因素实验与正交实验,得出最优脱蛋白条件;在此基础上,对比不同的大孔吸附树脂和离子交换树脂对玉竹多糖的脱色效果,选出最适合玉竹多糖脱色树脂类型,进行树脂柱动态参数优化。
1 材料与方法
1.1材料与仪器
玉竹根辽宁省宽甸满族自治县;大孔树脂:D900、脱色1号、D001、D101、DA201、DM130、S8沧州宝恩吸附材料科技有限公司;牛血清白蛋白(生化试剂) 南京奥生化学技术有限公司;考马斯亮蓝G-250(Fluka)上海化学试剂公司;木瓜蛋白酶(pangbo enzyme) 10000 u/g,分析纯,国药集团化学试剂有限公司;氯仿、正丁醇、三氯乙酸、盐酸、乙醚、丙酮、硫酸、苯酚均为分析纯。
HZS-H型水浴振荡器哈尔滨市东联电子技术开发有限公司;JD200-2型电子天平北京赛多利斯仪器有限公司;HH-6数显恒温水浴锅国华电器有限公司;TDL-5-A型离心机上海安亭科学仪器厂;RE-52A旋转蒸发仪上海亚荣生化仪器厂;DZF-6050真空干燥箱上海精宏实验设备有限公司;XA-1型固体样品粉碎机河南省巩义市光压仪器厂;7200型分光光度计尤尼柯(上海)仪器有限公司;HZS-H型水浴振荡器哈尔滨市东联电子技术开发有限公司;DHL-A恒流泵上海青浦沪西仪器厂。
1.2实验方法
1.2.1玉竹多糖的制备玉竹根粉末(清洗、烘干粉碎)→热水提取(70℃)→离心取上清液(10000 r/min,10 min)→浓缩至原来体积的三分之一→加4倍体积乙醇沉淀12 h→丙酮、乙醚洗涤沉淀→干燥得玉竹粗多糖。
1.2.2多糖脱蛋白
1.2.2.1方法一[7]sevag法脱蛋白:1 mg/mL的玉竹多糖溶液50 mL,按体积的1/3加入有机溶剂(氯仿∶正丁醇=5∶1),混匀,剧烈振荡20 min,离心(10000 r/min、10 min)去除沉淀后,取上清液测定蛋白质及多糖的含量,反复进行至无蛋白层。
1.2.2.2方法二[7]盐酸法脱蛋白:取1 mg/mL的玉竹多糖溶液50 mL,逐滴加入1 mol/L的盐酸溶液调节pH为4,在低温下(4℃)放置12 h,离心(10000 r/min、10 min)去除沉淀后,取上清液测定蛋白质及多糖的含量,反复进行至无蛋白层。
1.2.2.3方法三[7]三氯乙酸法(TCA法):取1 mg/mL的玉竹多糖溶液50 mL,缓慢加入体积分数为5%的三氯乙酸溶液,混匀剧烈振荡,在低温下(4℃)放置12 h,离心(10000 r/min、10 min)去除沉淀后,取上清液测定蛋白质及多糖的含量,反复进行至无蛋白层。
1.2.2.4方法四酶法与sevag法联用脱蛋白:取一定体积的玉竹多糖溶液,在一定的pH下加入一定量的木瓜蛋白酶,在水浴振荡器中振荡酶解一定的时间,离心得上清液,加入有机溶剂(氯仿和正丁醇),混匀,剧烈振荡,离心去除沉淀后,反复进行至无蛋白层。
1.2.3酶法与sevag法联用脱蛋白的单因素实验主要因素有酶用量、酶解pH、酶解温度与酶解时间。
1.2.3.1酶用量对蛋白质脱除效果的影响酶的质量分别为0.017、0.025、0.050、0.100、0.150 g,pH为7,温度50℃,酶解1 h。
1.2.3.3酶解温度对蛋白质脱除效果的影响酶的用量为0.05 g,pH为7,温度(40、50、60、70、80℃),酶解1 h。
1.2.3.4pH对蛋白质脱除效果的影响酶的用量为0.05 g,pH分别为5、6、7、8、9,温度50℃,时间1 h。
1.2.4正交实验根据单因素实验进行正交实验。1.2.5多糖的标准曲线制作采用硫酸-苯酚法[8],得标准曲线回归方程为:A=14.16C-0.004,R2=0.9998。
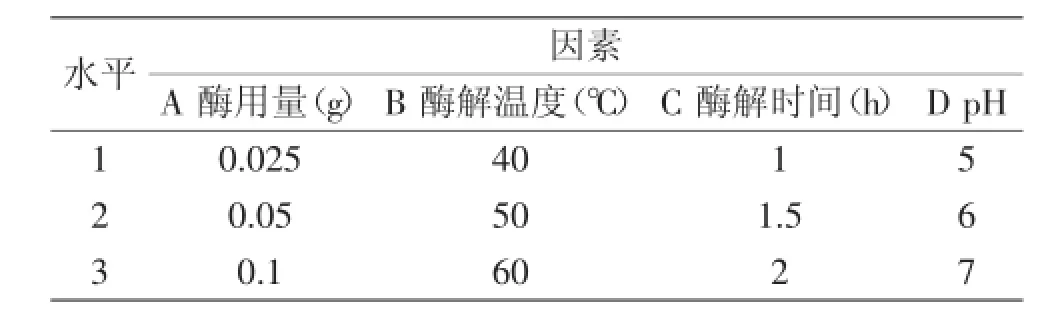
表1 实验因素水平表L9(34)Table 1 Factors and levels of L9(34)orthogonal test
牛血清白蛋白标准曲线的绘制:准确称取10 mg牛血清白蛋白,溶于蒸馏水中,定容至100 mL,配得标准蛋白溶液。精密量取标准蛋白溶液0、0.2、0.4、0.6、0.8、1.0 mL,各加水以补至1.0 mL,然后向每支试管中加入考马斯亮蓝G250蛋白试剂5 mL,迅速振荡摇匀,静置2 min后于595 nm处测定吸光度。以牛血清白蛋白浓度(C)为横坐标,吸光度(A)为纵坐标,进行线性回归,得标准曲线回归方程为:A=10.004C+ 0.0403,R2=0.995。
蛋白质脱除率的计算:
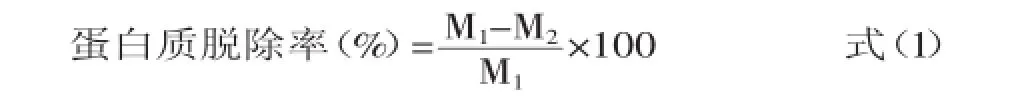
式中:M1为未脱蛋白溶液蛋白含量;M2为脱蛋白后溶液蛋白含量。
多糖损失率的计算:
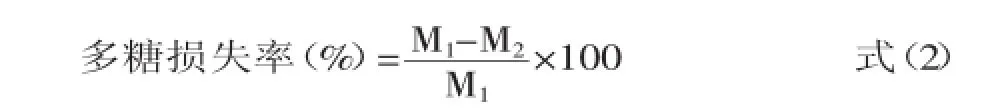
式中:M1为未脱色溶液多糖含量;M2为脱色后溶液多糖含量。
1.2.2 测量方法 由科研护士筛选患者,跟踪并发放问卷(放疗期间的第0、1、2、3、4、5、6 和第7 周及第 11 周分别发放问卷,(因为患者放疗周期一般为7周,因此第8、9、10周未予以每周测量,而是在放疗结束后1个月进行再次随访测量,也就是第11周)。讲解填写方法,填写有困难者由调查人员逐条询问记录完成。共接触患者127例,最后所有资料填写完整有效的为84例。
1.2.6树脂的预处理阳离子交换树脂→5%HCl浸泡10h→水洗,接近中性→5%NaOH浸泡10 h→水洗,接近中性→5%HCl浸泡10 h→水洗,接近中性;阴离子交换树脂(与阳离子交换树脂酸碱顺序相反);吸附树脂(同阳离子交换树脂,最后用无水乙醇浸泡10 h,清洗至无味)。
1.2.7静态吸附实验三角瓶中加入30 mL 20 mg/mL的玉竹多糖溶液,再分别加入1 g不同的处理好的大孔树脂,25℃恒温振荡脱色12 h。4000 r/min离心15 min后取上清液测定多糖的脱色率和多糖保留率,筛选出效果最好的树脂。
1.2.8动态吸附实验将处理好的树脂进行湿法装柱,体积为1 BV(20 mL),分别将不同浓度(1、2、3、4、5 mg/mL)的多糖溶液上样,上样量为(0.5、1.0、1.5、2.0、2.5 BV),上样速率为(1、2、3、4、5 mL/min),然后用2 BV的蒸馏水洗脱,收集合并多糖脱色液和洗脱液,分别测定脱色率和多糖保留率。
1.2.8.1上样浓度对多糖脱色效果的影响将1、2、3、4、5 mg/mL的多糖溶液上样,上样量为1BV,上样速率为1.0 mL/min。
1.2.8.2上样速率对多糖脱色效果的影响3 mg/mL的多糖溶液1 BV上样,上样速率分别设为1、2、3、4、5 mL/min。
1.2.8.3上样量对多糖脱色效果的影响3 mg/mL的多糖溶液上样,上样量分别为0.5、1.0、1.5、2.0、2.5 BV,上样速率为1.0 mL/min。
1.2.8.4脱色率的测定及计算方法[9-10]将待测多糖溶液分别在450、550、650 nm处测定吸光度。
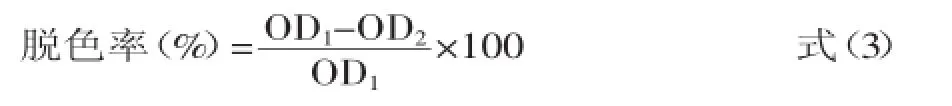
式中:OD1为脱色前溶液在450、550、650 nm处吸光度的总和;OD2为脱色后溶液在450、550、650 nm处吸光度的总和。
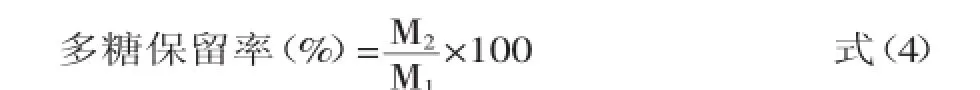
多糖保留率的计算:式中:M1为溶液脱色前的多糖含量;M2为溶液脱色后的多糖含量。
1.2.9数据处理方法Minitab单因素方差分析,对单因素不同水平的实验结果进行方差分析。
2 结果与分析
2.1不同脱蛋白方法的结果分析及比较

图1 不同脱蛋白方法的结果比较Fig.1 Comparison of the different deproteinization methods in polygonatum polysaccharides
从以上几种方法的脱蛋白效果来看,sevag法、盐酸法与三氯乙酸法均比酶法+sevag法联用的蛋白质脱除率高,但sevag法进行脱蛋白需要重复的次数多[11],多糖也会随着蛋白的除去而除去[12];三氯乙酸法中多糖的损失率较高,该法除蛋白反应较剧烈,易引起多糖降解[13]。经过对比可知,酶法+sevag法联用时多糖损失率较低,为22.16%,重复三次,蛋白质的脱除率也有所提高,为69.26%。
综合考虑各个脱蛋白方法的蛋白质脱除率与多糖损失率,可以看出在多糖损失率较低的情况下酶法+sevag法联用的蛋白质脱除率较高为69.26%。因此,对酶法+sevag法联用进行正交实验来确定脱蛋白的最优条件。
2.2酶法+sevag法联用参数优化
2.2.1单因素实验结果分析
2.2.1.1酶的用量对蛋白质脱除效果的影响由图2可以看出,当酶的用量在0.025~0.05 g之间蛋白质的脱除率较高,在0.05 g时为最大值67.6%,当大于0.05 g时蛋白质的脱除率逐渐下降,由于酶也是一种蛋白,当增加酶的用量时,也会增加待测溶液中蛋白的含量,因此蛋白质的脱除率低。当酶的用量为0.017 g时,由于酶的用量不够底物完全酶解,蛋白质脱除率小为19.8%。因此,综合考虑蛋白质的脱除率、酶量与节约成本方面,选择的酶的用量为0.025、0.05、0.1 g进行接下来的正交实验。
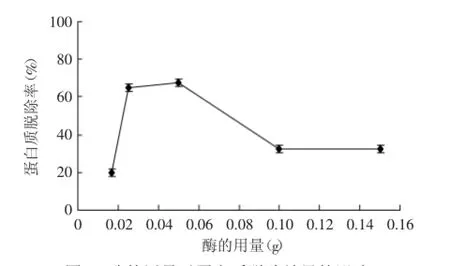
图2 酶的用量对蛋白质脱除效果的影响Fig.2 Effect of enzyme dosage on the protein removal rate
2.2.1.2酶解时间对蛋白质脱除效果的影响由图3可以看出,当酶解时间在1~2 h时,随着时间的增加,蛋白质脱除率不断增大;在2~3 h时,随着时间的增加,蛋白质脱除率减少。在2 h蛋白质脱除率达到最大为67.60%。而且随着酶解时间的延长也会增加能源消耗,增加成本。因此,选择进行正交实验的酶解时间为1、1.5、2 h。
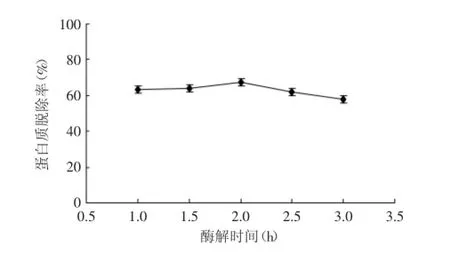
图3 酶解时间对蛋白质脱除效果的影响Fig.3 Effect of enzymolysis time on the protein removal rate
2.2.1.3酶解温度对蛋白质脱除效果的影响由图4可知,酶解温度在60℃时蛋白质的脱除率最高为70.1%。但随着温度继续升高,蛋白质的脱除率不断减小,是由于高温使蛋白酶的活性降低。由此可以看出温度对酶的活性有很大的影响,而且随着温度的升高,会增加成本。因此,进行正交实验选择的酶解温度为40、50、60℃。

图4 酶解温度对蛋白质脱除效果的影响Fig.4 Effect of enzymolysis temperature on the protein removal rate
2.2.1.4pH对蛋白质脱除效果的影响由图5可以看出,pH为5~6蛋白质的脱除率为63.7%~67.8%,当pH大于6时,随着pH的增加蛋白质的脱除率不断减小,这是由于碱性条件下木瓜蛋白酶的活性降低导致的。因此,正交实验选择的溶液pH为5、6、7。

图5 pH对蛋白质脱除效果的影响Fig.5 Effect of pH on the protein removal rate
2.2.2正交实验从表2极差(R)可知,以上4个因素对蛋白质脱除效果影响的主次关系:酶用量(A)>pH (D)>酶解时间(C)>酶解温度(B),最优组合为A3B1C1D1,即最优的脱蛋白条件为:酶用量0.1 g,酶解温度40℃,酶解时间1 h,pH为5,在此条件下,蛋白质脱除率为72.43%,多糖损失率为13.14%。
2.3不同树脂脱色效果的对比
由表3可知,从脱色率方面考虑,D900、脱色1号与S-8对玉竹多糖的脱色效果较好,均在60%左右,而且多糖保留率也在70%以上。但综合考虑,脱色1号的效果最好,在多糖保留率较高的基础上,达到较好的脱色效果。不同类型的树脂对色素、多糖的吸附效果各不相同。D900和脱色1号属于阴离子交换树脂,S-8属于极性树脂,因此推测玉竹多糖提取液中存在的色素可能以带负电荷的极性分子为主。但综合考虑,脱色1号的效果最好,在多糖保留率较高的基础上,达到较好的脱色效果。
2.4树脂柱动态操作参数优化
2.4.1上样速率对脱色效果的影响由图6可知,玉竹多糖溶液上样速率不同对脱色效果有一定的影响。随着上样速率的增加,脱色率呈现下降的趋势。这是由于速率越快,多糖溶液与树脂接触的时间越短,因而不够充分,脱色效果差。低速率有利于多糖溶液在通过树脂的过程中更充分地进行扩散作用,脱色效果更明显[14]。因此,上样速率选择较低的速率1 mL/min。

表2 正交实验结果表Table 2 Orthogonal array design and corresponding experimental results

表3 不同树脂对玉竹多糖脱色效果的比较Table 3 Comparison of decolorization efficiencies of differentresins on polygonatum polysaccharides
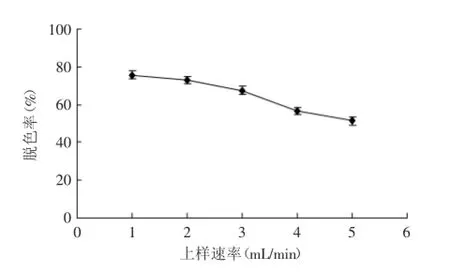
图6 上样速率对多糖脱色效果的影响Fig.6 Effect of the sample rate on decolorization of polysaccharide
2.4.2上样浓度对脱色效果的影响由图7可知,当上样浓度小于4 mg/mL时,随着上样浓度的不断增加,多糖液脱色率呈缓慢减小的趋势,但减小趋势缓慢。当多糖溶液浓度大于4 mg/mL时,脱色率小于50%。对以上数据进行单因素方差分析,可知,p≤0.01,有极显著差异;其次考虑到后续实验需要对多糖溶液进行浓缩,提高实验效率,因此在脱色率相差不大的情况下选择较高的上样浓度,选择比较合适的多糖溶液浓度为4 mg/mL。
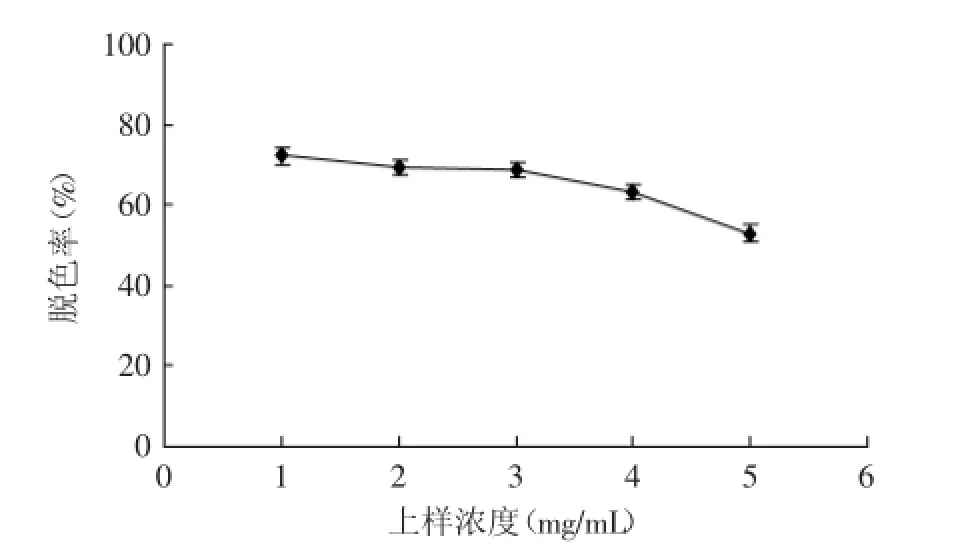
图7 上样浓度对多糖脱色效果的影响Fig.7 Effect of the sample concentration on decolorization of polysaccharide
2.4.3上样量对脱色效果的影响由图8可知,一定量的树脂的脱色能力有限,上样量越大,脱色效果就会越差。当上样量小于2 BV时,脱色率大小相差不多;当上样量大于2 BV时,脱色率呈现明显的下降趋势,这说明这一定质量的树脂的脱色能力达到了极限。因此,综合考虑脱色率和实验效率,选择上样量为2 BV。
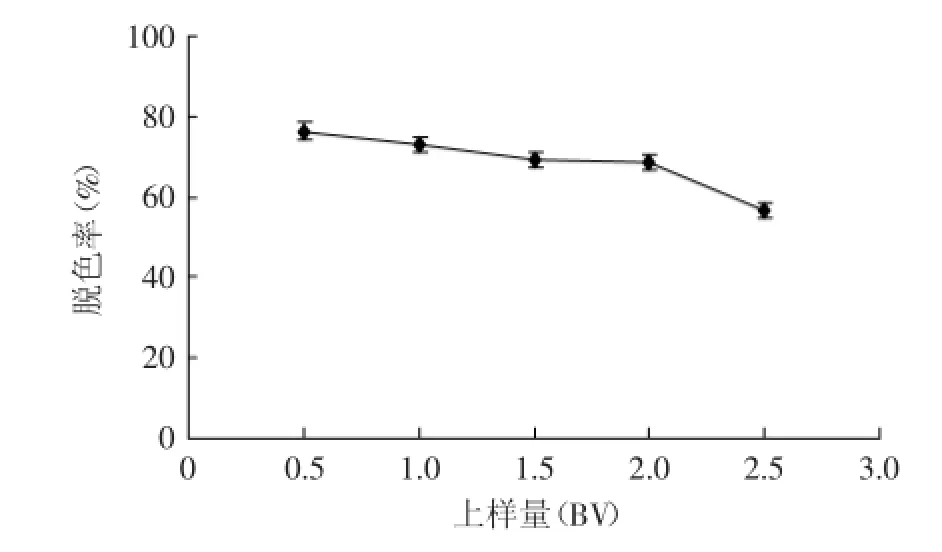
图8 上样量对多糖溶液脱色效果的影响Fig.8 Effect of the sampling amount on decolorization of polysaccharide
2.5最佳工艺验证
由静态吸附和动态吸附实验数据结果可知,脱色树脂为脱色1号,上样浓度为4 mg/mL,上样速率为1 mL/min,上样量为2 BV的条件下为最佳的脱色工艺,经过3次验证实验,计算脱色率和多糖保留率,结果脱色率为80.65%,多糖保留率为87.82%。
3 结论
酶法与sevag法联用为最佳的脱蛋白方法,在酶用量0.1 g,酶解温度40℃,酶解时间1 h,pH为5的条件下,玉竹多糖的脱蛋白效果最好,蛋白质脱除率为72.43%,多糖损失率为13.14%;对玉竹多糖脱色效果好的是大孔阴离子交换树脂脱色1号,上样浓度为4 mg/mL,上样速率为1 mL/min,上样量为2 BV时,脱色率达到80.65%,多糖保留率达到87.82%。
[1]刘塔斯.玉竹[M].北京:中国中医药出版社,2001:82.
[2]谢建军,王长松,胡蔓菁.玉竹多糖预处理对糖尿病大鼠胰岛β细胞损伤的影响[J].中国医院药学杂志,2010,30(14):200-1203.
[3]单颖,姜东,潘兴瑜,等.玉竹多糖对衰老模型鼠细胞及体液免疫功能的影响[J].中国临床康复,2006,10(19):146-148.
[4]江苏新医学院.中药大辞典[M].上海:上海人民出版社,1977:1156.
[5]竺平晖,陈爱萍.GC-MS法对湖南产玉竹挥发油成分的分析研究[J].中草药2010,41(8):1264-1265.
[6]陈振兴,陈地灵,林励,等.利用D-900树脂对巴戟天多糖脱色工艺进行优化[J].食品科学,2012,33(8):71-75.
[7]李艳辉,鲁巍巍,官艳丽,等.玉竹多糖脱蛋白方法的比较研究[J].时珍国医国药,2011,9:2127-2128.
[8]李新华,杨强,王琳.微波辅助提取银杏白果多糖的工艺研究[J].食品科技,2012,37(4):160-163
[9]杨强,李新华,林子木.银杏果多糖树脂脱色工艺[J].食品与发酵工业,2012,38(12):107-110.
[10]袁红波,张劲松,贾薇,等.利用大孔树脂对低分子量灵芝多糖脱色的研究[J].食品工业科技,2009,30(3):204-206.
[11]黄艳伟,张雪红,姚先超,等.剑麻果胶多糖脱蛋白方法研究[J].食品科技,2011,36(2):144-147.
[12]WANGXia,YUANYong,WANGKainai,etal. Deproteinization of gellan gum produced by Sphingomonas paucimobilis ATCC 31461[J].Journal of Biotechnology,2007,128(2):403-407.
[13]王传名,董祺,管从胜.日照绿茶粗多糖脱蛋白研究[J].食品工业科技,2010(8):274-276.
[14]刘海霞,牛鹏飞,王峰,等.大孔吸附树脂对大枣多糖提取液的脱色条件研究[J].食品与发酵工业,2007,33(10):180-184.
Optimization study on purification of polysaccharides in polygonatum odoratum
ZHENG Shuang,LI Xin-hua*,YANG Qiang,SUN Bu-yun
(Shenyang Agricultural University Food Institute,Shenyang 110866,China)
Single factor experiment and orthogonal experiment were undertaken to study the best deproteinization methods of polygonatum polysaccharides.On this basis,by contrasting the decolorizing effects of polygonatum polysaccharides of the different types of resin,choose the most suitable decolorization resin type and the optimal dynamic parameters.Enzymatic and sevag method combination was the best deproteinization.The results showed that the enzyme dosage of 0.1 g,enzymolysis temperature of 40℃,enzymolysis time of 1 h,solution pH of 5,the loss rate of polysaccharide was 13.14%and the protein removal rate was 72.43%.Under the conditions of using decolorization 1 resin,sample concentration 4 mg/mL,flow rate 1 mL/min,sample loading amount 2 BV,the decolorization rate of polygonatum polysaccharides was 80.65%,and the retention rate of the polysaccharides was 87.82%.
polygonatum polysaccharides;deproteinization;decoloration;polysaccharide losses;resin
TS201.1
B
1002-0306(2016)04-0322-05
10.13386/j.issn1002-0306.2016.04.056
2015-05-25
郑爽(1990-),女,硕士研究生,研究方向:粮油加工与转化,E-mail:zhengshuang_2013@163.com。
李新华(1955-),男,博士,教授,研究方向:粮油加工与转化,E-mail:lixh.syau@163.com。
