肉制品中羊源性成分微滴数字PCR法定量检测方法的研究
2016-09-14张秀平王永杰河南出入境检验检疫局检验检疫技术中心河南郑州450003河南检验检疫鉴定咨询中心河南郑州450003
苗 丽,张秀平,陈 静,李 轲,王永杰,白 杰(.河南出入境检验检疫局检验检疫技术中心,河南郑州450003;.河南检验检疫鉴定咨询中心,河南郑州450003)
肉制品中羊源性成分微滴数字PCR法定量检测方法的研究
苗丽1,张秀平2,陈静2,李轲2,王永杰2,白杰2
(1.河南出入境检验检疫局检验检疫技术中心,河南郑州450003;2.河南检验检疫鉴定咨询中心,河南郑州450003)
为准确定量肉及肉制品中羊源性成分的含量,建立了微滴数字PCR定量检测系统。结果显示在一定范围内羊肉质量与DNA含量、DNA含量与DNA拷贝数之间均呈现明显的线性关系,选择DNA含量作为中间换算值,计算出羊肉的质量与拷贝数之间的关系为M羊=0.03C+0.69。应用建立的微滴数字PCR定量检测方法对已知质量分数的羊肉模拟混合样品进行检测,发现无论在两两混合还是多肉样混合的情况下,其含量偏差最大为1.52%,具有较强的抗干扰能力。通过对市售样品的检测,显示该方法能够准确检测出不同样品中羊肉的含量,并发现可能存在掺假现象,说明该检测方法具有良好的市场应用前景。本实验建立的微滴数字PCR定量方法在肉及肉制品中羊源性成分检测方面具有较大的应用潜力,为肉制品日常检测及是否掺假提供有力的科学依据。
微滴数字PCR,定量,羊源成分,掺杂
随着我国经济的快速发展,消费者对食品质量与安全的要求也越来越高。疯牛病、马肉风波等食品安全事件的出现以及宗教、健康和市场监管等方面的原因,都急需一种快速、准确的检测方法对肉制品中所含肉源的成分及含量进行分析[1]。
近几年,我国的食品卫生面貌虽有了很大改观,但也有一些不法商贩不执行食品卫生法,在食品中掺假掺杂,用廉价肉代替价格较高的羊肉、牛肉等进行销售,严重损害了消费者的利益[2]。因此,当务之急是建立有效、快速、定量检测食品中肉源成分的检测方法,为质检部门提供可靠的检验依据。
在所有检测动物源性成分的技术中,发展较为完善、灵敏度及准确度都相对较好的技术手段是PCR技术[2-3]。研究者根据不同物种基因序列的差异,设计特异性引物进行PCR扩增,从而对物种进行鉴定或定量分析[4]。但在目前的国家标准、行业标准或是文献报道中,使用的检测方法多是定性检测肉或肉制品中某种动物源性成分,不能定量的检测样品中所含有的肉源成分的含量[5-6],特别是在一些掺杂使假案件的处理中,如何判定是故意掺假还是生产、取样过程中污染所致都需要有可靠的定量技术作为依托。
微滴式数字PCR技术,是将样本通过微滴发生器进行微滴化处理,生成约20000个微滴后进行PCR反应。PCR反应结束后,使用微滴检测器对每个微滴逐个检测,最终经分析软件计算出DNA分子的浓度(copies/μL)。本方法无需依靠标准曲线或参照基因,可直接得出DNA拷贝数,是对起始样品的绝对定量[7]。因此该技术广泛应用于物种鉴定[8]、病原检测[9]、转基因[10-11]及肉源成分检测[12-13]及基因表达分析[14]等,具有广阔的应用前景。
Morisset等[10]运用数字PCR技术准确定量转基因中靶基因的拷贝数,并在低浓度时较qPCR具有较好的重复性和准确性。朱鹏宇等[13]利用微滴数字PCR检测食品或饲料样品,但是没有建立具体的定量检测方法。本研究运用微滴式数字PCR技术,以DNA含量为中间换算单位,摸索羊肉的质量与DNA含量的关系,以及DNA含量与拷贝数之间的关系,以期建立定量检测肉制品中羊肉的含量,为质检部门定量检测肉源成分提供有力科学依据。
1 材料与方法
1.1材料与仪器
生鲜羊肉、牛肉、猪肉、鸭肉和鸡肉等肉样,羊肉卷、小肥羊、羊肉串等羊肉制品购自郑州某农贸市场;蛋白酶K(20 mg/mL) 购自TAKARA公司;Tris-饱和酚购自索莱宝生物科技有限公司;组织裂解液(1 mol/L Tris-HCL、0.5 mol/L EDTA、10%SDS)、3 mol/L醋酸钠、氯仿/异戊醇(24∶1)均为自配试剂;羊源性引物和探针由上海生物工程技术有限公司合成。
Bio-Rad QX200 ddPCR微滴生成仪美国Bio-Rad公司;HermLe Z36HK高速冷冻离心机HERMLE;DT500电子天平江苏常熟长青仪器厂;BioSpecnano微量核酸蛋白仪岛津企业管理(中国)有限公司;NTS-4000AM恒温振荡水槽Tokyo Tikakikai;Senso Quest LabCycler梯度PCR仪德国Senso公司。
1.2实验方法
1.2.1肉样制备取新鲜肉样的肌肉组织,绞碎后于烤箱中80℃烘干72 h,于组织匀浆机中进行匀质处理,作为实验的标准品[12],并用于制作模拟混合样品,匀质过程中不同肉类分开处理,防止不同动物组织粉末交叉污染。
1.2.2DNA提取采用苯酚/氯仿法提取基因组DNA[12]。向样品中加入700 μL组织裂解液和20 μL蛋白酶K(20 mg/mL),涡旋振荡混匀于56℃水浴2 h,取上清用于苯酚/氯仿核酸提取,最后加入100 μL ddH2O溶解DNA,采用核酸定量仪测定提取肉样的DNA含量,确保提取DNA的OD260/OD280比值在1.8~2.0之间,于-20℃保存备用。1.2.3微滴式数字PCR检测样品中羊源性成分羊源性成分的引物和探针序列参考René Köppel[3]合成,ovine-F:CCAACATGCCTTTAAACCCTCA,ovine-R:GGAACTGTAGCCTTCTGACTCG,ovine-Probe:5’-FAM-TGCCTTTCCTTCCCCGCCAGT CTC-BHQ-3’。
微滴式数字PCR反应体系为:ddPCRTM Supermix for Probes(No dUTP)10 μL,上下游引物各1.8 μL (900 nmol/L),探针0.5 μL(250 nmol/L),DNA模板4 μL,用双蒸水补齐至20 μL。通过微滴发生器进行微滴化处理,生成约20000个微滴后进行PCR反应。PCR反应条件:95℃10 min;94℃30 s,60℃1 min,98℃10 min,40个循环。最后用微滴分析器对微滴进行分析。
为更好地保护中国投资者的海外投资利益,且鉴于公司国籍国实施外交保护的权威性,中国宜采取的方案是:将“一国对由于损害的原因按照公司国籍国法律终止存在的公司在合理期限内未能提供外交保护”的情形,纳入股东国籍国实施外交保护的范围。
1.2.4羊肉的质量与拷贝数换算公式的确定
1.2.4.1羊肉的质量与DNA含量的关系分别称量10个质量梯度的羊肉(质量依次为5、10、15、20、25、30、35、40、45、50 mg)样品,提取基因组DNA,运用核酸定量测定仪测定DNA含量。每个梯度重复3次。
1.2.4.2羊肉的DNA含量与拷贝数的关系将提取的羊肉样品的DNA进行系列稀释,以10个浓度梯度的DNA含量(含量依次为25、50、75、100、125、150、175、200、225、250 ng/μL)进行微滴数字PCR的检测。每个梯度重复3次。
1.2.5模拟混合肉样的检测为验证所建微滴数字PCR方法的准确性以及多种肉样混合时的抗干扰能力,以总质量为50 mg,在羊肉样品最低含量(10%)时添加不同质量分数的其他肉种,制成多肉样混合样品。按1.2.2的方法提取混合肉样DNA,进行10倍稀释后,取4 μL进行微滴数字PCR检测。
1.2.6市售样品的检测分别从某市场中购买羊肉和羊肉制品(羊肉卷、孜然羊肉、小肥牛、羊肉串等),用建立的微滴数字PCR定量方法对其羊源性成分的质量进行分析,进一步验证所建方法的准确性和实际应用能力。
1.2.7数据分析所有结果采用SPSS 17.0软件进行统计学分析,利用Excel进行图表编辑。
2 结果与分析
2.1羊源性引物和探针特异性
为验证本实验选用的羊源性引物和探针的特异性,选择常见猪、牛、鸡、鸭肉的DNA模板进行数字PCR检测,以水为空白对照,结果显示选取的引物和探针对其他肉样均无交叉反应(图1),表明引物和探针的特异性良好,能够用于羊肉含量的检测。

图1 羊源性引物和探针体系的特异性检测Fig.1 The specificity detections of ovine primer-probe system
为摸索不同羊肉质量与提取DNA含量的关系,提取不同质量梯度(质量依次从5~50 mg)样品的DNA,运用核酸定量测定仪检测提取肉样的DNA含量。通过3次批间重复,结果显示羊肉的质量与其所测定的DNA含量之间有明显的线性关系,相关系数R2为0.9992(图2)。表明羊肉的质量在5~50 mg范围内与DNA含量有明显的线性关系。

图2 羊肉的质量与DNA含量的关系Fig.2 Linear relationship between meat quantity and nucleic acid content of ovine
2.3DNA含量与拷贝数的关系
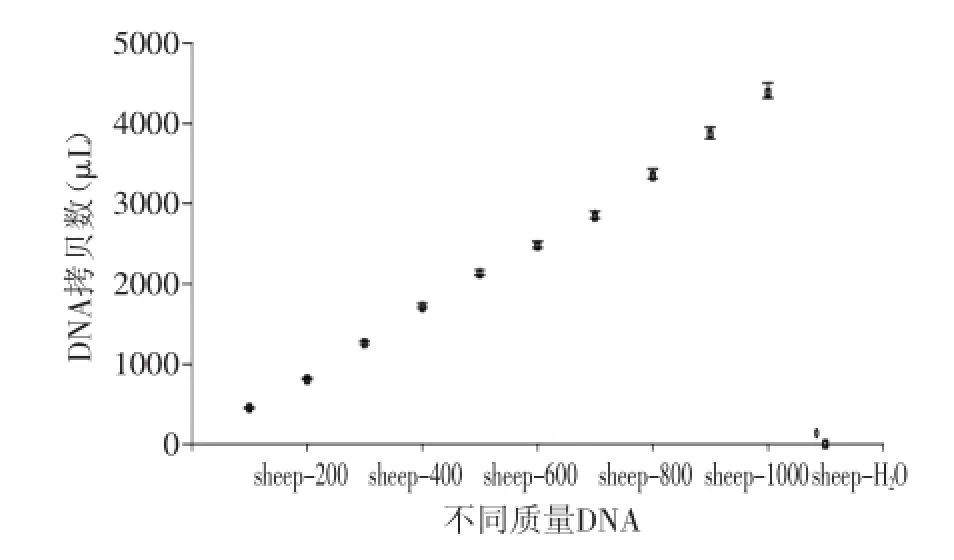
图3 不同含量DNA所测得的拷贝数Fig.3 The DNA copy number of ovine at different nucleic acid content
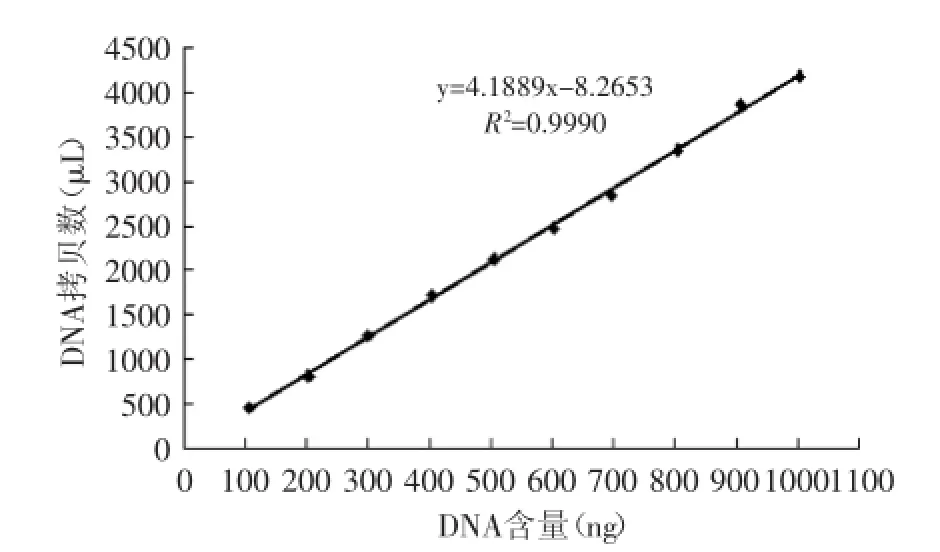
图4 羊肉DNA含量与拷贝数的关系Fig.4 Linear relationship between nucleic acid content and the DNA copy number of ovine
为摸索羊肉DNA含量与拷贝数之间的关系,在数字PCR检测最高核酸浓度范围内,将提取的羊肉DNA进行10个梯度的系列稀释(25~250 ng/μL),取4 μL模板进行微滴数字PCR的检测,以水为空白对照。结果显示每个样品的微滴生成均在15000个以上,满足了绝对定量的要求,且生成的拷贝数随着DNA含量的增加而增加(图3),两者之间有明显的线性关系,相关系数R2为0.9990(图4)。表明核酸的含量在25~250 ng/μL范围内与拷贝数呈明显的线性关性。
2.4羊肉质量与拷贝数关系的确定
根据羊肉的质量与DNA含量之间的线性关系,及DNA含量与拷贝数之间的线性关系,选择DNA含量作为中间换算值,得出羊肉的质量与拷贝数之间的关系为M羊=0.03C+0.69,其中,C指每微升的拷贝数(copies/μL),M羊指肉样的质量(mg)。
2.5已知质量混合肉样的微滴数字PCR抗干扰实验
为验证所建方法的准确性,分别对已知质量的混合样品提取DNA,进行10倍稀释后,取4 μL进行数字PCR检测,将测得的拷贝数值代入肉样质量与拷贝数关系式中计算原始肉样质量。结果显示羊肉的含量在5 mg时,单独与鸭肉、鸡肉、猪肉和牛肉混合时测得的值分别是5.208、5.025、5.265、5.37 mg,与真实值基本一致。且随着混合肉样种类的增加,不同混合肉样之间虽有一定的误差,但是其含量偏差最大为1.52%,显示该方法在混合肉样中基本不受外源肉样的干扰(表1),表明所建立的微滴数字PCR方法可以应用于不同肉制品中羊源成分的定量检测。
2.6市售样品的检测
市售样品复杂多样,含有多种成分,而DNA的提取过程往往会受到多种因素如组织成分、样品处理方式等的影响,会使得测得的肉产品的质量不能反应真实值。因此,为检测本研究建立的微滴数字PCR定量方法的市场应用能力,针对目标成分选取含有羊源成分的食品进行检测。结果如表2所示,不同的羊肉制品均检出羊源性成分,并且对其含量进行了初步的定量。其中,羊肉串样品测得的羊源成分较低,而商品配料成分仅显示羊肉及食品添加剂如食盐、香精及孜然粉,故其含量低怀疑可能添加其他肉代替羊肉,结果有待进一步验证。通过一系列的市售食品的定量检测,验证了建立的羊源性成分微滴数字定量PCR检测体系的实际应用能力,可以定量分析市售羊肉制品中羊肉的含量,具有较高的实际应用能力。

表1 已知质量分数的模拟混合肉样的数字PCR定量分析Table 1 The results of quantification PCR samples with known concentrations

表2 市售样品的数字PCR定量分析Table 2 The results of quantification PCR samples from the local supermarket
3 结论与讨论
微滴数字PCR由于其高度的准确性和稳定性,通过对阳性微滴进行分析,确定DNA的拷贝数,可以直接对样品进行定量,在肉源成分检测方面已经取得一定的成绩[8-12]。
本研究建立的检测肉制品中羊源性成分微滴数字PCR定量检测方法,通过建立标准曲线获得羊肉质量与拷贝数之间的关系为M羊=0.03C+0.69,因此,可以通过检测样品的拷贝数,直接计算出肉制品中羊源性成分的含量。对模拟混合肉样的检测发现无论在两两混合还是多肉样混合的情况下,其含量偏差最大为1.52%,说明本方法具有较强的抗干扰能力。在对肉及肉制品的检测中,样品中的成分往往是多种多样的,因此本研究对多种市售羊肉样品进行检测,结果表明本方法不但能够检测出不同样品中羊肉含量,而且还发现市售样品存在一定的掺假现象,说明该检测方法能够用于日常肉制品中羊源性成分含量的检测。本实验建立的微滴数字PCR定量方法在肉及肉制品中羊源性成分检测方面具有较大的应用潜力,为肉制品日常检测及是否掺假提供有力的科学依据,是防止商家掺假牟利的有效手段。
本研究方法仅限于对羊源性成分含量的检测,而市售的掺假肉制品往往不只含有一种肉源成分[15],单一检测某种肉样成分的定量检测体系不能准确检测出每种肉源成分的含量,存在一定的局限性,不能满足市场中多肉样定量检测的需求,因此建立多重肉源成分数字PCR定量检测方法,达到一检多得的目的是今后研究的方向。
综上所述,本研究建立的羊源性微滴数字PCR定量检测体系特异性强、灵敏度高、抗干扰能力强,能够用于肉及肉制品中羊源性成分含量检测,为质监部门提供有力的科学依据,是防止商家掺假牟利的有效手段。
[1]Lopez C I,Gonzalez I,Fajardo.Quantitative detection of goats’milk in sheep’s milk by real-time PCR[J].Food Control,2007,8(11):1466-1473.
[2]赵新,王勇,兰青阔,等.荧光定量PCR方法鉴别肉制品中羊源性成分[J].食品工业科技,2015,36(1):299-302.
[3]Koppel R,Jurg R.Multiplex real-time PCR for the detection and quantification of DNA from beef,pork,horse and sheep[J]. European Food Research and Technology,2011,232(6):151-155.
[4]高琳,徐幸莲,周光宏.PCR技术用于食品中原料肉物种鉴别的研究进展[J].肉类研究,2006,20(10):19-21.
[5]Ali M E,Hashim U,Mustafa S,et al.Analysis of pork adulteration in commercial meatballs targeting porcine-specific mitochondrial cytochrome b gene by TaqMan probe real-time polymerase chain reaction[J].Meat Science,2012,91(4):454-459.
[6]Calvo J H,Osta R,Zaragoza P.Quantitative PCR detection of pork in raw and heated ground beef and pate[J].Journal of Agricultural and Food Chemistry,2002,50(19):5265-5267.
[7]Sanders R,Huggett J F,Bushell C A,et al.Evaluation of digitalPCRforabsoluteDNAquantification[J].Analytical Chemistry,2011,83:6474-6484.
[8]胡伟,陈荣华,张晨,等.微滴式数字PCR技术用于生物样品种属鉴定和绝对定量[J].法医学杂志,2014,30(5):342-345.
[9]董莲华,张玲,姜君,等.大肠杆菌O157∶H7微滴数字PCR定量方法的建立[J].分析化学,2015,43(3):319-324.
[10]Morisset D,Stebih D,Milavec M,et al.Quantitative analysis of food and feed samples with droplet digital PCR[J].Plos One,2013,8(5):1-9.
[11]姜羽,胡佳莹,杨立桃.利用微滴数字PCR分析转基因生物外源基因拷贝数[J].农业生物技术学报,2014,22(10):1298-1305.
[12]Cai Y C,Li X,Lv R,et al.Quantitative analysis of pork and chicken products by droplet digital PCR[J].Bioed Research International,2014,8:1-6.
[13]朱鹏宇.利用微滴数字PCR定量检测食品或饲料样品[J].农业生物技术学报,2013,12:1-6.
[14]Brunetto G S,Massoud R,Leibovitch E C,et al.Digital droplet PCR(ddPCR)for the precise quantification of human T-lymphotropic virus 1 proviral loads in peripheral blood and cerebrospinal fluid of HAM/TSP patients and identification of viralmutations[J].Journal of Neurovirology,2014,20(4):341-351.
[15]王建昌,王金风,陈瑞春,等.鸭肉冒充牛羊肉的分子生物学检测[J].肉类研究,2012,26(6):20-23.
Development of quantitative analysis of ovine products by droplet digital PCR
MIAO Li1,ZHANG Xiu-ping2,CHEN Jing2,LI Ke2,WANG Yong-jie2,BAI Jie2
(1.Central Quarantine Laboratory of Henan Entry-Exit Inspection and Quarantine Bureau,Zhengzhou 450003,China;2.Identification Consulting Center of Henan Inspection and Quarantine,Zhengzhou 450003,China)
A quantitative method based on the droplet digital polymerase chain reaction(ddPCR)technique was developed to determine the weight of ovine in meat products.By using the ddPCR method,the relationships between the meat weight and DNA weight and between the DNA weight and DNA copy number were both close to linear within the dynamic range.The DNA weight was utilized as an intermediate value to establish the following formulae for calculating the original meat weight from the DNA copy number:Movine=0.03C+0.69.By examining the mixed meat samples of known composition,the final quantitative results were similar to the true meat weights,and the maximum content deviation was 1.52%.Analysis of commercial samples showed that ddPCR quantification system could determine the proportion and quantification of ovine and had a good practicability.Quantitative analysis indicated that ddPCR was highly precise in quantifying ovine in meat products and had the potential to be used in routine analysis and quality meat adulteration of various species.
droplet digital polymerase chain reaction;quantification;ovine products;adulteration
TS251
A
1002-0306(2016)04-0073-04
10.13386/j.issn1002-0306.2016.04.005
2015-07-28
苗丽(1971-),女,硕士,高级兽医师,研究方向:分子生物学及食品微生物学。
国家质检总局科技计划项目(2014IK089)。
