酶解-柠檬酸提取塔罗科血橙皮中的果胶及理化性质研究
2016-09-14阮尚全程晓琴汪建红内江师范学院化学化工学院四川内江6499四川省高等学校果类废弃物资源化重点实验室四川内江6499四川恒通动物制药有限公司四川内江64000
阮尚全,程晓琴,夏 旭,陈 婷,汪建红(.内江师范学院,化学化工学院,四川内江6499;2.四川省高等学校果类废弃物资源化重点实验室,四川内江6499;3.四川恒通动物制药有限公司,四川内江64000)
酶解-柠檬酸提取塔罗科血橙皮中的果胶及理化性质研究
阮尚全1,2,程晓琴1,3,夏旭1,陈婷1,汪建红1,2
(1.内江师范学院,化学化工学院,四川内江641199;
2.四川省高等学校果类废弃物资源化重点实验室,四川内江641199;
3.四川恒通动物制药有限公司,四川内江641000)
利用Design-Expert 8.05软件,建立了以纤维素酶酶解-柠檬酸提取塔罗科血橙皮中果胶的实验模型。最佳提取工艺条件为:提取温度90℃、时间30 min、pH2,验证实验得到果胶产率为29.447%,与果胶模型预测值29.928%的相对误差为1.6%。果胶产品酯化度为67.84%、含水率为7.66%、半乳糖醛酸含量为75.8%、总灰分为3.83%、酸不溶性灰分为0.1%、pH为3.10。本文为提高血橙的综合价值提供了理论依据和实验方法。
血橙皮,果胶,柠檬酸,理化性质
膳食纤维素分为水溶性和水不溶性膳食纤维,被称为人体的第七大营养素,对人类健康具有重要作用[1]。果胶为与纤维素和半纤维素交联在一起,是主要存在于植物细胞中的水溶性膳食纤维,按酯化程度不同分为高酯果胶和低脂果胶,在各领域中应用十分广泛[2-7]。目前,利用柑橘副产物制备膳食纤维主要为水溶性果胶,获得的方法分为酸提取、碱提取、微生物发酵、酶法或辅以其他技术如微波技术、超声波技术、离子交换树脂等,分离主要为醇沉法、盐析法、膜分离法等,提取一般都在较低的pH下进行,传统的工业生产中常以无机酸调节酸度[8-9]。纤维素酶因能降解纤维素,改变细胞壁的通透性,缩短内容物溶出的时间,在提高内容物的产率和质量方面,表现出了良好的应用潜力[10]。柠檬酸则为食品、医药、日化等行业大量使用的天然果酸,其羟三羧酸类结构是一种优良的络合剂,可以络合金属离子,解除金属离子对果胶的封闭,对提高果胶产率和品质具有良好的影响,且目前废液中的柠檬酸能有效的回收处理[11-13]。我国柑橘皮渣年产量在1000万t以上,皮渣中果胶含量为20%~30%,是目前国内提取商品化果胶的主要原料之一[14-15]。塔罗科血橙是唯一含花青素的橙类水果,仅四川省资中县栽植已超过0.69万hm2,年均产量超过20万吨,果汁加工超过10万吨,生产中产生的万吨级皮渣得不到有效利用,其生物利用研究还处于初级阶段,仅有少量研究报道[16-20]。本文综合纤维素酶及柠檬酸的特性,建立酶解-柠檬酸提取塔罗科血橙皮中的果胶的数学模型,符合绿色化学理念,对产品的理化性质进行初步测定,为更好地综合利用塔罗科血橙副产物提供新的实验依据和方法。
1 材料与方法
1.1材料与仪器
塔罗科血橙四川资中生产基地;纤维素酶(1.1万U/g)四川山野生物科技有限公司;柠檬酸(AR) 成都金山化学试剂有限公司;乙醇(AR) 成都金山化学试剂有限公司。
DFT-100粉碎机浙江温岭市林大机械有限公司;AE240电子天平梅特勒-托利多中国有限公司;实验室pH计奥豪斯仪器(上海)有限公司;恒温水浴振荡器上海玺袁科学仪器有限公司;TDL-5-A低速离心机上海安亭科学仪器厂;RE-2000B旋转蒸发仪上海亚荣生化仪器厂;DZF-6090真空干燥箱上海精宏实验设备有限公司。
1.2实验方法
1.2.1提取工艺实验用塔罗科血橙洗净取皮,沸水灭酶5 min,水洗3~4次去色素和糖分,50℃烘干粉碎备用。准确称取血橙皮粉2.000 g于提取瓶中,加入蒸馏水及纤维素酶,于一定酶活温度及pH下酶解,再以柠檬酸调节酸度,一定温度下水浴振荡提取,在4000 r/min下离心分离10 min,并洗涤残渣2次,滤液合并后浓缩,加入浓缩液1.5倍的无水乙醇醇析果胶、过滤,以50%乙醇洗涤2~3次,产物于50℃烘干称重,计算果胶产率。

1.2.2单因素实验在料液自然pH下酶解,以料液比为1∶40、酶用量为0.7 mg/mL、酶解时间为45 min、酶解温度为40℃、提取温度为90℃、提取时间为20 min、提取pH为2作基础条件。考查料液比为1∶20、1∶30、1∶40、1∶50、1∶60,酶用量为0.0、0.1、0.3、0.5、0.7、0.9 mg/mL,酶解时间为15、30、45、60、75 min,酶解温度为30、35、40、45、50℃,提取时间为15、20、25、30、35 min,提取温度为80、85、90、95、100℃,提取pH为1.0、1.5、2.0、2.5、3.0、3.5时对果胶产率的影响。
1.2.3响应面实验设计实验测得料液体系自然pH约为4.6。鉴于纤维素酶最佳活性pH为4~6、温度为40~60℃,果胶的提取需要较高的温度和酸度,当提取pH大于3.0时,果胶易发生酯的皂化反应和β-消除反应,对产率影响大。所以,采用原料在温和条件下预酶解后,重点考查柠檬酸提取实验条件对果胶产率的影响,响应面实验因素水平及编码见表1。

表1 响应面实验设计因素水平及编码Table 1 Factors,levels and codes of RSM design
1.2.4产品理化性质的测定果胶含水率参考GB5009.3-2010直接干燥法测定;总半乳糖醛酸含量参考GB25533-2010方法测定,并计算酯化度;总灰分、pH参考QB2484-2000测定;酸不溶灰分参照GB5009.4-2010测定。
2 结果与讨论
2.1单因素实验
2.1.1料液比对果胶产率的影响按照“1.2.2单因素实验”,改变料液比为1∶20、1∶30、1∶40、1∶50、1∶60进行实验,结果见图1。
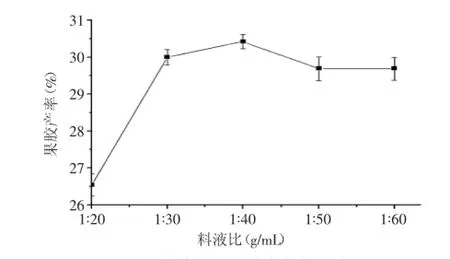
图1 料液比对果胶产率的影响Fig.1 Effect of material-liquid ratio on the pectin extraction yield
由图1可知,最初果胶产率随着提取溶剂用量增大而增加,料液比1∶40时提取效果最佳,之后随着提取溶剂用量增大而减小。因果胶析出与降解为动态过程,溶剂量少,果胶分子在粘度大的体系体系中扩散速度慢,且不易搅拌,增加分离难度且果胶易损失。但溶剂量过大时,会增加低分量和高酯化度果胶的溶解度而在过滤洗涤中损失,至果胶产率降低。
2.1.2酶用量对果胶产率的影响按照“1.2.2单因素实验”,改变酶用量为0.0、0.1、0.3、0.5、0.7、0.9 mg/mL进行实验,结果见图2。

图2 酶用量对血橙皮果胶产率的影响Fig.2 Effect of the amount of cellulase on the extraction yield of pectin
由图2可知,加酶对果胶产率影响明显,当酶量为0.7 mg/mL时果胶产率最大,酶量小于0.7 mg/mL时,果胶产率随着酶用量增大而增大。当酶用量大于0.7 mg/mL时,果胶的产率随着酶用量的增大而减小。纤维素酶系中包括内切葡聚糖酶(C1酶)、外切葡聚糖酶(Cx酶)以及β-葡聚糖酶等,之所以加酶过大使果胶产率降低,原因可能是实验用酶不纯(工业级),其中外切葡聚糖酶和β-葡聚糖酶等共同作用使果胶分子降解生成小分子量物质而损失。
2.1.3酶解时间对果胶产率的影响按照“1.2.2单因素实验”,改变酶解时间为15、30、45、60、75 min进行实验,结果见图3。
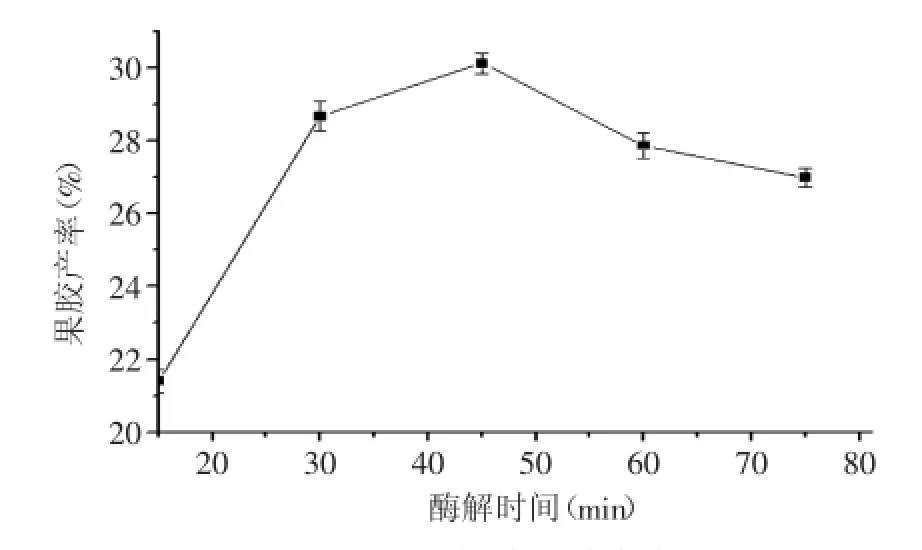
图3 酶解时间对血橙皮果胶产率的影响Fig.3 Effect of time on the pectin extraction yield
由图3可知:45 min为最佳酶解时间,在45 min之前,随着时间增加果胶溶出增加,在45 min之后果胶产率呈逐渐降低的趋势,这可能是当果胶溶出到一定程度时,酶系中外切葡聚糖酶与β-葡聚糖酶等对果胶的降解致果胶产率下降。
2.1.4酶解温度对果胶产率的影响按照“1.2.2单因素实验”,改变酶解温度为30、35、40、45、50℃进行实验,结果见图4。
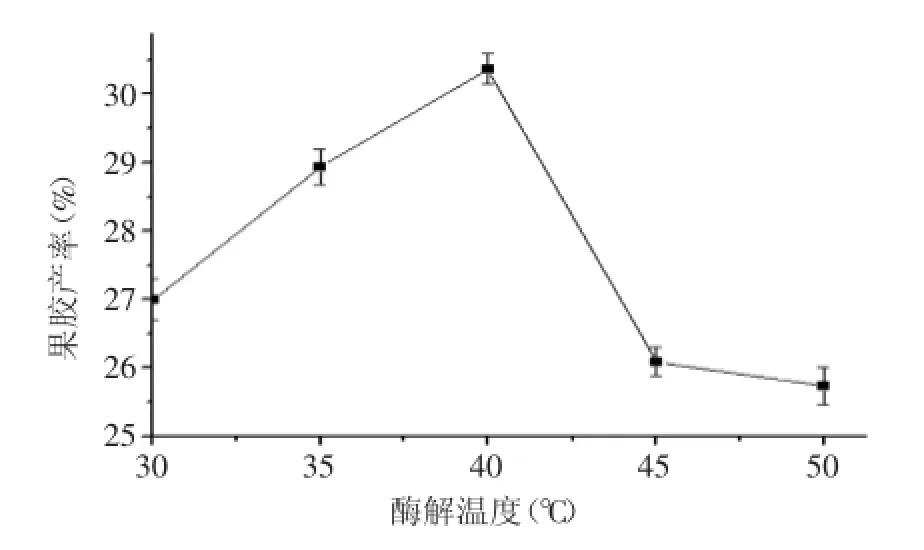
图4 酶解温度对血橙皮果胶产率的影响Fig.4 Effect of hydrolysis temperature on the pectin extraction yield
由图4可知:当温度在30~40℃之间,果胶产率随温度升高而增加,40℃时果胶产率最大,继续提高温度,果胶产率降低。这是由于升温使分子热运动加快,同时酶活力也增强,纤维素降解加剧,使果胶溶出速度加快,产率出现上升趋势。但温度过高易至酶活降低或失活,同时果胶降解也加快,从而使果胶的产率降低。
2.1.5提取时间对果胶产率的影响按照“1.2.2单因素实验”,改变提取时间为15、20、25、30、35 min进行实验,结果见图5。
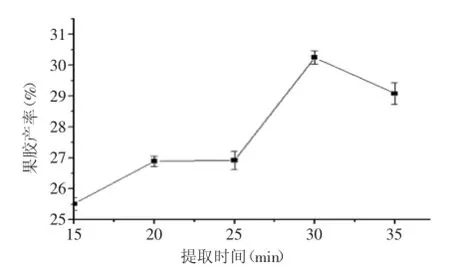
图5 提取时间对果胶产率的影响Fig.5 Effect of extracting time on the pectin extraction yield
由图5可知:果胶产率随着时间增加而增加,30 min时产率最高,继续延长时间,果胶产率降低。因为提取时间太短,原料中原果胶未能完全脱离和水解,但此阶段果胶的溶出起主导作用,故产率增加;随着果胶溶出量逐渐减少,一定时间后,在较高温度和酸性条件下果胶质水解会起主导作用,致使果胶产率降低。
2.1.6提取温度对果胶产率的影响按照“1.2.2单因素实验”,改变提取温度为80、85、90、95、100℃进行实验,结果见图6。

图6 提取温度对果胶产率的影响Fig.6 Effect of extracting temperature on the pectin extraction yield
由图6可知:随着提取温度的升高,果胶产率增加,但温度高于95℃时,产率降低。原因是提取温度升高,分子热运动加快,利于果胶溶出,但温度过高会致果胶水解加快,同时溶剂蒸发也加剧,致果胶产率降低。
2.1.7提取pH对果胶产率的影响按照“1.2.2单因素实验”,改变提取pH为1.0、1.5、2.0、2.5、3.0、3.5进行实验,结果见图7。
由图7可知:pH在1.0~2.0之间果胶产率变化不大,pH为1.5时果胶产率最大。酸度过低,果胶易发生脱脂反应,且当pH<2.0时,柠檬酸用量(pKa1=3.13)会急剧增加,继而提高成本和增加洗涤及分离难度。当pH>2.0时,果胶产率迅速降低,原因是提取液酸性变弱,原果胶酸解作用变迟钝,且果胶易发生酯的皂化和β-消除反应,致果胶产率下降。
2.2响应面实验设计结果及分析

图7 pH对果胶产率的影响Fig.7 Effect of pH on the pectin extraction yield
2.2.1响应曲面实验设计结果结合单因素实验结果,在确定酶解pH为自然条件、酶用量为0.7 mg/mL、酶解时间为45 min、酶解温度为40℃以及料液比为1∶40(g/mL)时,采用Box-Behnken中心组合设计,以提取pH(A)、提取温度(B)、提取时间(C)三个因素为自变量考查柠檬酸提取条件的影响,以果胶产率(R1)为响应值进行实验优化,进行12个试因实验、5个中心点实验,结果见表2。
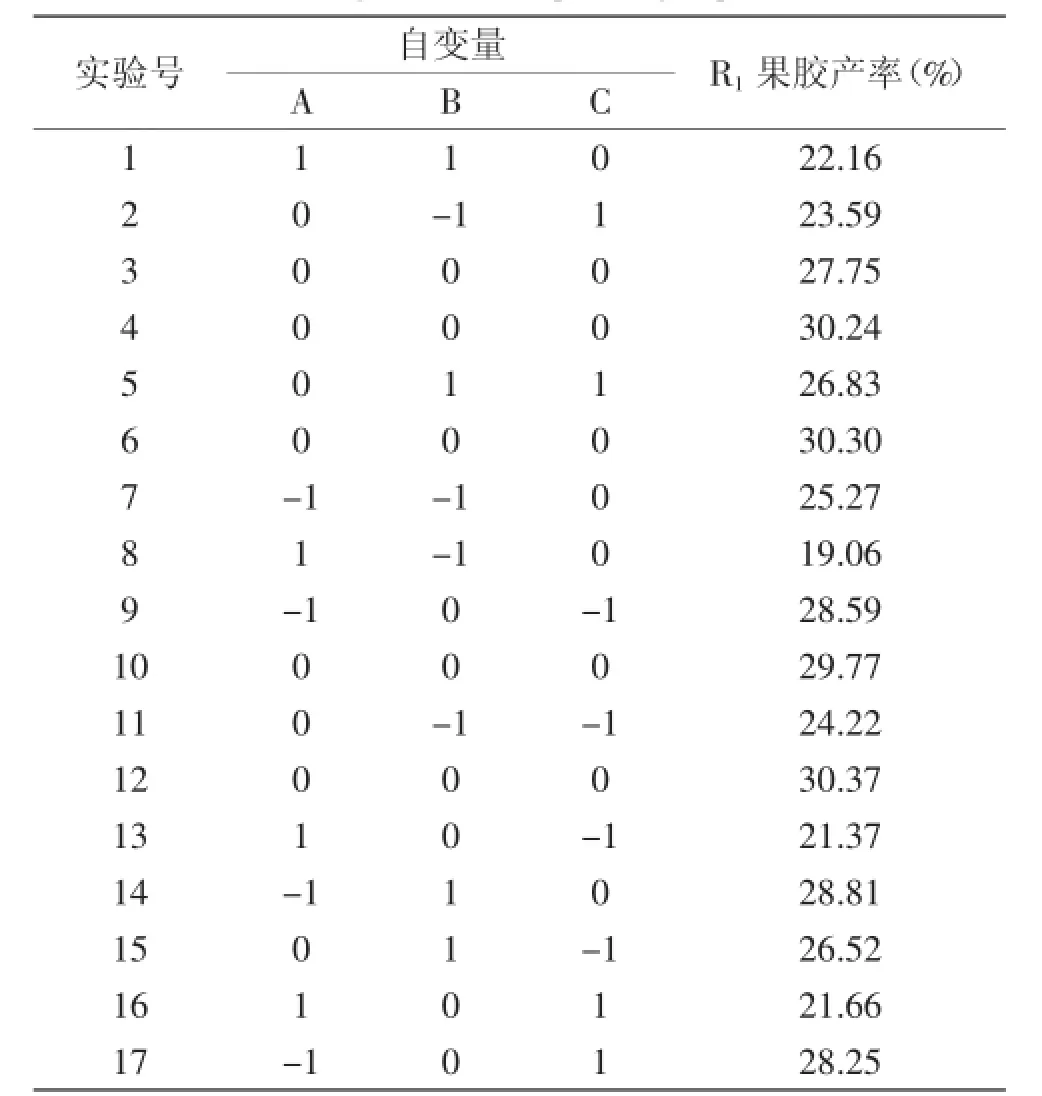
表2 响应面设计实验实验结果Table 2 RSM design and corresponding experimental results
2.2.2模型的方差分析经Design-Expert 8.05软件计算,得回归模型为:R1=29.69-3.33A+1.52B-0.046C-0.11AB+0.16AC+0.23BC-3.09A2-2.77B2-1.63C2。模型方差分析见表3。
由表3可知:果胶提取模型极显著,失拟项不显著;R2=0.9748,说明模型及方程回归效果好;R2Adj=0.9424,即模型可解释94.24%响应值的变化;CV%=3.29%,表明实验随机误差小。以上数据表明实验模型能很好地解释本法提取果胶的实验方法,并对其产率进行分析和预测。A及B对果胶产率影响极显著,提取时间C影响不显著,交互作用AB、AC、BC均不具显著性,二次项A2、B2、C2影响均极显著,F值反应出各因子的主效关系是A>B>C。

表3 实验模型的方差分析Table 3 Variance analysis of experimental model
2.2.3响应面分析果胶的二次回归方程的响应面见图8~图10。
图8~图10表明:溶液pH、温度和提取时间中的各因素均存在交互效应,pH影响使曲线最为陡峭,其次为温度、提取时间,结论与模型方差分析表一致。图8知:在pH不变条件下,果胶产率随温度出现先增长后降低的趋势,曲线表现为平缓;在提取温度一定时,产率先随pH增加略有增大,然后产率迅速下降,曲线表现为陡峭。图9可知:随着提取时间延长,果胶产率呈现先增加后减小趋势较小,曲线较为平缓;在提取时间一定时,产率先随pH增加略有增大,然后产率迅速下降,曲线表现为陡峭。由图10可知:提取温度不变时,果胶产率随提取时间的增大而增加,表现为曲线平缓;提取时间不变时,温度前期影响较大,后期较为平缓。

图8 pH(A)和温度(B)对果胶产率影响的响应面Fig.8 Response surface of the pH(A)and temperature(B)on the pectin extraction yield
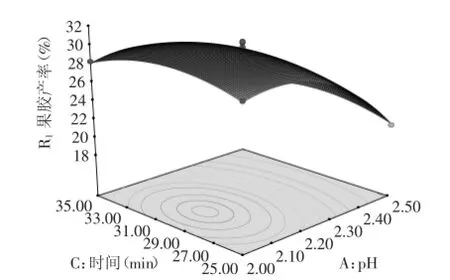
图9 pH(A)和提取时间(C)对果胶产率影响的响应面Fig.9 Response surface of the pH(A)and extraction time(C)on the pectin extraction yield
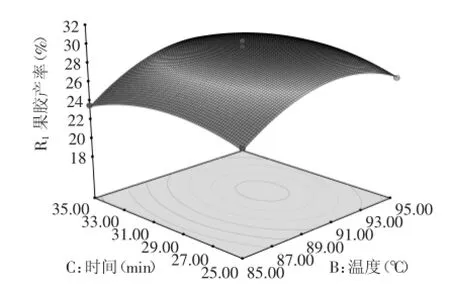
图10 温度(B)和时间(C)对果胶产率影响的响应面Fig.10 Response surface of the temperature(B)and extraction time(C)on the pectin extraction yield
2.2.4验证实验结果本研究以经济价值高的果胶产率最大化为基础,通过Design-Expert 8.05软件优化,得到果胶产率最大化的最佳工艺条件为:提取温度92.87℃、提取时间30.19 min、pH为2.09,果胶产率预测值为30.545%。考虑操作的可行性与简便,以提取温度90℃、提取时间30 min、pH为2进行验证,此条件下果胶产率的预测值为29.928%。5次平行实验的果胶产率均值为29.447%,与预测值的相对误差分别为1.6%。说明实验模型的具有实际应用意义。
2.2.5果胶理化性质测定结果果胶粗品色泽为米黄色,酯化度为67.84%,为高酯果胶;果胶含水率为7.66%,半乳糖醛酸含量为75.8%,酸不溶性灰分为0.1%。除pH3.10略高于QB2484-2000标准,其余指标均符合GB标准。总灰分为3.83%,低于QB2484-2000中规定的灰分值。
3 结论
实验利用了纤维素酶和柠檬酸的优点辅助提取塔罗科血橙皮原料中的果胶。在酶用量为0.7 mg/mL、酶解温度为40℃、料液比为1∶40、自然pH下酶解45 min后,以响应面法优化建立了柠檬酸提取果胶工艺的数学模型,最佳提取工艺条件为:提取温度92.87℃、时间30.19 min、pH为2.09。在提取温度为90℃、时间为30 min、pH为2时进行实验验证,果胶产率为29.447%,与该条件下果胶预测值29.928%的相对误差为1.6%。实验模型预测结果较好,产品理化性质符合国家标准。研究结果为工业化提取血橙皮渣中果胶提供了新的实验依据及方法。
[1]赵二劳,王璐.膳食纤维的保健功能及其制备研究进展[J].食品与机械,2011,27(3):165-168.
[2]Round A N,Rigby N M,MacDougall A J,et al.A new view of pectin structure revealed by acid hydrolysis and atomic force microscopy[J].Carbohydrate Research,2010,345:487-497.
[3]Willats W G T,Knox P,Mikkelsen J D.Pectin:new insights into an old polymer are starting to gel[J].Trends in Food Science &Technology,2006,17:97-104.
[4]Voragen A G J,Coenen G J,Verhoef R P,et al.Pectin,a versatile polysaccharide present in plant cell walls[J].Structural Chemistry,2009,20:263-275.
[5]Chittasupho C,JaturanpinyoM,Mangmool S.Pectin nanoparticle enhances cytotoxicity of methotrexate against hepG2 cells[J]. Drug Delivery,2013,20(1):1-9.
[6]汪多仁.果胶的开发与应用进展[J].饮料工业,2011,14(11):8-13.
[7]余映慧,高雪.果胶生产工艺及其在食品中的应用[J].现代农业科技,2009(23):351-352.
[8]岳贤田.国内果胶提取方法研究进展[J].安徽农业科学,2010,38(13):6932-6933,6960.
[9]蔡文,谭兴和,张喻,等.柑橘皮果胶提取与分离方法的研究进展[J].食品与机械,2011,27(2):161-164.
[10]邸铮,付才力,李娜,等.酶法提取苹果皮渣果胶的特性研究[J].食品科学,2007,28(4):133-137.
[11]廖文艳,于鹏,周杰.柠檬酸和柠檬酸钠在酸牛奶饮品中的应用[J].江西农业大学学报,2012,34(6):1240-1244.
[12]孙道华,李清彪,黄翠红,等.利用柠檬酸去除污泥中重金属的新工艺[J].离子交换与吸附,2006,22(6):497-502.
[13]鞠辉,杨慧茹,魏琦峰,等.萃取法分离柠檬酸的研究进展[J].化工进展,2014,33(2):285-288,303.
[14]潘虹.从不同原料中提取果胶工艺的研究综述[J].安徽农学通报,2009,15(3):73-75,79.
[15]孙金辉,陈海桂,卢沿钢,等.柑橘皮渣生物转化利用研究进展[J].食品科学,2011,32(19):312-315.
[16]史丹.资中塔罗科血橙产业现状及发展对策[J].四川农业科技,2014(9):48-49.
[17]刘义武,孔昭华,王碧.血橙营养成分研究进展[J].食品工业科技,2012,33(5):366-370.
[18]卓莉,阮尚全,黄云清.纤维素酶法提取血橙皮中黄酮类化合物[J].贵州农业科学,2013,41(6):168-169.
[19]阮尚全,黄雀宏,卓莉,等.超声波辅助提取塔罗科血橙皮中果胶的研究[J].河南农业科学,2013,42(1):152-154.
[20]阮尚全,漆婷,廖立敏,等.响应面优化微波提取塔罗科血橙皮中果胶的工艺研究[J].食品工业科技,2013,34(22):223-225,231.
Study on extraction of the pectin in the tarocco blood orange peel by hydrolysis-citric acid method and its physicochemical property
RUAN Shang-quan1,2,CHENG Xiao-qin1,3,XIA-Xu1,CHEN-Ting1,WANG Jian-hong1,2
(1.College of Chemistry and Chemical Engineering,Neijiang Normal University,Neijiang 641199,China;
2.Key Laboratory of Fruit Waste Treatment and Resource Recycling of the Sichuan Provincial College,Neijiang 641199,China;3.Sichuan Hengtong Animal Pharmaceutical Co.,Ltd.,Neijiang 641000,China)
Pectin in tarocco blood orange peel was extracted by hydrolysis-citric and the model was constructed with Design-Expert 8.05 software.The optimal extracting technological conditions were the extracting temperature 90℃,the time 30 min,the pH 2.In the verification test,the yield of the pectin was 29.447%,which relative errors was 1.6%for the model values of the pectin of 29.928%.The esterification degree,the moisture content,the galacturonic acid content,the total ash content,the acid insoluble ash content,and the pH of the pectin,respectively were 67.84%,7.66%,75.8%,3.83%,0.1%and 3.10.The theoretical basis and experimental method were provided by the experiment to advance the comprehensive value of blood orange.
blood orange peel;pectin;citric acid;physicochemical property
TS201.1
B
1002-0306(2016)04-0313-05
10.13386/j.issn1002-0306.2016.04.054
2015-08-19
阮尚全(1963-),男,本科,高级实验师,主要从事光谱分析及天然产物分离与应用方面的研究,E-mail:rsq2009nj@sina,com。
四川省教育厅自然科学基金重点项目(13ZA0004);内江师范学院自然科学基金重点项目(12NJZ02)。
